A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מיקרו-הנדסה הידרוג'ל קולגן תלת-ממדית עם יישור סיבים לטווח ארוך
In This Article
Summary
פרוטוקול זה מדגים את השימוש בתעלה מיקרופלואידית עם שינוי גיאומטריה לאורך כיוון זרימת הנוזל כדי ליצור מאמץ מאריך (מתיחה) ליישור סיבים בהידרוג'ל קולגן תלת-ממדי (עובי <250 מיקרומטר). היישור המתקבל משתרע על פני מספר מילימטרים ומושפע מקצב המאמץ המתארך.
Abstract
סיבי קולגן I מיושרים (COL1) מנחים את תנועתיות תאי הגידול, משפיעים על המורפולוגיה של תאי האנדותל, שולטים בהתמיינות תאי גזע והם סימן ההיכר של רקמות הלב והשרירים-שלד. כדי לחקור את תגובת התאים למיקרו-סביבות מיושרות במבחנה, פותחו מספר פרוטוקולים ליצירת מטריצות COL1 עם יישור סיבים מוגדר, כולל שיטות מגנטיות, מכניות, מבוססות תאים ומיקרופלואידיות. מבין אלה, גישות מיקרופלואידיות מציעות יכולות מתקדמות כגון שליטה מדויקת על זרימת הנוזלים והמיקרו-סביבה התאית. עם זאת, הגישות המיקרופלואידיות ליצירת מטריצות COL1 מיושרות עבור פלטפורמות מתקדמות של תרביות חוץ גופיות הוגבלו ל"מחצלות" דקות (<40 מיקרומטר עובי) של סיבי COL1 המשתרעים על פני מרחקים של פחות מ-500 מיקרומטר ואינם תורמים ליישומי תרביות תאים תלת-ממדיות. כאן, אנו מציגים פרוטוקול לייצור מטריצות 3D COL1 (130-250 מיקרומטר עובי) עם אזורים בקנה מידה מילימטרי של יישור סיבים מוגדר במכשיר מיקרופלואידי. פלטפורמה זו מספקת יכולות מתקדמות של תרביות תאים למדל מיקרו-סביבות רקמה מובנות על ידי מתן גישה ישירה למטריצה המהונדסת במיקרו עבור תרביות תאים.
Introduction
התאים שוכנים ברשת סיבית תלת-ממדית מורכבת הנקראת מטריצה חוץ-תאית (ECM), שרובה מורכב מסוג קולגן חלבוני מבני I (COL1)1,2. התכונות הביופיזיקליות של ECM מספקות רמזי הנחיה לתאים, ובתגובה, תאים מעצבים מחדש את מיקרו-ארכיטקטורה ECM 3,4,5. אינטראקציות הדדיות אלה בין תאים למטריצות יכולות ליצור תחומי סיבים מיושרים של COL16 המקדמים אנגיוגנזה ופלישת תאים בסביבת הגידול 7,8,9 ומשפיעים על מורפולוגיה של התא 10,11,12, קיטוב 13 והתמיינות 14. סיבי קולגן מיושרים גם מקדמים ריפוי פצעים 15, ממלאים תפקיד מפתח בהתפתחות רקמות16 ותורמים לתקשורת תאים ארוכת טווח17,18. לכן, שכפול המיקרו-ארכיטקטורה המקורית של סיבי COL1 במבחנה הוא צעד חשוב לקראת פיתוח מודלים מובנים לחקר תגובות תאים למיקרו-סביבות מיושרות.
מערכות תרבית תאים מיקרופלואידיות הוקמו כטכנולוגיה מועדפת לפיתוח מערכות מיקרופיזיולוגיות (MPS)19,20,21,22,23. תוך מינוף השפעות חיוביות של קנה מידה מיקרומטרי, מערכות אלה מספקות שליטה מדויקת על זרימת נוזלים, תומכות בהחדרה מבוקרת של כוחות מכניים ומגדירות את המיקרו-סביבה הביוכימית בתוך מיקרו-ערוץ 21,24,25,26,27. פלטפורמות MPS שימשו למדל מיקרו-סביבות ספציפיות לרקמות ולחקור אינטראקציות מרובות איברים28. במקביל, הידרוג'לים נחקרו באופן נרחב כדי לשחזר את המכניקה התלת-ממדית וההשפעה הביולוגית של ECM שנצפו in vivo29,30. עם דגש הולך וגובר על שילוב תרבית תלת ממדית עם פלטפורמות מיקרופלואידיות, גישות רבות יכולות לשלב הידרוג'ל COL1 בהתקנים מיקרופלואידים31,32,33. עם זאת, השיטות ליישור הידרוג'לים COL1 בתעלות מיקרופלואידיות הוגבלו ל"מחצלות" דו-ממדיות דקות (<40 מיקרומטר עובי) בתעלות ברוחב <1 מ"מ), המציעות פוטנציאל מוגבל למדל תגובות תאים במיקרו-סביבות תלת-ממדיות מיושרות31,34,35,36.
כדי להשיג הידרוג'לים תלת-ממדיים COL1 מיושרים במערכת מיקרופלואידית, הוכח כי כאשר תמיסת COL1 בהרכבה עצמית נחשפת לזרימות הארכה מקומיות (שינוי מהירות לאורך כיוון הנחל), ההידרוג'לים COL1 המתקבלים מציגים מידה של יישור סיבים ביחס ישר לגודל קצב המאמץ המתרחב שהם חווים37, 38. עיצוב המיקרו-ערוצים בפרוטוקול זה ייחודי בשתי דרכים; ראשית, העיצוב המקוטע מציג מתח הארכה מקומי לפתרון COL1, ושנית, המבנה "של שני חלקים" מאפשר למשתמש ליישר סיבי COL1 ולאחר מכן לפרק את התעלה כדי לגשת ישירות לסיבים המיושרים בפורמט פתוח. גישה זו יכולה להיות מאומצת גם לפיתוח פלטפורמות מיקרופלואידיות מודולריות המפתחות מערכות מיקרופיזיולוגיות עם מטריצות COL1 מסודרות. הפרוטוקול הבא מתאר את תהליך ייצור מיקרו-ערוצים מפולחים ומפרט את השימוש בתעלות ליישור אטלו בקר COL1. פרוטוקול זה מספק גם הוראות לגידול תאים ב- COL1 בפורמט באר פתוחה ודן בהוספת פונקציונליות לפלטפורמה באמצעות שכבת בסיס מגנטית מודולרית.
Protocol
1. ייצור ערוץ שני חלקים ובסיס פלטפורמה מודולרי
הערה: התעלה המיקרופלואידית בנויה משני חלקים – "מגרעת" התעלה המיקרופלואידית, שהיא חיתוך תער מיריעת פולי דימתיל סילוקסאן (PDMS) בעובי מוגדר, וכיסוי התעלה, שנקשר באופן הפיך למגרעת ויוצר את התעלה. התעלה מוקפת במסגרת פולי(מתיל מתקרילט) (PMMA) שתשמש כמאגר מדיה (איור 1). ניתן להשתמש במסגרת PMMA גם כדי להצמיד באופן מגנטי מודולים מיוחדים לקבלת פונקציונליות נוספת.
- תעלות חיתוך סכין גילוח מיריעות PDMS:
הערה: תכנון התעלה המיקרופלואידית עבור שלב זה מסופק באיור משלים 1. התעלה מורכבת מחמישה מקטעים באורך 5 מ"מ כל אחד וברוחב 10 מ"מ, 5 מ"מ, 2.5 מ"מ, 1.25 מ"מ ו-0.75 מ"מ. מהירות תמיסת הקולגן, המוזרקת בקצב זרימה קבוע (50-400 μL·min−1), גדלה מקומית לאורך הערוץ ככל שרוחב הערוץ קטן יותר כדי ליצור זרימה מאריכה.- הרכיבו יריעת PDMS בעובי 250 מיקרומטר על יריעת נשיאה מפלסטיק וחתכו בתער את העיצוב המיקרופלואידי באמצעות חותך מלאכה בעומק להב של 0.5 מ"מ, מהירות של 1 ס"מ·s−1 וכוח גבוה.
- באמצעות אמבטיה קולית, לנקות את מגזרות התעלה microfluidic במשך 5 דקות. שטפו את התעלות הסוניק במים שעברו דה-יוניזציה (DI) וייבשו אותן על פלטה נקייה בטמפרטורה של 100°C למשך 5 דקות.
- אחסנו את התעלות בכלי פטרי נקי ומכוסה עד לשימוש.
- ייצור כיסוי PDMS ופסיבציה של פני השטח:
הערה: מגרעת הערוץ מסעיף 1.1 דורשת כיסוי שניתן להניח מעליו כדי ליצור ערוץ סגור שניתן להזריק לתוכו תמיסת COL1 (איור משלים 1). ניתן להסיר את הכיסוי לאחר שה-COL1 הרכיב את עצמו. כדי למזער את הסיכוי שה-COL1 בתעלה ייקשר לכיסוי, הכיסוי עובר פסיבציה באמצעות אלבומין בסרום בקר (BSA). עיצוב התבנית עבור כיסוי PDMS מסופק. העובש חייב להיות בעובי של לפחות 2 מ"מ וצריכה להיות טביעת רגל השווה לטביעת הרגל של מגרעת התעלה המיקרופלואידית. בפרוטוקול זה, טביעת הרגל של העובש הייתה 35 מ"מ x 15 מ"מ.- להכנת התבנית, הדביקו יריעה של דבק רגיש ללחץ (PSA) ליריעת PMMA בעובי 2.5 מ"מ וחתכו בלייזר את צורת התבנית הרצויה.
- נקו את תבנית ה-PMMA שנחתכה בלייזר עם מגבון לח ללא סיבים והסר את הגב מסרט ה-PSA. חברו את התבנית לפרוסת סיליקון בקוטר 100 מ"מ בלחיצה חזקה כלפי מטה.
- הכנת PDMS ביחס של 10:1 (בסיס:crosslinker). ערבבו נמרצות במשך דקה אחת כדי להבטיח ערבוב תקין ונטרלו את התערובת בתא ואקום כדי להסיר בועות אוויר.
- שפכו את תמיסת ה-PDMS נטולת הגז לתבנית PMMA/סיליקון ורפאו על פלטה חמה בטמפרטורה של 100°C למשך 20 דקות. הניחו לתבנית להתקרר, הסירו את ה-PDMS שנרפא וקצצו כל עודף בעזרת סכין גילוח.
הערה: ודא שהצדדים הפונים לפרוסות סיליקון (צדדים שטוחים) של כיסויי PDMS פונים כלפי מעלה לאורך כל השלבים הבאים. - השתמש בניקוב ביופסיה בקוטר 1 מ"מ כדי ליצור חורי כניסה ויציאה המתאימים לקצות התעלה המיקרופלואידית. מגרעת הערוץ משלב 1.1 עשויה לשמש כתבנית להנחיית מיקום החורים.
- יש לסניק את הכיסוי באיזופרופנול (IPA) למשך 5 דקות, לשטוף במי DI, לייבש עם מקור אוויר דחוס ולאחר מכן לאחסן בצלחת פטרי נקייה ומכוסה. הניחו את צלחת הפטרי בתא עיקור UV (חשוף) למשך דקה אחת לעיקור.
- כיסוי והעברה לארון בטיחות ביולוגית (BSC).
- פיפטה 300 μL של 40 מ"ג•mL-1 אלבומין בסרום בקר (BSA) במי מלח חוצצים פוספט 1x (PBS) על כיסויי PDMS ולפזר את התמיסה באופן שווה באמצעות קצה פיפטה. הכניסו למקרר בטמפרטורה של 4°C למשך 4 שעות לפחות לפני השימוש.
- מעבירים את הכיסויים מהמקרר ל-BSC, שוטפים 5x עם 1x PBS ונותנים להם להתייבש באוויר למשך 10 דקות.
הערה: ניתן לאחסן את כיסויי PDMS במקרר עד שבוע לאחר ציפוים ב-BSA.
- טיפול גלוטראלדהיד בכיסויים
הערה: תפקוד החלקות הכיסוי עם גלוטראלדהיד קוואלנטי את COL1 למכסה ומונע את ניתוק ההידרוג'ל.- הכינו תמיסת אמינופרופיל טריאתוקסיסילן (APTES) 2% (v/v) בכד זכוכית על ידי הוספת 1 מ"ל APTES ל-49 מ"ל אצטון.
- יש לדלל תמיסת גלוטראלדהיד 25% ל-5% במי DI. הפוך 2 מ"ל של תמיסה עבור כל כיסוי 24 מ"מ x 50 מ"מ. עבור כיסויים בגודל 24 מ"מ x 24 מ"מ או 22 מ"מ x 22 מ"מ, הכינו תמיסה בנפח 1 מ"ל לכל כיסוי.
- נקו את הכיסויים בסוניק אמבטיה למשך 5 דקות באמצעות IPA. יש לשטוף את ה-IPA מהכיסויים באמצעות מי DI. ה- IPA נשטף לחלוטין כאשר ניתן לראות סרט מים חלק על הכיסוי.
- יבשו את הכיסויים על פלטה חמה במשך 5 דקות ב-100°C. הניחו את הכיסויים המיובשים בצלחות פטרי נקיות, וודאו שהן אינן חופפות.
- בעזרת שרביט פריקת קורונה, יש לחשוף את הכיסויים לפריקה של קורונה למשך דקה כל אחד.
הערה: שלב זה צריך להתבצע באזור מאוורר היטב או מכסה מנוע כימי. - הסירו את הכיסויים מצלחת הפטרי ולאחר מכן טבלו בתמיסת APTES למשך 10 שניות תוך 5 דקות מהחשיפה לקורונה, כדי לוודא שהכיסוי שקוע.
הערה: הקפד לעקוב אחר הצד שטופל בפלזמה ושמור אותו פונה כלפי מעלה. - לאחר מכן, לטבול את הכיסוי לתוך אצטון במשך 10 שניות ולייבש עם אוויר דחוס. החזירו את הכיסוי היבש לצלחת הפטרי, כשהצד המטופל פונה כלפי מעלה.
הערה: חזור על שלבים 1.3.5-1.3.7 עבור כל הכיסויים. - פיפטה 1 מ"ל של תמיסת גלוטראלדהיד על פני השטח של כל כיסוי. יש לכסות משטח רב ככל האפשר מבלי לאפשר לתמיסה להישפך מעבר לקצה הכיסוי. ניתן להוסיף תמיסת גלוטראלדהיד נוספת במידת הצורך. הקפידו לא לגרד את המשטח עם קצה הפיפטה.
- הניחו לכיסויים לשבת במגע עם התמיסה למשך 30 דקות ולאחר מכן שטפו במי DI במשך 20 שניות. יבשו את הכיסויים באמצעות אוויר דחוס והחזירו אותם לצלחות הפטרי, כשהם מטופלים בפלזמה כלפי מעלה.
הערה: ניתן לאחסן את הכיסויים למשך עד שבוע בטמפרטורת החדר (RT).
- חיתוך בלייזר של הבסיס המגנטי המודולרי
הערה: העיצוב של הבסיס המגנטי המודולרי מוצג באיור משלים 1. הבסיס המודולרי משמש כבאר להחזקת המדיה וניתן להשתמש בו גם לחיבור מגנטי של מודולים מיוחדים, כמתואר בעבודות שפורסמו בעבר 22,37,38,39.- גזרו את העיצובים משכבת PMMA באמצעות הגדרות לייזר מתאימות, כגון מספר המעברים והחשמל.
הערה: יש לכוונן את הגדרות הלייזר כך שניתן יהיה ללחוץ על המגנטים בשכבת PMMA. כל לייזר הוא שונה, ויש לייעל את פרמטרי החיתוך באופן ניסיוני. עבור לייזר של 45 ואט, מומלץ 100% מהירות, 100% הספק ו-3 מעברים לחיתוך PMMA בעובי 2 מ"מ עד 2 מ"מ. - שטפו את החלק החתוך בלייזר באמצעות מים וסבון כדי להסיר לכלוך מתהליך החיתוך בלייזר.
הערה: אין להשתמש בממסים כדי לנקות את החלקים שנחתכו בלייזר. ממסים עלולים לגרום להתפשטות של מיקרו-סדקים בקצוות שנחתכו בלייזר.
- גזרו את העיצובים משכבת PMMA באמצעות הגדרות לייזר מתאימות, כגון מספר המעברים והחשמל.
- הרכבת הפלטפורמה
- דוחפים מגנטים (3/16 קוטר, 1/16 אינץ 'עובי) ביד לתוך הבסיס בחיתוך לייזר. ניתן להשתמש בפטיש רך או בקצה מברג כדי לעזור לדחוף את המגנט. עובי המגנטים חייב להיות קטן מעובי בסיס PMMA כדי להבטיח שהמגנטים צמודים לפני השטח של הבסיס.
הערה: המגנטים מאפשרים למשתמש להוסיף פונקציונליות לפלטפורמה על ידי חיבור מודולים נוספים. - יש לקלף את הגב מיריעת ה-PSA ולחבר את הבסיס לכיסוי שטופל בגלוטראלדהיד כאשר הצד המתפקד פונה כלפי מעלה.
- הניחו בעדינות את מגרעת תעלת PDMS בחלל שהוגדר על-ידי המסגרת. לחץ כלפי מטה עם פינצטה בעלת קצה רחב כדי להסיר בועות אוויר ולהבטיח מגע קונפורמי.
- הניחו את כיסוי הערוץ שטופל ב-BSA על גבי מגרעת הערוץ, כאשר צד ה-BSA פונה כלפי מטה. ודא שיציאות הכניסה והשקע מיושרות עם הערוץ.
- המכשיר מוכן להזרקת COL1.
- דוחפים מגנטים (3/16 קוטר, 1/16 אינץ 'עובי) ביד לתוך הבסיס בחיתוך לייזר. ניתן להשתמש בפטיש רך או בקצה מברג כדי לעזור לדחוף את המגנט. עובי המגנטים חייב להיות קטן מעובי בסיס PMMA כדי להבטיח שהמגנטים צמודים לפני השטח של הבסיס.
2. הזרקת תמיסת COL1 למיקרו-ערוץ והסרת הכיסוי ליישומי תרביות תאים
- הכנת פתרון COL1
- הניחו את כל הריאגנטים הדרושים (תמיסת מלאי COL1 [6 מ"ג·מ"ל−1], מים טהורים במיוחד, 10x PBS, 0.1 M NaOH) על קרח בארון הבטיחות הביולוגית.
- חשב את נפח הריאגנטים כדלקמן

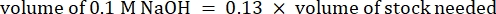
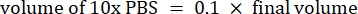
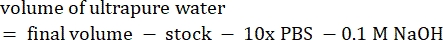
הערה: לכן, כדי לייצר 1 מ"ל של 2.5 מ"ג· מ"ל−1 קולגן מנוטרל מציר של 6 מ"ג·מ"ל−1 , הוסיפו 416.67 מיקרוליטר קולגן, 429.16 מיקרוליטר מי DI, 100 מיקרוליטר של 10x PBS ו-54.16 מיקרוליטר של 0.1 M NaOH לקבלת pH סופי של 7. הוסף 20 μL של 0.1 M NaOH כדי להשיג pH של 9.0. - הוסף את הריאגנטים לבקבוקון ריק של 5 מ"ל בסדר הבא: i) מלאי COL1, ii) DI מים, iii) 10x PBS, iv) 0.1 M NaOH.
הערה: השתמש בפיפט תזוזה כדי לטפל בתמיסת COL1. אובדן דגימה משמעותי עלול להתרחש אם נעשה שימוש בפיפט רגיל, מה שמוביל לתנודות בריכוז התמיסה הסופית. - העלה את רמת החומציות של התמיסה ל- pH הרצוי (בדרך כלל בין 7-9).
- הזרקת תמיסת COL1
- הכניסו משאבת מזרק, מזרק סטרילי מקורר, תמיסת COL1 מנוטרלת מקוררת ומחט נעילה סטרילית של 20 G 90° לארון בטיחות ביולוגית. טען את תמיסת COL1 לתוך המזרק, תוך הקפדה להימנע מהחדרת בועות.
- חבר את קצה המחט 90° 20 G למזרק, טען את המזרק לתוך משאבת המזרק, המחט פונה כלפי מטה, ומקדים את המחט עם תמיסת COL1.
- כוונו את משאבת המזרק לקצב הזרימה הנדרש, בין 50-2,000 מיקרוליטר/דקה.
- מניחים תעלות PDMS מוכנות (סעיף 1) על שקע מעבדה ומפלסות עם המחט.
- הכנס את המחט ליציאת הכניסה של תעלת PDMS (צד רחב). הזריקו את התעלה עד שטיפה ~ 30 μL של COL1 מצטברת בצד השקע.
- הורידו את שקע המעבדה והפרידו בעדינות את המחט מהתעלה שזה עתה התמלאה.
- חזור על שלבים 2.2.5-2.2.9 עד שכל הערוצים ימולאו בתמיסת COL1.
- העמיסו את התעלות המלאות לתוך צלחות פטרי לצד מגבון נקי ללא סיבים רווי במי DI כדי למנוע התייבשות של ג'ל COL1 שזה עתה נוצר.
- מכסים את צלחת הפטרי ומניחים את התעלות הטעונות באינקובטור (37°C, 95% לחות) למשך שעתיים לפני שלב הקילוף.
- קילוף ושיווי משקל תקשורתי
- חשוף את ג'ל COL1 הפולימרי על ידי הרמת כיסוי PDMS באמצעות פינצטה. טיפול ה-BSA מונע מ-COL1 להיצמד לכיסוי.
- הוסף 650 μL של EGM לבאר.
- השאירו את המכשירים באינקובטור (37°C, 95% לחות) למשך 4 שעות לפחות כדי לאזן את הג'ל והמדיה. החלפת המדיה לפני הזריעה בתאים
- זריעת תאים
- הניחו בארון הבטיחות הביולוגית 0.25% טריפסין חם ומדיה לתרבית יחד עם המספר הנדרש של פיפטות 5 מ"ל ו-10 מ"ל.
- תרבית תאי אנדותל של ורידים טבוריים אנושיים (HUVECs) למפגש של 80% במצע גידול אנדותל (EGM) ב-37°C, בלחות של 95%. הניחו את בקבוק תרבית הרקמה המכיל HUVECs ב- BSC לאחר בדיקת מפגש תחת מיקרוסקופ.
- השליכו את המדיה בבקבוק T25 ושטפו את התאים 2x עם 1x PBS. מוסיפים 1 מ"ל טריפסין לבקבוק ומניחים אותו באינקובטור (37°C, 95% לחות) למשך 3 דקות.
- בדוק את הבקבוק מתחת למיקרוסקופ לאחר 3 דקות כדי לוודא שהתאים מנותקים לחלוטין מפני השטח.
- הוסף 3 מ"ל של EGM (עם סרום) לבקבוק כדי לנטרל את טריפסין. לאחר מכן, להעביר את הפתרון התא באמצעות פיפטה 5 מ"ל לתוך צינור חרוטי 15 מ"ל. צנטריפוגה את הצינור החרוטי המכיל תאים ב 150 x גרם במשך 5 דקות.
- הניחו את הצינור החרוטי בארון הבטיחות הביולוגית והשליכו את הסופרנאטנט מבלי להפריע לכדורית התא. להשעות מחדש את התאים ב 1 מ"ל של מדיה תרבית טרייה.
- הוסף וערבב 15 μL של כחול טריפאן ו 15 μL של תמיסת התא resuspended בצינור חרוטי 1 מ"ל.
- הזריק תמיסת טריפאן כחול ותמיסת תאים משני צידי שקופית ספירת תאים והכנס את השקופית להתקן ספירת תאים.
- יש לדלל את תמיסת התא במצע הגידול של האנדותל לריכוז הנדרש בהתאם לריכוז התא המתקבל ממכשיר ספירת התא.
הערה: בקבוק T25 של HUVECs במפגש של 80% יניב ~750,000 תאים·ml−1 אם ידולל ב- 1 מ"ל של מדיה. נפח תרחיף התא שיש לזרוע מחושב כשטח משטח התרבית × צפיפות התא / ריכוזו של תרחיף התא. דוגמה: כדי לזרוע 20,000 תאים·cm−2 בבאר 35 מ"מ x 15 מ"מ, צריך ~ 140 μL של תרחיף התא. - שאפו את המדיה על מטריצת COL1 המהונדסת.
- הוסף את הנפח הנדרש של תמיסת התא למצע COL1 ותן לתאים להסתפק לפחות 4 שעות לפני ההדמיה.
- תיוג גרעין התא ושלד התא
- שאפו את המדיה מהתאים ושטפו 3x עם 1x PBS, 500 μL בכל כביסה. כסו את שכבת התא ב-4% פרפורמאלדהיד למשך 15 דקות ב-RT.
- יש לשאוף את הפרפורמאלדהיד ולשטוף עם 1x PBS Tween-20 למשך 5 דקות.
- חדרו את קרום התא באמצעות 500 μL של תמיסת טריטון-X 0.1% ב-PBS למשך 15 דקות. יש לשטוף עם 1x PBS Tween-20 למשך 5 דקות.
- חסום את אתרי הקישור הלא ספציפיים עם 500 μL של 4% BSA ב- PBS למשך 30 דקות ב- RT.
- לדלל את תמיסת התווית הפלואורסצנטית phalloidin-actin ב-4% BSA (1 μL של מלאי ב-400 μL של BSA).
- שאפו את תמיסת ה-BSA, הוסיפו את תמיסת הפלואידין לתאים והמתינו 30 דקות ב-RT.
- לדלל את הכתם הגרעיני ב 4% BSA (1 μL ב 500 μL), לשאוף את phalloidin, להוסיף את תמיסת הכתם הגרעיני עובד, ולחכות 15 דקות ב RT.
- שאפו את פתרון העבודה על הכתם הגרעיני, שטפו עם PBS Tween-20 3x למשך 5 דקות כל אחד, והוחלפו ב-1x PBS לפני ההדמיה.
- תמונה באמצעות מיקרוסקופ אפיפלואורסצנטי באמצעות ערוץ FITC (לדוגמה 491 nm/em 516 nm) וערוץ DAPI (ex 360 nm/em 460 nm) עם עדשת 40x. דמיינו את הקולגן באמצעות קונפוקל סורק לייזר במצב החזרה באמצעות קו לייזר של 488 ננומטר (הספק של 15%) ויעד טבילה במים של 40x.
תוצאות
כאשר תמיסת COL1 בהרכבה עצמית זורמת דרך ערוץ עם שטח חתך הולך ופוחת, מהירות הזרם (v x) של תמיסת COL1 גדלה מקומית בגודל, ∂v x, לאורך ההתכווצות בין שני המקטעים (∂x), וכתוצאה מכך נוצר קצב מאמץ מאריך (ε̇) כאשר ε̇ = ∂v x/∂x. ניתן לחשב את קצב המאמץ המתרחב ממהירות הנוזל, אשר נמדדת באמצעות מהירו?...
Discussion
פרוטוקולים ליצירת מטריצות COL1 עם סיבים מיושרים תוארו באמצעות שיטות מגנטיות, יישום ישיר של מתח מכני, וטכניקות מיקרופלואידיות47. גישות מיקרופלואידיות משמשות בדרך כלל ליצירת מערכות מיקרופיזיולוגיות בגלל מאפייני הזרימה וההובלה המוגדרים היטב שלהן, המאפשרים שליטה מדויקת על המיקר?...
Disclosures
כל המחברים מצהירים שאין אינטרסים מתחרים.
Acknowledgements
עבודה זו נתמכה בחלקה על ידי המכון הלאומי לבריאות תחת פרס מספר R21GM143658 ועל ידי הקרן הלאומית למדע תחת מענק מספר 2150798. התוכן הוא באחריות הכותבים בלבד ואינו מייצג בהכרח את העמדות הרשמיות של הגופים המממנים.
Materials
| Name | Company | Catalog Number | Comments |
| (3-Aminopropyl)triethoxysilane, 99% (APTES) | Sigma Aldrich | 440140-100ML | |
| 20 Gauge IT Series Angled Dispensing Tip | Jensen Global | JG-20-1.0-90 | |
| 3/16" dia. x 1/16" thick Nickel Plated Magnet | KJ Magnetics | D31 | |
| 3M (TC) 12X12-6-467MP | DigiKey | 3M9726-ND | |
| ACETONE ACS REAGENT ≥99.5% | Signa Aldrich | 179124-4L | |
| BD-20AC LABORATORY CORONA TREATER | Electro-Technic Products | 12051A | |
| Bovine Serum Albumin (BSA), Fraction V, 98%, Reagent Grade, Alfa Aesar | VWR | AAJ64100-09 | |
| Clear cast acrylic sheet | McMaster-Carr | 8560K181 | |
| Corning 100 mL Trypsin 10x, 2.5% Trypsin in HBSS [-] calcium, magnesium, phenol red, Porcine Parvovirus Tested | VWR | 45000-666 | |
| Countess II Automated Cell Counter | Thermo Fisher Scientific | AMQAX1000 | |
| CT-FIRE software | LOCI - University of Wisconsin | ||
| EGM-2 Endothelial Cell Growth Medium-2 BulletKit, (CC-3156 & CC-4176), Lonza CC-3162, 500 mL | Lonza | CC-3162 | |
| Glutaraldehyde 50% in aqueous solution, Reagent Grade, Packaging=HDPE Bottle, Size=100 mL | VWR | VWRV0875-100ML | |
| Graphtec CELITE-50 | Graphtec | CE LITE-50 | |
| HEPES (1 M) | Thermo Fisher Scientific | 15-630-080 | |
| High-Purity Silicone Rubber .010" Thick, 6" X 8" Sheet, 55A Durometer | McMaster-Carr | 87315K62 | |
| Human Umbilical Vein Endothelial cells | Thermo Fisher Scientific | C0035C | |
| Invitrogen Trypan Blue Stain (0.4%) | Thermo Fisher Scientific | T10282 | |
| Isopropanol | Fisher Scientific | A4154 | |
| Laser cutter | Full Spectrum | 20x12 H-series | |
| Microfluidics Syringe pump | New Era Syringe Pumps | NE-1002X | |
| Microman E Single Channel Pipettor, Gilson, Model M1000E | Gilson | FD10006 | |
| Molecular Probes Alexa Fluor 488 Phalloidin | Thermo Fisher Scientific | A12379 | |
| Molecular Probes Hoechst 33342, Trihydrochloride, Trihydrate | Thermo Fisher Scientific | H3570 | |
| Nutragen Bovine Atelo Collagen | Advanced BioMatrix | 5010-50ML | |
| Pbs (10x), pH 7.4 | VWR | 70011044.00 | |
| PBS pH 7.4 | Thermo Fisher Scientific | 10010049.00 | |
| Phosphate-buffered saline (PBS, 10x), with Triton X-100 | Alfa Aesar | J63521 | |
| Replacement carrier sheet for graphtec craft ROBO CC330L-20 | USCUTTER | GRPCARSHTN | |
| Restek Norm-Ject Plastic Syringe 1 mL Luer Slip | Restek | 22766.00 | |
| Silicon wafer | University wafer | 452 | |
| Sodium Hydroxide, ACS, Packaging=Poly Bottle, Size=500 g | VWR | BDH9292-500G | |
| Sylgard 184 | VWR | 102092-312 | |
| Thermo Scientific Pierce 20x PBS Tween 20 | Thermo Fisher Scientific | 28352.00 |
References
- Frantz, C., Stewart, K. M., Weaver, V. M. The extracellular matrix at a glance. Journal of Cell Science. 123 (24), 4195-4200 (2010).
- Bosman, F. T., Stamenkovic, I. Functional structure and composition of the extracellular matrix. The Journal of Pathology. 200 (4), 423-428 (2003).
- Cox, T. R., Erler, J. T. Remodeling and homeostasis of the extracellular matrix: Implications for fibrotic diseases and cancer. Disease Models & Mechanisms. 4 (2), 165-178 (2011).
- Cross, V. L., et al. Dense type I collagen matrices that support cellular remodeling and microfabrication for studies of tumor angiogenesis and vasculogenesis in vitro. Biomaterials. 31 (33), 8596-8607 (2010).
- Lu, P., Takai, K., Weaver, V. M., Werb, Z. Extracellular matrix degradation and remodeling in development and disease. Cold Spring Harbor Perspectives in Biology. 3 (12), 005058 (2011).
- Piotrowski-Daspit, A. S., Nerger, B. A., Wolf, A. E., Sundaresan, S., Nelson, C. M. Dynamics of tissue-induced alignment of fibrous extracellular matrix. Biophysical Journal. 113 (3), 702-713 (2017).
- Provenzano, P. P., et al. Collagen reorganization at the tumor-stromal interface facilitates local invasion. BMC Medicine. 4 (1), 38 (2006).
- Provenzano, P. P., et al. Collagen density promotes mammary tumor initiation and progression. BMC Medicine. 6 (1), 11 (2008).
- Szulczewski, J. M., et al. Directional cues in the tumor microenvironment due to cell contraction against aligned collagen fibers. Acta Biomaterialia. 129, 96-109 (2021).
- Aubin, H., et al. Directed 3D cell alignment and elongation in microengineered hydrogels. Biomaterials. 31 (27), 6941-6951 (2010).
- Gruschwitz, R., et al. Alignment and cell-matrix interactions of human corneal endothelial cells on nanostructured collagen type I matrices. Investigative Ophthalmology & Visual Science. 51 (12), 6303-6310 (2010).
- Wang, W. Y., et al. Extracellular matrix alignment dictates the organization of focal adhesions and directs uniaxial cell migration. APL Bioengineering. 2 (4), 046107 (2018).
- Wang, W. Y., Lin, D., Jarman, E. H., Polacheck, W. J., Baker, B. M. Functional angiogenesis requires microenvironmental cues balancing endothelial cell migration and proliferation. Lab on a Chip. 20 (6), 1153-1166 (2020).
- Lanfer, B. The growth and differentiation of mesenchymal stem and progenitor cells cultured on aligned collagen matrices. Biomaterials. 30 (30), 5950-5958 (2009).
- Brauer, E., et al. Collagen fibrils mechanically contribute to tissue contraction in an in vitro wound healing scenario. Advanced Science. 6 (9), 1801780 (2019).
- Ingber, D. E. From mechanobiology to developmentally inspired engineering. PhilosophicalTransactions of the Royal Society B: Biological Sciences. 373 (1759), 20170323 (2018).
- Wang, H., Abhilash, A. S., Chen, C. S., Wells, R. G., Shenoy, V. B. Long-range force transmission in fibrous matrices enabled by tension-driven alignment of fibers. Biophysical Journal. 107 (11), 2592-2603 (2014).
- Reinhart-King, C. A., Dembo, M., Hammer, D. A. Cell-cell mechanical communication through compliant substrates. Biophysical Journal. 95 (12), 6044-6051 (2008).
- Ahadian, S., et al. Organ-on-a-chip platforms: A convergence of advanced materials, cells, and microscale technologies. Advanced Healthcare Materials. 7 (2), 1700506 (2018).
- Hou, X., et al. Interplay between materials and microfluidics. Nature Reviews Materials. 2 (5), 17016 (2017).
- Abhyankar, V. V., et al. A platform for assessing chemotactic migration within a spatiotemporally defined 3D microenvironment. Lab on a Chip. 8 (9), 1507-1515 (2008).
- Abhyankar, V. V., Wu, M., Koh, C. Y., Hatch, A. V. A reversibly sealed, easy access, modular (SEAM) microfluidic architecture to establish in vitro tissue interfaces. PLoS One. 11 (5), 0156341 (2016).
- Williams, M. J., et al. A low-cost, rapidly integrated debubbler (RID) module for microfluidic cell culture applications. Micromachines. 10 (6), 360 (2019).
- Hsu, M. C., et al. A miniaturized 3D printed pressure regulator (µPR) for microfluidic cell culture applications. Scientific Reports. 12, 10769 (2022).
- Huh, D., Torisawa, Y. S., Hamilton, G. A., Kim, H. J., Ingber, D. E. Microengineered physiological biomimicry: organs-on-chips. Lab on a Chip. 12 (12), 2156-2164 (2012).
- Abhyankar, V. V., Lokuta, M. A., Huttenlocher, A., Beebe, D. J. Characterization of a membrane-based gradient generator for use in cell-signaling studies. Lab on a Chip. 6 (3), 389-393 (2006).
- Hasan, M. R., et al. One-step fabrication of flexible nanotextured PDMS as a substrate for selective cell capture. Biomedical Physics & Engineering Express. 4 (2), 025015 (2018).
- Meyvantsson, I., Beebe, D. J. Cell culture models in microfluidic systems. Annual Review of Physical Chemistry. 1, 423-449 (2008).
- Ma, Y., et al. Viscoelastic cell microenvironment: Hydrogel-based strategy for recapitulating dynamic ECM mechanics. Advanced Functional Materials. 31 (24), 2100848 (2021).
- Ma, Y., et al. 3D spatiotemporal mechanical microenvironment: A hydrogel-based platform for guiding stem cell fate. Advanced Materials. 30 (49), 1705911 (2018).
- Lee, P., Lin, R., Moon, J., Lee, L. P. Microfluidic alignment of collagen fibers for in vitro cell culture. Biomedical Microdevices. 8 (1), 35-41 (2006).
- Del Amo, C., Borau, C., Movilla, N., Asín, J., García-Aznar, J. M. Quantifying 3D chemotaxis in microfluidic-based chips with step gradients of collagen hydrogel concentrations. Integrative Biology. 9 (4), 339-349 (2017).
- Shi, N., et al. A 3D, magnetically actuated, aligned collagen fiber hydrogel platform recapitulates physical microenvironment of myoblasts for enhancing myogenesis. Small Methods. 5 (6), 2100276 (2021).
- Lanfer, B., et al. Aligned fibrillar collagen matrices obtained by shear flow deposition. Biomaterials. 29 (28), 3888-3895 (2008).
- Saeidi, N., Sander, E. A., Ruberti, J. W. Dynamic shear-influenced collagen self-assembly. Biomaterials. 30 (34), 6581-6592 (2009).
- Saeidi, N., Sander, E. A., Zareian, R., Ruberti, J. W. Production of highly aligned collagen lamellae by combining shear force and thin film confinement. Acta Biomaterialia. 7 (6), 2437-2447 (2011).
- Ahmed, A., et al. Microengineered 3D collagen gels with independently tunable fiber anisotropy and directionality. Advanced Materials Technologies. 6 (4), 2001186 (2021).
- Ahmed, A., et al. Local extensional flows promote long-range fiber alignment in 3D collagen hydrogels. Biofabrication. 14 (3), 035019 (2022).
- Mansouri, M., et al. The modular µSiM reconfigured: Integration of microfluidic capabilities to study in vitro barrier tissue models under flow. Advanced Healthcare Materials. , (2022).
- Paten, J. A., et al. Flow-induced crystallization of collagen: a potentially critical mechanism in early tissue formation. ACS Nano. 10 (5), 5027-5040 (2016).
- Liu, Y., Eliceiri, K. W. Quantifying fibrillar collagen organization with curvelet transform-based tools. Journal of Visualized Experiments. (165), e61931 (2020).
- Bredfeldt, J. S., et al. Automated quantification of aligned collagen for human breast carcinoma prognosis. Journal of Pathology Informatics. 5 (1), 28 (2014).
- Bredfeldt, J. S., et al. Computational segmentation of collagen fibers from second-harmonic generation images of breast cancer. Journal of Biomedical Optics. 19 (1), 016007 (2014).
- Carey, S. P., et al. Local extracellular matrix alignment directs cellular protrusion dynamics and migration through Rac1 and FAK. Integrative Biology. 8 (8), 821-835 (2016).
- Carey, S. P., Kraning-Rush, C. M., Williams, R. M., Reinhart-King, C. A. Biophysical control of invasive tumor cell behavior by extracellular matrix microarchitecture. Biomaterials. 33 (16), 4157-4165 (2012).
- Ahmed, A., et al. Engineering fiber anisotropy within natural collagen hydrogels. AmericanJournal of Physiology-Cell Physiology. 320 (6), 1112-1124 (2021).
- Mohammadi, H., Janmey, P. A., McCulloch, C. A. Lateral boundary mechanosensing by adherent cells in a collagen gel system. Biomaterials. 35 (4), 1138-1149 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved