Method Article
Tek Hücreli Multiomikler için Flaş Dondurulmuş Karaciğer Dokusundan Çekirdeklerin İzolasyonu
Bu Makalede
Özet
Burada, tek çekirdekli RNA-seq, ATAC-seq ve eklem multiomikleri (RNA-seq ve ATAC-seq) için flaş dondurulmuş, arşivlenmiş karaciğer dokularından çekirdekleri izole etmek için bir protokol sunuyoruz.
Özet
Karaciğer, diğerlerinin yanı sıra enerji homeostazının sürdürülmesi ve ksenobiyotiklerin metabolizması gibi birçok kritik fizyolojik fonksiyonun yerine getirilmesinden sorumlu karmaşık ve heterojen bir dokudur. Bu görevler, hepatik parankimal ve parankimal olmayan hücreler arasındaki sıkı koordinasyon yoluyla gerçekleştirilir. Ek olarak, çeşitli metabolik aktiviteler, karaciğer zonasyonu adı verilen bir fenomen olan hepatik lobülün belirli alanlarıyla sınırlıdır. Tek hücreli dizileme teknolojilerindeki son gelişmeler, araştırmacıları doku heterojenliğini tek hücreli bir çözünürlükte araştırmak için güçlendirmiştir. Karaciğer de dahil olmak üzere birçok karmaşık dokuda, sert enzimatik ve / veya mekanik ayrışma protokolleri, bu organı sağlık ve hastalıkta kapsamlı bir şekilde karakterize etmek için gereken tek hücreli süspansiyonların canlılığını veya kalitesini olumsuz yönde etkileyebilir.
Bu yazıda, çekirdekleri dondurulmuş, arşivlenmiş karaciğer dokularından izole etmek için sağlam ve tekrarlanabilir bir protokol açıklanmaktadır. Bu yöntem, tek çekirdekli RNA-seq, yüksek verimli dizileme (ATAC-seq) ile transpozaz erişimli kromatin testi ve multimodal omikler (eklem RNA-seq ve ATAC-seq) dahil olmak üzere aşağı akış, tek hücreli omik yaklaşımlarla uyumlu yüksek kaliteli çekirdekler verir. Bu yöntem, çekirdeklerin sağlıklı ve hastalıklı insan, fare ve insan dışı primat dondurulmuş karaciğer örneklerinden izole edilmesi için başarıyla kullanılmıştır. Bu yaklaşım, karaciğerdeki tüm ana hücre tiplerinin tarafsız izolasyonuna izin verir ve bu nedenle, karaciğeri tek hücreli çözünürlükte incelemek için sağlam bir metodoloji sunar.
Giriş
Tek hücreli genomik, karaciğer fonksiyonunu incelemek ve hücresel heterojenliğin sağlık ve hastalık koşullarındaki etkisini değerlendirmek için hızla önemli bir metodoloji haline gelmektedir1. Farklı bilgi katmanlarının eşzamanlı ölçümü için "multiomik" in hızlı gelişimi ve sağlam hesaplama boru hatlarının paralel genişlemesi, normal ve hastalıklı karaciğerde daha önce bilinmeyen hücre tiplerinin ve alt tiplerinin keşfedilmesinin yolunu açmaktadır2.
Biyobankaları ve arşivlenmiş dondurulmuş örnekleri keşfetme olasılığı, parankimal olmayan hücrelerin rolünü tekrar gözden geçirme ve keşfetme fırsatlarını önemli ölçüde artırmıştır 3,4,5 ve yaşlanma sırasında ve kronik hastalıklarda poliploid hepatositlerin rolünü araştırın 6,7,8,9 . Bu nedenle, bu yazıda flaş dondurulmuş (FF) arşivlenmiş karaciğerler için aşağı akış tek çekirdekli RNA dizilimi ve ATAC dizilimi ile multimodal omiklerle (eklem RNA-seq ve ATAC-seq) uyumlu sağlam ve tekrarlanabilir tek çekirdekli bir izolasyon protokolü açıklanmaktadır (Şekil 1).
Bu iş akışı, enzimatik ayrışma protokollerinde hücre boyutundan veya kırılganlığından bağımsız olarak karaciğerdeki tüm hücre tiplerinin transkriptomun ve kromatin erişilebilirliğinin araştırılmasına izin verir. Değerli insan örneklerinden veya transgenik farelerden küçük doku kesitleri (15-30 mg veya 5-10mm3) ile gerçekleştirilebilir. Çekirdek izolasyonunun yüksek saflığının belirlenmesi, artan hücre boyutu ve yaşlanma 10,11 ile ilişkili olabilecek nükleer boyutun nicelleştirilmesini ve ölçülmesini içerir ve bu saflık, hem hepatosit ploidi 12 hem de hücre boyutuna bağlı transkripsiyonel mekanizmaların analizi için geçerlidir11,13,14,15 . Ek olarak, dondurulmuş karaciğerlerden izole edilen çekirdekler, karaciğer zonasyonu hakkında değerli bilgileri korur. İş akışı ve doku toplama, tek hücreli genomik verilerin doğrulanmasına veya aynı dokudan ve aynı bireyden immünohistokimya veya uzamsal transkriptomikler gibi tamamlayıcı analizlere izin verir. Bu nedenle, bu yaklaşım çoklu karaciğer hastalığı koşullarına uygulanabilir ve organizmaları sistematik ve güvenilir bir şekilde modelleyebilir.
Protokol
Tüm hayvan deneyleri, Alman Hayvan Refahı Mevzuatı ve Yukarı Bavyera Hükümeti'nin düzenlemelerine uygun olarak gerçekleştirilmiştir. Hayvan barınağı, Alman Hayvan Refahı Yasası'nın 11. maddesine göre onaylanmış ve 2010/63/EU sayılı Direktife uygun olarak gerçekleştirilmiştir.
1. Doku hazırlığı
- 3 aylık bir ila 22 aylık erkek C57BL/6J fareyi servikal çıkık nedeniyle kurban edin. Hayvanı disseke eden bir tahtaya koyun, ekstremiteleri pimlerle sabitleyin ve% 70 etanol ile karnı dezenfekte edin.
- Treuting ve ark.16 tarafından önerildiği gibi nekropsi yapın.
- Karnı göğüs kafesine kadar açın, karaciğeri görselleştirin ve lobülleri delmeden karaciğeri dikkatlice çıkarmak için forseps kullanın.
- Diyaframı forseps ile tutarak ve bağlantı dokusunu makasla çıkararak sağlam karaciğeri çıkarın.
- Organı soğuk fosfat tamponlu salin (PBS) içinde yıkayın, temiz bir kağıt havlu üzerinde kurutun ve karaciğer lobüllerini farklı amaçlar için birkaç parçaya bölün: tek çekirdekli izolasyon ve multiomikler için FF; paraformaldehit sabit (% 10 PFA) parafin gömme için; ve/veya daha ileri histolojik analizler için optimum kesme sıcaklığı (OCT) bileşiğine gömülüdür (Şekil 1A).
- Karaciğer parçalarını kriyovyallere veya 5 mL vidalı kapaklı tüplere ayırın ve hemen sıvı azotta flaş-dondurun. Dondurulmuş karaciğer örneklerini aşağı akış tek çekirdekli multiomik deneyler için -80 ° C'de saklayın (Şekil 1B, C).
NOT: Kriyokorunmuş doku birkaç yıl boyunca -80 ° C'de güvenli bir şekilde saklanabilir ve kullanımdan önce daima -80 ° C'de kuru buz üzerinde taşınmalıdır.
2. Çekirdek izolasyonu
- Tamponların ve sarf malzemelerinin tezgah üstü temizliği ve hazırlanması
- Çalışma tezgahlarını ve pipetleri %70 etanol ve RNase dekontaminasyon çözeltisiyle temizleyin veya özel RNase içermeyen tezgah üstleri ve malzemeler kullanın.
- Hem sallanan kovayı hem de sabit açılı santrifüjleri, 1,5 mL/2 mL boruları ve çok kuyulu plakaları aşağıda ayrıntılı olarak açıklandığı gibi 4 °C'ye kadar önceden soğutun.
- Doku işleme için kullanılan RNaz içermeyen, tek kullanımlık cımbızları, tek kullanımlık steril bir neşteri ve kuru buz üzerinde bir Petri kabını (-60 ° C) önceden soğutun.
- Dounce cam homojenizatörünü ve havaneleri buz üzerinde (4 °C) önceden soğutun. Buzla doğrudan teması ve potansiyel RNaz kontaminasyonunu önlemek için her havaneyi (A ve B) 5 mL'lik bir tüpe yerleştirin.
- Seyreltici bir iyotiksanol ortamı (IDM) çözeltisi hazırlayın (Tablo 1A) ve% 60 iyodiksanol stok yoğunluğu gradyan ortamının% 50 ve% 29 seyreltisini yapmak için kullanın (sırasıyla Tablo 1B ve Tablo 1C).
- Tüm tüpleri önceden soğutun. İşlenecek her numune için aşağıdaki tüpleri hazırlayın:
- Üç adet 1.5 mL düşük DNA bağlayıcı tüp hazırlayın (biri filtrelenmiş doku homojenatı için, ikincisi% 50 iyotinkan çözeltisinin seyreltilmesinin 250 μL'sini içeren ikincisi ve temiz çekirdek süspansiyonu için üçüncüsü).
- Yoğunluk gradyanı ayrımı için% 29'luk bir iyodiksanol çözeltisinin 500 μL'lik seyreltilmesini içeren bir 2 mL yuvarlak tabanlı tüp hazırlayın.
- Çekirdek izolasyon ortamı-2 (NIM-2) ve homojenizasyon tamponu (HB) için bir adet 15 mL konik tüp hazırlayın.
- Çekirdek izolasyon ortamı-1'i (NIM-1) (Tablo 1D) hazırlayın ve NIM-2'yi (Tablo 1E) ve ardından HB'yi (Tablo 1F) yapmak için kullanın. Her iki RNAse inhibitörünü de protokolde aşağıda açıklandığı gibi, kullanımdan hemen önce ekleyin.
- Çekirdek depolama tamponunu (NSB) Tablo 1G'de açıklandığı gibi hazırlayın. Kullanımdan hemen önce rekombinant RNAse inhibitörü ekleyin. FACS ayıklama için kullanmadan önce NSB'ye protein bazlı RNAse inhibitörü ekleyin (isteğe bağlı).
- Homojenizatörlerin optimum temizliği ve bakımı için doku homojenizasyonunu takiben Dounce homojenizatörlerini ve havanelerini ıslatmak için steril suyla 500 mL'lik bir beher hazırlayın.
- Doku homojenizasyonu
- 20-30 mg'lık (veya 5mm3) bir doku parçasını kuru buz üzerinde Petri kabının içinde önceden soğutulmuş bir neşterle kesin. Ardından, Petri kabını hemen ıslak buza (4 ° C) aktarın. 1 mL HB ekleyin ve soğuk neşter kullanarak, 1 mL geniş delikli bir uç ile kolayca aspire edilmesini sağlamak için dokuyu mümkün olduğunca kesin.
NOT: Tüm doku/çekirdek transferleri için daima geniş delikli uçlar kullanın. Alternatif olarak, geniş delikler oluşturmak için steril plastik bir kapak üzerinde steril bir neşter ile 1 mL uçlar kesilebilir (Şekil 2A). - Doku süspansiyonunu toplayın ve önceden soğutulmuş 2 mL cam Sıçrama homojenizatörüne aktarın (Şekil 2B).
- Petri kabını ilave 0.5-1 mL HB ile yıkayın ve her şeyi buz üzerinde tutarken kalan tüm doku parçalarını toplayın.
- Buz üzerinde gevşek havaneli A ile yavaşça ve dikkatlice beş vuruş yapın. Havaneyi yukarı ve aşağı çekerken büküm hareketlerini kullanarak kabarcıklar oluşturmaktan kaçının. Havanenin her vuruşta homojenizatörün üstünden altına doğru dikkatlice hareket ettiğinden emin olun.
- Daha sonra, buz üzerinde sıkı havaneli B ile 10-15 yavaş vuruş yapın. Kabarcıklar oluşturmaktan kaçının.
NOT: Daha fazla vuruşa ihtiyaç duyulup duyulmadığını belirlemek için B havanesi ile 10 vuruştan sonra mikroskop altında çekirdeklerin görsel olarak incelenmesi önerilir. Bunu, tripan mavisi boyama (tripanın numuneye 1:1 oranı) ve manuel hemositometre (örneğin; 10 μL tripan mavisini 10 μL çekirdek süspansiyonu ile karıştırın ve mikroskop altında incelenmek üzere karışımın 10 μL'sini kullanın) kullanarak yapın; Şekil 2C). - Homojenatı 50 μm'lik bir hücre süzgecinden süzerken önceden soğutulmuş 1,5 mL'lik bir tüpe aktarın. Yüksek miktarda bağ dokusu kümeleri içeren homojenatlar için birden fazla filtre ve/veya tüp kullanın.
- Tüm doku homojenatını iyice toplamak için homojenizatörü ve kullanılan filtreleri ilave 0,5-1 mL HB ile durulayın. Yoğunluk gradyanı santrifüjlemeye geçin.
- 20-30 mg'lık (veya 5mm3) bir doku parçasını kuru buz üzerinde Petri kabının içinde önceden soğutulmuş bir neşterle kesin. Ardından, Petri kabını hemen ıslak buza (4 ° C) aktarın. 1 mL HB ekleyin ve soğuk neşter kullanarak, 1 mL geniş delikli bir uç ile kolayca aspire edilmesini sağlamak için dokuyu mümkün olduğunca kesin.
- Yoğunluk gradyanı santrifüjleme
- Filtrelenmiş homojenatı 4 °C'de 8 dakika boyunca 1.000 × g'da önceden soğutulmuş, sabit açılı bir santrifüjde santrifüj yapın.
- Numune dönerken, 250 μL% 50 iyodiksanol seyreltme içeren 1.5 mL'lik bir tüp ve 500 μL% 29 iyodiksanol seyreltme içeren bir 2 mL tüp hazırlayın. Her iki tüpü de buz üzerinde tutun.
- Santrifüjlemeyi takiben, bir vakum pompası kullanarak peleti rahatsız etmeden süpernatantı aspire edin.
NOT: Manuel pipetleme kullanmak, son çekirdek süspansiyonunun kalitesini tehlikeye atar. - 1 mL geniş delikli pipet ucunu kullanarak pelete 250 μL HB ekleyin ve çok yavaş bir şekilde yeniden askıya alın.
- Çekirdek süspansiyonunun 250 μL'sini, 250 μL% 50 iyodiksanol seyreltme içeren önceden soğutulmuş 1.5 mL'lik bir tüpe aktarın ve% 25'lik bir iyodiksanol / çekirdek süspansiyonu oluşturmak için nazikçe ama iyice karıştırın.
- %25 iyodiksanol/çekirdek süspansiyonunun 500 μL'sini, 500 μL %29 iyodiksanol seyreltme içeren önceden soğutulmuş 2 mL'lik bir tüpe aktarın.
NOT: %25 iyodiksanol/çekirdek süspansiyonunun 500 μL'si, %29'luk iyodiksanol çözeltisinin 500 μL'lik çözeltisinin üzerine nazikçe bırakılmalıdır, böylece %25/%29 iyodiksanol karışımları net faz ayrımı gösterir. Bu gradyan arabirimini oluşturmak için boru duvarının yan tarafını pipet ucu 45° açıyla konumlandırarak kullanın. O andan itibaren, bu gradyanı rahatsız etmemek için tüp nazikçe ele alınmalıdır. - Tüpü, fren KAPALI olarak ayarlanmış şekilde 20 dakika boyunca 12.500 g'da önceden soğutulmuş sallanan bir kova santrifüjünde santrifüj yapın.
- Santrifüjleme adımı tamamlanmadan hemen önce, scRNA-seq boru hatlarına ilerlerken RNAse inhibitörlerini NSB tamponuna ekleyin (bakınız Tablo 1G).
- Santrifüjlemeyi takiben, bir vakum pompası kullanarak peleti rahatsız etmeden süpernatantı aspire edin.
NOT: Manuel pipetleme kullanmak, son çekirdek süspansiyonunun kalitesini tehlikeye atar. - 1 mL geniş delikli pipet ucunu kullanarak, peleti 100-300 μL NSB içinde nazikçe yeniden askıya alın ve çekirdek süspansiyonunu temiz, önceden soğutulmuş 1,5 mL'lik bir tüpe aktarın.
- Tripan mavisi çözeltisi (tripanın numuneye 1:1 oranı) ve manuel bir hemositometre (örneğin; 10 μL tripan mavisini 10 μL çekirdek süspansiyonu ile karıştırın ve saymak için karışımın 10 μL'sini kullanın) kullanarak çekirdekleri sayın; Şekil 2D).
- Tek çekirdekli genomik test için elde edilen çekirdek süspansiyonunu hemen kullanın.
NOT: NSB'deki çekirdek süspansiyonu, akış ve/veya görüntüleme akışı sitometrisi ile daha fazla analiz için 4 °C'de 1 haftaya kadar soğutulmuş olarak saklanabilir, ancak snRNA-seq veya snATAC-seq için saklanamaz.
3. Hepatosit ploidi profilleme veya iyi tabanlı dizileme yaklaşımları için çekirdek ayıklama
- Akış sitometrisi tabanlı hücre sıralama için, çekirdek süspansiyonunu 50 μm'lik bir filtreden önceden soğutulmuş 5 mL FACS tüpüne filtreleyin.
- 100 μm nozul ile donatılmış bir akış sitometri sıralayıcısı kullanın. FACS tüpünü sıralayıcıya yükleyin ve numuneyi önizleyin.
- Çekirdek sıralama için geçit stratejisini ayarlayın, ileri saçılma alanını yan saçılma alanına (FSC-A/SSC-A) karşı çizerek bir saçılma kapısı ile başlayın, ardından Hoechst-Height versus Hoechst-Area (çekirdek kapısı) ve ardından Hoechst-Width versus Hoechst-Area (tekil kapı) ile devam edin. Hoechst-Area histogramındaki çekirdek ploidi profilini görselleştirin.
NOT: Daha iyi tepe çözünürlüğü için, Hoechst kanalını (450/50) doğrusal ölçekte görselleştirin (Şekil 3A). - 96-/384-kuyucuklu plakalara sıralamak için, damlacık gecikmesini ayarlayın ve daha önce açıklandığı gibi benzidin substratı-yaban turpu peroksidaz (TMB-HRP) ile kolorimetrik yöntemi kullanarak plaka hizalamasını optimize edin6.
- Hem numune soğutmasını hem de plaka tutucuyu, numune dönüşü 300 rpm'de açık olacak şekilde 4 °C'de soğuyacak şekilde ayarlayın.
- Tek çekirdekleri ~1 x 105 çekirdek/mL numune konsantrasyonunda ve akış hızı 200-500 olay/sn olacak şekilde sıralayın.
4. Görüntüleme sitometrisi ile nükleer parametrelerin görsel olarak incelenmesi ve ölçülmesi (isteğe bağlı)
- 50 μL çekirdek süspansiyonu içeren 0,5 mL'lik bir tüpü 2 × 107 çekirdek/mL konsantrasyonda yükleyin.
- Çekirdek ploidi profilini görselleştirmek için Hoechst floresan kanalına karşı en boy oranına dayalı bir tüm olaylar kapısı ayarlayın (Şekil 3B).
- Parlak alan (BF) ve Hoechst floresan kanalı kullanarak numuneyi 40x büyütmede elde edin.
- Görüntüleme sitometri yazılımı ile parlak alan ölçümünü ve Hoechst floresan yoğunluğunu kullanarak 2n ve 4n çekirdeklerini inceleyin ve ölçün (Şekil 3C).
5. Tek çekirdekli RNA-seq, ATAC-seq veya multiome kütüphane yapımı ve dizilimi
- Damlacık bazlı snRNA-seq yaklaşımları için, otomatik paralel bölümleme ve moleküler barkodlama17 için saflaştırılmış çekirdek süspansiyonunu doğrudan mikroakışkan cihaza yükleyin.
- Tek hücreli bölümleme cihazında mikroakışkan çalıştırma tamamlandıktan sonra, jel boncuk kapsüllü çekirdekleri toplayın, inkübe edin ve üreticinin kılavuzlarında daha önce açıklandığı gibi temizleyin17.
- Aşağıdaki programı kullanarak cDNA preamplifikasyonu için 11 polimeraz zincir reaksiyonu (PCR) döngüsü gerçekleştirin: 98 °C'de 3 dakika, (98 °C'de 15 sn, 63 °C'de 20 s ve 72 °C'de 1 dk) x 11, 72 °C'de 1 dakika ve 4 °C'de tutun. Üretici17 tarafından belirtildiği gibi bir son onarım ve A-kuyruklama adımı ve adaptör ligasyonu ile devam edin. Sonraki son gen ekspresyon kütüphanesi yapısı için, aşağıdaki programı kullanarak 10 PCR döngüsü gerçekleştirin: 98 ° C'de 45 sn, (98 ° C'de 20 sn, 54 ° C'de 30 sn, 72 ° C'de 20 sn) x 10, 72 ° C'de 1 dakika ve 4 ° C'de tutun.
- Elde edilen kütüphaneleri çekirdek başına ~ 20.000-50.000 ortalama okuma derinliğine kadar sıralayın.
- Eklem multiomikleri (RNA + ATAC) damlacık bazlı dizileme için, karaciğer çekirdeklerini lizis tamponunda 5 dakika boyunca inkübe edin ve daha sonra daha önce açıklandığı gibi 1 saat boyunca etiketleyin18.
- Otomatik paralel bölümleme ve moleküler barkodlama için etiketli çekirdekleri doğrudan mikroakışkan bir cihaza yükleyin.
- Mikroakışkan çalışma tamamlandıktan sonra, jel boncuk kapsüllü çekirdekleri toplayın, inkübe edin ve üretici18 tarafından açıklandığı gibi temizleyin.
- Aşağıdaki programı kullanarak cDNA preamplifikasyon adımı için altı PCR döngüsü gerçekleştirin: 72 °C'de 5 dakika, 98 °C'de 3 dakika, (98 °C'de 20 sn, 63 °C'de 30 sn, 72 °C'de 1 dakika) x 6, 72 °C'de 1 dakika ve 4 °C'de tutun.
- Ön amplifiye edilmiş numunenin 35 μL'sini alın ve aşağıdaki gibi bir cDNA amplifikasyonu gerçekleştirin: 98 ° C'de 3 dakika, (98 ° C'de 15 sn, 63 ° C'de 20 sn, 72 ° C'de 1 dakika) x 6, 72 ° C'de 1 dakika ve 4 ° C'de tutun. Üretici tarafından belirtildiği gibi son onarım ve A-kuyruk adımı ve adaptör ligasyonu ile devam edin18 . Sonraki son numune indeksleme PCR'si için aşağıdaki gibi 15 PCR döngüsü gerçekleştirin: 98 °C'de 45 sn, (98 °C'de 20 sn, 54 °C'de 30 sn, 72 °C'de 20 sn) x 15, 72 °C'de 1 dakika ve 4 °C'de tutun.
- ATAC kütüphanelerinin inşası için, aşağıdaki programı kullanarak numune indeksleme için 40 μL kullanın ve altı PCR döngüsü için yükseltin: 98 °C'de 45 sn, (98 °C'de 20 sn, 67 °C'de 30 sn, 72 °C'de 20 sn) x 6, 72 °C'de 1 dakika ve 4 °C'de tutun.
- Elde edilen multiome gen ekspresyon kütüphanelerini, üretici18 tarafından önerildiği gibi, çekirdek başına minimum 20.000 okuma çifti okuma derinliğine ve multiome ATAC kütüphanelerini hücre başına minimum 25.000 okuma çifti okuma derinliğine kadar sıralayın.
Sonuçlar
Dondurulmuş karaciğer örneklerinden tek çekirdekli izolasyon için bu iş akışı, tek çekirdekli multiomikler için uyarlanmıştır ve i) hücresel heterojenliğin ve doku mimarisinin paralel analizi için numune toplama, ii) tek çekirdekli süspansiyon ve iii) tek çekirdekli multiomikler (Şekil 1) olarak özetlenebilecek üç ana adıma dayanmaktadır. ). Ekstrakte edilen karaciğerler ötenazi farelerden diseke edilir ve parafin gömme, kriyoseksiyon veya her ikisi için histolojik inceleme için parçalara ayrılır. Diğer kesilmiş parçalar hemen çıkış yönü için sıvı azotta flaş dondurulur, multiomik analizler için tek çekirdekli izolasyon. Bu doku toplama sistemi, kullanıcının aynı bireyden doku kesitleri üzerindeki tek çekirdekli omik verileri daha fazla doğrulamasına izin verir, böylece veri setini uzamsal transkriptomiklerle veya gerekirse immünohistokimya analizleriyle tamamlar.
Dondurulmuş karaciğerlerden ekstrakte edilen çekirdeklerin burada açıklanan yöntemle mikroskobik olarak incelenmesi, yoğunluk gradyanı santrifüjleme adımının istenmeyen hücresel ve doku kalıntılarının uzaklaştırılmasını büyük ölçüde kolaylaştırdığını göstermektedir (Şekil 2C,D). Ayrıca, bu metodoloji, sitometrik analizlerle doğrulanabilen ve ölçülebilen tüm ploidi seviyelerini korur (Şekil 3).
Bu protokolün performansını daha da doğrulamak için, sıralanmamış ve FACS-sıralanmış çekirdekler üzerinde damlacık bazlı snRNA-seq gerçekleştirdik ve Seurat boru hattını takip eden verileri analiz ettik. Kısacası, ekstrakte edilen tek çekirdekler, daha önce19'da tanımlandığı gibi damlacık bazlı snRNA-seq için hazırlandı. 2n ve 4n çekirdeklerinin snRNA-seksi veya daha yüksek ploidi seviyeleri için, cDNA amplifikasyon adımı için 11 döngü ve son gen ekspresyon kütüphanesi yapımı için 10 döngü kullanılmıştır. Elde edilen kütüphaneler, çekirdek başına ~ 25.000-39.000 ortalama okuma derinliğine dizilendi. Elde edilen tek çekirdek okumaları GRCm39/mm39 fare genomu ile eşleştirildi. Ön işleme boru hattını çalıştırırken, çekirdeklerde bulunan eklenmemiş mesajcı RNA'nın (mRNA) dahil edilmesini ve nicelleştirilmesini belirlemek için -- include-intron komutu eklendi. Hizalayıcıya dahil edilen EmptyDrops algoritması, boş damlacıkları filtreledi ve çıkardı.
R paketi Seurat (sürüm 4.1.1), snRNA-seq analiz boru hattı tarafından çıkarılan benzersiz moleküler tanımlayıcı (UMI) sayı matrisini kullanarak kalite kontrol (QC) metriklerini hesaplamak için kullanılmıştır. 100'den az özelliğe (gen) ve 10'dan az hücreye sahip sayımlar çıkarıldı. Çekirdekler, tanımlanan QC eşiklerine göre filtrelendi: minimum gen sayısı = 200 ve maksimum gen sayısı = 8.000, mitokondriyal fraksiyon% <1 ve ribozomal fraksiyon% <2. Seurat'ta uygulandığı gibi, ana bileşen analizi (PCA) için ilk 3.000 yüksek değişkenli gen (HVG) kullanılmıştır. PCA analizinden elde edilen en iyi 15 PC boyutu girildikten sonra grafik tabanlı kümeleme gerçekleştirildi. Hücreleri kümelemek için, modülerlik optimizasyon tekniğini (Louvain algoritması) 0,5 olarak ayarlanmış bir çözünürlük parametresiyle uyguladık. Bu veri kümesini görselleştirmek ve keşfetmek için doğrusal olmayan boyutsal indirgeme, yani Tekdüzen Manifold Yaklaşım ve Projeksiyon (UMAP) çalıştırdık. Her kümenin kimliği, 6,20,21 işaretleyici genlerin önceden bilinmesine dayanarak atanmıştır.
Şekil 4A, bu çekirdek ekstraksiyon yöntemi kullanılarak elde edilen verilerden elde edilen yüksek kaliteli metrikleri göstermektedir. UMAP, tüm çekirdeklerdeki sayım sayısını ve yalnızca nükleer transkriptom ve nispeten sığ dizileme (hücre başına ~ 25.000-40.000 ortalama okuma) ile güvenle tanımlanabilen ana hücre tiplerini temsil eder (Şekil 4B). Bu yaklaşım, Hnf4a, Mlxipl ve Ppara gibi karaciğere özgü transkripsiyon faktörlerinin yanı sıra ksenobiyotiklerin metabolizmasında rol oynayan aşağı akış hedef genlerinin (yani, Cyp2e1 ve Cyp2f2) araştırılmasına izin verir (Şekil 4C). Ekstrakte edilen çekirdekler, perisantral Cyp2e1 ve periportal Cyp2f2 gibi ayırt edici genlerin tamamlayıcı paterninde gösterildiği gibi, karaciğer zonasyonu hakkında kritik bilgileri korumuştur (Şekil 4C).
Ayrıca, bu yöntem kullanılarak ekstrakte edilen sıralanmamış çekirdeklerin, aynı tek çekirdek18'deki epigenomik manzaranın (ATAC) ve gen ekspresyonunun (RNA) eşzamanlı profillemesi için daha yeni multiomik analizlerle uyumluluğunu değerlendirdik. Çekirdek lizis inkübasyon süresini transpozisyondan 5 dakika öncesine optimize ettik. Dizileme kütüphaneleri, cDNA preamplifikasyonu için altı PCR döngüsü çalıştırılarak oluşturulmuştur. Önceden amplifiye edilmiş numuneden, 35 μL alındı ve gen ekspresyon kütüphanesini oluşturmak için numune indekslemesi için 15 PCR döngüsü ile daha da güçlendirildi. cDNA izinin temsili bir elektroferogramı Şekil 5A'da (üstte) gösterilmiştir. ATAC kütüphanelerinin inşası için, 40 μL önceden amplifiye edilmiş numune kullanılmış ve numune indekslemesi için ek altı PCR döngüsü için çalıştırılmıştır, DNA izinin temsili elektroferogramı Şekil 5A'da gösterilmiştir (altta). Elde edilen gen ekspresyon kütüphanesi (RNA), çekirdek başına 44.600 okuma derinliğe ve ATAC kütüphanesi çekirdek başına 43.500 okuma derinliğe kadar sıralandı (Şekil 5B).
Yukarıda tarif edilenlere benzer şekilde, tek modalite, damlacık bazlı dizileme protokolü, okuma haritalama, hizalama, boş damla çıkarma ve parça sayımı, daha önce açıklandığı gibi, GRCm39 / mm39 referans genomu18 kullanılarak standart kılavuzlar izlenerek gerçekleştirilmiştir. Seurat ve Signac paketleri22'yi kullanarak, her iki modalitenin (RNA + ATAC) çoklu ölçümleri için "ağırlıklı en yakın komşu" (WNN) analizi gerçekleştirdik (Şekil 5C), bu da hücre büyüklüğü veya nükleer kırılganlık nedeniyle belirgin önyargılar olmadan hem majör hem de minör karaciğer hücre tiplerini tanımlamamıza ve açıklamamıza izin verdi (Şekil 5D). Satija laboratuvarı22,23 tarafından yayınlanan boru hattı, her iki tahlilde bağımsız olarak yapılan standart QC adımlarını (ön işleme ve boyutsal indirgeme) içerir. RNA-seq ve ATAC-seq modalitelerinin ağırlıklı kombinasyonunun iyi bir temsilini sağlamak için, WNN grafiği çizildi ve daha önce tanımlanmış işaretleyici genlere dayanan UMAP görselleştirme, kümeleme ve ek açıklama için kullanıldı 6,20,21. Tek modaliteyi kullanan tahlillere benzer şekilde, yukarı akış transkripsiyonel düzenleyicileri (Hnf4a, Ppara, Mlxipl) ve karaciğer zonasyonunun ayırt edici genlerini (Hamp, Cyp2e1 ve Cyp2f2) de tespit ettik (Şekil 5E).
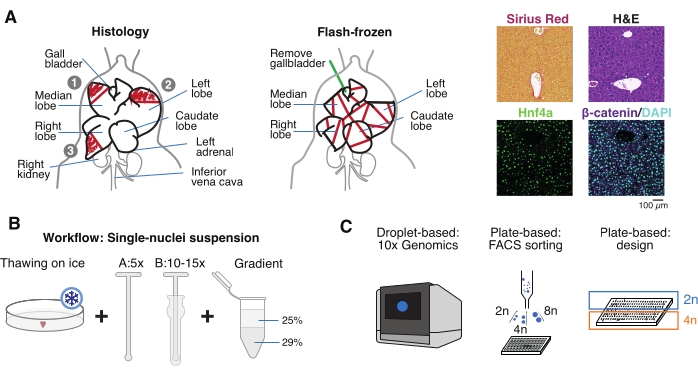
Şekil 1: Deneysel genel bakış, iş akışı ve tek hücreli genomik uygulamalar. (A) Histoloji için doku örneklemesinin açıklayıcı gösterimi (solda, parafin gömme ve / veya kriyoseksiyon için üç bölüm seçilmiştir), tek hücreli genomik için flaş dondurulmuş doku toplama (orta) ve temsili immünohistokimya ve immünofloresan analizleri (sağda); ölçek çubuğu = 100 μm. (B) Yüksek kaliteli tek çekirdekli süspansiyonlar için kritik adımlar. (C) Çekirdek süspansiyonları 10x krom çipine yüklenebilir veya FACS sıralama ve plaka tabanlı yaklaşımlar için kullanılabilir. Kısaltmalar: H & E = hematoksilin ve eozin; DAPI = 4',6-diamidino-2-fenilindol; FACS = floresan ile aktive edilmiş hücre sıralama. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 2: Karaciğer diseksiyonu ve Dounce-glass doku homojenizasyonu. (A) 3 aylık C57BL6/J fareden temsili murin karaciğeri (solda); tek çekirdekli izolasyonlar için kullanılan karaciğer bölümü, neşterle dokuyu kıymadan önce (orta) ve sonra (sağda). Ölçek çubukları = 1 cm. (B) "Gevşek" havane A (solda) ve "sıkı" havane B (sağda) ile vuruşlardan önce 2 mL Zıplayan cam homojenizasyonunun açıklayıcı görüntüleri. Gradyan santrifüjlemeden önce bir hemositometre (C) ve gradyan santrifüjlemeden sonra (D) kullanılarak doku homojenizasyonunun izlenmesi. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
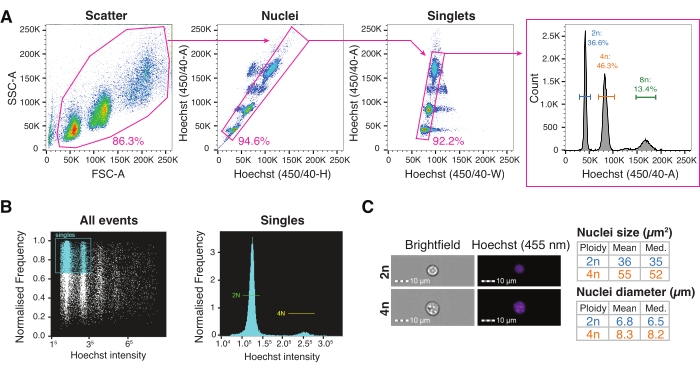
Şekil 3: Yüksek verimli çekirdek karakterizasyonu için floresan ile aktive edilmiş hücre sıralama ve görüntüleme akışı sitometrisi . (A) Farklı ploidi seviyelerinin sorgulanması için tek çekirdekli FACS ayıklaması için bir plakaya geçit stratejisi. Enkazı hariç tutmak için ayarlanan yan saçılma alanına karşı ileri saçılma alanına dayalı saçılma kapısı; çoklu çekirdek popülasyonlarını içeren Hoechst-Height'a karşı Hoechst-Area'ya dayanan çekirdek kapısı; çift ayrımcılığı için Hoechst-Width'e karşı Hoechst-A'ya dayanan tekil kapı; Hoechst-A histogramı, çekirdek ploidi profilinin görselleştirilmesini sağlar. (B) Diploid ve tetraploid çekirdekleri gösteren tüm olayların (solda) ve tek (sağda) olayların temsili görüntüleme sitometrisi ölçümü. (C) 2n ve 4n çekirdeklerinin brightfield ve Hoechst görüntüleri ve görüntüleme sitometrisi kullanılarak nicelleştirilmesi. Kısaltmalar: FACS = floresan ile aktive edilmiş hücre sıralama; FSC-A = ileri dağılım alanı; SSC-A = yan dağılım alanı; Hoechst-H = Hoechst-Height; Hoechst-A = Hoechst-Area; Hoechst-W = Hoechst-Genişlik. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
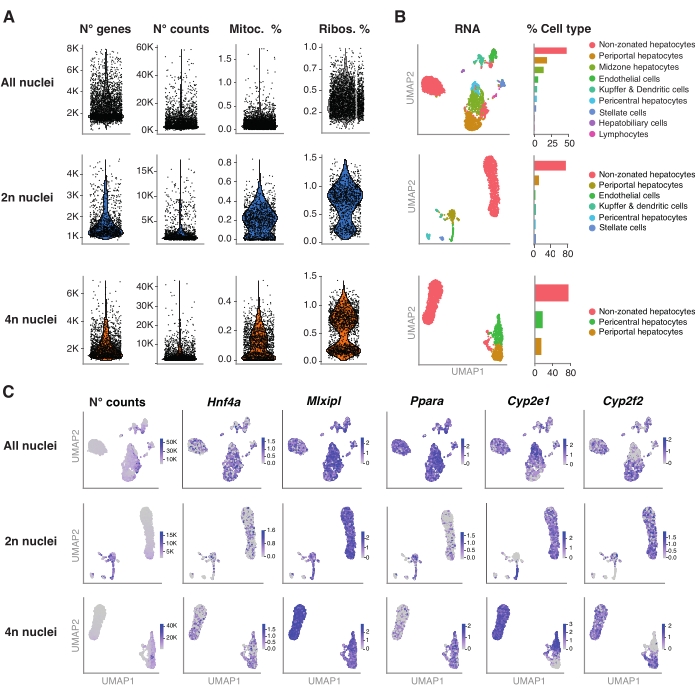
Şekil 4: Hepatosit ploidisinin snRNA-sek ile derin karakterizasyonu . (A) Tespit edilen gen sayısını, sayımlarını, mitokondriyal genlerin yüzdesini ve ribozomal genlerin yüzdesini gösteren keman grafikleri. (B) snRNA-seq (solda) kullanılarak tespit edilen hücre tiplerini gösteren UMAP, çekirdek yüzdesi (sağda) cinsinden ifade edilen niceleme ile. (C) UMAP, sayım sayısını gösterir ve hepatosit spesifik genlerin ekspresyonunu gösterir. Tüm çekirdekler (üst sıra), 2n çekirdek (orta sıra) ve 4n çekirdek (alt sıra). Kısaltmalar: snRNA-seq = tek çekirdekli RNA-seq; UMAP = Tekdüze Manifold Yaklaşımı ve Projeksiyonu; mitoc. = mitokondriyal genler; Ribolar. = ribozomal genler. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
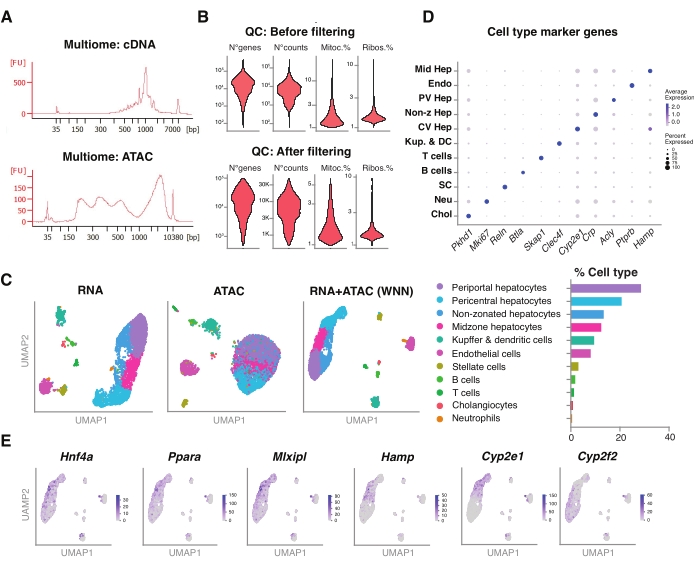
Şekil 5: Dondurulmuş, arşivlenmiş genç karaciğerlerden multiomiklerin (eklem RNA-seq ve ATAC-seq) kalite kontrolü ve analizi. (A) cDNA sentezi ve ATAC sonrası moleküler ağırlık ürününü gösteren multiomik boru hattından sonra elde edilen temsili otomatik elektroforetik izler. (B) ATAC-seq, RNA-seq, mitokondriyal genlerin yüzdesi ve filtrelemeden önce ve sonra ribozomal genlerin yüzdesi için sayım sayısını gösteren keman grafiği. (C) UMAP, RNA-seq (solda), ATAC-seq (orta) ve eklem modaliteleri-RNA-seq ve ATAC-seq (sağda) gen ekspresyonunu gösterir. (D) Farklı hücre tipleri, belirtilen hepatosit spesifik genlerin ekspresyonu ile farklı renklerde ek açıklamalar yapılır. (E) Belirtilen hücre tiplerinde belirtilen genlerin kümeye özgü ekspresyonunu gösteren özellik grafiği. Kısaltmalar: ATAC-seq = yüksek verimli dizileme ile transpozaz erişimli kromatin için tahlil; Orta Hep = orta zonal hepatositler; Endo = endotel hücreleri; PV Hep = periportal hepatositler; Non-z Hep = imarsız hepatositler; CV Hep = perisantral hepatositler; Kup & DC = Kupffer ve dendritik hücreler; SC = yıldız hücreleri, Neu = nötrofiller; Kol = kolanjiyositler; mitoc. = mitokondriyal genler; Ribolar. = ribozomal genler. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
| Reaktif | Stok | 10 mL | 15 mL | 50 mL | ||
| (A ) İyodiksanol Ortamı (IDM) | ||||||
| 250 mM Sakkaroz | 1milyon | 12,5 mL | ||||
| 150 mM KCl | 2milyon | 3,75 mL | ||||
| 30 mM MgCl2 | 1milyon | 1,5 mL | ||||
| 60 mM Tris tampon pH 8,0 | 1milyon | 3 mL | ||||
| Ultra saf RNase içermeyen su | 29,25 mL | |||||
| (B) % 50 IDM | ||||||
| İyodiksanol | 60% | 12,5 mL | ||||
| IDM | 2,5 mL | |||||
| (C) %29 IDM | ||||||
| İyodiksanol | 60% | 7,25 mL | ||||
| IDM | 7,75 milyon L | |||||
| (D ) Çekirdek İzolasyon Ortamı-1 (NIM-1) | ||||||
| 250 mM Sakkaroz | 1milyon | 12,5 mL | ||||
| 25 mM KCl | 2milyon | 0.625 mL | ||||
| 5 mM MgCl2 | 1milyon | 0,25 mL | ||||
| 10 mM Tris tampon pH 8,0 | 1milyon | 0,5 mL | ||||
| Ultra saf Rnazsız su | 36.125 milyon H | |||||
| (E ) Çekirdek İzolasyon Ortamı-2 (NIM-2) | ||||||
| NIM-1 arabellek | 9,99 milyon L | |||||
| Dithiothreitol (DTT) | 1 mM | 0,01 mL | ||||
| Proteaz İnhibitörü tablet (EDTA içermez) | 1 | 1 Tablet | ||||
| (F ) Homojenizasyon Arabelleği (HB) | ||||||
| NIM-2 arabellek | 9.697 milyon L | |||||
| Rekombinant RNaz İnhibitörü | 40 U/μL | 0,1 mL | ||||
| Protein Bazlı RNAse İnhibitörü (SUPERase•IN) | 20 U/μL | 0,1 mL | ||||
| %0.1 Triton-X | 10% | 0,1 mL | ||||
| 3 μg/mL Hoechst 33342 | 10 mg/mL | 0.003 mL | ||||
| (G ) Çekirdek Depolama Tamponu (NSB) | ||||||
| 166.5 mM Sakkaroz | 1milyon | 1.665 dk. | ||||
| 5 mM MgCl2 | 1milyon | 0,05 mL | ||||
| 10 mM Tris pH 8,0 | 1milyon | 0,1 mL | ||||
| Rekombinant RNaz İnhibitörü | 40 U/μL | 0,1 mL | ||||
| Protein Bazlı RNaz İnhibitörü (SUPERase•IN) * | 20 U/μL | 0,1 mL | ||||
| Ultra saf RNase içermeyen su | 8.085 milyon L | |||||
| * İsteğe bağlı (sadece FACS sıralama için) | ||||||
Tablo 1: Çözüm tarifleri. (A) İyodiksanol ortamının (IDM) hazırlanması; (B) İyodiksanol çözeltisinin %50 seyreltilmesi; (C) İyodiksanol çözeltisinin %29 seyreltilmesi. (D) Çekirdek izolasyon ortamı-1'in (NIM-1) hazırlanması. (E) Çekirdek izolasyon ortamı-2'nin (NIM-2) hazırlanması. (F) Homojenizasyon tamponunun (HB) hazırlanması. (G) Çekirdek depolama tamponunun (NSB) hazırlanması.
Tartışmalar
Karaciğerin hücresel bileşiminin tek hücreli veya tek çekirdekli RNA-seq ile diseke edilmesi, karaciğer hastalığının gelişimi ve ilerlemesi hakkında daha derin bir anlayış sağlar 3,4,5,24. Karaciğerlerden tek hücreli izolasyon zaman alıcıdır ve sert mekanik veya enzimatik ayrışmayı içeren protokoller gerektirir25,26,27. Her dokunun, optimal doku ayrışma protokolünü belirlemek için sistematik bir değerlendirmenin yanı sıra kırılgan hücre tiplerini veya çekirdek28'i yakalamak için uygun bir depolama yöntemi gerektirdiği yaygın olarak kabul edilmektedir. Doku mevcudiyetine, ilgilenilen hastalığa, gelişim aşamasına veya model organizmaya bağlı olarak, aşağı akış işleme için tek çekirdekli bir süspansiyonun hazırlanması, tek hücreli süspansiyonların kullanılmasından daha uygun bir metodoloji olabilir. Önemli olarak, karaciğerde, scRNA-seq ve snRNA-seq, nükleer ve sitoplazmik mRNA arasında yüksek bir korelasyon göstermiştir, bu da her iki yaklaşımın da tamamlayıcı bilgi 2,3,4,6,29 sunduğunu düşündürmektedir.
Bu makale, farelerden ve insanlar ve makaklar dahil olmak üzere diğer türlerden elde edilen dondurulmuş, arşivlenmiş karaciğer örneklerinden standartlaştırılmış, sağlam ve tekrarlanabilir tek çekirdekli bir izolasyon sağlar. Bu yöntem, chow ve yüksek yağlı diyet (HFD) ile beslenen vahşi tip fareler için ve hem iyi plaka bazlı hem de damlacık bazlı tek çekirdekli genomik yaklaşımlar kullanılarak karaciğer fibrozisinin fare modelleri için kullanılabilir6. Bu yöntem, başlangıçta Krishnaswami ve ark.30 tarafından beyin dokusu için tanımlanan protokole dayanır ve flaş dondurulmuş karaciğer için uyarlanmış ek modifikasyonlara sahiptir. Optimum homojenizasyon, nükleer membran bütünlüğünü olumsuz etkilemeden çekirdeklerin çoğunu dokudan serbest bırakır. Bununla birlikte, aşırı sıçrama, kırılgan çekirdeklere zarar verebilir ve genel kalitelerini düşürebilir. Genç ve / veya yağlı karaciğerler genellikle havane A ile sadece 5 vuruş ve B havanesi ile 10 vuruş gerektirirken, yaşlı ve / veya fibrotik karaciğerler havane B ile 15 vuruş gerektirebilir, ancak daha fazla değil. Bu nedenle, burada belirtilen sayıların ötesinde daha fazla kontur yapılması önerilmez. Aşırı sıçrama, tek çekirdekli süspansiyonun kalitesini olumsuz yönde etkileyebilir ve ortam RNA miktarını artırabilir. Daha sonra bu, aşağı akış veri analizleri sırasında ek hesaplamalı filtreleme adımlarının gerçekleştirilmesi gerekmesine neden olabilir.
Burada sunulan protokol çok yönlüdür ve genç (3 aylık) ve yaşlı (24 aylık) farelerde farklı karaciğer koşullarına göre ayarlanabilir. Eski, HFD ve fibrotik dokular için karaciğerin daha büyük bir bölümünün gerekli olduğunu bulduğumuzdan, işleme için mevcut dokunun boyutu, daha az miktarda başlangıç biyolojik materyaline sahip bazı kullanıcılar için bir sınırlama oluşturabilir. Bununla birlikte, damlacık bazlı genomik tahlillerle anında numune işleme için gradyan saflaştırması şiddetle tavsiye edilir. Çekirdeklerin, iyi tabanlı analizler için 96-/384-kuyucuklu plakalara sıralanmış FACS'a ihtiyacı varsa, gradyan saflaştırması ihmal edilebilir. FACS ayıklaması için önerilen çekirdek konsantrasyonunu elde etmek için yeterli doku örneği varsa (yani, ~1 × 105 çekirdek / mL) kullanıcıları hala gradyan saflaştırmasını yapmaya teşvik ediyoruz.
Karaciğer, hepatositlerinpoliploid doğası ile karakterizedir 9, ancak hepatosit ploidisinin normal fizyoloji ve hastalıktaki rolü henüz net değildir. Ploidinin genomik değişkenlik sağladığını gösteren artan sayıda kanıt vardır 31 ve ploidinin 32,33 yaşla birlikte arttığı iyi bilinmektedir. Bununla birlikte, mononüklee tetraploid hepatositlerin zenginleşmesi, klinik olarak insan hepatosellüler karsinomunda (HCC) kötü prognoz ile ilişkilidir34. Benzer şekilde, hepatosit ploidi düzeylerindeki değişiklikler, alkolsüz yağlı karaciğer hastalığı (NAFLD) 35,36,37 gibi yaşlanmaya bağlı kronik karaciğer hastalıkları ile bağlantılıdır. Ploidi, genomun ikiden fazla kopyasına sahip olma koşuludur ve genom içeriğinin Hoechst38 gibi bir DNA boyasıyla boyanmasıyla araştırılabilir. Ekstraksiyondan önce HB'ye eklenen Hoechst boyası, izolasyon protokolü sırasında tüm çekirdekleri etiketler. Bu, bir akış sitometri cihazı üzerinde bir UV (350 nm) veya menekşe (450 nm) lazer tarafından uyarıldığında DNA içeriğine dayanarak diploid ve poliploid çekirdekler arasında ayrım yapılmasını sağlar. Sergilenen geçit stratejisi ile, doku fonksiyonu1'de hücresel heterojenliğin rolünü daha iyi anlamak için dondurulmuş, arşivlenmiş karaciğerlerde 2n, 4n, 8n ve daha yüksek hepatosit ploidi seviyeleri araştırılabilir (Şekil 3A). Ayrıca, boyut ve hacim de dahil olmak üzere nükleer morfoloji, çekirdek boyutundaki değişiklikleri, ploidi seviyesine bağlı olarak toplam sayım sayısındaki veya gen sayısındaki değişikliklerle ilişkilendirmek için görüntüleme akışı sitometrisi kullanılarak ölçülebilir (Şekil 3B, C).
Multimodal omik ölçümü, genomik organizasyonun birkaç katmanını aynı anda araştırma fırsatı sunar. Eklem RNA + ATAC multiomik yaklaşımı, yukarı akış düzenleyicilerinin ve aşağı akış metabolik genlerinin araştırılmasına izin vererek, transkripsiyonel ağları ve tek hücreli çözünürlükte karaciğer fonksiyonu ile ilişkili kromatin mimarisini incelemek için kapsamlı bir yaklaşım sağlar. Ayrıca, veri seyrekliğini açıklayabilen hesaplama yöntemlerindeki ilerlemeler ve sıralama maliyetlerindeki azalma ile tek hücreli multiomik, aynı hücreden çoklu modalitelerin değerlendirilmesine öncülük etmektedir. Bu tek çekirdekli izolasyon protokolü, ekspresyon ve kromatin veri setlerinin bireysel ve ortak değerlendirmesi ile uyumludur. Verilerin kalitesini göstermek için Stuart et al.23 (Signac paketi) tarafından kurulan standart boru hatlarını kullandık, ancak aşağı akış analizleri için çeşitli mevcut ve alternatif hesaplama yöntemleri kolayca benimsenebilir 23,39,40,41.
Genel olarak, tek çekirdekli multiomikler, burada sunulan çekirdek ekstraksiyon protokolünü uygulayarak biyo-arşivlenmiş, FF fare, insan ve insan dışı primat karaciğer dokularının çok az miktarda başlangıç numunesi materyali kullanılarak araştırılmasına izin verir. Bu paha biçilmez araç, karaciğer biyologlarını çeşitli karaciğer patolojileri bağlamında hem gen ekspresyonunu hem de kromatin erişilebilirliğini sorgulamak için güçlendirecektir. Ek olarak, çeşitli hepatosit ploidi seviyeleri ve bunun sonucunda karaciğer lobülündeki konumlarına bağlı olarak gen ekspresyonunun ayarlanması, karaciğer patolojilerindeki rollerini ortaya çıkarabilir. Bu nedenle, hücresel heterojenliğin araştırılmasının, hassas tıbbın geliştirilmesi ve HCC ve NAFLD gibi hastalıklara karşı hedefli müdahaleler için yeni fırsatlar sağlayacağını öngörüyoruz.
Açıklamalar
Yazarlar çıkar çatışması olmadığını beyan ederler.
Teşekkürler
Bu araştırma Helmholtz Pioneer Kampüsü (M.S., K.Y., C.P.M.-J.) ve Hesaplamalı Biyoloji Enstitüsü (C.T.-L.) tarafından desteklenmiştir. Bu araştırma ayrıca AMED tarafından JP20jm0610035 Hibe Numarası (C.P.M.-J.) altında desteklenmiştir. HMGU (I. de la Rosa) ve Bioinformatics (T. Walzthoeni) desteğindeki Core Genomics'e, özellikle Xavier Pastor'a eğitim ve rehberlik için teşekkür ederiz. Teknik ve bilimsel destekleri için A. Feuchtinger, U. Buchholz, J. Bushe ve HMGU Patoloji ve Doku Analitik çekirdek tesisinden diğer tüm personele, ayrıca J. Zorn, R. Erdelen, D. Würzinger, E-Streifen personeli ve Laboratuvar Hayvan Hizmetleri çekirdek tesisine devam eden bilimsel destekleri ve tartışmaları için teşekkür ederiz. TranslaTUM (R. Mishra) ve Luminex, A DiaSorin Company (P. Rein) Çekirdek Tesis Hücre Analizine minnettarız. Teknik desteği için Dr. I Deligiannis'e teşekkür ederiz. Dr. M. Hartman, Dr. A. Schröder ve Bayan A. Barden (Helmholtz Pioneer Kampüsü) yasal, yönetsel ve idari destekleri için temeldi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 10% Tween 20 - 5 mL | Bio-Rad | 1662404 | |
| 2100 Bioanalyzer Instrument | Agilent | G2939BA | |
| Adhesive PCR film | Thermo Fisher Scientific | AB0558 | |
| Bioanalyzer High Sensitivity DNA Analysis | Agilent | 5067-4626 | |
| C1000 Touch Thermal Cycler | Bio-Rad | 1851196 | |
| Cell Sorter | For fluoresence-activated cell sorting (FACS); e.g. BD FACSAria Cell Sorter. | ||
| Centrifuge 5430R | Eppendorf | 5428000619 | Use chilled at 4 °C |
| Chromium Controller & Next GEM Accessory Kit | 10X Genomics | 1000204 | |
| Chromium Next GEM Chip G Single Cell Kit | 10X Genomics | 1000127 | |
| Chromium Next GEM Chip J Single cell kit, 16 reactions | 10X Genomics | 1000230 | |
| Chromium Next GEM Single Cell 3' Kit v3.1, 4 reactions | 10X Genomics | 1000269 | |
| Chromium Next GEM Single Cell Multiome ATAC + Gene Expression Reagent Bundle, 4 reactions | 10X Genomics | 1000285 | |
| cOmplete, EDTA-free Protease Inhibitor Cocktail | Sigma Aldrich | 11873580001 | |
| Dithiothreitol (DTT) 1 M solution | Sigma Aldrich | 646563 | Make 1 mM stock solution and use at 1 µM final concentration. |
| DNA AWAY Surface Decontaminant | Thermo Fisher Scientific | 10223471 | Wipe surfaces and pipettes before start of experiment |
| DNA LoBind Tubes, 1.5 mL | Thermo Fisher Scientific | 16628742 | |
| DNA LoBind Tubes, 2.0 mL | Thermo Fisher Scientific | 16638742 | |
| Elution Buffer (EB) - 250 mL | Qiagen | 19086 | |
| Eppendorf ThermoMixer C | Thermo Fisher Scientific | 13527550 | |
| Eppendorf ThermoMixer C Accessory: Smartblock | Thermo Fisher Scientific | 13518470 | |
| Ethanol, Absolute (200 Proof), Molecular Biology Grade - 100 mL | Thermo Fisher Scientific | 10517694 | |
| Filters 50 µm, sterile | SYSMEX PARTEC - CELLTRICS | 04-004-2327 | Adjust filter diameter according with tissue and nuclei size |
| Glycerin (Glycerol), 50% (v/v) - 1 L | Ricca Chemical Company | 3290-32 | |
| Hard-Shell, 384-Well PCR Plates, thin wall, skirted, clear/white | Bio-Rad | HSP3905 | |
| Herenz Heinz ABS Forceps | Thermo Fisher Scientific | 1131884 | |
| Hoechst 33342, Trihydrochloride, Trihydrate, 10 mg/mL Solution in Water | Invitrogen | H3570 | Light-sensitive |
| Imaging Flow Cytometer | For imaging flow cytometry analysis, e.g. Luminex Amnis ImageStream | ||
| Invitrogen TE Buffer - 100 mL | Thermo Fisher Scientific | 11568846 | |
| KCl (2 M), RNase-free, 100 mL | Thermo Fisher Scientific | AM9640G | |
| MgCl2 (1 M), 100 mL | Thermo Fisher Scientific | AM9530G | |
| MicroAmp 8-Cap Strip, clear-300 strips | Thermo Fisher Scientific | 10209104 | |
| MicroAmp 8-Tube Strip, 0.2 mL-125 strips | Thermo Fisher Scientific | 10733087 | |
| Mörser 2 mL DOUNCE | Wagner & Munz GmbH | 9651632 | RNase zap and rinse with MillQ before use |
| MyFuge 12 Mini MicroCentrifuge C1012 | Benchmark Scientific | C1012 | Or any other strip and tube mini centrifuge |
| Neubauer Hemocytometer | OMNILAB LABORZENTRUM | 5435293 | Visualize and count nuclei under microscope |
| Nuclease-Free Water (not DEPC-Treated) | Thermo Fisher Scientific | AM9937 | |
| OptiPrep Density Gradient Medium | Sigma Aldrich | D1556 | |
| Pipette tips RT LTS 1000 µL, Wide-O | Mettler Toledo | 30389218 | |
| Pistill "A" 2 mL | Wagner & Munz GmbH | 9651621 | RNase zap and rinse with MillQ before use |
| Pistill "B" 2 mL | Wagner & Munz GmbH | 9651627 | RNase zap and rinse with MillQ before use |
| Polypropylene 15 mL Centrifuge Tube | Thermo Fisher Scientific | 10579691 | |
| Polystyrene Petri dish, 60 mm x 15 mm | Thermo Fisher Scientific | 10634141 | |
| Polystyrene Round-Bottom 5 mL FACS Tubes | Thermo Fisher Scientific | 10100151 | |
| Protector RNase inhibitor - 2,000 U | Sigma Aldrich | 3335399001 | Keep in -20 °C until use |
| Protein-based RNase Inhibitor SUPERase•In (20 U/μL) | Thermo Fisher Scientific | AM2696 | Keep in -20 °C until use |
| Recombinant RNase Inhibitor | Clontech Takara | 2313B | Keep in -20 °C until use |
| RNAse free microfuge tubes - 0.5 mL | Thermo Fisher Scientific | AM12450 | |
| RNaseZap RNase Decontamination Solution | Thermo Fisher Scientific | AM9780 | Wipe surfaces and pipettes before start of experiment |
| SPRIselect - 60 mL | Beckman Coulter | B23318 | Aliquot and store in 4 °C |
| Sucrose, 500 g | Sigma Aldrich | S0389-500G | Make a 1 M stock solution |
| Swann-Morton Sterile Disposable Stainless Steel Scalpels | Thermo Fisher Scientific | 11798343 | |
| Tris-HCI (1M), pH 8.0 | Invitrogen | 15568025 | |
| Triton X-100, 98%, 100 mL | Thermo Fisher Scientific | 10671652 | Make 10% stock solution. Keep at 4 °C and protect from light. |
| Trypan Blue Solution, 0.4% | Thermo Fisher Scientific | 11538886 | |
| Vortex- Mixer | VWR | 444-1372 | Or any other type of vortex |
Referanslar
- Kamies, R., Martinez-Jimenez, C. P. Advances of single-cell genomics and epigenomics in human disease: where are we now. Mamm Genome. 31 (5-6), 170-180 (2020).
- Ramachandran, P., Matchett, K. P., Dobie, R., Wilson-Kanamori, J. R., Henderson, N. C. Single-cell technologies in hepatology: New insights into liver biology and disease pathogenesis. Nature Reviews Gastroenterology & Hepatology. 17 (8), 457-472 (2020).
- Ramachandran, P., et al. Resolving the fibrotic niche of human liver cirrhosis at single-cell level. Nature. 575 (7783), 512-518 (2019).
- Andrews, T. S., et al. Single-cell, single-nucleus, and spatial RNA sequencing of the human liver identifies cholangiocyte and mesenchymal heterogeneity. Hepatology Communications. 6 (4), 821-840 (2022).
- Xiong, X., et al. Landscape of intercellular crosstalk in healthy and NASH liver revealed by single-cell secretome gene analysis. Molecular Cell. 75 (3), 644-660 (2019).
- Richter, M. L., et al. Single-nucleus RNA-seq2 reveals functional crosstalk between liver zonation and ploidy. Nature Communications. 12 (1), 4264 (2021).
- Matsumoto, T., Wakefield, L., Tarlow, B. D., Grompe, M. In vivo lineage tracing of polyploid hepatocytes reveals extensive proliferation during liver regeneration. Cell Stem Cell. 26 (1), 34-47 (2020).
- Chen, F., et al. Broad distribution of hepatocyte proliferation in liver homeostasis and regeneration. Cell Stem Cell. 26 (1), 27-33 (2020).
- Donne, R., Saroul-Ainama, M., Cordier, P., Celton-Morizur, S., Desdouets, C. Polyploidy in liver development, homeostasis and disease. Nature Reviews. Gastroenterology & Hepatology. 17 (7), 391-405 (2020).
- Lengefeld, J., et al. Cell size is a determinant of stem cell potential during aging. Science Advances. 7 (46), 0271 (2021).
- Lanz, M. C., et al. Increasing cell size remodels the proteome and promotes senescence. Mol Cell. 82 (17), 3255-3269 (2022).
- Kim, J. Y., et al. PIDDosome-SCAP crosstalk controls high-fructose-diet-dependent transition from simple steatosis to steatohepatitis. Cell Metabolism. 34 (10), 1548-1560 (2022).
- Padovan-Merhar, O., et al. Single mammalian cells compensate for differences in cellular volume and DNA copy number through independent global transcriptional mechanisms. Molecular Cell. 58 (2), 339-352 (2015).
- Miettinen, T. P., et al. Identification of transcriptional and metabolic programs related to mammalian cell size. Current Biology. 24 (6), 598-608 (2014).
- Vargas-Garcia, C. A., Ghusinga, K. R., Singh, A. Cell size control and gene expression homeostasis in single-cells. Current Opinion in Systems Biology. 8, 109-116 (2018).
- Knoblaugh, S. E., Randolph-Habecker, J. . Necropsy and histology. In Comparative Anatomy and Histology: A Mouse, Rat, and Human Atlas (Second Edition). , (2018).
- Chromium Next GEM Single Cell 3 Reagent Kits v3.1 User Guide. Document number CG000204 (Rev D). 10x Genomics Available from: https://www.10xgenomics.com/support/single-cell-gene-expression/documentation/steps/library-prep/chromium-single-cell-3-reagent-kits-user-guide-v-3-1-chemistry (2019)
- Chromium Next GEM Single Cell Multiome ATAC + Gene Expression User Guide. Document number CG000338 (Rev D). 10x Genomics Available from: https://www.10xgenomics.com/support/single-cell-multiome-atac-plus-gene-expression/documentation/steps/library-prep/chromium-next-gem-single-cell-multiome-atac-plus-gene-expression-reagent-kits-user-guide (2021)
- MacParland, S. A., et al. Single cell RNA sequencing of human liver reveals distinct intrahepatic macrophage populations. Nature Communications. 9 (1), 4383 (2018).
- Martinez-Jimenez, C. P., Kyrmizi, I., Cardot, P., Gonzalez, F. J., Talianidis, I. Hepatocyte nuclear factor 4alpha coordinates a transcription factor network regulating hepatic fatty acid metabolism. Molecular and Cell Biology. 30 (3), 565-577 (2010).
- Schmidt, D., et al. Five-vertebrate ChIP-seq reveals the evolutionary dynamics of transcription factor binding. Science. 328 (5981), 1036-1040 (2010).
- Hao, Y., et al. Integrated analysis of multimodal single-cell data. Cell. 184 (13), 3573-3587 (2021).
- Stuart, T., Srivastava, A., Madad, S., Lareau, C. A., Satija, R. Single-cell chromatin state analysis with Signac. Nature Methods. 18 (11), 1333-1341 (2021).
- Sampaziotis, F., et al. Cholangiocyte organoids can repair bile ducts after transplantation in the human liver. Science. 371 (6531), 839-846 (2021).
- Gomez-Lechon, M. J., Donato, M. T., Castell, J. V., Jover, R. Human hepatocytes as a tool for studying toxicity and drug metabolism. Current Drug Metabolism. 4 (4), 292-312 (2003).
- Gomez-Lechon, M. J., Donato, M. T., Castell, J. V., Jover, R. Human hepatocytes in primary culture: The choice to investigate drug metabolism in man. Current Drug Metabolism. 5 (5), 443-462 (2004).
- vanden Brink, S. C., et al. Single-cell sequencing reveals dissociation-induced gene expression in tissue subpopulations. Nature Methods. 14 (10), 935-936 (2017).
- Denisenko, E., et al. Systematic assessment of tissue dissociation and storage biases in single-cell and single-nucleus RNA-seq workflows. Genome Biology. 21 (1), 130 (2020).
- Nault, R., Fader, K. A., Bhattacharya, S., Zacharewski, T. R. Single-nuclei RNA sequencing assessment of the hepatic effects of 2,3,7,8-tetrachlorodibenzo-p-dioxin. Cellular and Molecular Gastroenterology and Hepatology. 11 (1), 147-159 (2021).
- Krishnaswami, S. R., et al. Using single nuclei for RNA-seq to capture the transcriptome of postmortem neurons. Nature Protocols. 11 (3), 499-524 (2016).
- Duncan, A. W., et al. Aneuploidy as a mechanism for stress-induced liver adaptation. Journal of Clinical Investigation. 122 (9), 3307-3315 (2012).
- Kreutz, C., et al. Hepatocyte ploidy is a diversity factor for liver homeostasis. Frontiers in Physiology. 8, 862 (2017).
- Hunt, N. J., Kang, S. W. S., Lockwood, G. P., Le Couteur, D. G., Cogger, V. C. Hallmarks of aging in the liver. Computational and Structural Biotechnology Journal. 17, 1151-1161 (2019).
- Bou-Nader, M., et al. Polyploidy spectrum: a new marker in HCC classification. Gut. 69 (2), 355-364 (2019).
- Gentric, G., et al. Oxidative stress promotes pathologic polyploidization in nonalcoholic fatty liver disease. Journal of Clinical Investigation. 125 (3), 981-992 (2015).
- Schwartz-Arad, D., Zajicek, G., Bartfeld, E. The streaming liver IV: DNA content of the hepatocyte increases with its age. Liver. 9 (2), 93-99 (1989).
- Kudryavtsev, B. N., Kudryavtseva, M. V., Sakuta, G. A., Stein, G. I. Human hepatocyte polyploidization kinetics in the course of life cycle. Virchows Archiv. B, Cell Pathology Including Molecular Pathology. 64 (6), 387-393 (1993).
- Duncan, A. W., et al. The ploidy conveyor of mature hepatocytes as a source of genetic variation. Nature. 467 (7316), 707-710 (2010).
- Granja, J. M., et al. ArchR is a scalable software package for integrative single-cell chromatin accessibility analysis. Nature Genetics. 53 (3), 403-411 (2021).
- Bredikhin, D., Kats, I., Stegle, O. MUON: Multimodal omics analysis framework. Genome Biology. 23 (1), 42 (2022).
- Velten, B., et al. Identifying temporal and spatial patterns of variation from multimodal data using MEFISTO. Nature Methods. 19 (2), 179-186 (2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır