Method Article
Anofel Sivrisineklerinde Spermatogenezi İncelemek için Tam Montajlı Floresan In Situ Hibridizasyon
Bu Makalede
Özet
Basit anatomileri göz önüne alındığında, Anofel testisleri spermatogenezi incelemek için iyi bir sitolojik model sunar. Bu protokol, bu biyolojik süreci araştırmak için kullanılan bir teknik olan tam montajlı floresan in situ hibridizasyonun yanı sıra sperm üretiminde yer alan genlerde mutasyonları barındıran transgenik suşların fenotipini açıklar.
Özet
Spermatogenez, diploid hücrelerin ardışık mitotik ve mayotik bölünmeye uğradığı ve ardından haploid spermatozoa oluşturmak için büyük yapısal değişikliklerin izlediği karmaşık bir biyolojik süreçtir. Biyolojik yönün yanı sıra, spermatogenezin incelenmesi, sırasıyla Mendel kalıtımını ve sperm cinsiyet oranını değiştirerek, zararlı böcek popülasyonlarını kontrol etmek için kullanılabilecek gen sürücüsü ve sentetik cinsiyet oranı bozucuları gibi genetik teknolojileri anlamak ve geliştirmek için büyük önem taşımaktadır. Bu teknolojilerin laboratuvar ortamlarında çok umut verici olduğu kanıtlanmıştır ve potansiyel olarak sıtma vektörleri olan Anopheles sivrisineklerinin vahşi popülasyonlarını kontrol etmek için kullanılabilir. Testis anatomisinin basitliği ve tıbbi önemi nedeniyle, Sahra altı Afrika'da önemli bir sıtma vektörü olan Anopheles gambiae, spermatogenezi incelemek için iyi bir sitolojik modeli temsil eder. Bu protokol, X ve Y kromozomlarını spesifik olarak boyayan floresan problar kullanılarak spermatogenez yoluyla hücre nükleer yapısındaki dramatik değişiklikleri incelemek için tam montajlı floresan in situ hibridizasyonun (WFISH) nasıl kullanılabileceğini açıklar. FISH genellikle mitotik veya mayotik kromozomları ortaya çıkarmak için üreme organlarının parçalanmasını gerektirir ve floresan problarla spesifik genomik bölgelerin boyanmasına izin verir. WFISH, tekrarlayan DNA dizilerini hedefleyen floresan problardan iyi bir sinyal algılama seviyesi ile birlikte testisin doğal sitolojik yapısının korunmasını sağlar. Bu, araştırmacıların, sürecin her aşamasının açıkça ayırt edilebildiği organın yapısı boyunca mayoz bölünme geçiren hücrelerin kromozomal davranışındaki değişiklikleri takip etmelerini sağlar. Bu teknik, kromozom mayotik eşleşmesini incelemek ve örneğin sentetik cinsiyet oranı bozucuları, hibrit erkek kısırlığı ve spermatogenezde yer alan genlerin nakavt edilmesi ile ilişkili sitolojik fenotipleri araştırmak için özellikle yararlı olabilir.
Giriş
Sıtma, küresel insan nüfusunun sağlığı ve refahı üzerinde muazzam bir yük getirmektedir. 2021'de Dünya Sağlık Örgütü (WHO), sıtmanın 619.000 ölüme neden olduğunu ve bunların %96'sının Sahra Altı Afrika'da meydana geldiğini tahmin ediyor1. Hastalık, Anopheles cinsine ait sivrisinekler tarafından bulaşır ve Sahra Altı Afrika'da Anopheles gambiae (An. gambiae), Anopheles coluzzi (An, coluzzi) ve Anopheles arabiensis (An. Arabiensis) olmak üzere üç tür, sıtma bulaşmasında orantısız bir şekilde büyük bir role sahiptir ve küresel olarak sıtma vakalarının %95'ini oluşturmaktadır. Böcek öldürücüler ve sıtma ilaçları gibi geleneksel yöntemlere dayanan kontrol programları milyonlarca hayat kurtardı; Bununla birlikte, son yıllarda, bu kontrol yöntemlerine karşı artan direnç, etkinliklerinemeydan okumuştur 1,2. Buna ek olarak, COVID-19 pandemisinin getirdiği kısıtlamalar, 2022 DSÖ Dünya Sıtma Raporu'na göre sıtma insidansını artıran temel sıtma kontrol müdahalelerinin kullanılabilirliğini etkilemiştir1. Son yirmi yılda, Anopheles sivrisineklerinihedeflemek için laboratuvar ortamlarında yeni genetik kontrol yöntemleri geliştirilmiştir 3,4,5,6,7,8,9,10. Bu stratejiler arasında, gen tahrik sistemlerine (GDS'ler) ve sentetik cinsiyet oranı bozucularına (SD'ler) dayalı olanlar umut verici görünmektedir. GDS'ler, kadın doğurganlığını etkileyen veya sivrisinekte parazit yaşam döngüsünü bozan bir genetik modifikasyonu çok yüksek bir frekansta iletme olasılığına dayanır 5,11,12. SD'ler, bunun yerine, bir sivrisinek soyunun cinsiyet oranını erkeklere doğru çarpıtarak hareket eder ve bu da zamanla dişilerin eksikliği nedeniyle hedef popülasyonun çökmesine yol açar 4,6,13. Bu genetik sistemlerin ana bileşenleri, öncelikle mayotik bölünmeyi takiben gametlerin, yumurtaların ve spermlerin üretildiği sivrisineklerin üreme organlarına etki eder14.
Bu protokolde, kromozomların in situ davranışına odaklanarak An. gambiae'de spermatogenezi araştırmak için sitogenetik tekniklerdeki ilerlemeler kullanılmaktadır.Sivrisinek testisinin yapısı ve içinde yer alan biyolojik süreçler daha önce immünofloresan, floresan raportör transgenleri ve DNA ve RNA floresan in situ hibridizasyon (FISH) gibi bir dizi sitolojik yöntem kullanılarak araştırılmıştır15,16,17,18,19,20; Organlar, alt kutbun erkek aksesuar bezlerine bağlı bir çıkış kanalına bağlandığı iğ benzeri bir şekil gösterir. Üst kutupta, germ hattı kök hücre nişi çoğalır ve somatik hücreler tarafından oluşturulan spermatokistlerin içine gömülü spermatogonia hücrelerine farklılaşır. Birden fazla mitotik bölünme turunu takiben, spermatogonia mayoza giren spermatositlere farklılaşır. Profazda, otozom ve cinsiyet kromozomları homologlarıyla eşleşir ve çaprazlama gerçekleşir. Mayotik bölünmelerden sonra, yuvarlak haploid spermatidler üretilir ve spermiyogeneze girer ve bu süreç, sitoplazmanın çıkarıldığı, nükleer kromatinin yoğunlaştığı ve çekirdeğin bazal kısmında kamçının ortaya çıktığı olgun haploid spermatozoa oluşumuna yol açar21,22 (Şekil 1 ve Şekil 2).
Genel olarak, spermiyogenez orta pupa evresinde başlar ve olgun spermatozoa, sperm rezervuarındaki geç pupa evresindetespit edilebilir 23. Spermatokistlerin olgunlaşma süreci erişkin yaşamda da devam eder23,24,25. Anofel testislerinde, spermatokistteki hücrelerin nükleer morfolojisine bakılarak spermatogenezin her aşaması kolayca tanımlanabilir (Şekil 2). Bu protokolde açıklanan tam montajlı floresan in situ hibridizasyon (WFISH), araştırmacıların bir kromozomal bölgeyi spesifik olarak etiketlemesine ve organ ve hücre çekirdeği pozisyonunun doğal yapısını korurken spermatogenez sırasında izlemesine olanak tanır; bu, organın genellikle ezildiği ve doku hasarına yol açtığı standart DNA FISH protokolüne kıyasla bir avantajı temsil eder19. Mevcut protokolde, cinsiyet kromozomları üzerindeki tekrarlayan dizileri boyamak ve böylece diploid bölünen hücrelerden olgun haploid spermatozoalara kadar spermatogenez sırasındaki davranışlarını izlemek için floresan problar kullanılmaktadır. WFISH, cinsiyet kromozomu mayotik eşleşmesini incelemek ve örneğin sentetik cinsiyet oranı bozucuları, hibrit erkek kısırlığı ve spermatogenezde yer alan genlerin nakavtedilmesi ile ilişkili sitolojik fenotipleri araştırmak için özellikle yararlı olabilir 4,19,26,27.
Sıtma vektörleri olarak rolleri göz önüne alındığında, Anofel sivrisinekleri, genellikle bu organizmaların üreme organlarında hareket eden artan sayıda genetik vektör kontrol stratejisinin hedefidir. Yeni sitolojik tekniklerin araştırılmasını gerektiren çeşitli sivrisinek mutantları ve sitolojik fenotipler üretilmiştir26,27,28,29. Bu çalışmada açıklanan yöntem, sıtma bulaştıran sivrisinekleri kontrol etme potansiyeline sahip genetik stratejilerin arkasındaki sitolojik mekanizmaların yanı sıra spermatogenezin anlaşılmasına da ışık tutmaktadır.
Protokol
1. DNA probu etiketleme
NOT: Aşağıda, An. gambiae sivrisineklerinin cinsiyet kromozomlarını özel olarak etiketleyen floresan DNA probları oluşturmak için teknik adımlar verilmiştir.
- PCR kullanarak prob etiketleme
- Ticari olarak temin edilebilen bir genomik DNA ekstraksiyon kiti kullanarak X veya Y kromozomlarını etiketlemek için pupalardan veya yetişkin erkeklerden genomik DNA'yı çıkarın (bkz.
- PCR reaksiyon karışımını hazırlayın: 200 ng genomik DNA, 0.05 mM etiketlenmemiş nükleotid (dATP, dCTP, dGTP), 0.015 mM dTTP ve 1 uL floresan etiketli dUTP (Cy3, Cy5 veya başka bir florokrom), 50 pmol ileri ve geri primer (Tablo 1), 5 μL 10x PCR tamponu ve 10 U Taq DNA polimeraz (bkz.
- 18S rDNA ve uydu AgY53B'yi etiketlemek için (Tablo 1), aşağıdaki PCR parametrelerini kullanarak bir PCR reaksiyonu gerçekleştirin: 10 dakika boyunca 95 °C'lik bir döngü; 30 sn için 95 °C, 30 sn için 52 °C ve 45 sn için 72 °C olmak üzere 35 döngü; 5 dakika boyunca 72 °C'lik bir döngü; ve 4 °C'de son bir tutuş.
NOT: Başarılı bir WFISH için kritik olan PCR etiketleme yöntemiyle (5 μL'de ~1 μg) iyi bir prob konsantrasyonu elde etmek için PCR reaksiyonunun oldukça verimli olması gerekir. Bu nedenle, probu etiketlemeden önce, amplifikasyon için seçilen primerlerin etkinliğinin test edilmesi şiddetle tavsiye edilir. Ek olarak, PCR reaksiyonuna (floresan dUTP olmadan) pozitif bir kontrolün dahil edilmesi, etiketleme reaksiyonunun etkinliğinin doğrulanmasına yardımcı olacaktır. - Probu −20 °C'de karanlık bir yerde saklayın.
- 3' uçlu floresan oligonükleotid problarının elde edilmesi
- Nükleotid dizisinin 3' ucuna Cy3 veya Cy5 florokromları (veya başka herhangi bir florokrom) ekleyerek modifiye oligolar olarak ticari olarak temin edilebilen floresan oligonükleotid probları elde edin (bkz. Y-bağlı uydu AgY1-AgY477B bağlantı bölgesini ve Contig_240'den X-bağlı uyduyu etiketlemek için kullanılan referans dizileri için Tablo 53'deki primerlere/oligonükleotidi görün.
NOT: Kullanıcı genellikle satın almadan önce bunu seçebileceğinden, 3' uç etiketli oligonükleotidlerin konsantrasyonu ile ilgili herhangi bir teknik engel yoktur. Oligo probu kullanarak verimli etiketleme için hibridizasyon tamponunda ~800 ng oligo prob çözeltisinin seyreltilmesini öneririz. X ve Y'ye özgü oligo probları daha önce WFISH için Liang ve Sharakhov19 tarafından kullanılmıştır ve referans dizisi Tablo 1'de bulunabilir.
- Nükleotid dizisinin 3' ucuna Cy3 veya Cy5 florokromları (veya başka herhangi bir florokrom) ekleyerek modifiye oligolar olarak ticari olarak temin edilebilen floresan oligonükleotid probları elde edin (bkz. Y-bağlı uydu AgY1-AgY477B bağlantı bölgesini ve Contig_240'den X-bağlı uyduyu etiketlemek için kullanılan referans dizileri için Tablo 53'deki primerlere/oligonükleotidi görün.
2. Hibridizasyon çözeltisinin hazırlanması
NOT: Adım 1'de üretilen floresan problar, hedef dizilerle hibritleşen kimyasal bir çözeltiye dahil edilmelidir.
- Floresan in situ hibridizasyondan önce prob çökeltme
- 1.5 mL'lik bir tüpe, 5 μL etiketli DNA probu (PCR etiketleme yöntemiyle elde edilmişse) veya 1. adımdan 2.2 μL 3' modifiye oligo probu (~800 ng prob) ve 5 μL somon sperm DNA'sı ekleyin (bkz. Farklı genomik bölgelere özgü probları aynı tüpte birleştirin ve aşağıdaki adımlarda benzersiz bir çözüm olarak kullanın.
- 0.1 hacim 3 M sodyum asetat ve 2 hacim %100 etanol ekleyerek DNA probunu çökeltin. En az 2,5 saat −20 °C'de tutun (inkübasyon süresinin −20 °C'de artırılması nihai verimi artıracaktır). Bu aşamada, problar santrifüjlemeden önce gece boyunca da saklanabilir.
- 17.000 x g'da 4 °C'de 20 dakika santrifüjleyin, etanolü çıkarın ve peleti RT'de karanlıkta ~20 dakika havayla kurutun.
- Hibridizasyon çözümü
- Testis diseksiyonuna geçmeden önce (adım 3), aşağıdaki reaktifleri 1.5 tüpte karıştırarak hibridizasyon tamponunu hazırlayın: 500 μL formamid, 0.2 g dekstran sülfat, 100 μL 20x sodyum salin sitrat (SSC) ve 200 μL steril H20 (bkz. Hibridizasyon çözeltisini 1 dakika vorteksleyin ve dekstran sülfatın 37 ° C'de 30 dakika çözünmesine izin verin.
- Hibridizasyon çözeltisini elde etmek için peleti adım 2.1.3'ten 20-30 μL hibridizasyon tamponunda çözün (yaklaşık 1 dakika vorteksleyin, hızlı bir dönüş gerçekleştirin ve tüpleri karanlıkta 37 °C'de saklayın).
3. Testis diseksiyonu ve fiksasyonu
- Oda sıcaklığında (RT), steril 1x fosfat tamponlu salin (PBS) çözeltisinde pupalardan veya 1 günlük yetişkinlerdenen az ~ 20 testisi inceleyin ve bunları taze bir damla 1x PBS çözeltisi içeren temiz bir mikroskop lamına aktarın.
- Testisleri P1.000 geniş delikli filtreli uç veya 1x PBS'den bir diseksiyon iğnesinin ucu kullanarak% 0.1 Tween-20 (PBST) ile 1x PBS'de% 3.7 formaldehit içeren bir embriyo kabına aktarın ve RT'de 10 dakika inkübe edin.
- Testisleri RT'de 5 dakika boyunca 1x PBST'de yıkayın. Testisleri 37 ° C'de 30 dakika boyunca steril 1x PBS içinde seyreltilmiş 0.1 mg / mL RNAse A (Malzeme Tablosuna bakınız) içinde inkübe edin.
- RNAse çözeltisini çıkarın, penetran çözeltiyi ekleyin (1x PBST'de %1 Triton/0.1 M HCl) ve RT'de 10 dakika inkübe edin.
NOT: Proteinaz K, testislerin geçirgenliğini artırmak için 1x PBST'de 10 μg/mL'lik bir nihai konsantrasyonda penetran bir ajan olarak kullanılabilir. - Testisleri RT'de her biri 5 dakika boyunca iki kez 1x PBST'de yıkayın.
4. Hibridizasyon
NOT: Bu bölüm, yerinde hibridizasyon için son adımları açıklamaktadır.
- Yıkama adımından sonra (adım 3.5), testisleri önceden hazırlanmış probu içeren 20-30 μL hibridizasyon solüsyonu ile 1.5 mL'lik bir tüpe aktarın (adım 2.2.2). Çözeltiyi nazikçe karıştırmak için pipetin ucunu kullanın. Sonraki adımlara geçmeden önce tüpü beş kez hafifçe vurun.
- DNA denatürasyonu için 75 °C'de 5 dakika inkübe edin.
- DNA-DNA hibridizasyonunun bir gecesinde 37 °C'de (mümkünse 100 rpm'den daha az sallanarak) inkübe edin.
- Testisleri P1.000 geniş delikli filtrelenmiş uç kullanarak bir embriyo kabına geri aktarın ve 5 dakika boyunca 50 ° C'ye ısıtılmış 2x SSC'de yıkayın.
NOT: Hibridizasyon adımından sonra, 2x SSC kullanan son bir yıkama adımı gereklidir; Bu, organ dokusu içinde hibritlenmemiş probların varlığından kaynaklanan herhangi bir arka plan sinyalinin uzaklaştırılmasında önemli bir rol oynar. Güçlü bir arka plan sinyali varsa, son yıkama adımının tekrarlanması önerilir. - 2x SSC'yi çıkarın ve testisleri 4',6-diamidino-2-fenilindol (DAPI) (Malzeme Tablosuna bakınız) ile piyasada bulunan bir montaj ortamı kullanarak buzlu bir cam slayt üzerine monte edin, lamel dolgu macunu ile kapatın ve karanlıkta RT'de en az 2 saat inkübe edin.
- Konfokal görüntüleme gerçekleştirin. Tüm testisler 40x veya 63x yağa daldırma objektifleri kullanılarak görselleştirilebilir. Bir z-yığını gerçekleştirilirse, 1,25 μm'lik bir z-adımı kullanmanızı öneririz.
Sonuçlar
Bu çalışmada, An. gambiae'de spermatogenez sırasında kromozom davranışını araştırmak için WFISH kullanılmıştır. Bu protokolün uygulanmasında ilk önemli adım, diseksiyon sonrası düşük düzeyde morfolojik değişiklik gösteren testislerin elde edilmesidir. Başarılı bir testis diseksiyonu gerçekleştirmek için sivrisinek anatomisi hakkında temel bilgi gereklidir ve aşağıda bu prosedür için bazı kılavuzlar verilmiştir. Anofel sivrisineklerinde, olgun testisler pupa ve yetişkin evrelerinin altıncı karın segmentinde bulunabilir21. Şekil 1'de gösterildiği gibi, vas deferens testisleri karnın son segmentinde bulunan erkek aksesuar bezlerine (MAG'ler) bağlar. MAG'ler, spermleri ve seminal sıvıları çiftleşme organına ve erkek genital aparatınındış kısmına ileten benzersiz bir boşalma kanalına bağlanır 21. Tüm iç erkek genital aparatı, sivrisineğin yaşam evresine bağlı olarak farklı yaklaşımlar kullanılarak diseke edilebilir. Pupa evresinde, altıncı segmentin yakınında karnın ventral tarafına bakılarak ışık kütikülü boyunca stereomikroskop kullanılarak testisler kolayca tanımlanabilir (Şekil 1). Testisleri incelemek için, altıncı segment de dahil olmak üzere karnın alt kısmı, bir çift iğne kullanılarak vücudun geri kalanından izole edilebilir ve temiz bir 1x PBS damlasına aktarılabilir. Son segmentin çıkarılmasını takiben, diseksiyon iğneleri ile hafif basınç uygulanarak tüm aparat karın dışına ezilebilir. Testisleri yetişkin erkeklerden ayırmak için ilk adım, tüm karnı taze bir 1x PBS damlasında izole etmeyi ve ardından erkek çiftleşme yapıları olan tokaları taşıyan son segmenti çıkarmayı içerir (Şekil 1). Bu noktada MAG'lerin alt kısmı ortaya çıkmalı ve sarı renklerinden dolayı kolayca ayırt edilebilmelidir. Tüm erkek aparatı daha sonra bir iğne veya forseps yardımıyla vas deferens'e bağlı testis çifti görünene kadar 1x PBS'lik bir damla ile yavaşça dışarı çekilebilir. Fiksasyona geçmeden önce, vas deferensin alt kısmının yakınından kesilerek testislerin erkek aparatının diğer kısımlarından izole edilmesi önemlidir (Şekil 1).
Pupaların veya yetişkin erkeklerin yaşı, araştırılan spermatogenez aşamasına bağlı olarak dikkate alınması gereken önemli bir faktördür. An. gambiae'de spermatogenez erken/orta pupa evresinde başlar ve bireyin tüm yaşamı boyunca devam eder24. Pupasyondan 3 saat ila 10 saat sonra, premayotik ve mayotik aşamalar testiste daha fazla temsil edilir (mayotik faz, mayotik bölünmeler), spermatid DNA'sı nispeten yoğunlaşmamıştır ve olgun spermler henüz oluşmamıştır. Geç pupa ve 1 günlük yetişkinler premayotik, mayotik ve mayotik sonrası aşamalar arasında iyi bir denge sunar (Şekil 2 ve Şekil 3). 4 günlükten daha eski yetişkinlerde, premayotik evreler ve spermatokistler daha az temsil edilir ve testisler esas olarak sperm rezervuarında bulunan olgun spermler tarafından işgal edilir.
Spermatogenezin farklı aşamalarında cinsiyet kromozomlarının davranışını araştırmak için, tüm sürecin iyi bir temsilini sağlamak için geç pupa aşamasında diseke edilen testisler üzerinde WFISH gerçekleştirildi. Bu kromozomların davranışını takip etmek için, yalnızca X veya Y kromozomunda bulunan tekrarlayan dizilere özgü floresan problar kullanıldı. Floresan problar, PCR kullanılarak üretilebilir veya ticari olarak 3' uç etiketli oligonükleotidler olarak elde edilebilir. Floresan oligo probundan iyi sinyal algılaması sağlamak için >40 bps uzunluğunda bir oligo kullanılması önerilir. Deneyimlerimize göre, 3' uç etiketli oligolar, sinyal tespiti açısından PCR etiketli problardan daha iyi performans gösterir. Ek olarak, hedef dizinin kopya sayısı WFISH'in etkinliğini etkileyebilecek bir faktördür. Etiketleme başarısız olursa, daha uzun bir parça üzerinde PCR etiketleme yönteminin kullanılması veya hedef bölgeye özgü birkaç oligo tasarlanması önerilir.
Penetran bir çözelti (1x PBST'de %1 Triton/0.1 M HCl) kullanımına dayanan mevcut yöntemler, iyi düzeyde testis geçirgenliğine ve probların penetrasyonuna izin vererek başarılı bir hibridizasyon reaksiyonu ile sonuçlanır. Cinsiyet kromozomu tekrarlayan dizilere özgü oligo problar, Hall ve ark.20 tarafından gerçekleştirilen tekrarlayan elementlerin kapsamlı karakterizasyonuna dayalı olarak tasarlanabilir. Ek olarak, X- veya Y-bağlantılı tekrarlayan elemanlara özgü konsensüs dizileri, RedKmer boru hattı30 gibi bir biyoinformatik platform kullanılarak elde edilebilir. Cinsiyet kromozomu problarının uydular ve retrotranspozonlar gibi tekrarlayan unsurları hedefleyebildiğini ve incelenen türebağlı olarak X veya Y kromozomları ile farklı bir hibridizasyon seviyesine sahip olabileceklerini fark etmek önemlidir 20,31,32. Şekil 3'te gösterildiği gibi, probların iyi bir hibridizasyon seviyesi ve düşük arka plan, spermatogenez boyunca hedeflenen kromozomların görselleştirilmesine izin verdi. Etiketli cinsiyet kromozomlarının eşleşmesi, premayotik ve mayotik aşamalarda görülebilir. Bunu, mayotik bölünmelerden kaynaklanan haploid hücre çekirdeği kromozomlarındaki X veya Y kromozomlarının saptanması izledi. Daha sonra, X veya Y içeren spermatidler, farklı DNA yoğunlaşma seviyeleri ile işaretlenmiş spermiyogenez boyunca, ok şeklindeki olgun spermatozoanın son adımına kadar takip edilebilir. Mevcut deney düzeneğinde, bu işlem sırasında hücrelerin 3 boyutlu uzamsal organizasyonu hakkında bilgi edinmek için konfokal Z-yığınları kullanılmıştır (Video 1).
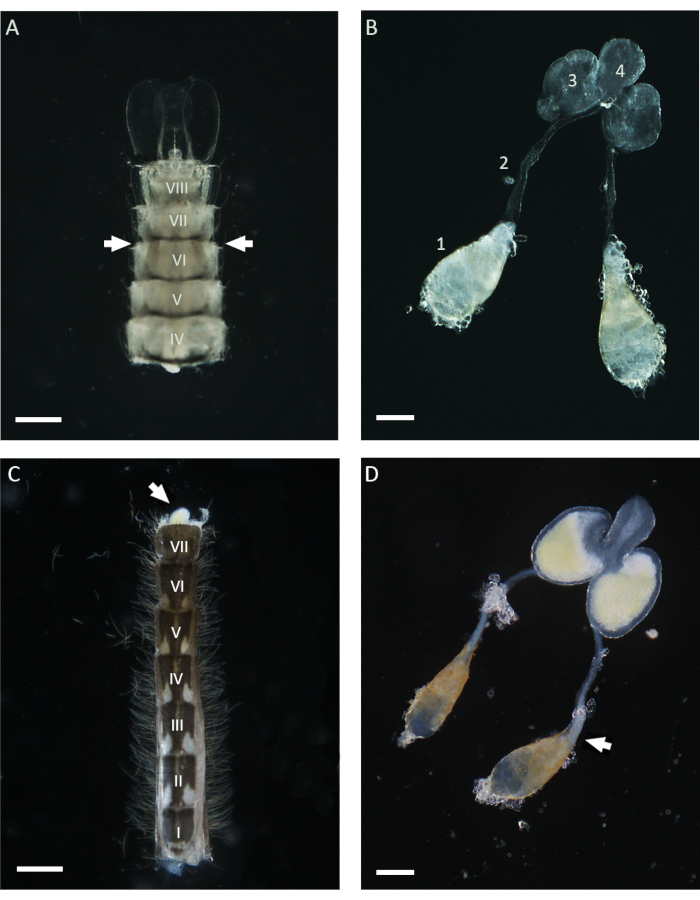
Şekil 1: Pupalardan ve 1 günlük erişkin Anopheles gambiae erkeklerinden diseke edilen testisler. (A) Geç pupa evresinde diseke edilen bir karın, testislerin altıncı karın segmentinin yakınında konumunu gösterir. Testisler kütikül boyunca tanımlanabilir ve karnın her iki tarafında kahverengimsi yapılar olarak görünür (oklarla). (B) Pupa aşamasında diseke edilen testisler, olgun testisleri (1), vas deferens (2), MAG'leri (3) ve boşalma kanalını (4) gösterir. (C) Bazal toka segmenti çıkarıldıktan sonra 1 günlük yetişkin bir erkekten çıkarılan bir karın. MAG'ler hafif bir basınç (beyaz ok) uygulanarak karından ezilebilir. (D) 1 günlük yetişkin bir erkekten çıkarılan erkek iç üreme aparatı. Beyaz ok, testisin bazal kutbunda beyaz bir agrega olarak görünen olgun spermlerin işgal ettiği pozisyonu gösterir. Ölçek çubukları: (A,C) 200 μm; (B,D) 100 μm. I'den VIII'e kadar olan Romen rakamları karın segmentlerini gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
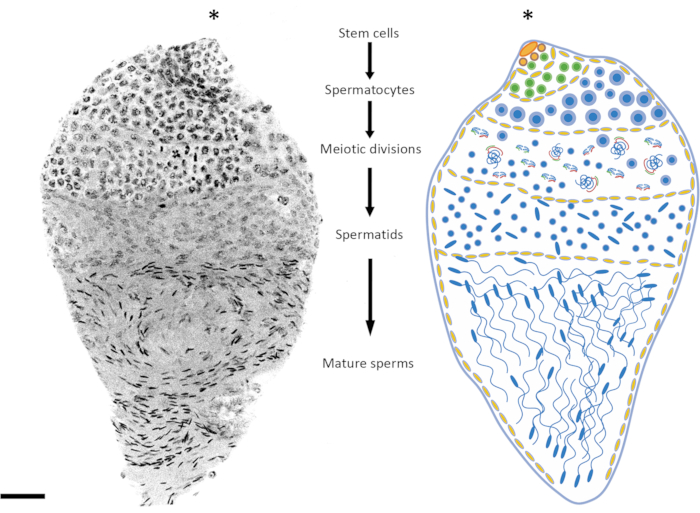
Şekil 2: Anopheles gambiae'de spermatogenezin temsili.Soldaki resim, tam montajlı DAPI boyamasını takiben bir An. gambiae geç pupa testisini göstermektedir. Sağ tarafta, daha iyi görselleştirme için şematik bir versiyon var. Nükleer şekli ve yoğunlaşma seviyesini gözlemleyerek, diploid hücrelerden haploid spermatozoaya kadar tüm spermatogenez aşamalarını takip etmek nispeten kolaydır. Kök hücre nişi, spermatogonia'ya farklılaşmanın başladığı organın üst kutbunda bulunur. Spermatogonia hücreleri mitotik bölünmeden sonra sayıca artar (yeşil hücreler) ve spermatokistlerin boyutu artar (sarı hücreler). Spermatogonia hücreleri, birden fazla mitotik bölünme turundan (mavi hücreler) sonra spermatositlere farklılaşır. İşlemin diğer aşamalarındaki hücrelerden nispeten daha büyük çekirdeklerle karakterize edilen spermatositler, mayotik bölünmeye uğrayacak hücrelerdir. Mayoz bölünme geçiren hücreler, farklı mayotik aşamalarda kromozomların varlığına bakılarak tespit edilebilir; Kiazmata ve metafaz kromozomları düşük büyütmede bile tespit edilebilir. Premayotik evreler, erken pupa evresinde diseke edilen testislerde aşırı temsil edilir. Birinci ve ikinci mayotik bölünmelerden sonra spermatidler üretilir ve genellikle testisin ortasında bulunur. Spermatidlerin çekirdekleri, yuvarlaktan ok benzeri bir şekle kadar şekillerinde belirli bir derecede değişiklik gösterir. Spermatidler, çekirdeklerin yoğunlaşmaya başladığı spermiyogenez sürecine girer ve yapıları ok benzeri noktalara dönüşür. Sivrisinekler ortaya çıktıktan sonra cinsel olarak olgunlaştığında, olgun spermler içeren spermatokistler, farklı bir gelişim aşamasında spermatokistler pahasına testis hacminin çoğunu işgal edebilir. Ölçek çubuğu: 20 μm. Yıldız işareti (*) testisin apikal kısmını gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
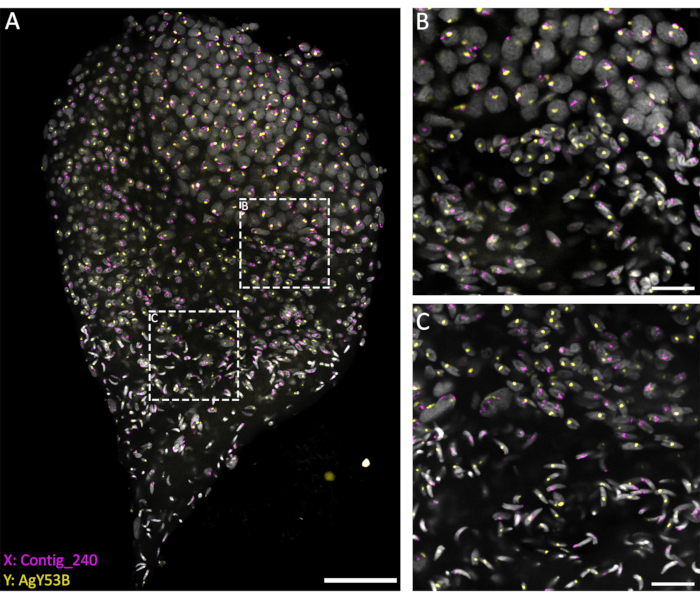
Şekil 3: Geç pupa evresinden diseke edilen bir An. gambiae testisi üzerinde WFISH. WFISH, X (Contig_240) ve Y (AgY53B'ye özgü oligo probu) kromozomlarına özgü problar kullanılarak gerçekleştirildi. (A) WFISH, diploid hücrelerden haploid spermatozoaya spermatozoa spermatogenez sırasında cinsiyet kromozomunun davranışını izlemeye izin verir. Bu görüntüde, çekirdeklerin spermatogenez sırasında geçirdiği dramatik değişiklikleri takdir etmek mümkündür. Cinsiyet kromozomlarının etiketlenmesi, diploid ve haploid hücreler arasında ayrım yapılmasına izin verir. Diploid hücrelerde, cinsiyet kromozomlarından gelen sinyal aynı çekirdeğe bağlanır. Haploid hücrelerde (spermatidler ve spermatozoa), cinsiyet kromozomlarının sinyali, mayotik indirgeme bölünmesi nedeniyle bağlantısızdır. (B,C) Testisin daha yüksek büyütmeli (63x) bir görüntüsü (A)'da gösterilmiştir. Z ekseni boyunca farklı konumlarda elde edildiler. Beyaz noktalı çerçeveler edinme alanını gösterir. (B) Spermatositler ve spermatidler arasındaki geçiş aşaması, haploid hücrelerin oluşumunu ve cinsiyet kromozomlarından gelen sinyallerin ayrı çekirdeklere ayrılmasını gösterir. (C) Haploid spermatidler ve olgun spermatozoa arasındaki geçiş aşaması. Bu aşama nükleer yoğunlaşma seviyesindeki değişiklikleri gösterir; Olgun spermatozoalar, spermatidlerden daha yoğun ve uzun bir şekil gösterir. Ölçek çubukları: (A), 30 μm; (B,C), 10 μm; Gri: DAPI. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Hedef dizisi | Primer Dizisi ve Oligo-prob konsensüsü | Referans |
| Contig_240 (X) | 5'-CAATAAATTTCCTTTTTAATGATGC AAAATCTACGTCTCTAGC-3'-[Florokrom] | 19 |
| AgY53B (Y) | 5'AGAAGAATAGAATCAGAATAGTCGG TTTCTTCATCCTGAAAGCC-3'-[Florokrom] | Bu çalışma |
| AgY477- AgY53B Kavşak bölge (Y) | 5'-TTCTAAGTTTCTAGGCTTTAAGGAT GAAGAAACCGACTATTC-3'-[Florokrom] | 19 |
| 18S rDNA (X) | F: AACTGTGGAAAAGCCAGAGC R: TCCACTTGATCCTTGCAAAA | 19 |
| AgY53B (Y) | F: CCTTTAAACACATGCTCAAATT R: GTTTCTTCATCCTTAAAGCCTAG | 19 |
Tablo 1: An. gambiae'de X veya Y kromozomuna özgü oligo probların listesi.
Video 1: WFISH'te bir An. gambiae testis, geç pupa aşamasından diseke edildi. Spermatogenez sürecinin 3 boyutlu bir temsilini elde etmek için, az sayıda yapısal değişiklik gösteren testisler üzerinde konfokal bir 3 boyutlu yığın gerçekleştirilebilir. Bu çalışmada, hücrelerin 3 boyutlu uzamsal organizasyonu hakkında bilgi kaybetmemek için yığınlar, 63x veya 40x yağ merceği altında iki optik kesit arasında 1.25 μm aralıklarla gerçekleştirilmiştir. Gri: DAPI, sarı: Contig_240 (X), macenta: AgY53B (Y). Bu videoyu indirmek için lütfen buraya tıklayın.
Tartışmalar
Genellikle, FISH protokolleri, kromozom boyamasına izin vermek için ilgilenilen organın ezilmesini gerektirir. Bu, o organ içindeki hücrelerin mekansal düzenlemesi ile ilgili bilgi kaybına neden olur33. Bu protokol, testisin bozulmamış doğal yapısını ve iç sitolojik organizasyonunu korurken, spermatogenez gibi biyolojik süreçlerin in situ olarak nasıl çalışılabileceğini açıklar. Özellikle cinsiyet kromozomları20 bakımından zenginleştirilmiş farklı DNA tekrarlayan unsurları hedefleyen problar, sperm olgunlaşmasının dinamiklerini ortaya çıkarmak için aynı anda kullanılabilir. Testis diseksiyonunun zamanlamasına bağlı olarak, WFISH, sivrisinek gelişimi yoluyla spermatogenezin farklı aşamalarını inceleme fırsatı sunar. WFISH, Anofel sivrisineklerinde premeiotik başarısızlık ve cinsiyet kromozomu ayrılmaması gibi mayotik kusurların varlığından kaynaklanan melez uyumsuzluk gibi belirli fenomenleri incelemek için yararlıdır 19,34,35. Biyolojik yönün yanı sıra, spermatogenez, Anofel sivrisinekleri gibi zararlı böcekleri kontrol etmek için geliştirilen bir dizi genetik stratejinin hedefidir. Bu bağlamda, An. gambiae'nin X'e bağlı rDNA lokusu, X taşıyan spermlere zarar vererek dölleri erkeklere karşı önyargılı hale getiren sentetik bir cinsiyet oranı bozucu geliştirmek için bir hedef olarak kullanılmıştır 4,8,13.
Bu teknoloji, sivrisinekler de dahil olmak üzere çeşitli taksonlarda tanımlanan, ancak yine de tam olarak anlaşılamayandoğal cinsiyet oranı mayotik sürücülerinin etkisini yansıtır 28,36,37,38,39,40,41. WFISH, bu fenomeni araştırma fırsatı sunar ve örneğin, sperm üretiminin sitolojisinin, cinsiyet kromozomu parçalama için kullanılan hedef bölgelerin seçiminden nasıl etkilendiği hakkında bilgi sağlayarak, cinsiyet çarpıtmasına dayalı genetik stratejilerin rafine edilmesinin veya iyileştirilmesinin yolunu açar. Deneyimlerimize göre, WFISH yüksek başarı şansı gösterse de, başarısızlık yine de meydana gelebilir. Bu, penetran çözeltinin inkübasyon süresini artırarak üstesinden gelinebilen verimsiz bir doku geçirgenliği seviyesinden kaynaklanıyor olabilir. Alternatif olarak, geçirgenlik aşaması sırasında Proteinaz K kullanılabilir. Bazı durumlarda, spermatosit çekirdeklerinde daha yüksek bir sinyal ve mayotik ve spermiyogenez aşamalarında daha düşük veya eksik bir sinyal ile düzgün olmayan bir prob penetrasyonu seviyesi fark ettik. Bu, hücre aşamasına bağlı olarak geçirgenlik seviyesindeki bir farktan kaynaklanıyor olabilir. Ek olarak, WFISH, yüksek kopya sayılarında bulunan DNA dizilerini hedeflemek için tasarlanmış floresan problar kullanıldığında değerli olduğunu kanıtladı. Tek kopya genleri hedeflerken, sinyal tespiti yeterli olmayabilir. Bu durumda, tiramid sinyal amplifikasyonu (TSA) gibi sinyal amplifikasyonu yöntemleri entegre edilmelidir42.
Bu protokol, immün boyama veya germ hattına özgü floresan belirteçleri16,18 barındıran transgenik raportör suşlarla birleştirilebilir, çünkü bu, protein lokalizasyonu ve gen ekspresyonu in situ hakkında bilgi ekleyecektir.Bu çalışmada WFISH, Anofel sivrisineklerinde spermatogenezi araştırmak için bir teknik olarak tanımlanmaktadır; Bununla birlikte, erkek üreme organlarının ortak anatomisi göz önüne alındığında, bu protokol hastalık bulaşmasında rol oynayan diğer sivrisinek türlerine uygulanabilir. Benzer şekilde, kadın gametogenezi bu teknik kullanılarak araştırılabilir. Ek olarak, parazit istilası için bir hedef olan sivrisinek midgut veya melez sivrisineklerde olduğu gibi atipik genetik arka planlar gibi ilgilenilen organ veya dokularda sitolojik çalışmalar araştırılabilir43. Ayrıca, bu teknik potansiyel olarak Diptera düzeni içindeki diğer organizmalara aktarılabilir.
Açıklamalar
Yazarların açıklayacak hiçbir şeyi yok.
Teşekkürler
Bu çalışma, Bill & Melinda Gates Vakfı ve Open Philanthropy'den bir hibe ile desteklenmiştir. Mikroskopi analizi için Imperial College London'daki Işık Mikroskobu ile Görüntüleme Tesisi'ne (FILM) teşekkür ederiz. Şekil 2 Biorender.com ile oluşturulmuştur.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Amersham CyDye Fluorescent Nucleotides, Cy3-dUTP | Cytiva | PA53022 | |
| Amersham CyDye Fluorescent Nucleotides, Cy5-dUTP | Cytiva | PA55022 | |
| ART Wide Bore Filtered Pipette Tips | ThermoFisher Scientific | 2079GPK | |
| CytoBond Removable Coverslip Sealant | SciGene | 2020-00-1 | |
| Dextran sulfate sodium salt from Leuconostoc spp. | Sigma-Aldrich | D8906-5G | |
| DNeasy Blood & Tissue Kits | Qiagen | 69504 | |
| Embryo Dishes | VWR | 70543-30 | |
| Ethanol, molecular grade | Sigma-Aldrich | 51976 | |
| Formamide | ThermoFisher Scientific | 17899 | |
| GoTaq G2 DNA Polymerase | Promega | M7841 | |
| Hydrochloric acid, 37% | Sigma-Aldrich | 320331 | |
| Microscope slides, SuperFrost | VWR | 631-0114 | |
| PBS (10x), pH 7.4 | ThermoFisher Scientific | 70011044 | |
| Pierce 16% Formaldehyde (w/v), Methanol-free | ThermoFisher Scientific | 28906 | |
| ProLong Gold Antifade Mountant with DAPI | ThermoFisher Scientific | P36941 | |
| RNase A/T1 Mix | ThermoFisher Scientific | EN0551 | |
| Set of dATP, dCTP, dGTP, dTTP | Promega | U1330 | |
| Sodium Acetate Solution | ThermoFisher Scientific | R1181 | |
| SP8 inverted confocal microscope | Leica | ||
| Triton X-100 | Sigma-Aldrich | 9036-19-5 | |
| TWEEN 20 | Sigma-Aldrich | P1379 | |
| UltraPure Salmon Sperm DNA Solution | ThermoFisher Scientific | 15632011 | |
| UltraPure SSC 20x | ThermoFisher Scientific | 15557044 | |
| Primer sequences | |||
| 5’-CAATAAATTTCCTTTTTAATGATGC AAAATCTACGTCTCTAGC-3’-[Fluorochrome] | Eurofins Genomics | Contig_240 (X) | |
| 5’AGAAGAATAGAATCAGAATAGT CGG TTTCTTCATCCTGAAAGCC-3’-[Fluorochrome] | Eurofins Genomics | AgY53B (Y) | |
| 5’-TTCTAAGTTTCTAGGCTTTAAGGA T GAAGAAACCGACTATTC-3’-[Fluorochrome] | Eurofins Genomics | AgY477- AgY53B junction region (Y) | |
| F: AACTGTGGAAAAGCCAGAGC R: TCCACTTGATCCTTGCAAAA | Eurofins Genomics | 18S rDNA (X) | |
| F: CCTTTAAACACATGCTCAAATT R: GTTTCTTCATCCTTAAAGCCTAG | Eurofins Genomics | AgY53B (Y) |
Referanslar
- World Malaria Report. World Health Organization Available from: https://www.who.int/teams/global-malaria-programme/reports/world-malaria-report-2022 (2022)
- Bhatt, S., et al. The effect of malaria control on Plasmodium falciparum in Africa between 2000 and 2015. Nature. 526 (7572), 207-211 (2015).
- Hammond, A., et al. A CRISPR-Cas9 gene drive system targeting female reproduction in the malaria mosquito vector Anopheles gambiae. Nature Biotechnology. 34 (1), 78-83 (2016).
- Galizi, R., et al. A synthetic sex ratio distortion system for the control of the human malaria mosquito. Nature Communications. 5 (1), 3977 (2014).
- Kyrou, K., et al. A CRISPR-Cas9 gene drive targeting doublesex causes complete population suppression in caged Anopheles gambiae mosquitoes. Nature Biotechnology. 36 (11), 1062-1066 (2018).
- Simoni, A., et al. A male-biased sex-distorter gene drive for the human malaria vector Anopheles gambiae. Nature Biotechnology. 38 (9), 1054-1060 (2020).
- Gantz, V. M., et al. Highly efficient Cas9-mediated gene drive for population modification of the malaria vector mosquito Anopheles stephensi. Proceedings of the National Academy of Sciences of the United States of America. 112 (49), E6736-E6743 (2015).
- Bernardini, F., Kriezis, A., Galizi, R., Nolan, T., Crisanti, A. Introgression of a synthetic sex ratio distortion system from Anopheles gambiae into Anopheles arabiensis. Scientific Reports. 9 (1), 5158 (2019).
- Hammond, A. M., Galizi, R. Gene drives to fight malaria: Current state and future directions. Pathogens and Global Health. 111 (8), 412-423 (2017).
- Garrood, W. T., et al. Driving down malaria transmission with engineered gene drives. Frontiers in Genetics. 13, 891218 (2022).
- Hoermann, A., et al. Gene drive mosquitoes can aid malaria elimination by retarding Plasmodium sporogonic development. Science Advances. 8 (38), (2022).
- Nash, A., et al. Integral gene drives for population replacement. Biology Open. 8 (1), (2019).
- Galizi, R., et al. A CRISPR-Cas9 sex-ratio distortion system for genetic control. Scientific Reports. 6 (1), 31139 (2016).
- Terradas, G., Hermann, A., James, A. A., McGinnis, W., Bier, E. High-resolution in situ analysis of Cas9 germline transcript distributions in gene-drive Anopheles mosquitoes. G3: Genes, Genomes, Genetics. 12 (1), (2022).
- Durant, A. C., Donini, A. Ammonium transporter expression in sperm of the disease vector Aedes aegypti mosquito influences male fertility. Proceedings of the National Academy of Sciences of the United States of America. 117 (47), 29712-29719 (2020).
- Taxiarchi, C., et al. High-resolution transcriptional profiling of Anopheles gambiae spermatogenesis reveals mechanisms of sex chromosome regulation. Scientific Reports. 9 (1), 14841 (2019).
- Pompon, J., Levashina, E. A. A new role of the mosquito complement-like cascade in male fertility in Anopheles gambiae. PLoS Biology. 13 (9), e1002255 (2015).
- Papathanos, P. A., Windbichler, N., Menichelli, M., Burt, A., Crisanti, A. The vasa regulatory region mediates germline expression and maternal transmission of proteins in the malaria mosquito Anopheles gambiae: A versatile tool for genetic control strategies. BMC Molecular Biology. 10 (1), 13 (2009).
- Liang, J., Sharakhov, I. V. Premeiotic and meiotic failures lead to hybrid male sterility in the Anopheles gambiae complex. Proceedings of the Royal Society B. 286 (1906), 20191080 (2019).
- Hall, A. B., et al. Radical remodeling of the Y chromosome in a recent radiation of malaria mosquitoes. Proceedings of the National Academy of Sciences of the United States of America. 113 (15), E2114-E2123 (2016).
- Clements, A. N. . The Biology of Mosquitoes. Volume 1: Development, Nutrition and Reproduction. , (1992).
- Demarco, R. S., Eikenes, &. #. 1. 9. 7. ;. H., Haglund, K., Jones, D. L. Investigating spermatogenesis in Drosophila melanogaster. Methods. 68 (1), 218-227 (2014).
- Helinski, M. E., Parker, A. G., Knols, B. G. Radiation biology of mosquitoes. Malaria Journal. 8, S6 (2009).
- Huho, B. J., et al. A reliable morphological method to assess the age of male Anopheles gambiae. Malaria Journal. 5 (1), 62 (2006).
- Fabian, L., Brill, J. A. Drosophila spermiogenesis. Spermatogenesis. 2 (3), 197-212 (2012).
- Li, M., et al. Suppressing mosquito populations with precision guided sterile males. Nature Communications. 12 (1), 5374 (2021).
- Thailayil, J., Magnusson, K., Godfray, H. C., Crisanti, A., Catteruccia, F. Spermless males elicit large-scale female responses to mating in the malaria mosquito Anopheles gambiae. Proceedings of the National Academy of Sciences of the United States of America. 108 (33), 13677-13681 (2011).
- Haghighat-Khah, R. E., et al. Cellular mechanisms regulating synthetic sex ratio distortion in the Anopheles gambiae germline. Pathogens and Global Health. 114 (7), 370-378 (2020).
- Yamamoto, D. S., et al. A synthetic male-specific sterilization system using the mammalian pro-apoptotic factor in a malaria vector mosquito. Scientific Reports. 9 (1), 8160 (2019).
- Papathanos, P. A., Windbichler, N. Redkmer: An assembly-free pipeline for the identification of abundant and specific X-chromosome target sequences for X-shredding by CRISPR endonucleases. The CRISPR Journal. 1 (1), 88-98 (2018).
- Sharma, A., Kinney, N. A., Timoshevskiy, V. A., Sharakhova, M. V., Sharakhov, I. V. Structural variation of the X chromosome heterochromatin in the Anopheles gambiae complex. Genes. 11 (3), 327 (2020).
- Krzywinski, J., Sangaré, D., Besansky, N. J. Satellite DNA from the Y chromosome of the malaria vector Anopheles gambiae. Genetics. 169 (1), 185-196 (2005).
- Timoshevskiy, V. A., Sharma, A., Sharakhov, I. V., Sharakhova, M. V. Fluorescent in situ hybridization on mitotic chromosomes of mosquitoes. Journal of Visualized Experiments. (67), e4215 (2012).
- Liang, J., Hodge, J. M., Sharakhov, I. V. Asymmetric phenotypes of sterile hybrid males from reciprocal crosses between species of the Anopheles gambiae complex. Frontiers in Ecology and Evolution. 9, 660207 (2021).
- Slotman, M., Torre, A. D., Powell, J. R. The genetics of inviability and male sterility in hybrids between Anopheles gambiae and An. arabiensis. Genetics. 167 (1), 275-287 (2004).
- Wood, R. J., Newton, M. E. Sex-ratio distortion caused by meiotic drive in mosquitoes. The American Naturalist. 137 (3), 379-391 (1991).
- Cazemajor, M., Joly, D., Montchamp-Moreau, C. Sex-ratio meiotic drive in Drosophila simulans is related to equational nondisjunction of the Y chromosome. Genetics. 154 (1), 229-236 (2000).
- Jaenike, J. Sex chromosome meiotic drive. Annual Review of Ecology and Systematics. 32 (1), 25-49 (2001).
- Courret, C., Chang, C. H., Wei, K. H., Montchamp-Moreau, C., Larracuente, A. M. Meiotic drive mechanisms: Lessons from Drosophila. Proceedings of the Royal Society B. 286 (1913), 20191430 (2019).
- Zanders, S. E., Unckless, R. L. Fertility costs of meiotic drivers. Current Biology. 29 (11), R512-R520 (2019).
- Newton, M. E., Wood, R. J., Southern, D. I. A cytogenetic analysis of meiotic drive in the mosquito, Aedes aegypti (L.). Genetica. 46 (3), 297-318 (1976).
- Carabajal Paladino, L. Z., Nguyen, P., Šíchová, J., Marec, F. Mapping of single-copy genes by TSA-FISH in the codling moth, Cydia pomonella. BMC Genomic Data. 15, S15 (2014).
- Bernardini, F., et al. Cross-species Y chromosome function between malaria vectors of the Anopheles gambiae species complex. Genetics. 207 (2), 729-740 (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır