Method Article
Hybridation in situ par fluorescence complète pour étudier la spermatogenèse chez le moustique anophèle
Dans cet article
Résumé
Compte tenu de leur anatomie simple, les testicules d’anophèles offrent un bon modèle cytologique pour l’étude de la spermatogenèse. Ce protocole décrit l’hybridation in situ par fluorescence complète, une technique utilisée pour étudier ce processus biologique, ainsi que le phénotype des souches transgéniques présentant des mutations dans les gènes impliqués dans la production de spermatozoïdes.
Résumé
La spermatogenèse est un processus biologique complexe au cours duquel les cellules diploïdes subissent une division mitotique et méiotique successive, suivie de grands changements structurels pour former des spermatozoïdes haploïdes. Outre l’aspect biologique, l’étude de la spermatogenèse est d’une importance capitale pour la compréhension et le développement de technologies génétiques telles que le forçage génétique et les distordeurs synthétiques du sex-ratio, qui, en modifiant respectivement l’hérédité mendélienne et le sex-ratio des spermatozoïdes, pourraient être utilisées pour contrôler les populations d’insectes ravageurs. Ces technologies se sont avérées très prometteuses en laboratoire et pourraient potentiellement être utilisées pour contrôler les populations sauvages de moustiques anophèles , qui sont des vecteurs du paludisme. En raison de la simplicité de l’anatomie testiculaire et de leur importance médicale, Anopheles gambiae, un vecteur majeur du paludisme en Afrique subsaharienne, représente un bon modèle cytologique pour l’étude de la spermatogenèse. Ce protocole décrit comment l’hybridation in situ par fluorescence complète (WFISH) peut être utilisée pour étudier les changements spectaculaires de la structure nucléaire cellulaire par spermatogenèse à l’aide de sondes fluorescentes qui colorent spécifiquement les chromosomes X et Y. La FISH nécessite généralement la perturbation des organes reproducteurs pour exposer les chromosomes mitotiques ou méiotiques et permettre la coloration de régions génomiques spécifiques avec des sondes fluorescentes. WFISH permet de préserver la structure cytologique native du testicule, couplée à un bon niveau de détection du signal à partir de sondes fluorescentes ciblant des séquences d’ADN répétitives. Cela permet aux chercheurs de suivre les changements dans le comportement chromosomique des cellules subissant une méiose le long de la structure de l’organe, où chaque phase du processus peut être clairement distinguée. Cette technique pourrait être particulièrement utile pour étudier l’appariement méiotique des chromosomes et étudier les phénotypes cytologiques associés, par exemple, aux distorsions synthétiques du sex-ratio, à la stérilité masculine hybride et à l’élimination des gènes impliqués dans la spermatogenèse.
Introduction
Le paludisme fait peser un lourd fardeau sur la santé et le bien-être de la population mondiale. En 2021, l’Organisation mondiale de la santé (OMS) estimait que le paludisme avait causé 619 000 décès, dont 96 % en Afrique subsaharienne1. La maladie est transmise par des moustiques appartenant au genre Anopheles, et en Afrique subsaharienne, trois espèces, à savoir Anopheles gambiae (An. gambiae), Anopheles coluzzi (An, coluzzi) et Anopheles arabiensis (An. Arabiensis) jouent un rôle disproportionné dans la transmission du paludisme, représentant 95 % des cas de paludisme dans le monde. Les programmes de lutte reposant sur des méthodes traditionnelles telles que les insecticides et les antipaludiques ont sauvé des millions de vies. Cependant, ces dernières années, la résistance croissante à ces méthodes de contrôle a remis en question leur efficacité 1,2. En outre, les restrictions imposées par la pandémie de COVID-19 ont affecté la disponibilité des principales interventions de lutte contre le paludisme, ce qui, selon le Rapport mondial sur le paludisme 2022 de l’OMS, a augmenté l’incidence du paludisme1. Au cours des deux dernières décennies, de nouvelles méthodes de lutte génétique ont été mises au point en laboratoire pour cibler les moustiques anophèles 3,4,5,6,7,8,9,10. Parmi ces stratégies, celles basées sur les systèmes de forçage génétique (GDS) et les distordeurs synthétiques du sex-ratio (SD) semblent prometteuses. Les GDS reposent sur la possibilité de transmettre, à une fréquence très élevée, une modification génétique qui affecte la fertilité des femelles ou altère le cycle de vie du parasite chez le moustique 5,11,12. Les SD, au contraire, agissent en biaisant le rapport de masculinité d’une progéniture de moustique vers les mâles, ce qui conduit, au fil du temps, à l’effondrement d’une population cible en raison d’un manque de femelles 4,6,13. Les principaux composants de ces systèmes génétiques agissent principalement sur les organes reproducteurs des moustiques, où les gamètes, les ovules et les spermatozoïdes sont produits après la division méiotique14.
Dans ce protocole, les progrès des techniques cytogénétiques sont utilisés pour explorer la spermatogenèse chez An. gambiae en se concentrant sur le comportement des chromosomes in situ. La structure du testicule du moustique et les processus biologiques qui s’y déroulent ont déjà été étudiés à l’aide d’un certain nombre de méthodes cytologiques, telles que l’immunofluorescence, les transgènes rapporteurs fluorescents et l’hybridation in situ par fluorescence de l’ADN et de l’ARN (FISH)15,16,17,18,19,20; Les organes présentent une forme fusiforme, dans laquelle le pôle inférieur est attaché à un conduit déférent relié aux glandes accessoires mâles. Dans le pôle supérieur, la niche des cellules souches germinales prolifère et se différencie en cellules de spermatogonie intégrées dans des spermatocystes formés par des cellules somatiques. Après plusieurs cycles de division mitotique, les spermatogonies se différencient en spermatocytes, qui entrent en méiose. Lors de la prophase, les chromosomes autosomiques et sexuels s’appairent avec leurs homologues et se croisent. Après les divisions méiotiques, des spermatides haploïdes rondes sont générées et entrent en spermiogenèse, et ce processus conduit à la formation de spermatozoïdes haploïdes matures dans lesquels le cytoplasme a été retiré, la chromatine nucléaire est condensée et les flagelles émergent dans la partie basale des noyaux21,22 (Figure 1 et Figure 2).
En général, la spermiogenèse commence vers le stade mi-nymphal, et les spermatozoïdes matures peuvent être détectés au stade nymphal tardif dans le réservoir de spermatozoïdes23. Le processus de maturation des spermatocystes se poursuit au cours de la vie adulte23,24,25. Chez les testicules anophèles, chaque étape de la spermatogenèse peut être facilement identifiée en examinant la morphologie nucléaire des cellules de chaque spermatocyste (Figure 2). L’hybridation in situ par fluorescence intégrale (WFISH), décrite dans ce protocole, permet aux chercheurs de marquer spécifiquement une région chromosomique et de la suivre au cours de la spermatogenèse tout en préservant la structure native de l’organe et de la position des noyaux cellulaires ; cela représente un avantage par rapport au protocole standard DNA FISH dans lequel l’organe est généralement écrasé, ce qui entraîne des lésions tissulaires19. Dans le protocole actuel, les sondes fluorescentes sont utilisées pour colorer les séquences répétitives sur les chromosomes sexuels et, ainsi, suivre leur comportement au cours de la spermatogenèse, des cellules diploïdes en division aux spermatozoïdes haploïdes matures. WFISH peut être particulièrement utile pour étudier l’appariement méiotique des chromosomes sexuels et étudier les phénotypes cytologiques associés, par exemple, aux distorsions synthétiques du sex-ratio, à la stérilité masculine hybride et à l’élimination des gènes impliqués dans la spermatogenèse 4,19,26,27.
Compte tenu de leur rôle de vecteurs du paludisme, les moustiques anophèles sont la cible d’un nombre croissant de stratégies de lutte antivectorielle génétique, qui agissent souvent dans les organes reproducteurs de ces organismes. Plusieurs mutants de moustiques et phénotypes cytologiques ont été générés qui nécessitent de nouvelles techniques cytologiques pour être étudiés26,27,28,29. La méthode décrite dans cette étude met en lumière la compréhension de la spermatogenèse, ainsi que les mécanismes cytologiques qui sous-tendent les stratégies génétiques qui ont le potentiel de contrôler les moustiques transmetteurs du paludisme.
Protocole
1. Marquage de la sonde ADN
REMARQUE : Vous trouverez ci-dessous les étapes techniques pour générer des sondes d’ADN fluorescentes qui marquent spécifiquement les chromosomes sexuels des moustiques An. gambiae.
- Marquage de la sonde par PCR
- Extraire l’ADN génomique des pupes ou des mâles adultes pour marquer les chromosomes X ou Y à l’aide d’une trousse d’extraction d’ADN génomique disponible dans le commerce (voir le tableau des matériaux).
- Préparer le mélange réactionnel de PCR : 200 ng d’ADN génomique, 0,05 mM de nucléotide non marqué (dATP, dCTP, dGTP), 0,015 mM de dTTP et 1 uL de dUTP marqué par fluorescence (Cy3, Cy5 ou un autre fluorochrome), 50 pmol d’amorce directe et inverse (tableau 1), 5 μL de tampon PCR 10x et 10 U d’ADN polymérase Taq (voir tableau des matériaux).
- Pour marquer l’ADNr 18S et le satellite AgY53B (Tableau 1), effectuer une réaction PCR en utilisant les paramètres PCR suivants : un cycle de 95 °C pendant 10 min ; 35 cycles de 95 °C pendant 30 s, 52 °C pendant 30 s et 72 °C pendant 45 s ; un cycle de 72 °C pendant 5 min ; et un maintien final à 4 °C.
REMARQUE : Pour obtenir une bonne concentration de sonde avec la méthode de marquage PCR (~1 μg dans 5 μL), ce qui est essentiel pour la réussite d’un WFISH, la réaction PCR doit être très efficace. Pour cette raison, avant d’étiqueter la sonde, il est fortement suggéré de tester l’efficacité des amorces sélectionnées pour l’amplification. De plus, l’inclusion d’un contrôle positif dans la réaction PCR (sans le dUTP fluorescent) aidera à vérifier l’efficacité de la réaction de marquage. - Conservez la sonde à −20 °C dans un endroit sombre.
- Obtention de sondes oligonucléotidiques fluorescentes à l’extrémité 3'
- Obtenir des sondes oligonucléotidiques fluorescentes disponibles dans le commerce sous forme d’oligogrammes modifiés en ajoutant des fluorochromes Cy3 ou Cy5 (ou tout autre fluorochrome) à l’extrémité 3' de la séquence nucléotidique (voir le tableau des matériaux). Voir amorces/oligonucléotides dans le tableau 1 pour les séquences de référence utilisées pour marquer la région de jonction AgY477-AgY53B du satellite lié à l’Y et le satellite lié à l’X à partir de Contig_240.
REMARQUE : Il n’y a pas d’obstacles techniques liés à la concentration d’oligonucléotides marqués à l’extrémité 3', car l’utilisateur peut généralement choisir cela avant l’achat. Nous suggérons de diluer ~800 ng de solution d’oligosonde dans le tampon d’hybridation pour un marquage efficace à l’aide de l’oligosonde. Des oligosondes spécifiques X et Y ont déjà été utilisées pour le WFISH par Liang et Sharakhov19, et la séquence de référence se trouve dans le tableau 1.
- Obtenir des sondes oligonucléotidiques fluorescentes disponibles dans le commerce sous forme d’oligogrammes modifiés en ajoutant des fluorochromes Cy3 ou Cy5 (ou tout autre fluorochrome) à l’extrémité 3' de la séquence nucléotidique (voir le tableau des matériaux). Voir amorces/oligonucléotides dans le tableau 1 pour les séquences de référence utilisées pour marquer la région de jonction AgY477-AgY53B du satellite lié à l’Y et le satellite lié à l’X à partir de Contig_240.
2. Préparation de la solution d’hybridation
REMARQUE : Les sondes fluorescentes générées à l’étape 1 doivent être incorporées dans une solution chimique qui s’hybride avec les séquences cibles.
- Précipitation de la sonde avant l’hybridation in situ par fluorescence
- Dans un tube de 1,5 mL, ajouter 5 μL de sonde d’ADN marquée (si obtenue par la méthode de marquage par PCR) ou 2,2 μL de sonde oligo-modifiée 3' (~800 ng de sonde) de l’étape 1 et 5 μL d’ADN de spermatozoïde de saumon (voir le tableau des matériaux). Combinez les sondes spécifiques à différentes régions génomiques dans le même tube, et utilisez-les comme solution unique dans les étapes suivantes.
- Précipiter la sonde d’ADN en ajoutant 0,1 volume d’acétate de sodium 3 M et 2 volumes d’éthanol à 100 %. Conserver à −20 °C pendant au moins 2,5 h (augmenter le temps d’incubation à −20 °C augmentera le rendement final). À ce stade, les sondes peuvent également être stockées pendant la nuit avant la centrifugation.
- Centrifuger à 17 000 x g à 4 °C pendant 20 min, retirer l’éthanol et sécher le granulé à l’air libre à RT dans l’obscurité pendant ~20 min.
- Solution d’hybridation
- Avant de procéder au curage testiculaire (étape 3), préparer le tampon d’hybridation en mélangeant les réactifs suivants dans un tube de 1,5 : 500 μL de formamide, 0,2 g de sulfate de dextran, 100 μL de citrate salin de sodium 20x (SSC) et 200 μL de H20 stérile (voir Tableau des matériaux). Faire vortex la solution d’hybridation pendant 1 min et laisser le sulfate de dextran se dissoudre à 37 °C pendant 30 min.
- Dissoudre la pastille de l’étape 2.1.3 dans 20-30 μL de tampon d’hybridation (vortex pendant environ 1 min, effectuer un essorage rapide et stocker les tubes à 37 °C dans l’obscurité) pour obtenir la solution d’hybridation.
3. Dissection et fixation des testicules
- À température ambiante (RT), disséquez21 testicules d’au moins ~20 pupes ou d’adultes âgés d’un jour dans une solution saline stérile tamponnée au phosphate (PBS) et transférez-les sur une lame de microscope propre contenant une goutte fraîche de solution PBS 1x.
- Transférez les testicules à l’aide d’un embout filtré P1 000 ou de la pointe d’une aiguille de dissection de la goutte 1x PBS dans une boîte embryonnaire contenant 3,7% de formaldéhyde dans 1x PBS avec 0,1% Tween-20 (PBST), et incubez pendant 10 min à RT.
- Laver les testicules dans 1x PBST pendant 5 min à RT. Incuber les testicules dans 0,1 mg/mL d’ARNase A (voir tableau des matériaux) dilué dans 1x PBS stérile pendant 30 min à 37 °C.
- Retirer la solution d’ARNase, ajouter la solution pénétrante (1 % de Triton/0,1 M HCl dans 1x PBST) et incuber à RT pendant 10 min.
REMARQUE : La protéinase K peut être utilisée comme agent pénétrant à une concentration finale de 10 μg/mL dans 1x PBST pour augmenter la perméabilisation des testicules. - Lavez les testicules dans 1x PBST deux fois pendant 5 min chacun à RT.
4. L’hybridation
NOTE : Cette section décrit les étapes finales de l’hybridation in situ .
- Après l’étape de lavage (étape 3.5), transférer les testicules dans un tube de 1,5 mL avec 20 à 30 μL de solution d’hybridation contenant la sonde préalablement préparée (étape 2.2.2). Utilisez l’embout de la pipette pour mélanger délicatement la solution. Effleurez doucement le tube cinq fois avant de passer aux étapes suivantes.
- Incuber pendant 5 min à 75 °C pour la dénaturation de l’ADN.
- Incuber pendant la nuit à 37 °C (si possible, avec un balancement à moins de 100 tr/min) pour l’hybridation ADN-ADN.
- Transférez les testicules dans une boîte à embryons à l’aide d’un embout filtré P1 000 et lavez-les dans 2x SSC préchauffés à 50 °C pendant 5 min.
REMARQUE : Après l’étape d’hybridation, une étape de lavage finale à l’aide de 2x SSC est nécessaire ; Cela joue un rôle important dans l’élimination de tout signal de fond causé par la présence de sondes non hybridées à l’intérieur du tissu de l’organe. Si un signal de fond fort est présent, il est recommandé de répéter l’étape finale de lavage. - Retirez les 2x SSC et montez les testicules à l’aide d’un milieu de montage disponible dans le commerce avec du 4′,6-diamidino-2-phénylindole (DAPI) (voir le tableau des matériaux) sur une lame de verre dépoli, scellez avec un scellant à lamelles et incubez pendant au moins 2 h à RT dans l’obscurité.
- Réaliser l’imagerie confocale. L’ensemble des testicules peut être visualisé à l’aide d’objectifs d’immersion dans l’huile 40x ou 63x. Si une pile z est effectuée, nous suggérons d’utiliser un pas z de 1,25 μm.
Résultats
Dans ce travail, WFISH a été utilisé pour étudier le comportement chromosomique au cours de la spermatogenèse chez An. gambiae. La première étape cruciale pour l’application de ce protocole est l’obtention de testicules présentant un faible niveau d’altération morphologique après dissection. Une connaissance de base de l’anatomie du moustique est nécessaire pour effectuer une dissection testiculaire réussie, et ci-dessous, quelques conseils pour cette procédure sont donnés. Chez le moustique anophèle , les testicules matures se trouvent dans le sixième segment abdominal des stades nymphal et adulte21. Comme le montre la figure 1, le canal déférent relie les testicules aux glandes accessoires mâles (MAG), qui sont situées dans le dernier segment de l’abdomen. Les MAG sont reliés à un canal éjaculatoire unique qui achemine les spermatozoïdes et les fluides séminaux à l’organe copulateur et à la partie externe de l’appareil génital masculin21. L’ensemble de l’appareil génital masculin interne peut être disséqué à l’aide de différentes approches en fonction du stade de vie du moustique. Au stade nymphal, les testicules peuvent être facilement identifiés à l’aide d’un stéréomicroscope dans toute la cuticule légère en regardant la face ventrale de l’abdomen à proximité du sixième segment (Figure 1). Pour disséquer les testicules, la partie inférieure de l’abdomen, y compris le sixième segment, peut être isolée du reste du corps à l’aide d’une paire d’aiguilles et transférée dans une goutte propre de 1x PBS. Après l’ablation du dernier segment, l’ensemble de l’appareil peut être écrasé hors de l’abdomen en appliquant une légère pression avec les aiguilles de dissection. Pour disséquer les testicules des mâles adultes, la première étape consiste à isoler l’ensemble de l’abdomen dans une goutte fraîche de 1x PBS, puis à retirer le dernier segment portant les fermoirs, qui sont les structures copulatoires mâles (Figure 1). À ce stade, la partie inférieure des MAG devrait émerger et être facilement identifiable en raison de leur couleur jaune. L’ensemble de l’appareil mâle peut ensuite être retiré lentement à l’aide d’une aiguille ou d’une pince dans une goutte de 1x PBS jusqu’à ce que la paire de testicules attachés au canal déférent soit visible. Avant de procéder à la fixation, il est important d’isoler les testicules des autres parties de l’appareil mâle en coupant à proximité de la partie inférieure du canal déférent (Figure 1).
L’âge des pupes ou des mâles adultes est un facteur important à prendre en compte en fonction du stade de spermatogenèse à l’étude. Chez An. gambiae, la spermatogenèse commence au stade précoce/milieu de la nymphe et se poursuit tout au long de la vie de l’individu24. Entre 3 h et 10 h après la nymphose, les stades préméiotique et méiotique sont plus représentés dans le testicule (prophase méiotique, divisions méiotiques), l’ADN spermatide est relativement peu condensé et les spermatozoïdes matures ne se sont pas encore formés. Les pupes tardives et les adultes âgés de 1 jour offrent un bon équilibre entre les stades préméiotique, méiotique et post-méiotique (Figure 2 et Figure 3). Chez les adultes âgés de plus de 4 jours, les stades préméiotiques et les spermatocystes sont moins représentés, et les testicules sont principalement occupés par des spermatozoïdes matures contenus dans le réservoir de spermatozoïdes.
Pour étudier le comportement des chromosomes sexuels au cours des différentes étapes de la spermatogenèse, WFISH a été réalisée sur des testicules disséqués à la fin du stade nymphal afin d’assurer une bonne représentation de l’ensemble du processus. Pour suivre le comportement de ces chromosomes, des sondes fluorescentes spécifiques à des séquences répétitives situées exclusivement sur le chromosome X ou Y ont été utilisées. Les sondes fluorescentes peuvent être générées par PCR ou obtenues commercialement sous forme d’oligonucléotides marqués à l’extrémité 3'. L’utilisation d’un oligo d’une longueur de >40 bps est recommandée pour permettre une bonne détection du signal de l’oligosonde fluorescente. D’après notre expérience, les oligos marqués à l’extrémité 3' sont plus performants que les sondes marquées PCR en termes de détection de signaux. De plus, le nombre de copies de la séquence cible est un facteur qui peut affecter l’efficacité de WFISH. En cas d’échec du marquage, il est suggéré d’utiliser la méthode de marquage par PCR sur un fragment plus long ou de concevoir plusieurs oligos spécifiques à la région cible.
Les méthodes actuelles, basées sur l’utilisation d’une solution pénétrante (1% Triton/0,1 M HCl dans 1x PBST), permettent un bon niveau de perméabilisation des testicules et de pénétration des sondes, ce qui se traduit par une réaction d’hybridation réussie. Des sondes oligoscopiques spécifiques aux séquences répétitives des chromosomes sexuels peuvent être conçues sur la base de la caractérisation approfondie des éléments répétitifs effectuée par Hall et al.20. De plus, des séquences de consensus spécifiques aux éléments répétitifs liés à l’X ou au Y peuvent être obtenues à l’aide d’une plateforme bioinformatique telle que le pipeline RedKmer30. Il est important de noter que les sondes chromosomiques sexuelles peuvent cibler des éléments répétitifs tels que les satellites et les rétrotransposons, et qu’elles peuvent avoir un niveau d’hybridation différent avec les chromosomes X ou Y selon les espèces examinées 20,31,32. Comme le montre la figure 3, un bon niveau d’hybridation des sondes et un faible bruit de fond ont permis de visualiser les chromosomes ciblés tout au long de la spermatogenèse. L’appariement des chromosomes sexuels marqués a pu être observé dans les stades préméiotique et méiotique. Cela a été suivi par la détection des chromosomes X ou Y dans les chromosomes des noyaux des cellules haploïdes résultant des divisions méiotiques. Par la suite, des spermatides porteuses d’X ou de Y ont pu être suivies tout au long de la spermiogenèse, marquée par différents niveaux de condensation de l’ADN, jusqu’à l’étape finale des spermatozoïdes matures en forme de flèche. Dans le présent dispositif expérimental, des empilements confocaux en Z ont été utilisés pour acquérir des informations sur l’organisation spatiale 3D des cellules au cours de ce processus (vidéo 1).
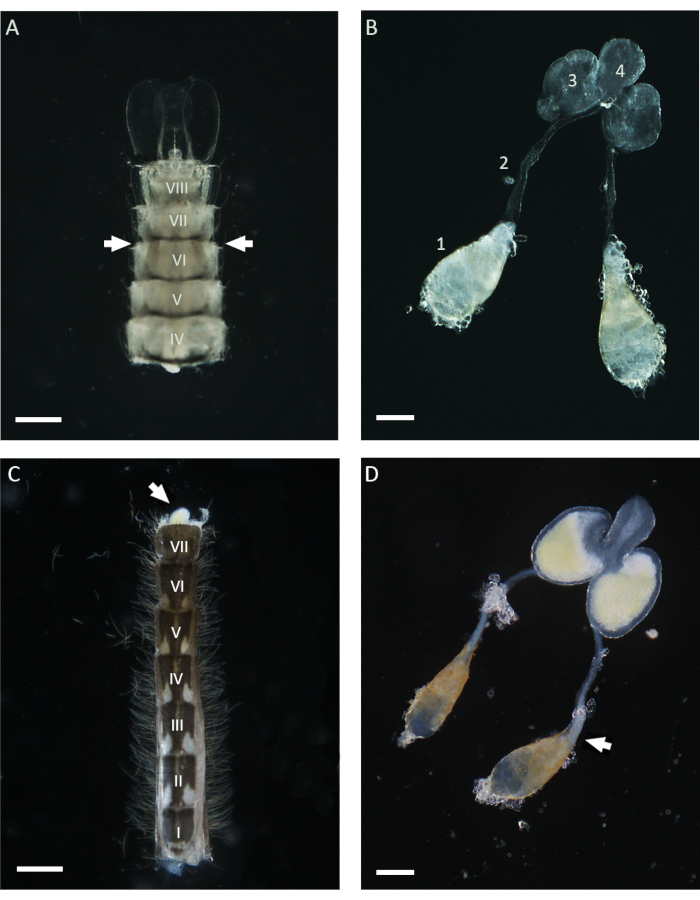
Figure 1 : Testicules disséqués de pupes et de mâles adultes d’Anopheles gambiae âgés de 1 jour. (A) Un abdomen disséqué à la fin du stade nymphal montrant la position des testicules à proximité du sixième segment abdominal. Les testicules peuvent être identifiés dans toute la cuticule et apparaissent comme des structures brunâtres des deux côtés de l’abdomen (avec des flèches). (B) Testicules disséqués au stade nymphal, montrant les testicules matures (1), le canal déférent (2), les MAG (3) et le canal éjaculateur (4). (C) Un abdomen disséqué d’un mâle adulte âgé de 1 jour après avoir retiré le segment de fermoir basal. Les MAG peuvent être écrasés de l’abdomen en appliquant une légère pression (flèche blanche). (D) Appareil reproducteur interne mâle disséqué d’un mâle adulte âgé de 1 jour. La flèche blanche indique la position occupée par les spermatozoïdes matures, qui apparaissent sous la forme d’un agrégat blanc au pôle basal du testicule. Barres d’échelle : (A,C) 200 μm ; (B,D) 100 μm. Les chiffres romains de I à VIII indiquent les segments abdominaux. Veuillez cliquer ici pour voir une version agrandie de cette figure.
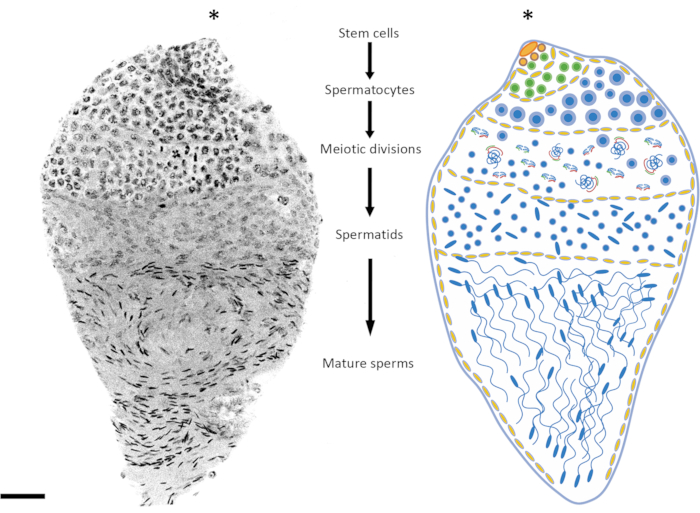
Figure 2 : Représentation de la spermatogenèse chez Anopheles gambiae. L’image de gauche montre une chrysalide testiculaire tardive d’An. gambiae à la suite d’une coloration DAPI complète. Sur la droite se trouve une version schématique pour une meilleure visualisation. En observant la forme du noyau et le niveau de condensation, il est relativement facile de suivre toutes les étapes de la spermatogenèse des cellules diploïdes aux spermatozoïdes haploïdes. La niche des cellules souches est située dans le pôle supérieur de l’organe, où commence la différenciation en spermatogonies. Les spermatogonies augmentent en nombre après la division mitotique (globules verts) et les spermatocystes augmentent en taille (globules jaunes). Les cellules de spermatogonie se différencient en spermatocytes après plusieurs cycles de divisions mitotiques (globules bleus). Les spermatocytes, qui sont caractérisés par des noyaux relativement plus gros que les cellules des autres étapes du processus, sont les cellules qui subiront la division méiotique. Les cellules subissant une méiose peuvent être détectées en examinant la présence de chromosomes à différents stades méiotiques ; Les chiasmes et les chromosomes en métaphase peuvent être détectés même à faible grossissement. Les stades préméiotiques sont surreprésentés dans les testicules disséqués au stade nymphal précoce. Après la première et la deuxième division méiotique, des spermatides sont produites et se trouvent généralement au milieu du testicule. Les noyaux des spermatides présentent un certain degré de variation dans leur forme, passant d’une forme ronde à une forme en forme de flèche. Les spermatides entrent dans le processus de spermiogenèse, au cours duquel les noyaux commencent à se condenser et leur structure se transforme en points en forme de flèche. Lorsque les moustiques mûrissent sexuellement après avoir émergé, les spermatocystes contenant des spermatozoïdes matures peuvent occuper la majeure partie du volume des testicules aux dépens des spermatocystes à un stade de développement différent. Barre d’échelle : 20 μm. L’astérisque (*) indique la partie apicale du testicule. Veuillez cliquer ici pour voir une version agrandie de cette figure.
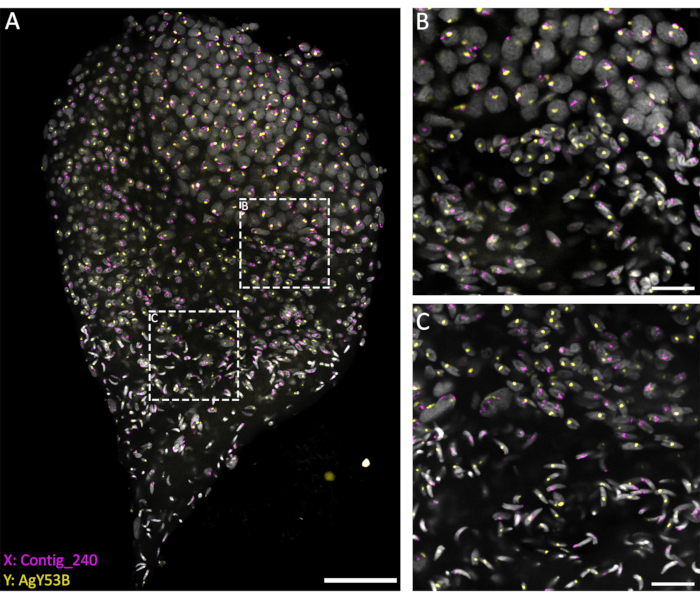
Figure 3 : WFISH sur un testicule d’An. gambiae disséqué à partir de la fin du stade nymphal. WFISH a été réalisée à l’aide de sondes spécifiques pour les chromosomes X (Contig_240) et Y (sonde oligo spécifique pour AgY53B). (A) WFISH permet de suivre le comportement du chromosome sexuel au cours de la spermatogenèse des cellules diploïdes aux spermatozoïdes haploïdes. Dans cette image, il est possible d’apprécier les changements spectaculaires que subissent les noyaux au cours de la spermatogenèse. Le marquage des chromosomes sexuels permet de faire la distinction entre les cellules diploïdes et haploïdes. Dans les cellules diploïdes, le signal des chromosomes sexuels est lié aux mêmes noyaux. Dans les cellules haploïdes (spermatides et spermatozoïdes), le signal des chromosomes sexuels n’est pas lié en raison de la division réductionnelle méiotique. (B,C) Une image du testicule à fort grossissement (63x) est illustrée en (A). Ils ont été acquis à différentes positions le long de l’axe Z. Les cadres en pointillés blancs indiquent la zone d’acquisition. (B) La phase de transition entre les spermatocytes et les spermatides, montrant la formation de cellules haploïdes et la séparation des signaux des chromosomes sexuels en noyaux séparés. (C) L’étape de transition entre les spermatides haploïdes et les spermatozoïdes matures. Cette étape montre les changements dans le niveau de condensation nucléaire ; Les spermatozoïdes matures présentent une forme plus condensée et allongée que les spermatides. Barres d’échelle : (A), 30 μm ; (B,C), 10 μm ; Gris : DAPI. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Séquence cible | Consensus sur la séquence d’amorce et l’oligo-sonde | Référence |
| Contig_240 (X) | 5'-CAATAAATTTCCTTTTTAATGATGC AAAATCTACGTCTCTAGC-3'-[Fluorochrome] | 19 |
| AgY53B (Y) | 5'AGAAGAATAGAATCAGAATAGTCGG TTTCTTCATCCTGAAAGCC-3'-[Fluorochrome] | Cette étude |
| AgY477- AgY53B jonction région (Y) | 5'-TTCTAAGTTTCTAGGCTTTAAGGAT GAAGAAACCGACTATTC-3'-[Fluorochrome] | 19 |
| ADNr 18S (X) | F : AACTGTGGAAAAGCCAGAGC R : TCCACTTGATCCTTGCAAAA | 19 |
| AgY53B (Y) | Télécopieur : CCTTTAAACACATGCTCAAATT R : GTTTCTTCATCCTTAAAGCCTAG | 19 |
Tableau 1 : Liste des sondes oligoscopiques spécifiques du chromosome X ou Y chez An. gambiae.
Vidéo 1 : Un empilement 3D sur WFISH réalisé sur un testicule d’An. gambiae disséqué à partir du stade nymphal tardif. Pour obtenir une représentation 3D du processus de spermatogenèse, un empilement confocal 3D peut être réalisé sur des testicules présentant un faible nombre d’altérations structurelles. Dans cette étude, les empilements ont été réalisés avec un intervalle de 1,25 μm entre deux sections optiques sous une lentille d’huile 63x ou 40x afin de ne pas perdre d’informations sur l’organisation spatiale 3D des cellules. Gris : DAPI, jaune : Contig_240 (X), magenta : AgY53B (Y). Veuillez cliquer ici pour télécharger cette vidéo.
Discussion
Généralement, les protocoles FISH exigent l’écrasement de l’organe d’intérêt pour permettre la coloration des chromosomes. Cela entraîne une perte d’informations concernant la disposition spatiale des cellules à l’intérieur de cet organe33. Ce protocole décrit comment les processus biologiques, tels que la spermatogenèse, peuvent être étudiés in situ tout en maintenant la structure native intacte du testicule et son organisation cytologique interne. Des sondes ciblant différents éléments répétitifs de l’ADN, particulièrement enrichis en chromosomes sexuels20, peuvent être utilisées simultanément pour révéler la dynamique de la maturation des spermatozoïdes. En fonction du moment de la dissection testiculaire, WFISH offre la possibilité d’étudier différentes étapes de la spermatogenèse à travers le développement du moustique. Le WFISH est utile pour étudier des phénomènes spécifiques tels que l’incompatibilité hybride, qui, chez les moustiques anophèles, est due à la présence de défauts méiotiques tels que l’insuffisance préméiotique et la non-disjonction des chromosomes sexuels 19,34,35. Outre l’aspect biologique, la spermatogenèse est la cible d’un certain nombre de stratégies génétiques développées pour lutter contre les insectes nuisibles tels que les moustiques anophèles. Dans ce contexte, le locus d’ADNr lié à l’X d’An. gambiae a été utilisé comme cible pour développer un distordeur synthétique du sex-ratio, qui, en endommageant les spermatozoïdes porteurs d’X, biaise la descendance en faveur des mâles 4,8,13.
Cette technologie reflète l’action des pulsions méiotiques naturelles du sex-ratio qui ont été identifiées chez plusieurs taxons, dont les moustiques, mais qui restent encore mal comprises 28,36,37,38,39,40,41. WFISH offre la possibilité d’étudier ce phénomène et ouvre la voie à l’affinement ou à l’amélioration des stratégies génétiques basées sur la distorsion sexuelle, par exemple en fournissant des informations sur la façon dont la cytologie de la production de spermatozoïdes est affectée par le choix des sites cibles utilisés pour le déchiquetage des chromosomes sexuels. Bien que, d’après notre expérience, WFISH présente de grandes chances de succès, l’échec peut toujours se produire. Cela peut être dû à un niveau inefficace de perméabilisation des tissus, qui peut être surmonté en augmentant le temps d’incubation de la solution pénétrante. Alternativement, la protéinase K peut être utilisée pendant l’étape de perméabilisation. Dans certains cas, nous avons remarqué un niveau de pénétration de la sonde non uniforme, avec un signal plus élevé dans les noyaux des spermatocytes et un signal plus faible ou absent dans les étapes méiotique et spermiogenèse. Cela peut être dû à une différence dans le niveau de perméabilisation en fonction du stade cellulaire. De plus, le WFISH s’est avéré utile lors de l’utilisation de sondes fluorescentes conçues pour cibler les séquences d’ADN présentes en grand nombre de copies. Lors du ciblage de gènes à copie unique, la détection du signal peut ne pas être suffisante. Dans ce cas, des méthodes d’amplification du signal, telles que l’amplification du signal du tyramide (TSA), doivent être intégrées42.
Ce protocole pourrait être couplé à l’immunomarquage ou à des souches rapporteures transgéniques hébergeant des marqueurs fluorescents spécifiques à la lignée germinale16,18, car cela ajouterait des informations sur la localisation des protéines et l’expression des gènes in situ. Dans ce travail, le WFISH est décrit comme une technique permettant d’étudier la spermatogenèse chez les moustiques anophèles ; Cependant, étant donné l’anatomie commune des organes reproducteurs mâles, ce protocole pourrait être appliqué à d’autres espèces de moustiques qui jouent un rôle dans la transmission de maladies. De même, la gamétogenèse féminine pourrait être étudiée à l’aide de cette technique. En outre, des études cytologiques dans des organes ou des tissus d’intérêt, tels que l’intestin moyen des moustiques, qui est une cible pour l’invasion parasitaire, ou des antécédents génétiques atypiques, tels que ceux des moustiques hybrides, pourraient être explorées43. De plus, cette technique peut potentiellement être transférée à d’autres organismes de l’ordre des diptères.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par une subvention de la Fondation Bill & Melinda Gates et d’Open Philanthropy. Nous remercions le Facility for Imaging by Light Microscopy (FILM) de l’Imperial College London pour l’analyse microscopique. La figure 2 a été créée avec Biorender.com.
matériels
| Name | Company | Catalog Number | Comments |
| Amersham CyDye Fluorescent Nucleotides, Cy3-dUTP | Cytiva | PA53022 | |
| Amersham CyDye Fluorescent Nucleotides, Cy5-dUTP | Cytiva | PA55022 | |
| ART Wide Bore Filtered Pipette Tips | ThermoFisher Scientific | 2079GPK | |
| CytoBond Removable Coverslip Sealant | SciGene | 2020-00-1 | |
| Dextran sulfate sodium salt from Leuconostoc spp. | Sigma-Aldrich | D8906-5G | |
| DNeasy Blood & Tissue Kits | Qiagen | 69504 | |
| Embryo Dishes | VWR | 70543-30 | |
| Ethanol, molecular grade | Sigma-Aldrich | 51976 | |
| Formamide | ThermoFisher Scientific | 17899 | |
| GoTaq G2 DNA Polymerase | Promega | M7841 | |
| Hydrochloric acid, 37% | Sigma-Aldrich | 320331 | |
| Microscope slides, SuperFrost | VWR | 631-0114 | |
| PBS (10x), pH 7.4 | ThermoFisher Scientific | 70011044 | |
| Pierce 16% Formaldehyde (w/v), Methanol-free | ThermoFisher Scientific | 28906 | |
| ProLong Gold Antifade Mountant with DAPI | ThermoFisher Scientific | P36941 | |
| RNase A/T1 Mix | ThermoFisher Scientific | EN0551 | |
| Set of dATP, dCTP, dGTP, dTTP | Promega | U1330 | |
| Sodium Acetate Solution | ThermoFisher Scientific | R1181 | |
| SP8 inverted confocal microscope | Leica | ||
| Triton X-100 | Sigma-Aldrich | 9036-19-5 | |
| TWEEN 20 | Sigma-Aldrich | P1379 | |
| UltraPure Salmon Sperm DNA Solution | ThermoFisher Scientific | 15632011 | |
| UltraPure SSC 20x | ThermoFisher Scientific | 15557044 | |
| Primer sequences | |||
| 5’-CAATAAATTTCCTTTTTAATGATGC AAAATCTACGTCTCTAGC-3’-[Fluorochrome] | Eurofins Genomics | Contig_240 (X) | |
| 5’AGAAGAATAGAATCAGAATAGT CGG TTTCTTCATCCTGAAAGCC-3’-[Fluorochrome] | Eurofins Genomics | AgY53B (Y) | |
| 5’-TTCTAAGTTTCTAGGCTTTAAGGA T GAAGAAACCGACTATTC-3’-[Fluorochrome] | Eurofins Genomics | AgY477- AgY53B junction region (Y) | |
| F: AACTGTGGAAAAGCCAGAGC R: TCCACTTGATCCTTGCAAAA | Eurofins Genomics | 18S rDNA (X) | |
| F: CCTTTAAACACATGCTCAAATT R: GTTTCTTCATCCTTAAAGCCTAG | Eurofins Genomics | AgY53B (Y) |
Références
- World Malaria Report. World Health Organization Available from: https://www.who.int/teams/global-malaria-programme/reports/world-malaria-report-2022 (2022)
- Bhatt, S., et al. The effect of malaria control on Plasmodium falciparum in Africa between 2000 and 2015. Nature. 526 (7572), 207-211 (2015).
- Hammond, A., et al. A CRISPR-Cas9 gene drive system targeting female reproduction in the malaria mosquito vector Anopheles gambiae. Nature Biotechnology. 34 (1), 78-83 (2016).
- Galizi, R., et al. A synthetic sex ratio distortion system for the control of the human malaria mosquito. Nature Communications. 5 (1), 3977 (2014).
- Kyrou, K., et al. A CRISPR-Cas9 gene drive targeting doublesex causes complete population suppression in caged Anopheles gambiae mosquitoes. Nature Biotechnology. 36 (11), 1062-1066 (2018).
- Simoni, A., et al. A male-biased sex-distorter gene drive for the human malaria vector Anopheles gambiae. Nature Biotechnology. 38 (9), 1054-1060 (2020).
- Gantz, V. M., et al. Highly efficient Cas9-mediated gene drive for population modification of the malaria vector mosquito Anopheles stephensi. Proceedings of the National Academy of Sciences of the United States of America. 112 (49), E6736-E6743 (2015).
- Bernardini, F., Kriezis, A., Galizi, R., Nolan, T., Crisanti, A. Introgression of a synthetic sex ratio distortion system from Anopheles gambiae into Anopheles arabiensis. Scientific Reports. 9 (1), 5158 (2019).
- Hammond, A. M., Galizi, R. Gene drives to fight malaria: Current state and future directions. Pathogens and Global Health. 111 (8), 412-423 (2017).
- Garrood, W. T., et al. Driving down malaria transmission with engineered gene drives. Frontiers in Genetics. 13, 891218 (2022).
- Hoermann, A., et al. Gene drive mosquitoes can aid malaria elimination by retarding Plasmodium sporogonic development. Science Advances. 8 (38), (2022).
- Nash, A., et al. Integral gene drives for population replacement. Biology Open. 8 (1), (2019).
- Galizi, R., et al. A CRISPR-Cas9 sex-ratio distortion system for genetic control. Scientific Reports. 6 (1), 31139 (2016).
- Terradas, G., Hermann, A., James, A. A., McGinnis, W., Bier, E. High-resolution in situ analysis of Cas9 germline transcript distributions in gene-drive Anopheles mosquitoes. G3: Genes, Genomes, Genetics. 12 (1), (2022).
- Durant, A. C., Donini, A. Ammonium transporter expression in sperm of the disease vector Aedes aegypti mosquito influences male fertility. Proceedings of the National Academy of Sciences of the United States of America. 117 (47), 29712-29719 (2020).
- Taxiarchi, C., et al. High-resolution transcriptional profiling of Anopheles gambiae spermatogenesis reveals mechanisms of sex chromosome regulation. Scientific Reports. 9 (1), 14841 (2019).
- Pompon, J., Levashina, E. A. A new role of the mosquito complement-like cascade in male fertility in Anopheles gambiae. PLoS Biology. 13 (9), e1002255 (2015).
- Papathanos, P. A., Windbichler, N., Menichelli, M., Burt, A., Crisanti, A. The vasa regulatory region mediates germline expression and maternal transmission of proteins in the malaria mosquito Anopheles gambiae: A versatile tool for genetic control strategies. BMC Molecular Biology. 10 (1), 13 (2009).
- Liang, J., Sharakhov, I. V. Premeiotic and meiotic failures lead to hybrid male sterility in the Anopheles gambiae complex. Proceedings of the Royal Society B. 286 (1906), 20191080 (2019).
- Hall, A. B., et al. Radical remodeling of the Y chromosome in a recent radiation of malaria mosquitoes. Proceedings of the National Academy of Sciences of the United States of America. 113 (15), E2114-E2123 (2016).
- Clements, A. N. . The Biology of Mosquitoes. Volume 1: Development, Nutrition and Reproduction. , (1992).
- Demarco, R. S., Eikenes, &. #. 1. 9. 7. ;. H., Haglund, K., Jones, D. L. Investigating spermatogenesis in Drosophila melanogaster. Methods. 68 (1), 218-227 (2014).
- Helinski, M. E., Parker, A. G., Knols, B. G. Radiation biology of mosquitoes. Malaria Journal. 8, S6 (2009).
- Huho, B. J., et al. A reliable morphological method to assess the age of male Anopheles gambiae. Malaria Journal. 5 (1), 62 (2006).
- Fabian, L., Brill, J. A. Drosophila spermiogenesis. Spermatogenesis. 2 (3), 197-212 (2012).
- Li, M., et al. Suppressing mosquito populations with precision guided sterile males. Nature Communications. 12 (1), 5374 (2021).
- Thailayil, J., Magnusson, K., Godfray, H. C., Crisanti, A., Catteruccia, F. Spermless males elicit large-scale female responses to mating in the malaria mosquito Anopheles gambiae. Proceedings of the National Academy of Sciences of the United States of America. 108 (33), 13677-13681 (2011).
- Haghighat-Khah, R. E., et al. Cellular mechanisms regulating synthetic sex ratio distortion in the Anopheles gambiae germline. Pathogens and Global Health. 114 (7), 370-378 (2020).
- Yamamoto, D. S., et al. A synthetic male-specific sterilization system using the mammalian pro-apoptotic factor in a malaria vector mosquito. Scientific Reports. 9 (1), 8160 (2019).
- Papathanos, P. A., Windbichler, N. Redkmer: An assembly-free pipeline for the identification of abundant and specific X-chromosome target sequences for X-shredding by CRISPR endonucleases. The CRISPR Journal. 1 (1), 88-98 (2018).
- Sharma, A., Kinney, N. A., Timoshevskiy, V. A., Sharakhova, M. V., Sharakhov, I. V. Structural variation of the X chromosome heterochromatin in the Anopheles gambiae complex. Genes. 11 (3), 327 (2020).
- Krzywinski, J., Sangaré, D., Besansky, N. J. Satellite DNA from the Y chromosome of the malaria vector Anopheles gambiae. Genetics. 169 (1), 185-196 (2005).
- Timoshevskiy, V. A., Sharma, A., Sharakhov, I. V., Sharakhova, M. V. Fluorescent in situ hybridization on mitotic chromosomes of mosquitoes. Journal of Visualized Experiments. (67), e4215 (2012).
- Liang, J., Hodge, J. M., Sharakhov, I. V. Asymmetric phenotypes of sterile hybrid males from reciprocal crosses between species of the Anopheles gambiae complex. Frontiers in Ecology and Evolution. 9, 660207 (2021).
- Slotman, M., Torre, A. D., Powell, J. R. The genetics of inviability and male sterility in hybrids between Anopheles gambiae and An. arabiensis. Genetics. 167 (1), 275-287 (2004).
- Wood, R. J., Newton, M. E. Sex-ratio distortion caused by meiotic drive in mosquitoes. The American Naturalist. 137 (3), 379-391 (1991).
- Cazemajor, M., Joly, D., Montchamp-Moreau, C. Sex-ratio meiotic drive in Drosophila simulans is related to equational nondisjunction of the Y chromosome. Genetics. 154 (1), 229-236 (2000).
- Jaenike, J. Sex chromosome meiotic drive. Annual Review of Ecology and Systematics. 32 (1), 25-49 (2001).
- Courret, C., Chang, C. H., Wei, K. H., Montchamp-Moreau, C., Larracuente, A. M. Meiotic drive mechanisms: Lessons from Drosophila. Proceedings of the Royal Society B. 286 (1913), 20191430 (2019).
- Zanders, S. E., Unckless, R. L. Fertility costs of meiotic drivers. Current Biology. 29 (11), R512-R520 (2019).
- Newton, M. E., Wood, R. J., Southern, D. I. A cytogenetic analysis of meiotic drive in the mosquito, Aedes aegypti (L.). Genetica. 46 (3), 297-318 (1976).
- Carabajal Paladino, L. Z., Nguyen, P., Šíchová, J., Marec, F. Mapping of single-copy genes by TSA-FISH in the codling moth, Cydia pomonella. BMC Genomic Data. 15, S15 (2014).
- Bernardini, F., et al. Cross-species Y chromosome function between malaria vectors of the Anopheles gambiae species complex. Genetics. 207 (2), 729-740 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon