Method Article
Hibridação in situ por fluorescência de montagem total para estudo da espermatogênese no mosquito Anopheles
Neste Artigo
Resumo
Dada a sua anatomia simples, os testículos de Anopheles oferecem um bom modelo citológico para o estudo da espermatogênese. Este protocolo descreve a hibridização in situ por fluorescência total, uma técnica utilizada para investigar esse processo biológico, bem como o fenótipo de cepas transgênicas que abrigam mutações nos genes envolvidos na produção de espermatozoides.
Resumo
A espermatogênese é um processo biológico complexo durante o qual as células diploides sofrem sucessivas divisões mitóticas e meióticas seguidas por grandes mudanças estruturais para formar espermatozoides haploides. Além do aspecto biológico, o estudo da espermatogênese é de suma importância para o entendimento e desenvolvimento de tecnologias genéticas como a movimentação gênica e as distorções sintéticas da razão sexual, que, alterando a herança mendeliana e a razão sexual espermática, respectivamente, poderiam ser utilizadas no controle de populações de insetos-praga. Essas tecnologias têm se mostrado muito promissoras em ambientes de laboratório e poderiam ser usadas para controlar populações selvagens de mosquitos Anopheles , que são vetores da malária. Devido à simplicidade da anatomia testicular e sua importância médica, Anopheles gambiae, um dos principais vetores da malária na África subsaariana, representa um bom modelo citológico para o estudo da espermatogênese. Este protocolo descreve como a hibridação in situ por fluorescência de montagem inteira (WFISH) pode ser usada para estudar as mudanças dramáticas na estrutura nuclear celular através da espermatogênese usando sondas fluorescentes que coram especificamente os cromossomos X e Y. A FISH geralmente requer a ruptura dos órgãos reprodutivos para expor cromossomos mitóticos ou meióticos e permitir a coloração de regiões genômicas específicas com sondas fluorescentes. WFISH permite a preservação da estrutura citológica nativa do testículo, juntamente com um bom nível de detecção de sinal de sondas fluorescentes visando sequências repetitivas de DNA. Isso permite que os pesquisadores acompanhem as mudanças no comportamento cromossômico das células que passam pela meiose ao longo da estrutura do órgão, onde cada fase do processo pode ser claramente distinguida. Esta técnica poderia ser particularmente útil para estudar o pareamento meiótico cromossômico e investigar os fenótipos citológicos associados, por exemplo, a distorções sintéticas da razão sexual, a esterilidade masculina híbrida e o knock-out de genes envolvidos na espermatogênese.
Introdução
A malária impõe um enorme fardo à saúde e ao bem-estar da população humana global. Em 2021, a Organização Mundial da Saúde (OMS) estimou que a malária causou 619.000 mortes, das quais 96% ocorreram na África Subsaariana1. A doença é transmitida por mosquitos pertencentes ao gênero Anopheles e, na África Subsaariana, três espécies, Anopheles gambiae (An. gambiae), Anopheles coluzzi (An, coluzzi) e Anopheles arabiensis (An. Arabiensis) têm um papel desproporcionalmente grande na transmissão da malária, sendo responsáveis por 95% dos casos de malária em todo o mundo. Programas de controle baseados em métodos tradicionais, como inseticidas e antimaláricos, salvaram milhões de vidas; No entanto, nos últimos anos, a crescente resistência a esses métodos de controle tem desafiado sua eficácia 1,2. Além disso, as restrições impostas pela pandemia de COVID-19 afetaram a disponibilidade de intervenções-chave de controle da malária, o que, de acordo com o Relatório Mundial de Malária da OMS de 2022, aumentou a incidência de malária1. Nas últimas duas décadas, novos métodos de controle genético têm sido desenvolvidos em laboratório para atingir mosquitos Anopheles 3,4,5,6,7,8,9,10. Dentre essas estratégias, aquelas baseadas em sistemas de condução gênica (GDSs) e distorções sintéticas da razão sexual (SDs) parecem promissoras. As GDS dependem da possibilidade de transmitir, em frequência muito alta, uma modificação genética que afeta a fertilidade feminina ou prejudica o ciclo de vida do parasita no mosquito 5,11,12. Os DS, ao contrário, atuam distorcendo a razão sexual de uma progênie de mosquito em relação aos machos, o que leva, ao longo do tempo, ao colapso de uma população-alvo devido à falta de fêmeas 4,6,13. Os principais componentes desses sistemas genéticos atuam principalmente nos órgãos reprodutivos dos mosquitos, onde os gametas, óvulos e espermatozoides são produzidos após a divisão meiótica14.
Neste protocolo, avanços em técnicas citogenéticas são empregados para explorar a espermatogênese em An. gambiae com foco no comportamento dos cromossomos in situ. A estrutura do testículo do mosquito e os processos biológicos que ocorrem dentro dele foram previamente investigados usando uma série de métodos citológicos, tais como imunofluorescência, transgenes repórteres fluorescentes e hibridização in situ (FISH) por fluorescência de DNA e RNA15,16,17,18,19,20; Os órgãos apresentam uma forma fusiforme, na qual o polo inferior está ligado a um ducto deferente conectado às glândulas acessórias masculinas. No polo superior, o nicho das células-tronco germinativas prolifera e se diferencia em espermatogônias embutidas no interior de espermatocistos formados por células somáticas. Após múltiplas rodadas de divisão mitótica, as espermatogônias se diferenciam em espermatócitos, que entram na meiose. Na prófase, os cromossomos autossômicos e sexuais se emparelham com seus homólogos, e o cruzamento acontece. Após as divisões meióticas, espermátides haploides redondas são geradas e entram na espermiogênese, e esse processo leva à formação de espermatozoides haploides maduros, nos quais o citoplasma foi removido, a cromatina nuclear é condensada e flagelos emergem na parte basal dos núcleos21,22 (Figura 1 e Figura 2).
Em geral, a espermiogênese inicia-se por volta do estágio médio-pupal, e espermatozoides maduros podem ser detectados no estágio pupal tardio no reservatório espermático23. O processo de maturação dos espermatocistos continua durante a vida adulta23,24,25. Nos testículos de Anopheles, cada etapa da espermatogênese pode ser facilmente identificada observando-se a morfologia nuclear das células em cada espermatocisto (Figura 2). A hibridação in situ por fluorescência total (WFISH), descrita neste protocolo, permite aos pesquisadores marcar especificamente uma região cromossômica e rastreá-la durante a espermatogênese, preservando a estrutura nativa do órgão e a posição dos núcleos celulares; isso representa uma vantagem quando comparado ao protocolo padrão de DNA FISH, no qual o órgão é usualmente esmagado, levando a dano tecidual19. No protocolo atual, sondas fluorescentes são usadas para corar sequências repetitivas nos cromossomos sexuais e, assim, rastrear seu comportamento durante a espermatogênese, desde células diploides em divisão até espermatozoides haploides maduros. WFISH pode ser particularmente útil para estudar o pareamento meiótico de cromossomos sexuais e investigar os fenótipos citológicos associados, por exemplo, a distorções sintéticas da razão sexual, à esterilidade masculina híbrida e ao knock-out de genes envolvidos na espermatogênese 4,19,26,27.
Dado seu papel como vetores da malária, os mosquitos Anopheles são alvo de um número crescente de estratégias de controle genético de vetores, que muitas vezes atuam nos órgãos reprodutivos desses organismos. Vários mutantes de mosquitos e fenótipos citológicos têm sido gerados e requerem novas técnicas citológicas para serem investigados26,27,28,29. O método descrito neste estudo lança luz sobre a compreensão da espermatogênese, bem como os mecanismos citológicos por trás de estratégias genéticas que têm o potencial de controlar mosquitos transmissores da malária.
Protocolo
1. Marcação de sonda de DNA
NOTA: Abaixo estão os passos técnicos para gerar sondas de DNA fluorescentes que rotulam especificamente os cromossomos sexuais de mosquitos An. gambiae.
- Marcação de sonda usando PCR
- Extrair DNA genômico de pupas ou machos adultos para rotular os cromossomos X ou Y usando um kit de extração de DNA genômico disponível comercialmente (consulte a Tabela de Materiais).
- Preparar a mistura da reação de PCR: 200 ng de DNA genômico, 0,05 mM de nucleotídeo não marcado (dATP, dCTP, dGTP), 0,015 mM de dTTP e 1 uL de dUTP fluorescentemente marcado (Cy3, Cy5 ou outro fluorocromo), 50 pmol de primer direto e reverso (Tabela 1), 5 μL de tampão de PCR 10x e 10 U de Taq DNA polimerase (ver Tabela de Materiais).
- Para marcar o 18S rDNA e o satélite AgY53B (Tabela 1), realizar uma reação de PCR usando os seguintes parâmetros de PCR: um ciclo de 95 °C por 10 min; 35 ciclos de 95 °C por 30 s, 52 °C por 30 s e 72 °C por 45 s; um ciclo de 72 °C por 5 min; e uma retenção final a 4 °C.
NOTA: Para obter uma boa concentração de sonda com o método de marcação por PCR (~1 μg em 5 μL), que é crítico para um WFISH bem-sucedido, a reação de PCR deve ser altamente eficiente. Por esse motivo, antes da marcação da sonda, sugere-se fortemente testar a eficácia dos primers selecionados para a amplificação. Além disso, a inclusão de um controle positivo na reação de PCR (sem a dUTP fluorescente) ajudará a verificar a eficácia da reação de marcação. - Conservar a sonda a -20 °C num local escuro.
- Obtenção de sondas de oligonucleotídeos fluorescentes de 3'
- Obter sondas de oligonucleotídeos fluorescentes comercialmente disponíveis como oligos modificados adicionando fluorocromos Cy3 ou Cy5 (ou qualquer outro fluorocromo) à extremidade 3' da sequência de nucleotídeos (ver Tabela de Materiais). Veja primers/oligonucleotídeo na Tabela 1 para as sequências de referência usadas para rotular a região de junção do satélite ligado em Y AgY477-AgY53B e o satélite ligado ao X de Contig_240.
NOTA: Não há impedimentos técnicos relacionados à concentração de oligonucleotídeos marcados com 3' finais, pois o usuário geralmente pode escolher isso antes da compra. Sugerimos diluir ~800 ng de solução de sonda oligo no tampão de hibridização para marcação eficiente usando a sonda oligo. Oligossondas específicas para X e Y foram previamente utilizadas para WFISH por Liang e Sharakhov19, e a sequência de referência pode ser encontrada na Tabela 1.
- Obter sondas de oligonucleotídeos fluorescentes comercialmente disponíveis como oligos modificados adicionando fluorocromos Cy3 ou Cy5 (ou qualquer outro fluorocromo) à extremidade 3' da sequência de nucleotídeos (ver Tabela de Materiais). Veja primers/oligonucleotídeo na Tabela 1 para as sequências de referência usadas para rotular a região de junção do satélite ligado em Y AgY477-AgY53B e o satélite ligado ao X de Contig_240.
2. Preparação da solução de hibridização
NOTA: As sondas fluorescentes geradas na etapa 1 devem ser incorporadas em uma solução química que hibridiza com as sequências alvo.
- Precipitação da sonda antes da hibridação in situ fluorescente
- A um tubo de 1,5 ml, adicione 5 μL de sonda de ADN marcada (se obtida pelo método de marcação por PCR) ou 2,2 μL de sonda oligo modificada de 3' (~800 ng de sonda) dos passos 1 e 5 μL de ADN de esperma de salmão (ver Tabela de Materiais). Combine as sondas específicas para diferentes regiões genômicas no mesmo tubo e use-as como uma solução única nas etapas a seguir.
- Precipitar a sonda de DNA adicionando 0,1 volume de acetato de sódio 3 M e 2 volumes de etanol 100%. Manter a -20 °C por pelo menos 2,5 h (aumentar o tempo de incubação a -20 °C aumentará o rendimento final). Nesta fase, as sondas também podem ser armazenadas durante a noite antes da centrifugação.
- Centrifugar a 17.000 x g a 4 °C por 20 min, remover o etanol e secar o pellet em RT no escuro por ~20 min.
- Solução de hibridização
- Antes de proceder à dissecção do testículo (passo 3), preparar o tampão de hibridização misturando os seguintes reagentes num tubo de 1,5: 500 μL de formamida, 0,2 g de sulfato de dextrana, 100 μL de 20x citrato salino de sódio (SSC) e 200 μL de H20 estéril (ver Tabela de Materiais). Vórtice a solução de hibridização por 1 min e deixe dissolver o sulfato de dextran a 37 °C por 30 min.
- Dissolver o pellet da etapa 2.1.3 em 20-30 μL de tampão de hibridização (vórtice por cerca de 1 min, realizar um giro rápido e armazenar os tubos a 37 °C no escuro) para obter a solução de hibridização.
3. Dissecção e fixação testicular
- À temperatura ambiente (TR), disseque21 pelo menos ~20 testículos de pupas ou adultos de 1 dia de idade em solução salina estéril 1x tamponada com fosfato (PBS) e transfira-os para uma lâmina limpa de microscópio contendo uma nova gota de solução de PBS 1x.
- Transfira os testículos usando uma ponta filtrada de furo largo P1.000 ou a ponta de uma agulha de dissecção da gota de PBS 1x para uma placa de embrião contendo formaldeído a 3,7% em 1x PBS com Tween-20 a 0,1% (PBST) e incube por 10 min no TR.
- Lavar os testículos em 1x PBST durante 5 min em RT. Incubar os testículos em 0,1 mg/ml de RNAse A (ver Tabela de Materiais) diluído em 1x PBS estéril durante 30 minutos a 37 °C.
- Remover a solução de RNAse, adicionar a solução penetrante (1% Triton/0,1 M HCl em 1x PBST) e incubar em RT por 10 min.
NOTA: A proteinase K pode ser usada como agente penetrante na concentração final de 10 μg/mL em 1x PBST para aumentar a permeabilização dos testículos. - Lave os testículos em 1x PBST duas vezes por 5 min cada no TR.
4. Hibridização
NOTA: Esta seção descreve as etapas finais para a hibridização in situ .
- Após a etapa de lavagem (passo 3.5), transferir os testículos para um tubo de 1,5 ml com 20-30 μL de solução de hibridização contendo a sonda previamente preparada (passo 2.2.2). Use a ponta da pipeta para misturar a solução suavemente. Agite suavemente o tubo cinco vezes antes de prosseguir para os próximos passos.
- Incubar durante 5 minutos a 75 °C para desnaturação do ADN.
- Incubar durante a noite a 37 °C (se possível, com balanço a menos de 100 rpm) para hibridização DNA-DNA.
- Transfira os testículos de volta para uma placa de embriões usando uma ponta filtrada de furo largo P1.000 e lave-os em 2x SSC pré-aquecidos a 50 °C por 5 min.
OBS: Após a etapa de hibridização, é necessária uma etapa final de lavagem utilizando 2x SSC; Isso desempenha um papel importante na remoção de qualquer sinal de fundo causado pela presença de sondas não hibridizadas dentro do tecido do órgão. Se um forte sinal de fundo estiver presente, recomenda-se repetir a etapa final de lavagem. - Remova o CSC 2x e monte os testículos usando um meio de montagem comercialmente disponível com 4′,6-diamidino-2-fenilindol (DAPI) (consulte a Tabela de Materiais) em uma lâmina de vidro fosco, sele com selante de deslizamento e incube por pelo menos 2 h no RT no escuro.
- Realizar imagens confocais. Os testículos inteiros podem ser visualizados usando objetivas de imersão em óleo de 40x ou 63x. Se uma pilha z for realizada, sugerimos o uso de um passo z de 1,25 μm.
Resultados
Neste trabalho, WFISH foi usado para investigar o comportamento cromossômico durante a espermatogênese em An. gambiae. O primeiro passo crucial para a aplicação deste protocolo é a obtenção de testículos que apresentem baixo nível de alteração morfológica após dissecção. O conhecimento básico da anatomia do mosquito é necessário para realizar uma dissecção testicular bem-sucedida e, abaixo, algumas orientações para esse procedimento são dadas. No mosquito Anopheles , testículos maduros podem ser encontrados situados no sexto segmento abdominal das fases pupal eadulta21. Como mostrado na Figura 1, o ducto deferente conecta os testículos às glândulas acessórias masculinas (MAGs), que estão localizadas no último segmento do abdome. Os MAGs estão conectados a um ducto ejaculatório único que entrega os espermatozoides e fluidos seminais ao órgão copulatório e à parte externa do aparelho genital masculino21. Todo o aparelho genital masculino interno pode ser dissecado usando diferentes abordagens, dependendo do estágio de vida do mosquito. Durante a fase pupal, os testículos podem ser facilmente identificados por meio de um estereomicroscópio em toda a cutícula clara, observando-se a face ventral do abdome nas proximidades do sexto segmento (Figura 1). Para dissecar os testículos, a parte inferior do abdômen, incluindo o sexto segmento, pode ser isolada do resto do corpo usando um par de agulhas e transferida para uma gota limpa de 1x PBS. Após a remoção do último segmento, todo o aparelho pode ser esmagado para fora do abdome aplicando uma pressão suave com as agulhas dissecantes. Para dissecar os testículos de machos adultos, o primeiro passo consiste em isolar todo o abdome em uma nova gota de 1x PBS e, em seguida, retirar o último segmento que carrega as presilhas, que são as estruturas copulatórias masculinas (Figura 1). Neste ponto, a parte inferior dos MAGs deve emergir e ser facilmente identificável devido à sua cor amarela. Todo o aparelho masculino pode então ser lentamente retirado com a ajuda de uma agulha ou pinça em uma gota de 1x PBS até que o par de testículos ligados ao ducto deferente seja visível. Antes de proceder à fixação, é importante isolar os testículos das demais partes do aparelho masculino, cortando nas proximidades da parte inferior do ducto deferente (Figura 1).
A idade das pupas ou machos adultos é um fator importante a ser considerado dependendo do estágio da espermatogênese sob investigação. Em An. gambiae, a espermatogênese inicia-se no estágio inicial/médio-pupal e continua durante toda a vida do indivíduo24. Entre 3 h e 10 h após a pupação, os estágios pré-meiótico e meiótico estão mais representados no testículo (prófase meiótica, divisões meióticas), o DNA da espermátida é relativamente não condensado e os espermatozoides maduros ainda não foram formados. Pupas tardias e adultos de 1 dia de idade oferecem um bom equilíbrio entre os estágios pré-meiótico, meiótico e pós-meiótico (Figura 2 e Figura 3). Em adultos com mais de 4 dias de vida, os estágios pré-meióticos e espermatocistos são menos representados, e os testículos são ocupados principalmente por espermatozoides maduros contidos no reservatório espermático.
Para investigar o comportamento dos cromossomos sexuais durante os diferentes estágios da espermatogênese, WFISH foi realizada em testículos dissecados na fase de pupa tardia para garantir uma boa representação de todo o processo. Para acompanhar o comportamento desses cromossomos, foram utilizadas sondas fluorescentes específicas para sequências repetitivas localizadas exclusivamente no cromossomo X ou Y. As sondas fluorescentes podem ser geradas por PCR ou obtidas comercialmente como oligonucleotídeos marcados com 3'. O uso de um oligo com um comprimento de >40 bps é recomendado para permitir uma boa detecção de sinal a partir da sonda fluorescente oligo. Em nossa experiência, oligos marcados com 3' têm melhor desempenho do que sondas marcadas com PCR em termos de detecção de sinal. Além disso, o número de cópias da sequência alvo é um fator que pode afetar a eficácia da WFISH. Se a marcação não for bem-sucedida, sugere-se o uso do método de marcação por PCR em um fragmento mais longo ou o desenho de vários oligos específicos para a região de destino.
Os métodos atuais, baseados no uso de uma solução penetrante (1% Triton/HCl 0,1 M em 1x PBST), permitem um bom nível de permeabilização testicular e penetração das sondas, resultando em uma reação de hibridização bem-sucedida. Sondas oligo específicas para sequências repetitivas de cromossomos sexuais podem ser desenhadas com base na extensa caracterização de elementos repetitivos realizada por Hall et al.20. Além disso, sequências de consenso específicas para elementos repetitivos ligados a X ou Y podem ser obtidas usando uma plataforma de bioinformática como o pipeline RedKmer30. É importante notar que sondas de cromossomos sexuais podem ter como alvo elementos repetitivos, como satélites e retrotransposons, e podem ter um nível diferente de hibridização com os cromossomos X ou Y, dependendo da espécie examinada20,31,32. Como mostrado na Figura 3, um bom nível de hibridização das sondas e baixo background permitiram a visualização dos cromossomos alvo ao longo da espermatogênese. O pareamento de cromossomos sexuais marcados pôde ser observado nos estágios pré-meiótico e meiótico. Em seguida, detectou-se os cromossomos X ou Y nos núcleos das células haploides, cromossomos resultantes de divisões meióticas. Posteriormente, espermátides portadoras de X ou Y puderam ser acompanhadas ao longo da espermiogênese, marcada por diferentes níveis de condensação do DNA, até a etapa final dos espermatozoides maduros em forma de flecha. No presente arranjo experimental, pilhas Z confocais foram utilizadas para adquirir informações sobre a organização espacial 3D das células durante este processo (Vídeo 1).
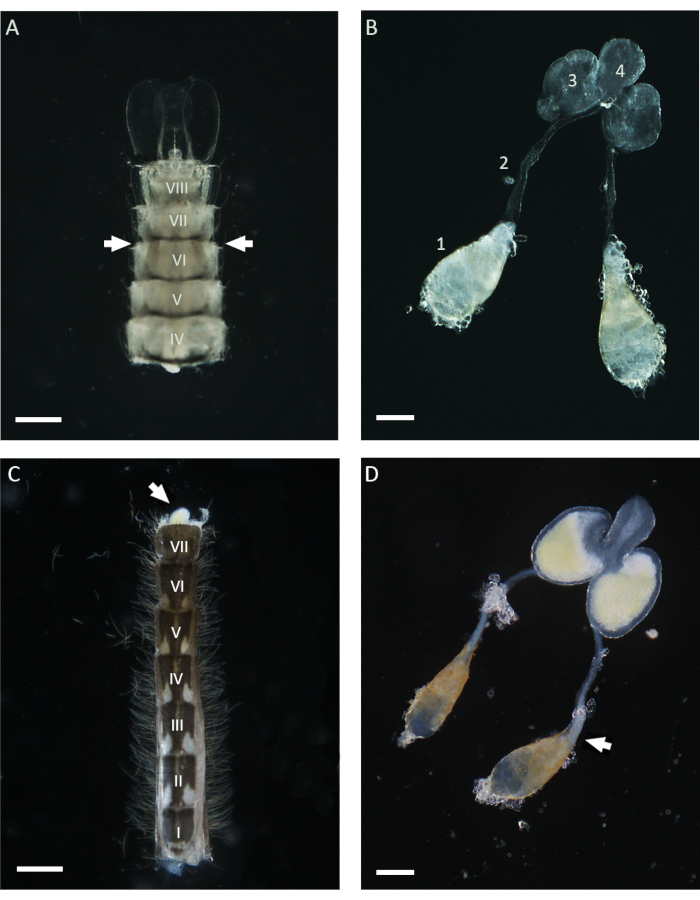
Figura 1: Testículos dissecados de pupas e machos adultos de 1 dia de idade de Anopheles gambiae. (A) Abdome dissecado na fase pupal tardia mostrando a posição dos testículos nas proximidades do sexto segmento abdominal. Os testículos podem ser identificados em toda a cutícula e aparecem como estruturas acastanhadas em ambos os lados do abdômen (com setas). (B) Testículos dissecados na fase pupal, mostrando testículos maduros (1), ducto deferente (2), MAGs (3) e ducto ejaculatório (4). (C) Abdome dissecado de um macho adulto de 1 dia de idade após a remoção do segmento basal do grampo. Os MAGs podem ser esmagados a partir do abdômen aplicando pressão suave (seta branca). (D) Aparelho reprodutor interno masculino dissecado de um macho adulto de 1 dia de idade. A seta branca indica a posição ocupada pelos espermatozoides maduros, que aparecem como um agregado branco no polo basal do testículo. Barras de escala: (A,C) 200 μm; (B,D) 100 μm. Os algarismos romanos de I a VIII indicam os segmentos abdominais. Clique aqui para ver uma versão maior desta figura.
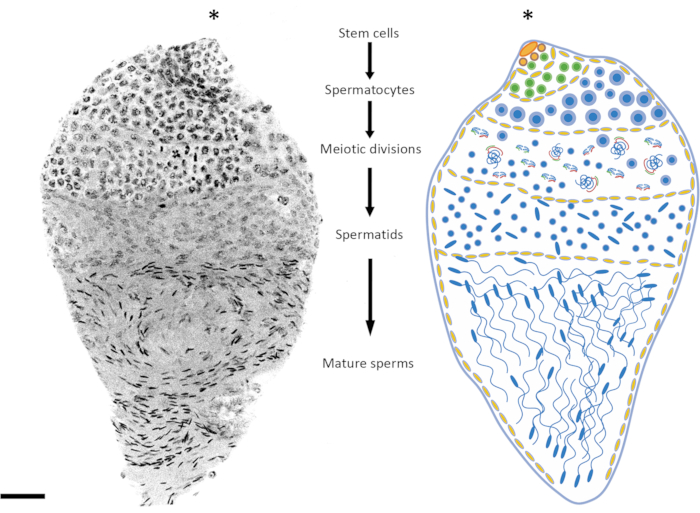
Figura 2: Representação da espermatogênese em Anopheles gambiae. A imagem à esquerda mostra um testículo de pupa tardio de An. gambiae após coloração DAPI de montagem inteira. À direita está uma versão esquemática para melhor visualização. Observando a forma nuclear e o nível de condensação, é relativamente fácil acompanhar todos os estágios da espermatogênese, desde células diploides até espermatozoides haploides. O nicho de células-tronco está situado no polo superior do órgão, onde se inicia a diferenciação em espermatogônias. As células das espermatogônias aumentam em número após a divisão mitótica (células verdes), e os espermatocistos aumentam de tamanho (células amarelas). As células espermatogônicas diferenciam-se em espermatócitos após múltiplas rodadas de divisões mitóticas (células azuis). Os espermatócitos, que se caracterizam por núcleos relativamente maiores que as células das outras etapas do processo, são as células que sofrerão divisão meiótica. Células em meio à meiose podem ser detectadas observando a presença de cromossomos em diferentes estágios meióticos; Chiasmata e cromossomos metásicos podem ser detectados mesmo em baixa magnificação. Os estágios pré-meióticos são super-representados nos testículos dissecados no estágio inicial da pupa. Após a primeira e segunda divisões meióticas, as espermátides são produzidas e geralmente podem ser encontradas no meio do testículo. Os núcleos das espermátides mostram um certo grau de variação em sua forma, de uma forma redonda a uma forma semelhante a uma flecha. As espermátides entram no processo de espermiogênese, durante o qual os núcleos começam a se condensar e sua estrutura se transforma em pontos semelhantes a flechas. Quando os mosquitos amadurecem sexualmente após emergirem, espermatocistos contendo espermatozoides maduros podem ocupar a maior parte do volume testicular às custas de espermatocistos em um estágio diferente de desenvolvimento. Barra de escala: 20 μm. O asterisco (*) indica a parte apical do testículo. Clique aqui para ver uma versão maior desta figura.
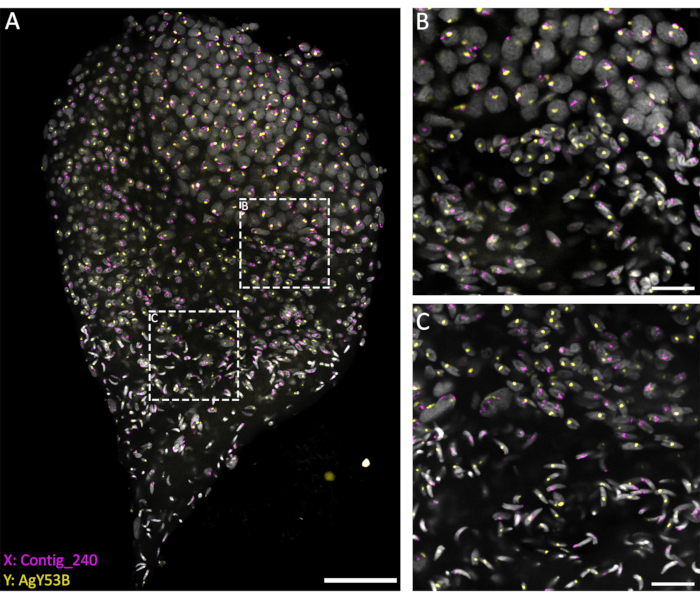
Figura 3: WFISH em um testículo de An. gambiae dissecado do estágio de pupa tardia. A WFISH foi realizada utilizando sondas específicas para os cromossomos X (Contig_240) e Y (oligo sonda específica para AgY53B). (A) WFISH permite acompanhar o comportamento do cromossomo sexual durante a espermatogênese, desde células diploides até espermatozoides haploides. Nesta imagem, é possível apreciar as mudanças dramáticas que os núcleos sofrem durante a espermatogênese. A marcação dos cromossomos sexuais permite a discriminação entre células diploides e haploides. Nas células diploides, o sinal dos cromossomos sexuais está ligado aos mesmos núcleos. Nas células haploides (espermátides e espermatozoides), o sinal dos cromossomos sexuais é desvinculado devido à divisão reducional meiótica. (B,C) Uma imagem de maior aumento (63x) do testículo é mostrada em (A). Eles foram adquiridos em diferentes posições ao longo do eixo Z. Os quadros pontilhados brancos indicam a área de aquisição. (B) Estágio de transição entre espermatócitos e espermátides, mostrando a formação de células haploides e a separação dos sinais dos cromossomos sexuais em núcleos separados. (C) Estágio de transição entre espermátides haploides e espermatozoides maduros. Esta etapa mostra as mudanças no nível de condensação nuclear; Os espermatozoides maduros apresentam uma forma mais condensada e alongada do que as espermátidas. Barras de escala: (A), 30 μm; (B,C), 10 μm; Cinza: DAPI. Clique aqui para ver uma versão maior desta figura.
| Sequência de destino | Sequência de Primers e Consenso Oligo-sonda | Referência |
| Contig_240 (X) | 5'-CAATAAATTTCCTTTTTAATGATGC AAAATCTACGTCTCTAGC-3'-[Fluorocromo] | 19 |
| AgY53B (Y) | 5'AGAAGAATAGAATCAGAATAGTCGG TTTCTTCATCCTGAAAGCC-3'-[Fluorocromo] | Este estudo |
| AgY477- AgY53B junção região (Y) | 5'-TTCTAAGTTTCTAGGCTTTAAGGAT GAAGAAACCGACTATTC-3'-[Fluorocromo] | 19 |
| 18S rDNA (X) | F: AACTGTGGAAAAGCCAGAGC R: TCCACTTGATCCTTGCAAAA | 19 |
| AgY53B (Y) | F: CCTTTAAACACATGCTCAAATT R: GTTTCTTCATCCTTAAAGCCTAG | 19 |
Tabela 1: Lista de oligossondas específicas para o cromossomo X ou Y em An. gambiae.
Vídeo 1: Uma pilha 3D em WFISH realizada em um testículo de An. gambiae dissecado do estágio de pupa tardia. Para obter uma representação 3D do processo de espermatogênese, uma pilha 3D confocal pode ser realizada em testículos mostrando um baixo número de alterações estruturais. Neste estudo, as pilhas foram realizadas com um intervalo de 1,25 μm entre duas seções ópticas sob uma lente de óleo de 63x ou 40x, a fim de não perder informações sobre a organização espacial 3D das células. Cinza: DAPI, amarelo: Contig_240 (X), magenta: AgY53B (Y). Clique aqui para baixar este vídeo.
Discussão
Comumente, os protocolos de FISH requerem o esmagamento do órgão de interesse para permitir a coloração cromossômica. Isso causa uma perda de informação sobre o arranjo espacial das células dentro desse órgão33. Este protocolo descreve como processos biológicos, como a espermatogênese, podem ser estudados in situ, mantendo intacta a estrutura nativa do testículo e sua organização citológica interna. Sondas visando diferentes elementos repetitivos do DNA, que são particularmente enriquecidos em cromossomos sexuais20, podem ser usadas simultaneamente para revelar a dinâmica da maturação espermática. Dependendo do momento da dissecção do testículo, o WFISH oferece a oportunidade de estudar diferentes estágios da espermatogênese através do desenvolvimento do mosquito. A WFISH é útil para o estudo de fenômenos específicos, como a incompatibilidade híbrida, que, em mosquitos Anopheles, se deve à presença de defeitos meióticos como falha pré-meiótica e não disjunção dos cromossomos sexuais 19,34,35. Além do aspecto biológico, a espermatogênese é alvo de uma série de estratégias genéticas desenvolvidas para o controle de insetos-praga como os mosquitos Anopheles. Nesse contexto, o locus de rDNA ligado ao X de An. gambiae tem sido usado como alvo para desenvolver um distorcedor sintético da razão sexual que, ao danificar espermatozoides portadores do X, enviesa a progênie para os machos 4,8,13.
Essa tecnologia reflete a ação de impulsos meióticos naturais da razão sexual que têm sido identificados em vários táxons, incluindo mosquitos, mas que ainda permanecem pouco compreendidos 28,36,37,38,39,40,41. O WFISH oferece a oportunidade de investigar esse fenômeno e abre caminho para refinar ou melhorar estratégias genéticas baseadas em distorção sexual, por exemplo, fornecendo informações sobre como a citologia da produção de espermatozoides é afetada pela escolha dos locais-alvo usados para a trituração de cromossomos sexuais. Embora, em nossa experiência, WFISH mostre grandes chances de sucesso, o fracasso ainda pode ocorrer. Isso pode ser devido a um nível ineficiente de permeabilização tecidual, que pode ser superado com o aumento do tempo de incubação da solução penetrante. Alternativamente, a proteinase K pode ser usada durante a etapa de permeabilização. Em alguns casos, observou-se um nível não uniforme de penetração da sonda, com maior sinal nos núcleos dos espermatócitos e menor ou ausente nos estágios meiótico e espermiogênico. Isso pode ser devido a uma diferença no nível de permeabilização dependendo do estágio celular. Além disso, WFISH provou ser valioso ao usar sondas fluorescentes projetadas para atingir sequências de DNA presentes em alto número de cópias. Ao visar genes de cópia única, a detecção de sinal pode não ser suficiente. Nesse caso, métodos de amplificação de sinal, como a amplificação do sinal de tiramida (TSA), devem ser integrados42.
Esse protocolo poderia ser acoplado à imunomarcação ou a cepas repórteres transgênicas contendo marcadores fluorescentes germinativo-específicos16,18, pois acrescentaria informações sobre a localização de proteínas e a expressão gênica in situ. Neste trabalho, WFISH é descrito como uma técnica para investigar a espermatogênese em mosquitos Anopheles; No entanto, dada a anatomia compartilhada dos órgãos reprodutivos masculinos, este protocolo poderia ser aplicado a outras espécies de mosquitos que desempenham um papel na transmissão da doença. Da mesma forma, a gametogênese feminina poderia ser investigada por meio dessa técnica. Além disso, estudos citológicos em órgãos ou tecidos de interesse, como o intestino médio do mosquito, alvo de invasão de parasitas, ou antecedentes genéticos atípicos, como os de mosquitos híbridos, poderiam ser explorados43. Além disso, esta técnica pode potencialmente ser transferida para outros organismos dentro da ordem dos dípteros.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi apoiado por uma bolsa da Fundação Bill e Melinda Gates e da Open Philanthropy. Agradecemos ao Facility for Imaging by Light Microscopy (FILM) do Imperial College London pela análise microscópica. A Figura 2 foi criada com Biorender.com.
Materiais
| Name | Company | Catalog Number | Comments |
| Amersham CyDye Fluorescent Nucleotides, Cy3-dUTP | Cytiva | PA53022 | |
| Amersham CyDye Fluorescent Nucleotides, Cy5-dUTP | Cytiva | PA55022 | |
| ART Wide Bore Filtered Pipette Tips | ThermoFisher Scientific | 2079GPK | |
| CytoBond Removable Coverslip Sealant | SciGene | 2020-00-1 | |
| Dextran sulfate sodium salt from Leuconostoc spp. | Sigma-Aldrich | D8906-5G | |
| DNeasy Blood & Tissue Kits | Qiagen | 69504 | |
| Embryo Dishes | VWR | 70543-30 | |
| Ethanol, molecular grade | Sigma-Aldrich | 51976 | |
| Formamide | ThermoFisher Scientific | 17899 | |
| GoTaq G2 DNA Polymerase | Promega | M7841 | |
| Hydrochloric acid, 37% | Sigma-Aldrich | 320331 | |
| Microscope slides, SuperFrost | VWR | 631-0114 | |
| PBS (10x), pH 7.4 | ThermoFisher Scientific | 70011044 | |
| Pierce 16% Formaldehyde (w/v), Methanol-free | ThermoFisher Scientific | 28906 | |
| ProLong Gold Antifade Mountant with DAPI | ThermoFisher Scientific | P36941 | |
| RNase A/T1 Mix | ThermoFisher Scientific | EN0551 | |
| Set of dATP, dCTP, dGTP, dTTP | Promega | U1330 | |
| Sodium Acetate Solution | ThermoFisher Scientific | R1181 | |
| SP8 inverted confocal microscope | Leica | ||
| Triton X-100 | Sigma-Aldrich | 9036-19-5 | |
| TWEEN 20 | Sigma-Aldrich | P1379 | |
| UltraPure Salmon Sperm DNA Solution | ThermoFisher Scientific | 15632011 | |
| UltraPure SSC 20x | ThermoFisher Scientific | 15557044 | |
| Primer sequences | |||
| 5’-CAATAAATTTCCTTTTTAATGATGC AAAATCTACGTCTCTAGC-3’-[Fluorochrome] | Eurofins Genomics | Contig_240 (X) | |
| 5’AGAAGAATAGAATCAGAATAGT CGG TTTCTTCATCCTGAAAGCC-3’-[Fluorochrome] | Eurofins Genomics | AgY53B (Y) | |
| 5’-TTCTAAGTTTCTAGGCTTTAAGGA T GAAGAAACCGACTATTC-3’-[Fluorochrome] | Eurofins Genomics | AgY477- AgY53B junction region (Y) | |
| F: AACTGTGGAAAAGCCAGAGC R: TCCACTTGATCCTTGCAAAA | Eurofins Genomics | 18S rDNA (X) | |
| F: CCTTTAAACACATGCTCAAATT R: GTTTCTTCATCCTTAAAGCCTAG | Eurofins Genomics | AgY53B (Y) |
Referências
- World Malaria Report. World Health Organization Available from: https://www.who.int/teams/global-malaria-programme/reports/world-malaria-report-2022 (2022)
- Bhatt, S., et al. The effect of malaria control on Plasmodium falciparum in Africa between 2000 and 2015. Nature. 526 (7572), 207-211 (2015).
- Hammond, A., et al. A CRISPR-Cas9 gene drive system targeting female reproduction in the malaria mosquito vector Anopheles gambiae. Nature Biotechnology. 34 (1), 78-83 (2016).
- Galizi, R., et al. A synthetic sex ratio distortion system for the control of the human malaria mosquito. Nature Communications. 5 (1), 3977 (2014).
- Kyrou, K., et al. A CRISPR-Cas9 gene drive targeting doublesex causes complete population suppression in caged Anopheles gambiae mosquitoes. Nature Biotechnology. 36 (11), 1062-1066 (2018).
- Simoni, A., et al. A male-biased sex-distorter gene drive for the human malaria vector Anopheles gambiae. Nature Biotechnology. 38 (9), 1054-1060 (2020).
- Gantz, V. M., et al. Highly efficient Cas9-mediated gene drive for population modification of the malaria vector mosquito Anopheles stephensi. Proceedings of the National Academy of Sciences of the United States of America. 112 (49), E6736-E6743 (2015).
- Bernardini, F., Kriezis, A., Galizi, R., Nolan, T., Crisanti, A. Introgression of a synthetic sex ratio distortion system from Anopheles gambiae into Anopheles arabiensis. Scientific Reports. 9 (1), 5158 (2019).
- Hammond, A. M., Galizi, R. Gene drives to fight malaria: Current state and future directions. Pathogens and Global Health. 111 (8), 412-423 (2017).
- Garrood, W. T., et al. Driving down malaria transmission with engineered gene drives. Frontiers in Genetics. 13, 891218 (2022).
- Hoermann, A., et al. Gene drive mosquitoes can aid malaria elimination by retarding Plasmodium sporogonic development. Science Advances. 8 (38), (2022).
- Nash, A., et al. Integral gene drives for population replacement. Biology Open. 8 (1), (2019).
- Galizi, R., et al. A CRISPR-Cas9 sex-ratio distortion system for genetic control. Scientific Reports. 6 (1), 31139 (2016).
- Terradas, G., Hermann, A., James, A. A., McGinnis, W., Bier, E. High-resolution in situ analysis of Cas9 germline transcript distributions in gene-drive Anopheles mosquitoes. G3: Genes, Genomes, Genetics. 12 (1), (2022).
- Durant, A. C., Donini, A. Ammonium transporter expression in sperm of the disease vector Aedes aegypti mosquito influences male fertility. Proceedings of the National Academy of Sciences of the United States of America. 117 (47), 29712-29719 (2020).
- Taxiarchi, C., et al. High-resolution transcriptional profiling of Anopheles gambiae spermatogenesis reveals mechanisms of sex chromosome regulation. Scientific Reports. 9 (1), 14841 (2019).
- Pompon, J., Levashina, E. A. A new role of the mosquito complement-like cascade in male fertility in Anopheles gambiae. PLoS Biology. 13 (9), e1002255 (2015).
- Papathanos, P. A., Windbichler, N., Menichelli, M., Burt, A., Crisanti, A. The vasa regulatory region mediates germline expression and maternal transmission of proteins in the malaria mosquito Anopheles gambiae: A versatile tool for genetic control strategies. BMC Molecular Biology. 10 (1), 13 (2009).
- Liang, J., Sharakhov, I. V. Premeiotic and meiotic failures lead to hybrid male sterility in the Anopheles gambiae complex. Proceedings of the Royal Society B. 286 (1906), 20191080 (2019).
- Hall, A. B., et al. Radical remodeling of the Y chromosome in a recent radiation of malaria mosquitoes. Proceedings of the National Academy of Sciences of the United States of America. 113 (15), E2114-E2123 (2016).
- Clements, A. N. . The Biology of Mosquitoes. Volume 1: Development, Nutrition and Reproduction. , (1992).
- Demarco, R. S., Eikenes, &. #. 1. 9. 7. ;. H., Haglund, K., Jones, D. L. Investigating spermatogenesis in Drosophila melanogaster. Methods. 68 (1), 218-227 (2014).
- Helinski, M. E., Parker, A. G., Knols, B. G. Radiation biology of mosquitoes. Malaria Journal. 8, S6 (2009).
- Huho, B. J., et al. A reliable morphological method to assess the age of male Anopheles gambiae. Malaria Journal. 5 (1), 62 (2006).
- Fabian, L., Brill, J. A. Drosophila spermiogenesis. Spermatogenesis. 2 (3), 197-212 (2012).
- Li, M., et al. Suppressing mosquito populations with precision guided sterile males. Nature Communications. 12 (1), 5374 (2021).
- Thailayil, J., Magnusson, K., Godfray, H. C., Crisanti, A., Catteruccia, F. Spermless males elicit large-scale female responses to mating in the malaria mosquito Anopheles gambiae. Proceedings of the National Academy of Sciences of the United States of America. 108 (33), 13677-13681 (2011).
- Haghighat-Khah, R. E., et al. Cellular mechanisms regulating synthetic sex ratio distortion in the Anopheles gambiae germline. Pathogens and Global Health. 114 (7), 370-378 (2020).
- Yamamoto, D. S., et al. A synthetic male-specific sterilization system using the mammalian pro-apoptotic factor in a malaria vector mosquito. Scientific Reports. 9 (1), 8160 (2019).
- Papathanos, P. A., Windbichler, N. Redkmer: An assembly-free pipeline for the identification of abundant and specific X-chromosome target sequences for X-shredding by CRISPR endonucleases. The CRISPR Journal. 1 (1), 88-98 (2018).
- Sharma, A., Kinney, N. A., Timoshevskiy, V. A., Sharakhova, M. V., Sharakhov, I. V. Structural variation of the X chromosome heterochromatin in the Anopheles gambiae complex. Genes. 11 (3), 327 (2020).
- Krzywinski, J., Sangaré, D., Besansky, N. J. Satellite DNA from the Y chromosome of the malaria vector Anopheles gambiae. Genetics. 169 (1), 185-196 (2005).
- Timoshevskiy, V. A., Sharma, A., Sharakhov, I. V., Sharakhova, M. V. Fluorescent in situ hybridization on mitotic chromosomes of mosquitoes. Journal of Visualized Experiments. (67), e4215 (2012).
- Liang, J., Hodge, J. M., Sharakhov, I. V. Asymmetric phenotypes of sterile hybrid males from reciprocal crosses between species of the Anopheles gambiae complex. Frontiers in Ecology and Evolution. 9, 660207 (2021).
- Slotman, M., Torre, A. D., Powell, J. R. The genetics of inviability and male sterility in hybrids between Anopheles gambiae and An. arabiensis. Genetics. 167 (1), 275-287 (2004).
- Wood, R. J., Newton, M. E. Sex-ratio distortion caused by meiotic drive in mosquitoes. The American Naturalist. 137 (3), 379-391 (1991).
- Cazemajor, M., Joly, D., Montchamp-Moreau, C. Sex-ratio meiotic drive in Drosophila simulans is related to equational nondisjunction of the Y chromosome. Genetics. 154 (1), 229-236 (2000).
- Jaenike, J. Sex chromosome meiotic drive. Annual Review of Ecology and Systematics. 32 (1), 25-49 (2001).
- Courret, C., Chang, C. H., Wei, K. H., Montchamp-Moreau, C., Larracuente, A. M. Meiotic drive mechanisms: Lessons from Drosophila. Proceedings of the Royal Society B. 286 (1913), 20191430 (2019).
- Zanders, S. E., Unckless, R. L. Fertility costs of meiotic drivers. Current Biology. 29 (11), R512-R520 (2019).
- Newton, M. E., Wood, R. J., Southern, D. I. A cytogenetic analysis of meiotic drive in the mosquito, Aedes aegypti (L.). Genetica. 46 (3), 297-318 (1976).
- Carabajal Paladino, L. Z., Nguyen, P., Šíchová, J., Marec, F. Mapping of single-copy genes by TSA-FISH in the codling moth, Cydia pomonella. BMC Genomic Data. 15, S15 (2014).
- Bernardini, F., et al. Cross-species Y chromosome function between malaria vectors of the Anopheles gambiae species complex. Genetics. 207 (2), 729-740 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados