Method Article
Флуоресцентная гибридизация in situ для изучения сперматогенеза комара Anopheles
В этой статье
Резюме
Учитывая их простую анатомию, семенники Anopheles представляют собой хорошую цитологическую модель для изучения сперматогенеза. Этот протокол описывает флуоресцентную гибридизацию in situ , метод, используемый для исследования этого биологического процесса, а также фенотип трансгенных штаммов, содержащих мутации в генах, участвующих в производстве сперматозоидов.
Аннотация
Сперматогенез – это сложный биологический процесс, в ходе которого диплоидные клетки подвергаются последовательному митотическому и мейотическому делению, за которым следуют большие структурные изменения с образованием гаплоидных сперматозоидов. Помимо биологического аспекта, изучение сперматогенеза имеет первостепенное значение для понимания и разработки генетических технологий, таких как генный драйв и синтетические искажатели соотношения полов, которые, изменяя менделевское наследование и соотношение полов сперматозоидов соответственно, могут быть использованы для контроля популяций насекомых-вредителей. Эти технологии оказались очень перспективными в лабораторных условиях и потенциально могут быть использованы для контроля диких популяций комаров рода Anopheles , которые являются переносчиками малярии. Благодаря простоте анатомии яичек и их медицинскому значению, Anopheles gambiae, основной переносчик малярии в Африке к югу от Сахары, представляет собой хорошую цитологическую модель для изучения сперматогенеза. Этот протокол описывает, как полномасштабная флуоресцентная гибридизация in situ (WFISH) может быть использована для изучения драматических изменений в структуре ядра клетки в процессе сперматогенеза с использованием флуоресцентных зондов, которые специфически окрашивают X- и Y-хромосомы. FISH обычно требует нарушения репродуктивных органов, чтобы обнажить митотические или мейотические хромосомы и позволить окрашивать определенные области генома флуоресцентными зондами. WFISH позволяет сохранить нативную цитологическую структуру яичка в сочетании с хорошим уровнем обнаружения сигналов от флуоресцентных зондов, нацеленных на повторяющиеся последовательности ДНК. Это позволяет исследователям проследить изменения в хромосомном поведении клеток, подвергающихся мейозу, вдоль структуры органа, где можно четко различить каждую фазу процесса. Этот метод может быть особенно полезен для изучения мейотических спариваний хромосом и изучения цитологических фенотипов, связанных, например, с синтетическими искажателями соотношения полов, гибридной мужской стерильностью и нокаутом генов, участвующих в сперматогенезе.
Введение
Малярия ложится огромным бременем на здоровье и благополучие населения планеты. По оценкам Всемирной организации здравоохранения (ВОЗ), в 2021 г. малярия стала причиной 619 000 смертей, 96% из которых произошли встранах Африки к югу от Сахары1. Болезнь переносится комарами, принадлежащими к роду Anopheles, а в странах Африки к югу от Сахары три вида, а именно Anopheles gambiae (An. gambiae), Anopheles coluzzi (An, coluzzi) и Anopheles arabiensis (An. Arabiensis), играют непропорционально большую роль в передаче малярии, на их долю приходится 95% случаев заболевания малярией во всем мире. Программы борьбы, основанные на традиционных методах, таких как инсектициды и противомалярийные препараты, спасли миллионы жизней; Однако в последние годы растущее сопротивление этим методам борьбы поставило под сомнение их эффективность 1,2. Кроме того, ограничения, введенные пандемией COVID-19, повлияли на доступность основных мероприятий по борьбе с малярией, что, согласно Всемирному докладу ВОЗ о малярии 2022 г., привело к росту заболеваемости малярией1. За последние два десятилетия в лабораторных условиях были разработаны новые методы генетического контроля для борьбы с комарами рода Anopheles 3,4,5,6,7,8,9,10. Среди этих стратегий многообещающими представляются те, которые основаны на системах генного драйва (GDS) и синтетических искажающих соотношение полов (SD). GDS полагаются на возможность передачи с очень высокой частотой генетической модификации, которая влияет на фертильность самок или нарушает жизненный цикл паразита у комаров 5,11,12. Вместо этого УР действуют, изменяя соотношение полов потомства комаров в сторону самцов, что со временем приводит к коллапсу целевой популяции из-за нехватки самок 4,6,13. Основные компоненты этих генетических систем воздействуют в первую очередь на репродуктивные органы комаров, где гаметы, яйцеклетки и сперматозоиды образуются после мейотического деления14.
В этом протоколе используются достижения цитогенетических методов для изучения сперматогенеза у An. gambiae с акцентом на поведение хромосом in situ. Строение семенников комара и протекающие в нем биологические процессы ранее исследовались с использованием ряда цитологических методов, таких как иммунофлуоресценция, флуоресцентные репортерные трансгены, флуоресцентная гибридизация ДНК и РНК in situ (FISH)15,16,17,18,19,20; Органы имеют веретенообразную форму, в которой нижний полюс прикреплен к семявыносящему протоку, соединенному с мужскими добавочными железами. На верхнем полюсе ниша стволовых клеток зародышевой линии пролиферируется и дифференцируется в клетки сперматогоний, встроенные в сперматоцисты, образованные соматическими клетками. После нескольких циклов митотического деления сперматогонии дифференцируются в сперматоциты, которые вступают в мейоз. В профазе аутосомы и половые хромосомы спариваются со своими гомологами, и происходит кроссинговер. После мейотических делений образуются круглые гаплоидные сперматиды, которые вступают в спермиогенез, и этот процесс приводит к образованию зрелых гаплоидных сперматозоидов, в которых цитоплазма удалена, ядерный хроматин конденсируется, а в базальной части ядер появляются жгутики21,22 (рис. 1 и рис. 2).
Как правило, спермиогенез начинается примерно на стадии средней куколки, а зрелые сперматозоиды могут быть обнаружены на поздней стадии куколки в резервуаре сперматозоидов23. Процесс созревания сперматоцист продолжается и во взрослой жизни23,24,25. У семенников Anopheles каждый этап сперматогенеза можно легко определить, взглянув на ядерную морфологию клеток в каждой сперматоцисте (рис. 2). Флуоресцентная гибридизация in situ (WFISH), описанная в этом протоколе, позволяет исследователям специфически маркировать хромосомную область и отслеживать ее во время сперматогенеза, сохраняя при этом нативную структуру органа и положение клеточных ядер; это представляет собой преимущество по сравнению со стандартным протоколом DNA FISH, в котором орган обычно раздавливается, что приводит к повреждению тканей19. В нынешнем протоколе флуоресцентные зонды используются для окрашивания повторяющихся последовательностей на половых хромосомах и, таким образом, отслеживания их поведения во время сперматогенеза, от диплоидных делящихся клеток до зрелых гаплоидных сперматозоидов. WFISH может быть особенно полезен для изучения мейотического спаривания половых хромосом и исследования цитологических фенотипов, связанных, например, с синтетическими искажателями соотношения полов, гибридной мужской бесплодностью и нокаутом генов, участвующих в сперматогенезе 4,19,26,27.
Учитывая их роль в качестве переносчиков малярии, комары Anopheles становятся мишенью для растущего числа генетических стратегий борьбы с переносчиками, которые часто действуют в репродуктивных органах этих организмов. Было создано несколько мутантов комаров и цитологических фенотипов, которые требуют новых цитологических методов исследования26,27,28,29. Метод, описанный в этом исследовании, проливает свет на понимание сперматогенеза, а также на цитологические механизмы, лежащие в основе генетических стратегий, которые потенциально могут контролировать комаров, переносящих малярию.
протокол
1. Маркировка ДНК-зондов
ПРИМЕЧАНИЕ: Ниже приведены технические шаги по созданию флуоресцентных ДНК-зондов, которые специфически маркируют половые хромосомы комаров An. gambiae.
- Маркировка зондов с помощью ПЦР
- Извлеките геномную ДНК из куколок или взрослых самцов для маркировки X- или Y-хромосом с помощью коммерчески доступного набора для экстракции геномной ДНК (см. таблицу материалов).
- Приготовьте реакционную смесь для ПЦР: 200 нг геномной ДНК, 0,05 мМ немеченого нуклеотида (dATP, dCTP, dGTP), 0,015 мМ dTTP и 1 мкл флуоресцентно меченного dUTP (Cy3, Cy5 или другого флуорохрома), 50 пмоль прямого и обратного праймера (табл. 1), 5 мкл 10-кратного ПЦР-буфера и 10 ЕД Taq ДНК-полимеразы (см. таблицу материалов).
- Для мечения 18S рДНК и сателлита AgY53B (табл. 1) проводят ПЦР-реакцию со следующими параметрами ПЦР: один цикл 95 °C в течение 10 мин; 35 циклов 95 °C в течение 30 с, 52 °C в течение 30 с и 72 °C в течение 45 с; один цикл при температуре 72 °C в течение 5 мин; и окончательная выдержка при 4 °C.
ПРИМЕЧАНИЕ: Для получения хорошей концентрации зонда методом ПЦР-мечения (~1 мкг в 5 мкл), что имеет решающее значение для успешного WFISH, реакция ПЦР должна быть высокоэффективной. По этой причине, прежде чем маркировать зонд, настоятельно рекомендуется проверить эффективность праймеров, выбранных для амплификации. Кроме того, включение положительного контроля в реакцию ПЦР (без флуоресцентного dUTP) поможет проверить эффективность реакции мечения. - Храните зонд при температуре −20 °C в темном месте.
- Получение 3'-концевых флуоресцентных олигонуклеотидных зондов
- Получить коммерчески доступные флуоресцентные олигонуклеотидные зонды в виде модифицированных олиго, добавив флуорохромы Cy3 или Cy5 (или любой другой флуорохром) к 3'-концу нуклеотидной последовательности (см. таблицу материалов). В таблице 1 приведены эталонные последовательности, используемые для маркировки Y-сцепленного сателлита AgY477-AgY53B и X-сцепленного сателлита из Contig_240.
ПРИМЕЧАНИЕ: Нет никаких технических препятствий, связанных с концентрацией 3'-меченых олигонуклеотидов, так как пользователь обычно может выбрать ее перед покупкой. Мы предлагаем разбавлять ~800 нг раствора олигозонда в гибридизационном буфере для эффективного мечения с помощью олигозонда. X- и Y-специфичные олигозонды ранее использовались для WFISH Ляном и Шараховым19, а эталонную последовательность можно найти в таблице 1.
- Получить коммерчески доступные флуоресцентные олигонуклеотидные зонды в виде модифицированных олиго, добавив флуорохромы Cy3 или Cy5 (или любой другой флуорохром) к 3'-концу нуклеотидной последовательности (см. таблицу материалов). В таблице 1 приведены эталонные последовательности, используемые для маркировки Y-сцепленного сателлита AgY477-AgY53B и X-сцепленного сателлита из Contig_240.
2. Приготовление гибридизационного раствора
ПРИМЕЧАНИЕ: Флуоресцентные зонды, полученные на этапе 1, должны быть включены в химический раствор, который гибридизируется с целевыми последовательностями.
- Осаждение зонда до флуоресцентной гибридизации in situ
- К пробирке объемом 1,5 мл добавляют 5 мкл меченого ДНК-зонда (если он получен методом ПЦР-мечения) или 2,2 мкл 3'-модифицированного олигозонда (~800 нг зонда) из стадии 1 и 5 мкл ДНК сперматозоида лосося (см. таблицу материалов). Объедините зонды, специфичные для разных областей генома, в одной пробирке и используйте их в качестве уникального решения на следующих этапах.
- Осаждают зонд ДНК, добавляя 0,1 объема 3 М ацетата натрия и 2 объема 100% этанола. Хранить при температуре −20 °C не менее 2,5 ч (увеличение времени инкубации при −20 °C увеличит конечный урожай). На этом этапе зонды также могут храниться в течение ночи перед центрифугированием.
- Центрифуга при 17 000 x g при 4 °C в течение 20 минут, удалите этанол и высушите гранулы на воздухе при RT в темноте в течение ~20 минут.
- Решение для гибридизации
- Прежде чем приступить к рассечению яичка (шаг 3), приготовьте буфер для гибридизации, смешав в пробирке 1,5 следующие реагенты: 500 мкл формамида, 0,2 г декстрана сульфата, 100 мкл 20-кратного солевого цитрата натрия (SSC) и 200 мкл стерильного H20 (см. таблицу материалов). Встряхните раствор гибридизации в течение 1 мин и дайте сульфату декстрана раствориться при 37 °C в течение 30 минут.
- Растворите гранулу из стадии 2.1.3 в 20-30 мкл гибридизационного буфера (вихрь в течение примерно 1 мин, выполните быстрый отжим и храните пробирки при 37 °C в темноте) для получения раствора для гибридизации.
3. Рассечение и фиксация яичек
- При комнатной температуре (RT) препарируют21 не менее ~20 яичек от куколок или взрослых особей в возрасте 1 дня в стерильном растворе 1x фосфатно-солевого буфера (PBS) и переносят их на чистое предметное стекло микроскопа, содержащее свежую каплю 1x раствора PBS.
- Пересадить семенники с помощью широкопроходного фильтрующего наконечника P1,000 или кончика иглы для диссекции из капли 1x PBS в чашку для эмбрионов, содержащую 3,7% формальдегида в 1x PBS с 0,1% Tween-20 (PBST), и инкубировать в течение 10 минут при RT.
- Промывают яички в 1x PBST в течение 5 мин при RT. Инкубируют яички в 0,1 мг/мл РНКазе А (см. таблицу материалов), разведенной в стерильной 1x PBS, в течение 30 мин при 37 °C.
- Раствор РНКазы удаляют, добавляют проникающий раствор (1% тритон/0,1 М HCl в 1x PBST) и инкубируют при RT в течение 10 мин.
ПРИМЕЧАНИЕ: Протеиназа К может быть использована в качестве проникающего агента в конечной концентрации 10 мкг/мл в 1x PBST для увеличения проницаемости яичек. - Промывают яички в 1х ПБСТ два раза по 5 мин каждый при РТ.
4. Гибридизация
ПРИМЕЧАНИЕ: В этом разделе описываются заключительные этапы гибридизации in situ .
- После этапа промывки (этап 3.5) переносят семенники в пробирку объемом 1,5 мл с 20-30 мкл раствора гибридизации, содержащего заранее подготовленный зонд (этап 2.2.2). Аккуратно перемешайте раствор кончиком пипетки. Осторожно щелкните тюбиком пять раз, прежде чем переходить к следующим шагам.
- Инкубируйте в течение 5 минут при 75 °C для денатурации ДНК.
- Инкубируйте в течение ночи при 37 °C (если возможно, с раскачиванием при менее 100 об/мин) для гибридизации ДНК-ДНК.
- Перенесите семенники обратно в чашку для эмбрионов с помощью широкопроходного фильтрующего наконечника P1,000 и промойте их в 2x SSC, предварительно нагретом до 50 °C, в течение 5 минут.
ПРИМЕЧАНИЕ: После этапа гибридизации требуется заключительный этап промывки с использованием 2x SSC; Это играет важную роль в удалении любого фонового сигнала, вызванного присутствием негибридизованных зондов внутри ткани органа. При наличии сильного фонового сигнала рекомендуется повторить последний этап стирки. - Снимите 2x SSC и установите семенники с помощью имеющейся в продаже монтажной среды с 4′,6-диамидино-2-фенилиндолом (DAPI) (см. Таблицу материалов) на предметное стекло, запечатайте покровным герметиком и инкубируйте не менее 2 ч при RT в темноте.
- Выполните конфокальную визуализацию. Все яички могут быть визуализированы с помощью 40-кратных или 63-кратных объективов для погружения в масло. Если выполняется z-стек, мы рекомендуем использовать z-шаг 1,25 мкм.
Результаты
В данной работе WFISH был использован для изучения поведения хромосом во время сперматогенеза у An. gambiae. Первым важным шагом для применения этого протокола является получение семенников, которые показывают низкий уровень морфологических изменений после диссекции. Для успешного вскрытия яичек требуются базовые знания анатомии комаров, и ниже приведены некоторые рекомендации по этой процедуре. У комара Anopheles зрелые семенники находятся в шестом брюшном сегменте куколки и взрослой особи21 стадии. Как показано на рисунке 1, семявыносящий проток соединяет семенники с мужскими добавочными железами (MAG), которые расположены в последнем сегменте брюшной полости. МАГ соединены с уникальным эякуляторным протоком, который доставляет сперматозоиды и семенные жидкости к копулятивному органу и наружной части мужского полового аппарата21. Весь внутренний мужской половой аппарат может быть препарирован с помощью различных подходов в зависимости от стадии жизни комара. На стадии куколки семенники можно легко идентифицировать с помощью стереомикроскопа по всей светлой кутикуле, посмотрев на вентральную сторону брюшка в непосредственной близости от шестого сегмента (рис. 1). Для рассечения яичек нижнюю часть брюшной полости, включая шестой сегмент, можно изолировать от остального тела с помощью пары игл и перенести в чистую каплю 1x PBS. После удаления последнего сегмента весь аппарат можно выдавить из брюшной полости, слегка надавливая препарирующими иглами. Чтобы отделить семенники от взрослых самцов, первый шаг включает в себя изоляцию всего брюшка в свежей капле 1x PBS, а затем извлечение последнего сегмента с застежками, которые являются копулятивными структурами самцов (Рисунок 1). В этот момент нижняя часть MAG должна появиться и быть легко узнаваемой по их желтому цвету. Затем весь мужской аппарат можно медленно вытащить с помощью иглы или щипцов в каплю 1x PBS до тех пор, пока не станет видна пара яичек, прикрепленных к семявыносящему протоку . Прежде чем приступить к фиксации, важно изолировать семенники от других отделов мужского аппарата, разрезав в непосредственной близости нижнюю часть семявыносящего протока (рисунок 1).
Возраст куколок или взрослых самцов является важным фактором, который следует учитывать в зависимости от исследуемой стадии сперматогенеза. У An. gambiae сперматогенез начинается на ранней/средней стадии куколки и продолжается на протяжении всей жизни особи24. Между 3 и 10 часами после окукливания премейотическая и мейотическая стадии более представлены в яичке (мейотическая профаза, мейотические деления), ДНК сперматид относительно неконденсирована, зрелые сперматозоиды еще не сформировались. Поздние куколки и взрослые особи в возрасте 1 дня обеспечивают хороший баланс между премейотической, мейотической и постмейотической стадиями (рис. 2 и рис. 3). У взрослых особей, возраст которых превышает 4 дня, премейотические стадии и сперматоцисты представлены меньше, а семенники в основном заняты зрелыми сперматозоидами, содержащимися в резервуаре сперматозоидов.
Для изучения поведения половых хромосом на различных стадиях сперматогенеза WFISH проводили на семенниках, препарированных на поздней стадии куколки, чтобы обеспечить хорошее представление всего процесса. Для наблюдения за поведением этих хромосом использовались флуоресцентные зонды, специфичные для повторяющихся последовательностей, расположенных исключительно на X или Y хромосоме. Флуоресцентные зонды могут быть получены с помощью ПЦР или получены в промышленных масштабах в виде 3'-меченых олигонуклеотидов. Рекомендуется использовать олиго длиной >40 бит/с, чтобы обеспечить хорошее обнаружение сигнала от флуоресцентного олигозонда. По нашему опыту, 3'-меченые олиго работают лучше, чем ПЦР-меченые зонды с точки зрения обнаружения сигнала. Кроме того, число копий целевой последовательности является фактором, который может повлиять на эффективность WFISH. Если мечение не увенчалось успехом, рекомендуется использовать метод ПЦР-мечения на более длинном фрагменте или сконструировать несколько олигометов, специфичных для целевой области.
Современные методы, основанные на использовании проникающего раствора (1% Triton/0,1 M HCl в 1x PBST), позволяют обеспечить хороший уровень проницаемости яичек и проникновения зондов, что приводит к успешной реакции гибридизации. Олигозонды, специфичные для повторяющихся последовательностей половых хромосом, могут быть разработаны на основе обширной характеристики повторяющихся элементов, выполненной Hall et al.20. Кроме того, консенсусные последовательности, специфичные для X- или Y-связанных повторяющихся элементов, могут быть получены с помощью биоинформатической платформы, такой как конвейер RedKmer30. Важно отметить, что зонды половых хромосом могут воздействовать на повторяющиеся элементы, такие как сателлиты и ретротранспозоны, и они могут иметь различный уровень гибридизации с X- или Y-хромосомами в зависимости от исследуемого вида 20,31,32. Как показано на рисунке 3, хороший уровень гибридизации зондов и низкий фон позволили визуализировать целевые хромосомы на протяжении всего сперматогенеза. Спаривание меченых половых хромосом можно наблюдать на премейотической и мейотической стадиях. За этим последовало обнаружение X- или Y-хромосом в хромосомах ядер гаплоидных клеток, образовавшихся в результате мейотических делений. Впоследствии, сперматиды, несущие X- или Y, могут быть прослежены на протяжении всего спермиогенеза, отмеченного различными уровнями конденсации ДНК, до последней стадии зрелых сперматозоидов в форме стрелы. В настоящей экспериментальной установке конфокальные Z-стеки использовались для получения информации о трехмерной пространственной организации клеток во время этого процесса (Видео 1).
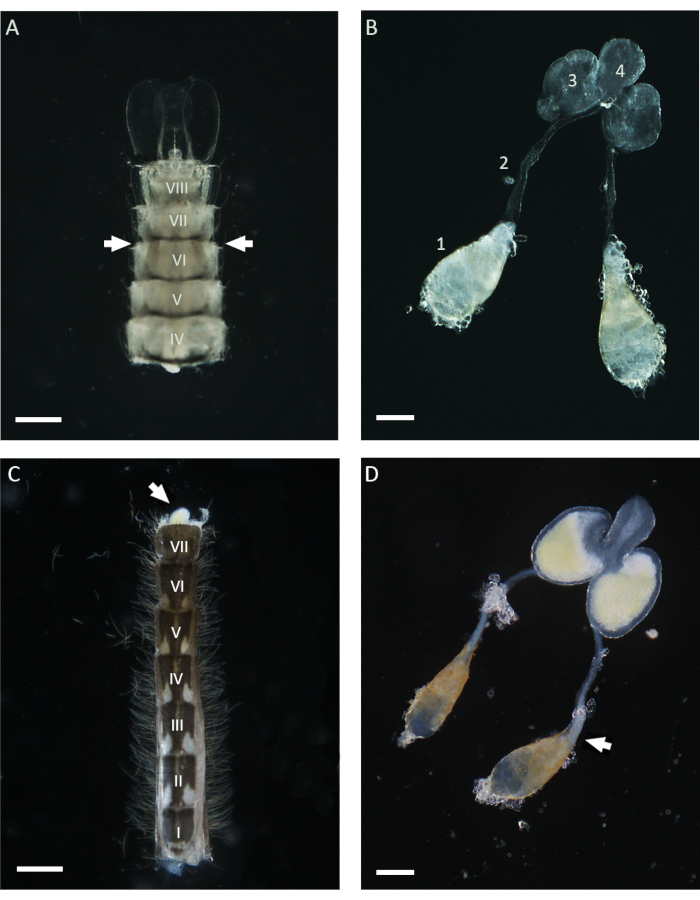
Рисунок 1: Семенники, вскрытые от куколок и 1-дневных взрослых самцов Anopheles gambiae. (А) Брюшко, рассеченное на поздней стадии куколки, показывающее положение семенников в непосредственной близости от шестого брюшного сегмента. Семенники могут быть идентифицированы по всей кутикуле и выглядят как коричневатые структуры по обеим сторонам брюшка (со стрелками). (B) Семенники, рассеченные на стадии куколки, с выявлением зрелых яичек (1), семявыносящих протоков (2), MAG (3) и семяизвергающего протока (4). (C) Брюшная полость, вскрытая у взрослого самца в возрасте 1 дня после удаления базального сегмента застежки. MAG можно выдавливать из брюшной полости, слегка надавливая (белая стрелка). (D) Мужской внутренний репродуктивный аппарат, препарированный у взрослого мужчины в возрасте 1 дня. Белая стрелка указывает на положение, занимаемое зрелыми сперматозоидами, которые выглядят в виде белого агрегата на базальном полюсе яичка. Масштабные линейки: (A,C) 200 мкм; (B,D) 100 мкм. Римские цифры от I до VIII обозначают брюшные сегменты. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
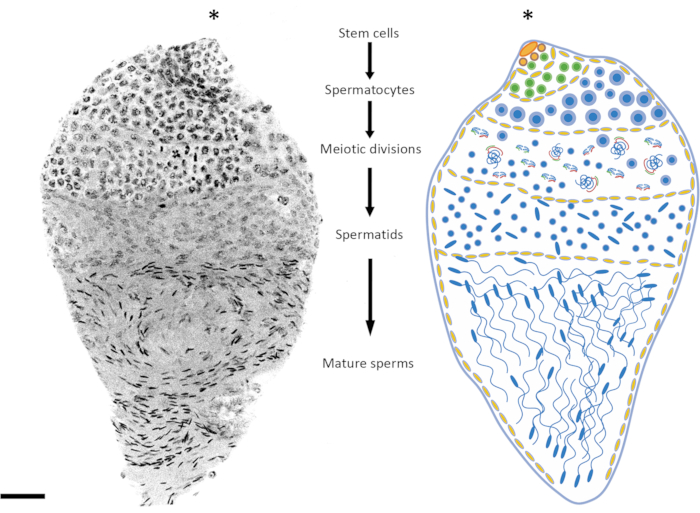
Рисунок 2: Представление сперматогенеза у Anopheles gambiae. На рисунке слева показана поздняя куколка An. gambiae после полного окрашивания DAPI. Справа приведена схематическая версия для лучшей визуализации. Наблюдая за формой ядра и уровнем конденсации, относительно легко проследить все стадии сперматогенеза от диплоидных клеток до гаплоидных сперматозоидов. Ниша стволовых клеток находится в верхнем полюсе органа, где начинается дифференцировка в сперматогонии. Клетки сперматогоний увеличиваются в количестве после митотического деления (зеленые клетки), а сперматоцисты увеличиваются в размерах (желтые клетки). Клетки сперматогоний дифференцируются в сперматоциты после нескольких раундов митотических делений (синие клетки). Сперматоциты, которые характеризуются относительно более крупными ядрами, чем клетки других стадий процесса, являются клетками, которые будут подвергаться мейотическому делению. Клетки, подвергающиеся мейозу, могут быть обнаружены по наличию хромосом на разных мейотических стадиях; Хиазматы и метафазные хромосомы могут быть обнаружены даже при малом увеличении. Премейотические стадии чрезмерно представлены в семенниках, препарированных на ранней стадии куколки. После первого и второго мейотических делений образуются сперматиды, которые обычно можно найти в середине яичка. Ядра сперматид демонстрируют определенную степень изменчивости в своей форме, от круглой до стреловидной формы. Сперматиды вступают в процесс спермиогенеза, во время которого ядра начинают уплотняться, а их структура меняется на стреловидные точки. Когда комары созревают половым путем после появления, сперматоцисты, содержащие зрелые сперматозоиды, могут занимать большую часть объема яичек за счет сперматоцист на другой стадии развития. Масштабная линейка: 20 мкм. Звездочкой (*) обозначена верхушечная часть яичка. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
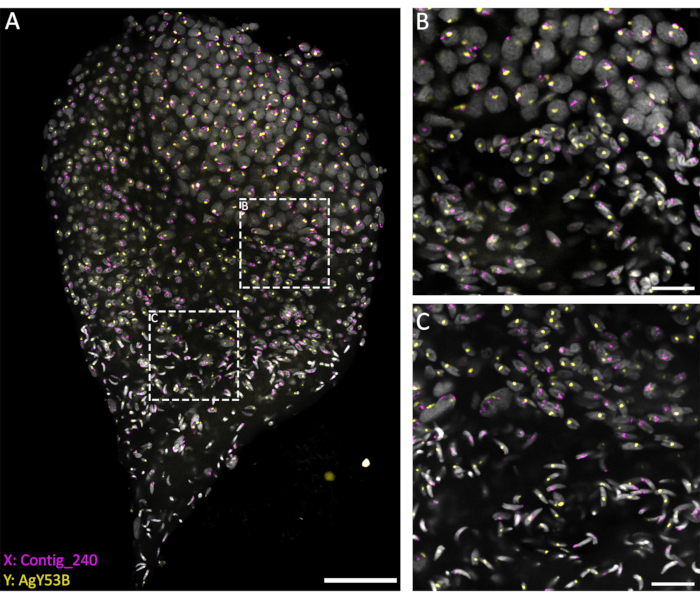
Рисунок 3: WFISH на семеннике An. gambiae, вскрытом от поздней стадии куколки. WFISH проводили с использованием зондов, специфичных для X (Contig_240) и Y (олигозонд, специфичный для AgY53B) хромосом. (A) WFISH позволяет проследить поведение половой хромосомы во время сперматогенеза от диплоидных клеток до гаплоидных сперматозоидов. На этом снимке можно оценить драматические изменения, которые претерпевают ядра во время сперматогенеза. Маркировка половых хромосом позволяет различать диплоидные и гаплоидные клетки. В диплоидных клетках сигнал от половых хромосом связан с теми же ядрами. В гаплоидных клетках (сперматидах и сперматозоидах) сигнал половых хромосом не связан из-за мейотического редукционного деления. (В,В) Изображение яичка с большим увеличением (63x) показано на рисунке (А). Они были получены в разных положениях вдоль оси Z. Белыми пунктирными рамками обозначена область приобретения. Б) Переходная стадия между сперматоцитами и сперматидами, показывающая образование гаплоидных клеток и разделение сигналов от половых хромосом на отдельные ядра. (C) Переходная стадия между гаплоидными сперматидами и зрелыми сперматозоидами. На этом этапе показаны изменения уровня ядерной конденсации; Зрелые сперматозоиды имеют более плотную и вытянутую форму, чем сперматиды. Масштабные линейки: (А), 30 мкм; (В,С), 10 мкм; Серый: DAPI. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
| Целевая последовательность | Последовательность праймеров и консенсус олигозондов | Ссылка |
| Contig_240 (Х) | 5'-CAATAAATTTCCTTTTTAATGATGC AAAATCTACGTCTCTAGC-3'-[Флуорохром] | 19 |
| AgY53B (Y) | 5'АГААГААТААГААТКААГААААААААААААААААААААААААААААААААААААА TTTCTTCATCCTGAAAGCC-3'-[Флуорохром] | Данное исследование |
| AgY477- AgY53B соединение регион (Y) | 5'-TTCTAAGTTTCTAGGCTTTAAGGAT GAAGAAACCGACTATTC-3'-[Флуорохром] | 19 |
| 18S рДНК (X) | Ф: AACTGTGGAAAAGCCAGAGC Р: TCCACTTGATCCTTGCAAAA | 19 |
| AgY53B (Y) | F: CCTTTAAACACATGCTCAAATT Р: GTTTCTTCATCCTTAAAGCCTAG | 19 |
Таблица 1: Список олигозондов, специфичных для X- или Y-хромосомы у An. gambiae.
Видео 1: 3D-стек на WFISH, выполненный на семеннике An. gambiae , препарированном из поздней стадии куколки. Чтобы получить 3D-представление процесса сперматогенеза, можно провести конфокальный 3D-стек на яичках, демонстрирующих малое количество структурных изменений. В данном исследовании стеки выполнялись с интервалом 1,25 мкм между двумя оптическими участками под 63-кратной или 40-кратной масляной линзой, чтобы не потерять информацию о 3D-пространственной организации клеток. Серый: DAPI, желтый: Contig_240 (X), пурпурный: AgY53B (Y). Пожалуйста, нажмите здесь, чтобы скачать это видео.
Обсуждение
Как правило, протоколы FISH требуют раздавливания интересующего органа, чтобы обеспечить окрашивание хромосом. Это приводит к потере информации о пространственном расположении клеток в этом органе33. Этот протокол описывает, как биологические процессы, такие как сперматогенез, могут быть изучены in situ, сохраняя при этом неповрежденную нативную структуру яичка и его внутреннюю цитологическую организацию. Зонды, нацеленные на различные повторяющиеся элементы ДНК, которые особенно обогащены половыми хромосомами20, могут быть одновременно использованы для выявления динамики созревания сперматозоидов. В зависимости от сроков рассечения яичка, WFISH предлагает возможность изучать различные стадии сперматогенеза через развитие комаров. WFISH полезен для изучения специфических явлений, таких как гибридная несовместимость, которая у комаров рода Anopheles обусловлена наличием мейотических дефектов, таких как премейотическая недостаточность и нерасхождение половых хромосом 19,34,35. Помимо биологического аспекта, сперматогенез является целью ряда генетических стратегий, разработанных для борьбы с насекомыми-вредителями, такими как комары Anopheles. В этом контексте Х-сцепленный локус рДНК An. gambiae был использован в качестве мишени для разработки синтетического исказителя соотношения полов, который, повреждая сперматозоиды, несущие Х, склоняет потомство в сторону самцов 4,8,13.
Эта технология отражает действие естественных мейотических побуждений соотношения полов, которые были идентифицированы у нескольких таксонов, включая комаров, но которые до сих пор остаются малоизученными 28,36,37,38,39,40,41. WFISH дает возможность исследовать это явление и прокладывает путь к уточнению или улучшению генетических стратегий, основанных на искажении пола, например, предоставляя информацию о том, как на цитологию производства сперматозоидов влияет выбор целевых участков, используемых для измельчения половых хромосом. Хотя, по нашему опыту, WFISH показывает высокие шансы на успех, неудача все же может произойти. Это может быть связано с неэффективным уровнем проницаемости тканей, который можно преодолеть, увеличив время инкубации проникающего раствора. В качестве альтернативы протеиназа К может быть использована на этапе пермеабилизации. В некоторых случаях отмечался неравномерный уровень проникновения зонда, с более высоким сигналом в ядрах сперматоцитов и более низким или отсутствующим сигналом на стадиях мейотического и спермиогенеза. Это может быть связано с разницей в уровне пермеабилизации в зависимости от стадии клетки. Кроме того, WFISH оказался полезным при использовании флуоресцентных зондов, предназначенных для нацеливания на последовательности ДНК, присутствующие в большом количестве копий. При нацеливании на однокопийные гены обнаружения сигнала может быть недостаточно. В этом случае методы усиления сигнала, такие как тирамидное усиление сигнала (TSA), должны быть интегрированы42.
Этот протокол может сочетаться с иммуноокрашиванием или с трансгенными репортерными штаммами, содержащими флуоресцентные маркеры, специфичные для зародышевой линии,16,18, поскольку это добавит информацию о локализации белка и экспрессии генов in situ. В этой работе WFISH описывается как метод исследования сперматогенеза у комаров рода Anopheles; Однако, учитывая общую анатомию мужских репродуктивных органов, этот протокол может быть применен и к другим видам комаров, которые играют роль в передаче болезни. Точно так же с помощью этого метода можно было бы исследовать гаметогенез самок. Кроме того, могут быть изучены цитологические исследования в интересующих органах или тканях, таких как средняя кишка комаров, которая является мишенью для инвазии паразитов, или атипичные генетические фоны, например, у гибридных комаров. Более того, этот метод потенциально может быть перенесен на другие организмы отряда двукрылых.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана грантом Фонда Билла и Мелинды Гейтс и Open Philanthropy. Мы благодарим Центр визуализации с помощью световой микроскопии (FILM) Имперского колледжа Лондона за микроскопический анализ. Рисунок 2 был создан с помощью Biorender.com.
Материалы
| Name | Company | Catalog Number | Comments |
| Amersham CyDye Fluorescent Nucleotides, Cy3-dUTP | Cytiva | PA53022 | |
| Amersham CyDye Fluorescent Nucleotides, Cy5-dUTP | Cytiva | PA55022 | |
| ART Wide Bore Filtered Pipette Tips | ThermoFisher Scientific | 2079GPK | |
| CytoBond Removable Coverslip Sealant | SciGene | 2020-00-1 | |
| Dextran sulfate sodium salt from Leuconostoc spp. | Sigma-Aldrich | D8906-5G | |
| DNeasy Blood & Tissue Kits | Qiagen | 69504 | |
| Embryo Dishes | VWR | 70543-30 | |
| Ethanol, molecular grade | Sigma-Aldrich | 51976 | |
| Formamide | ThermoFisher Scientific | 17899 | |
| GoTaq G2 DNA Polymerase | Promega | M7841 | |
| Hydrochloric acid, 37% | Sigma-Aldrich | 320331 | |
| Microscope slides, SuperFrost | VWR | 631-0114 | |
| PBS (10x), pH 7.4 | ThermoFisher Scientific | 70011044 | |
| Pierce 16% Formaldehyde (w/v), Methanol-free | ThermoFisher Scientific | 28906 | |
| ProLong Gold Antifade Mountant with DAPI | ThermoFisher Scientific | P36941 | |
| RNase A/T1 Mix | ThermoFisher Scientific | EN0551 | |
| Set of dATP, dCTP, dGTP, dTTP | Promega | U1330 | |
| Sodium Acetate Solution | ThermoFisher Scientific | R1181 | |
| SP8 inverted confocal microscope | Leica | ||
| Triton X-100 | Sigma-Aldrich | 9036-19-5 | |
| TWEEN 20 | Sigma-Aldrich | P1379 | |
| UltraPure Salmon Sperm DNA Solution | ThermoFisher Scientific | 15632011 | |
| UltraPure SSC 20x | ThermoFisher Scientific | 15557044 | |
| Primer sequences | |||
| 5’-CAATAAATTTCCTTTTTAATGATGC AAAATCTACGTCTCTAGC-3’-[Fluorochrome] | Eurofins Genomics | Contig_240 (X) | |
| 5’AGAAGAATAGAATCAGAATAGT CGG TTTCTTCATCCTGAAAGCC-3’-[Fluorochrome] | Eurofins Genomics | AgY53B (Y) | |
| 5’-TTCTAAGTTTCTAGGCTTTAAGGA T GAAGAAACCGACTATTC-3’-[Fluorochrome] | Eurofins Genomics | AgY477- AgY53B junction region (Y) | |
| F: AACTGTGGAAAAGCCAGAGC R: TCCACTTGATCCTTGCAAAA | Eurofins Genomics | 18S rDNA (X) | |
| F: CCTTTAAACACATGCTCAAATT R: GTTTCTTCATCCTTAAAGCCTAG | Eurofins Genomics | AgY53B (Y) |
Ссылки
- World Malaria Report. World Health Organization Available from: https://www.who.int/teams/global-malaria-programme/reports/world-malaria-report-2022 (2022)
- Bhatt, S., et al. The effect of malaria control on Plasmodium falciparum in Africa between 2000 and 2015. Nature. 526 (7572), 207-211 (2015).
- Hammond, A., et al. A CRISPR-Cas9 gene drive system targeting female reproduction in the malaria mosquito vector Anopheles gambiae. Nature Biotechnology. 34 (1), 78-83 (2016).
- Galizi, R., et al. A synthetic sex ratio distortion system for the control of the human malaria mosquito. Nature Communications. 5 (1), 3977 (2014).
- Kyrou, K., et al. A CRISPR-Cas9 gene drive targeting doublesex causes complete population suppression in caged Anopheles gambiae mosquitoes. Nature Biotechnology. 36 (11), 1062-1066 (2018).
- Simoni, A., et al. A male-biased sex-distorter gene drive for the human malaria vector Anopheles gambiae. Nature Biotechnology. 38 (9), 1054-1060 (2020).
- Gantz, V. M., et al. Highly efficient Cas9-mediated gene drive for population modification of the malaria vector mosquito Anopheles stephensi. Proceedings of the National Academy of Sciences of the United States of America. 112 (49), E6736-E6743 (2015).
- Bernardini, F., Kriezis, A., Galizi, R., Nolan, T., Crisanti, A. Introgression of a synthetic sex ratio distortion system from Anopheles gambiae into Anopheles arabiensis. Scientific Reports. 9 (1), 5158 (2019).
- Hammond, A. M., Galizi, R. Gene drives to fight malaria: Current state and future directions. Pathogens and Global Health. 111 (8), 412-423 (2017).
- Garrood, W. T., et al. Driving down malaria transmission with engineered gene drives. Frontiers in Genetics. 13, 891218 (2022).
- Hoermann, A., et al. Gene drive mosquitoes can aid malaria elimination by retarding Plasmodium sporogonic development. Science Advances. 8 (38), (2022).
- Nash, A., et al. Integral gene drives for population replacement. Biology Open. 8 (1), (2019).
- Galizi, R., et al. A CRISPR-Cas9 sex-ratio distortion system for genetic control. Scientific Reports. 6 (1), 31139 (2016).
- Terradas, G., Hermann, A., James, A. A., McGinnis, W., Bier, E. High-resolution in situ analysis of Cas9 germline transcript distributions in gene-drive Anopheles mosquitoes. G3: Genes, Genomes, Genetics. 12 (1), (2022).
- Durant, A. C., Donini, A. Ammonium transporter expression in sperm of the disease vector Aedes aegypti mosquito influences male fertility. Proceedings of the National Academy of Sciences of the United States of America. 117 (47), 29712-29719 (2020).
- Taxiarchi, C., et al. High-resolution transcriptional profiling of Anopheles gambiae spermatogenesis reveals mechanisms of sex chromosome regulation. Scientific Reports. 9 (1), 14841 (2019).
- Pompon, J., Levashina, E. A. A new role of the mosquito complement-like cascade in male fertility in Anopheles gambiae. PLoS Biology. 13 (9), e1002255 (2015).
- Papathanos, P. A., Windbichler, N., Menichelli, M., Burt, A., Crisanti, A. The vasa regulatory region mediates germline expression and maternal transmission of proteins in the malaria mosquito Anopheles gambiae: A versatile tool for genetic control strategies. BMC Molecular Biology. 10 (1), 13 (2009).
- Liang, J., Sharakhov, I. V. Premeiotic and meiotic failures lead to hybrid male sterility in the Anopheles gambiae complex. Proceedings of the Royal Society B. 286 (1906), 20191080 (2019).
- Hall, A. B., et al. Radical remodeling of the Y chromosome in a recent radiation of malaria mosquitoes. Proceedings of the National Academy of Sciences of the United States of America. 113 (15), E2114-E2123 (2016).
- Clements, A. N. . The Biology of Mosquitoes. Volume 1: Development, Nutrition and Reproduction. , (1992).
- Demarco, R. S., Eikenes, &. #. 1. 9. 7. ;. H., Haglund, K., Jones, D. L. Investigating spermatogenesis in Drosophila melanogaster. Methods. 68 (1), 218-227 (2014).
- Helinski, M. E., Parker, A. G., Knols, B. G. Radiation biology of mosquitoes. Malaria Journal. 8, S6 (2009).
- Huho, B. J., et al. A reliable morphological method to assess the age of male Anopheles gambiae. Malaria Journal. 5 (1), 62 (2006).
- Fabian, L., Brill, J. A. Drosophila spermiogenesis. Spermatogenesis. 2 (3), 197-212 (2012).
- Li, M., et al. Suppressing mosquito populations with precision guided sterile males. Nature Communications. 12 (1), 5374 (2021).
- Thailayil, J., Magnusson, K., Godfray, H. C., Crisanti, A., Catteruccia, F. Spermless males elicit large-scale female responses to mating in the malaria mosquito Anopheles gambiae. Proceedings of the National Academy of Sciences of the United States of America. 108 (33), 13677-13681 (2011).
- Haghighat-Khah, R. E., et al. Cellular mechanisms regulating synthetic sex ratio distortion in the Anopheles gambiae germline. Pathogens and Global Health. 114 (7), 370-378 (2020).
- Yamamoto, D. S., et al. A synthetic male-specific sterilization system using the mammalian pro-apoptotic factor in a malaria vector mosquito. Scientific Reports. 9 (1), 8160 (2019).
- Papathanos, P. A., Windbichler, N. Redkmer: An assembly-free pipeline for the identification of abundant and specific X-chromosome target sequences for X-shredding by CRISPR endonucleases. The CRISPR Journal. 1 (1), 88-98 (2018).
- Sharma, A., Kinney, N. A., Timoshevskiy, V. A., Sharakhova, M. V., Sharakhov, I. V. Structural variation of the X chromosome heterochromatin in the Anopheles gambiae complex. Genes. 11 (3), 327 (2020).
- Krzywinski, J., Sangaré, D., Besansky, N. J. Satellite DNA from the Y chromosome of the malaria vector Anopheles gambiae. Genetics. 169 (1), 185-196 (2005).
- Timoshevskiy, V. A., Sharma, A., Sharakhov, I. V., Sharakhova, M. V. Fluorescent in situ hybridization on mitotic chromosomes of mosquitoes. Journal of Visualized Experiments. (67), e4215 (2012).
- Liang, J., Hodge, J. M., Sharakhov, I. V. Asymmetric phenotypes of sterile hybrid males from reciprocal crosses between species of the Anopheles gambiae complex. Frontiers in Ecology and Evolution. 9, 660207 (2021).
- Slotman, M., Torre, A. D., Powell, J. R. The genetics of inviability and male sterility in hybrids between Anopheles gambiae and An. arabiensis. Genetics. 167 (1), 275-287 (2004).
- Wood, R. J., Newton, M. E. Sex-ratio distortion caused by meiotic drive in mosquitoes. The American Naturalist. 137 (3), 379-391 (1991).
- Cazemajor, M., Joly, D., Montchamp-Moreau, C. Sex-ratio meiotic drive in Drosophila simulans is related to equational nondisjunction of the Y chromosome. Genetics. 154 (1), 229-236 (2000).
- Jaenike, J. Sex chromosome meiotic drive. Annual Review of Ecology and Systematics. 32 (1), 25-49 (2001).
- Courret, C., Chang, C. H., Wei, K. H., Montchamp-Moreau, C., Larracuente, A. M. Meiotic drive mechanisms: Lessons from Drosophila. Proceedings of the Royal Society B. 286 (1913), 20191430 (2019).
- Zanders, S. E., Unckless, R. L. Fertility costs of meiotic drivers. Current Biology. 29 (11), R512-R520 (2019).
- Newton, M. E., Wood, R. J., Southern, D. I. A cytogenetic analysis of meiotic drive in the mosquito, Aedes aegypti (L.). Genetica. 46 (3), 297-318 (1976).
- Carabajal Paladino, L. Z., Nguyen, P., Šíchová, J., Marec, F. Mapping of single-copy genes by TSA-FISH in the codling moth, Cydia pomonella. BMC Genomic Data. 15, S15 (2014).
- Bernardini, F., et al. Cross-species Y chromosome function between malaria vectors of the Anopheles gambiae species complex. Genetics. 207 (2), 729-740 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены