Method Article
Ganzkörper-Fluoreszenz-in-situ-Hybridisierung zur Untersuchung der Spermatogenese in der Anopheles-Mücke
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Aufgrund ihrer einfachen Anatomie bieten Anopheles-Hoden ein gutes zytologisches Modell für die Untersuchung der Spermatogenese. Dieses Protokoll beschreibt die Whole-Mount-Fluoreszenz-in-situ-Hybridisierung , eine Technik, die zur Untersuchung dieses biologischen Prozesses verwendet wird, sowie den Phänotyp transgener Stämme, die Mutationen in den Genen aufweisen, die an der Spermienproduktion beteiligt sind.
Zusammenfassung
Die Spermatogenese ist ein komplexer biologischer Prozess, bei dem diploide Zellen eine sukzessive mitotische und meiotische Teilung durchlaufen, gefolgt von großen strukturellen Veränderungen, um haploide Spermien zu bilden. Neben dem biologischen Aspekt ist die Untersuchung der Spermatogenese von größter Bedeutung für das Verständnis und die Entwicklung genetischer Technologien wie Gene Drive und synthetische Geschlechterverhältnisverzerrer, die durch die Veränderung der Mendelschen Vererbung bzw. des Geschlechterverhältnisses der Spermien zur Kontrolle von Schädlingsinsektenpopulationen eingesetzt werden könnten. Diese Technologien haben sich im Labor als sehr vielversprechend erwiesen und könnten möglicherweise zur Bekämpfung von wilden Populationen von Anopheles-Mücken eingesetzt werden, die Überträger von Malaria sind. Aufgrund der Einfachheit der Hodenanatomie und ihrer medizinischen Bedeutung stellt Anopheles gambiae, ein wichtiger Malariaüberträger in Afrika südlich der Sahara, ein gutes zytologisches Modell für die Untersuchung der Spermatogenese dar. Dieses Protokoll beschreibt, wie die Whole-Mount-Fluoreszenz-in-situ-Hybridisierung (WFISH) verwendet werden kann, um die dramatischen Veränderungen in der Zellkernstruktur durch Spermatogenese unter Verwendung von Fluoreszenzsonden zu untersuchen, die speziell die X- und Y-Chromosomen färben. FISH erfordert in der Regel die Störung der Fortpflanzungsorgane, um mitotische oder meiotische Chromosomen freizulegen und die Färbung bestimmter Genomregionen mit fluoreszierenden Sonden zu ermöglichen. WFISH ermöglicht die Erhaltung der nativen zytologischen Struktur des Hodens, gekoppelt mit einer guten Signaldetektion von Fluoreszenzsonden, die auf sich wiederholende DNA-Sequenzen abzielen. Dies ermöglicht es den Forschern, Veränderungen im Chromosomenverhalten von Zellen, die sich in der Meiose befinden, entlang der Struktur des Organs zu verfolgen, wobei jede Phase des Prozesses klar unterschieden werden kann. Diese Technik könnte besonders nützlich sein, um die meiotische Paarung von Chromosomen zu untersuchen und die zytologischen Phänotypen zu untersuchen, die z. B. mit synthetischen Verzerrern des Geschlechterverhältnisses, hybrider männlicher Sterilität und dem Knock-out von Genen verbunden sind, die an der Spermatogenese beteiligt sind.
Einleitung
Malaria stellt eine enorme Belastung für die Gesundheit und das Wohlergehen der Weltbevölkerung dar. Im Jahr 2021 schätzte die Weltgesundheitsorganisation (WHO), dass Malaria 619.000 Todesfälle verursachte, von denen 96 % in Afrika südlich der Sahara auftraten1. Die Krankheit wird von Stechmücken der Gattung Anopheles übertragen, und in Afrika südlich der Sahara spielen drei Arten, nämlich Anopheles gambiae (An. gambiae), Anopheles coluzzi (An, coluzzi) und Anopheles arabiensis (An. arabiensis), eine überproportional große Rolle bei der Übertragung von Malaria und machen 95 % der Malariafälle weltweit aus. Kontrollprogramme, die sich auf traditionelle Methoden wie Insektizide und Malariamedikamente stützen, haben Millionen von Menschenleben gerettet. In den letzten Jahren hat jedoch die zunehmende Resistenz gegen diese Bekämpfungsmethoden ihre Wirksamkeit in Frage gestellt 1,2. Darüber hinaus haben sich die durch die COVID-19-Pandemie auferlegten Einschränkungen auf die Verfügbarkeit wichtiger Maßnahmen zur Malariabekämpfung ausgewirkt, was laut dem Weltmalariabericht 2022 der WHO zu einem Anstieg der Malariainzidenzgeführt hat 1. In den letzten zwei Jahrzehnten wurden neuartige genetische Kontrollmethoden im Labor entwickelt, um Anopheles-Mücken zu bekämpfen 3,4,5,6,7,8,9,10. Unter diesen Strategien scheinen diejenigen, die auf Gene-Drive-Systemen (GDS) und synthetischen Verzerrern des Geschlechterverhältnisses (SDs) basieren, vielversprechend zu sein. GDS beruhen auf der Möglichkeit, mit einer sehr hohen Frequenz eine genetische Veränderung zu übertragen, die die weibliche Fruchtbarkeit beeinträchtigt oder den Lebenszyklus des Parasiten in der Mücke beeinträchtigt 5,11,12. SDs hingegen wirken, indem sie das Geschlechterverhältnis einer Mückennachkommenschaft in Richtung Männchen verzerren, was im Laufe der Zeit zum Zusammenbruch einer Zielpopulation aufgrund eines Mangels an Weibchen führt 4,6,13. Die Hauptbestandteile dieser genetischen Systeme wirken vor allem auf die Fortpflanzungsorgane der Mücken, wo die Keimzellen, Eier und Spermien nach der meiotischen Teilung produziert werden14.
In diesem Protokoll werden Fortschritte in zytogenetischen Techniken eingesetzt, um die Spermatogenese in An. gambiae zu untersuchen, wobei der Schwerpunkt auf dem Verhalten der Chromosomen in situ liegt. Die Struktur des Mückenhodens und die biologischen Prozesse, die in ihm ablaufen, wurden bereits mit einer Reihe von zytologischen Methoden untersucht, wie z. B. Immunfluoreszenz, fluoreszierende Reportertransgene und DNA- und RNA-Fluoreszenz-in-situ-Hybridisierung (FISH)15,16,17,18,19,20; Die Organe weisen eine spindelartige Form auf, bei der der untere Pol an einem Gang befestigt ist, der mit den männlichen akzessorischen Drüsen verbunden ist. Am oberen Pol proliferiert und differenziert sich die Nische der Keimbahnstammzellen zu Spermatogonienzellen, die in Spermatozysten eingebettet sind, die von somatischen Zellen gebildet werden. Nach mehreren Runden der mitotischen Teilung differenzieren sich die Spermatogonien zu Spermatozyten, die in die Meiose eintreten. In der Prophase paaren sich Autosom- und Geschlechtschromosomen mit ihren Homologen, und es findet eine Kreuzung statt. Nach den meiotischen Teilungen werden runde haploide Spermatiden erzeugt, die in die Spermiogenese eintreten, und dieser Prozess führt zur Bildung reifer haploider Spermien, bei denen das Zytoplasma entfernt wurde, das Kernchromatin kondensiert wird und Flagellen im basalen Teil der Kerne21,22 austreten (Abbildung 1 und Abbildung 2).
Im Allgemeinen beginnt die Spermiogenese etwa im mittleren Puppenstadium, und reife Spermien können im späten Puppenstadium im Spermienreservoirnachgewiesen werden 23. Der Reifungsprozess der Spermatozysten setzt sich im Erwachsenenalter fort23,24,25. Bei Anopheles testes kann jeder Schritt der Spermatogenese leicht identifiziert werden, indem man sich die Kernmorphologie der Zellen in jeder Spermatozyste ansieht (Abbildung 2). Die in diesem Protokoll beschriebene Whole-Mount-Fluoreszenz-in-situ-Hybridisierung (WFISH) ermöglicht es den Forschern, eine Chromosomenregion spezifisch zu markieren und sie während der Spermatogenese zu verfolgen, während die native Struktur des Organs und der Zellkernposition erhalten bleibt. Dies stellt einen Vorteil gegenüber dem Standard-DNA-FISH-Protokoll dar, bei dem das Organ in der Regel gequetscht wird, was zu Gewebeschäden führt19. Im aktuellen Protokoll werden fluoreszierende Sonden verwendet, um sich wiederholende Sequenzen auf den Geschlechtschromosomen zu färben und so ihr Verhalten während der Spermatogenese zu verfolgen, von diploiden sich teilenden Zellen bis hin zu reifen haploiden Spermatozoen. WFISH kann besonders nützlich sein, um die meiotische Paarung von Geschlechtschromosomen zu untersuchen und die zytologischen Phänotypen zu untersuchen, die z. B. mit synthetischen Verzerrern des Geschlechterverhältnisses, hybrider männlicher Sterilität und dem Knock-out von Genen verbunden sind, die an der Spermatogenese beteiligt sind 4,19,26,27.
Aufgrund ihrer Rolle als Malaria-Überträger sind Anopheles-Mücken das Ziel einer zunehmenden Anzahl genetischer Vektorkontrollstrategien, die häufig in den Fortpflanzungsorganen dieser Organismen wirken. Es wurden mehrere Mückenmutanten und zytologische Phänotypen generiert, die neuartige zytologische Techniken erfordern, um untersucht zu werden26,27,28,29. Die in dieser Studie beschriebene Methode gibt Aufschluss über das Verständnis der Spermatogenese sowie über die zytologischen Mechanismen hinter genetischen Strategien, die das Potenzial haben, Malaria übertragende Mücken zu kontrollieren.
Protokoll
1. Markierung der DNA-Sonde
HINWEIS: Im Folgenden finden Sie die technischen Schritte zur Erzeugung fluoreszierender DNA-Sonden, die die Geschlechtschromosomen von An. gambiae-Mücken spezifisch markieren.
- Sondenmarkierung mittels PCR
- Extrahieren Sie genomische DNA von Puppen oder erwachsenen Männchen, um die X- oder Y-Chromosomen mit einem handelsüblichen genomischen DNA-Extraktionskit zu markieren (siehe Materialtabelle).
- Bereiten Sie die PCR-Reaktionsmischung vor: 200 ng genomische DNA, 0,05 mM unmarkiertes Nukleotid (dATP, dCTP, dGTP), 0,015 mM dTTP und 1 μl fluoreszenzmarkiertes dUTP (Cy3, Cy5 oder ein anderes Fluorochrom), 50 pmol Vorwärts- und Rückwärtsprimer (Tabelle 1), 5 μl 10x PCR-Puffer und 10 U Taq-DNA-Polymerase (siehe Materialtabelle).
- Um 18S rDNA und den Satelliten AgY53B zu markieren (Tabelle 1), wird eine PCR-Reaktion mit den folgenden PCR-Parametern durchgeführt: ein Zyklus von 95 °C für 10 Minuten; 35 Zyklen mit 95 °C für 30 s, 52 °C für 30 s und 72 °C für 45 s; ein Zyklus von 72 °C für 5 Minuten; und ein endgültiges Halten bei 4 °C.
HINWEIS: Um mit der PCR-Markierungsmethode eine gute Sondenkonzentration (~1 μg in 5 μl) zu erhalten, die für einen erfolgreichen WFISH entscheidend ist, sollte die PCR-Reaktion hocheffizient sein. Aus diesem Grund wird dringend empfohlen, vor der Markierung der Sonde die Wirksamkeit der für die Amplifikation ausgewählten Primer zu testen. Darüber hinaus wird die Einbeziehung einer Positivkontrolle in die PCR-Reaktion (ohne die fluoreszierende dUTP) dazu beitragen, die Wirksamkeit der Markierungsreaktion zu überprüfen. - Lagern Sie die Sonde bei −20 °C an einem dunklen Ort.
- Gewinnung von fluoreszierenden Oligonukleotidsonden mit 3'-Ende
- Erhalten Sie kommerziell erhältliche fluoreszierende Oligonukleotidsonden als modifizierte Oligos, indem Sie Cy3- oder Cy5-Fluorochrome (oder ein anderes Fluorochrom) zum 3'-Ende der Nukleotidsequenz hinzufügen (siehe Materialtabelle). Siehe Primer/Oligonukleotid in Tabelle 1 für die Referenzsequenzen, die zur Markierung der Y-chromosomalen Satellitenregion AgY477-AgY53B und des X-chromosomalen Satelliten aus Contig_240 verwendet werden.
HINWEIS: Es gibt keine technischen Hindernisse im Zusammenhang mit der Konzentration von endmarkierten 3'-Oligonukleotiden, da der Benutzer dies in der Regel vor dem Kauf auswählen kann. Wir empfehlen, ~800 ng Oligosondenlösung im Hybridisierungspuffer zu verdünnen, um eine effiziente Markierung mit der Oligosonde zu ermöglichen. X- und Y-spezifische Oligosonden wurden bereits von Liang und Sharakhov19 für WFISH verwendet, und die Referenzsequenz ist in Tabelle 1 zu finden.
- Erhalten Sie kommerziell erhältliche fluoreszierende Oligonukleotidsonden als modifizierte Oligos, indem Sie Cy3- oder Cy5-Fluorochrome (oder ein anderes Fluorochrom) zum 3'-Ende der Nukleotidsequenz hinzufügen (siehe Materialtabelle). Siehe Primer/Oligonukleotid in Tabelle 1 für die Referenzsequenzen, die zur Markierung der Y-chromosomalen Satellitenregion AgY477-AgY53B und des X-chromosomalen Satelliten aus Contig_240 verwendet werden.
2. Herstellung der Hybridisierungslösung
HINWEIS: Die in Schritt 1 erzeugten Fluoreszenzsonden müssen in eine chemische Lösung eingearbeitet werden, die mit den Zielsequenzen hybridisiert.
- Sondenfällung vor der Fluoreszenz-in-situ-Hybridisierung
- In ein 1,5-ml-Röhrchen werden 5 μl markierte DNA-Sonde (falls mit der PCR-Markierungsmethode gewonnen) oder 2,2 μl modifizierte 3'-Oligosonde (~800 ng Sonde) aus Schritt 1 und 5 μl Lachsspermien-DNA (siehe Materialtabelle) gegeben. Kombinieren Sie die Sonden, die für verschiedene Genomregionen spezifisch sind, im selben Röhrchen und verwenden Sie sie in den folgenden Schritten als einzigartige Lösung.
- Die DNA-Sonde wird durch Zugabe von 0,1 Volumen 3 M Natriumacetat und 2 Volumen 100%igem Ethanol gefällt. Bei −20 °C mindestens 2,5 h aufbewahren (eine Verlängerung der Inkubationszeit auf −20 °C erhöht die Endausbeute). In diesem Stadium können die Sonden auch über Nacht gelagert werden, bevor sie zentrifugiert werden.
- Bei 17.000 x g bei 4 °C für 20 min zentrifugieren, das Ethanol entfernen und das Pellet bei RT im Dunkeln ~20 min an der Luft trocknen.
- Hybridisierungslösung
- Bevor Sie mit der Hodendissektion (Schritt 3) fortfahren, bereiten Sie den Hybridisierungspuffer vor, indem Sie die folgenden Reagenzien in einem 1,5-Röhrchen mischen: 500 μl Formamid, 0,2 g Dextransulfat, 100 μl 20x Natriumsalzcitrat (SSC) und 200 μl sterilesH20 (siehe Materialtabelle). Die Hybridisierungslösung wird 1 min lang vortexzt und das Dextransulfat 30 min lang bei 37 °C aufgelöst.
- Das Pellet aus Schritt 2.1.3 wird in 20-30 μl Hybridisierungspuffer aufgelöst (ca. 1 min vortexen, eine schnelle Drehung durchführen und die Röhrchen bei 37 °C im Dunkeln lagern), um die Hybridisierungslösung zu erhalten.
3. Hodendissektion und Fixierung
- Bei Raumtemperatur (RT) werden21 mindestens ~20 Hoden von Puppen oder 1 Tag alten Erwachsenen in steriler 1x phosphatgepufferter Kochsalzlösung (PBS) präpariert und auf einen sauberen Objektträger übertragen, der einen frischen Tropfen 1x PBS-Lösung enthält.
- Übertragen Sie die Hoden mit einer gefilterten P1.000-Weitrohrspitze oder der Spitze einer Seziernadel aus dem 1x PBS-Tropfen in eine Embryoschale mit 3,7 % Formaldehyd in 1x PBS mit 0,1 % Tween-20 (PBST) und inkubieren Sie 10 Minuten lang bei RT.
- Waschen Sie die Hoden in 1x PBST für 5 min bei RT. Inkubieren Sie die Hoden in 0,1 mg/ml RNAse A (siehe Materialtabelle), verdünnt in sterilem 1x PBS für 30 min bei 37 °C.
- Entfernen Sie die RNAse-Lösung, fügen Sie die Penetrationslösung (1 % Triton/0,1 M HCl in 1x PBST) hinzu und inkubieren Sie 10 Minuten lang bei RT.
HINWEIS: Proteinase K kann als Penetrationsmittel in einer Endkonzentration von 10 μg/ml in 1x PBST verwendet werden, um die Permeabilisierung der Hoden zu erhöhen. - Waschen Sie die Hoden in 1x PBST zweimal für jeweils 5 min bei RT.
4. Hybridisierung
HINWEIS: In diesem Abschnitt werden die letzten Schritte für die In-situ-Hybridisierung beschrieben.
- Nach dem Waschschritt (Schritt 3.5) werden die Hoden in ein 1,5-ml-Röhrchen mit 20-30 μl Hybridisierungslösung überführt, das die zuvor vorbereitete Sonde enthält (Schritt 2.2.2). Verwenden Sie die Spitze der Pipette, um die Lösung vorsichtig zu mischen. Schnippen Sie den Schlauch fünfmal vorsichtig, bevor Sie mit den nächsten Schritten fortfahren.
- 5 Minuten bei 75 °C zur DNA-Denaturierung inkubieren.
- Über Nacht bei 37 °C inkubieren (wenn möglich mit Schaukeln bei weniger als 100 U/min) für die DNA-DNA-Hybridisierung.
- Die Hoden werden mit einer gefilterten Spitze mit P1.000 mit großem Durchmesser zurück in eine Embryonenschale übertragen und in 2x SSC 5 Minuten lang auf 50 °C vorgewärmt.
HINWEIS: Nach dem Hybridisierungsschritt ist ein abschließender Waschschritt mit 2x SSC erforderlich; Dies spielt eine wichtige Rolle bei der Entfernung von Hintergrundsignalen, die durch das Vorhandensein von nicht hybridisierten Sonden im Organgewebe verursacht werden. Wenn ein starkes Hintergrundsignal vorhanden ist, wird empfohlen, den letzten Waschschritt zu wiederholen. - Entfernen Sie das 2x SSC und montieren Sie die Hoden mit einem handelsüblichen Eindeckmedium mit 4′,6-Diamidino-2-phenylindol (DAPI) (siehe Materialtabelle) auf einem Milchglasobjektträger, versiegeln Sie es mit Deckglasversiegelung und inkubieren Sie mindestens 2 h bei RT im Dunkeln.
- Führen Sie eine konfokale Bildgebung durch. Die gesamten Hoden können mit 40-fachen oder 63-fachen Ölimmersionsobjektiven visualisiert werden. Wenn ein Z-Stapel durchgeführt wird, empfehlen wir die Verwendung eines z-Schritts von 1,25 μm.
Ergebnisse
In dieser Arbeit wurde WFISH verwendet, um das Chromosomenverhalten während der Spermatogenese in An. gambiae zu untersuchen. Der erste entscheidende Schritt für die Anwendung dieses Protokolls ist die Entnahme von Hoden, die nach der Präparation ein geringes Maß an morphologischer Veränderung aufweisen. Um eine erfolgreiche Hodendissektion durchzuführen, sind Grundkenntnisse der Anatomie der Mücken erforderlich, und im Folgenden werden einige Anleitungen für dieses Verfahren gegeben. Bei der Anopheles-Mücke befinden sich reife Hoden im sechsten Abdominalsegment des Puppen- und Erwachsenenstadiums21. Wie in Abbildung 1 dargestellt, verbindet der Samenleiter die Hoden mit den männlichen akzessorischen Drüsen (MAGs), die sich im letzten Segment des Abdomens befinden. Die MAGs sind mit einem einzigartigen Ejakulationskanal verbunden, der die Spermien und Samenflüssigkeiten an das Kopulationsorgan und den äußeren Teil des männlichen Genitalapparats21 abgibt. Der gesamte innere männliche Genitalapparat kann je nach Lebensstadium der Mücke mit unterschiedlichen Ansätzen präpariert werden. Während des Puppenstadiums können die Hoden mit einem Stereomikroskop in der gesamten hellen Kutikula leicht identifiziert werden, indem die ventrale Seite des Abdomens in der Nähe des sechsten Segments betrachtet wird (Abbildung 1). Um die Hoden zu präparieren, kann der untere Teil des Abdomens, einschließlich des sechsten Segments, mit einem Paar Nadeln vom Rest des Körpers isoliert und in einen sauberen Tropfen von 1x PBS überführt werden. Nach der Entfernung des letzten Segments kann die gesamte Apparatur durch sanften Druck mit den Präpariernadeln aus dem Bauchraum gequetscht werden. Um die Hoden von erwachsenen Männchen zu sezieren, besteht der erste Schritt darin, den gesamten Hinterleib in einem frischen Tropfen 1x PBS zu isolieren und dann das letzte Segment herauszuziehen, das die Klammern trägt, die die männlichen Kopulationsstrukturen sind (Abbildung 1). An dieser Stelle sollte der untere Teil der MAGs hervortreten und aufgrund seiner gelben Farbe leicht zu erkennen sein. Der gesamte männliche Apparat kann dann mit Hilfe einer Nadel oder Pinzette in einem Tropfen von 1x PBS langsam herausgezogen werden, bis das an den Samenleitern befestigte Hodenpaar sichtbar ist. Bevor mit der Fixation fortgefahren wird, ist es wichtig, die Hoden von den anderen Teilen des männlichen Apparates zu isolieren, indem in der Nähe des unteren Teils der Samenleiter geschnitten wird (Abbildung 1).
Das Alter der Puppen oder erwachsenen Männchen ist ein wichtiger Faktor, der je nach untersuchtem Spermatogenesestadium zu berücksichtigen ist. Bei An. gambiae beginnt die Spermatogenese im frühen/mittleren Puppenstadium und setzt sich während des gesamten Lebens des Individuums fort24. Zwischen 3 und 10 Stunden nach der Verpuppung sind die prämeiotischen und meiotischen Stadien stärker im Hoden vertreten (meiotische Prophase, meiotische Teilungen), die spermatide DNA ist relativ unkondensiert und reife Spermien haben sich noch nicht gebildet. Späte Puppen und 1 Tag alte Erwachsene bieten ein gutes Gleichgewicht zwischen den prämeiotischen, meiotischen und postmeiotischen Stadien (Abbildung 2 und Abbildung 3). Bei Erwachsenen, die älter als 4 Tage sind, sind die prämeiotischen Stadien und Spermatozysten weniger vertreten, und die Hoden sind hauptsächlich mit reifen Spermien besetzt, die im Spermienreservoir enthalten sind.
Um das Verhalten der Geschlechtschromosomen in verschiedenen Stadien der Spermatogenese zu untersuchen, wurde WFISH an Hoden durchgeführt, die im späten Puppenstadium präpariert wurden, um eine gute Darstellung des gesamten Prozesses zu gewährleisten. Um das Verhalten dieser Chromosomen zu verfolgen, wurden Fluoreszenzsonden verwendet, die spezifisch für repetitive Sequenzen sind, die sich ausschließlich auf dem X- oder Y-Chromosom befinden. Die Fluoreszenzsonden können mittels PCR erzeugt oder kommerziell als 3'-endmarkierte Oligonukleotide erhalten werden. Die Verwendung eines Oligos mit einer Länge von >40 bps wird empfohlen, um eine gute Signaldetektion von der fluoreszierenden Oligosonde zu ermöglichen. Unserer Erfahrung nach schneiden 3'-endmarkierte Oligos in Bezug auf die Signaldetektion besser ab als PCR-markierte Sonden. Darüber hinaus ist die Kopienzahl der Zielsequenz ein Faktor, der die Wirksamkeit von WFISH beeinflussen kann. Wenn die Markierung nicht erfolgreich ist, wird die Verwendung der PCR-Markierungsmethode an einem längeren Fragment oder das Design mehrerer Oligos vorgeschlagen, die für die Zielregion spezifisch sind.
Die derzeitigen Methoden, die auf der Verwendung einer Penetrationslösung (1% Triton/0,1 M HCl in 1x PBST) basieren, ermöglichen ein gutes Maß an Hodenpermeabilisierung und Penetration der Sonden, was zu einer erfolgreichen Hybridisierungsreaktion führt. Oligosonden, die spezifisch für repetitive Sequenzen der Geschlechtschromosomen sind, können auf der Grundlage der umfangreichen Charakterisierung repetitiver Elemente von Hall et al.20 entworfen werden. Darüber hinaus können Konsensussequenzen, die spezifisch für X- oder Y-chromosomale repetitive Elemente sind, mit einer bioinformatischen Plattform wie der RedKmerPipeline 30 erhalten werden. Es ist wichtig zu beachten, dass Geschlechtschromosomensonden auf repetitive Elemente wie Satelliten und Retrotransposons abzielen können und je nach untersuchter Spezies einen unterschiedlichen Grad der Hybridisierung mit den X- oder Y-Chromosomen aufweisen können 20,31,32. Wie in Abbildung 3 gezeigt, ermöglichte ein guter Hybridisierungsgrad der Sonden und ein geringer Hintergrund die Visualisierung der Zielchromosomen während der gesamten Spermatogenese. Die Paarung der markierten Geschlechtschromosomen konnte im prämeiotischen und meiotischen Stadium beobachtet werden. Es folgte der Nachweis der X- oder Y-Chromosomen in haploiden Zellkernchromosomen, die aus meiotischen Teilungen resultieren. Anschließend konnten X- oder Y-tragende Spermatiden während der gesamten Spermiogenese, die durch unterschiedliche Stufen der DNA-Kondensation gekennzeichnet ist, bis zum letzten Schritt der pfeilförmigen reifen Spermien verfolgt werden. Im vorliegenden Versuchsaufbau wurden konfokale Z-Stapel verwendet, um Informationen über die räumliche 3D-Organisation der Zellen während dieses Prozesses zu erhalten (Video 1).
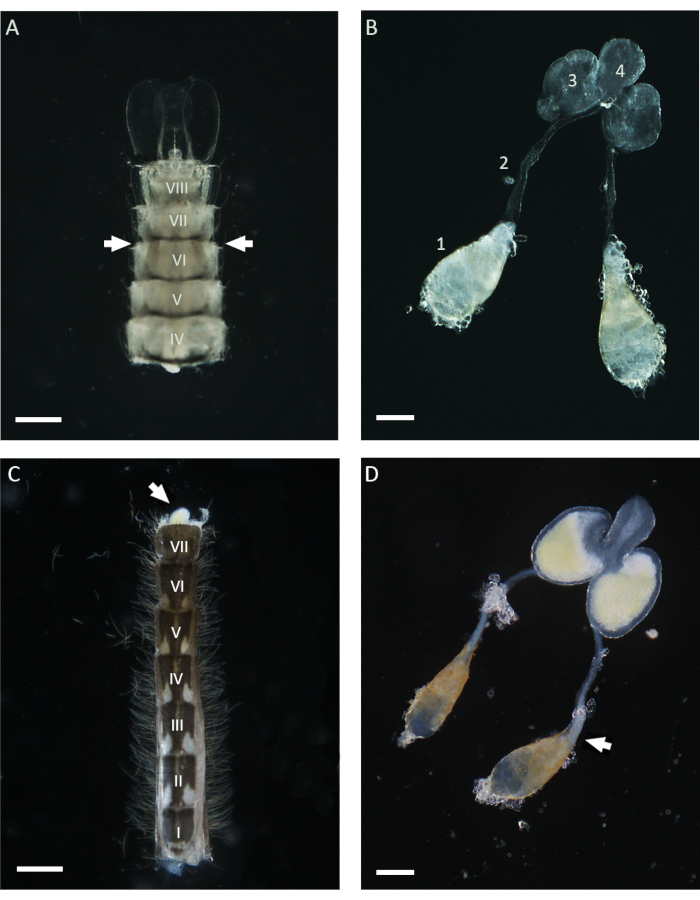
Abbildung 1: Hoden von Puppen und 1 Tag alten erwachsenen Anopheles gambiae-Männchen. (A) Ein im späten Puppenstadium präpariertes Abdomen, das die Lage der Hoden in der Nähe des sechsten Abdominalsegments zeigt. Die Hoden sind in der gesamten Kutikula zu erkennen und erscheinen als bräunliche Strukturen auf beiden Seiten des Abdomens (mit Pfeilen). (B) Hoden, die im Puppenstadium präpariert wurden, mit den reifen Hoden (1), den Samenleitern (2), den MAGs (3) und dem Ejakulationsgang (4). (C) Ein Abdomen, das von einem 1 Tag alten erwachsenen Mann nach Entfernung des basalen Klammersegments präpariert wurde. Die MAGs können durch sanften Druck aus dem Bauch herausgequetscht werden (weißer Pfeil). (D) Männlicher innerer Fortpflanzungsapparat, der von einem 1 Tag alten erwachsenen Männchen seziert wurde. Der weiße Pfeil zeigt die Position der reifen Spermien an, die als weißes Aggregat am Basalpol des Hodens erscheinen. Maßstabsleisten: (A,C) 200 μm; (B,D) 100 μm. Die römischen Ziffern von I bis VIII bezeichnen die Bauchsegmente. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
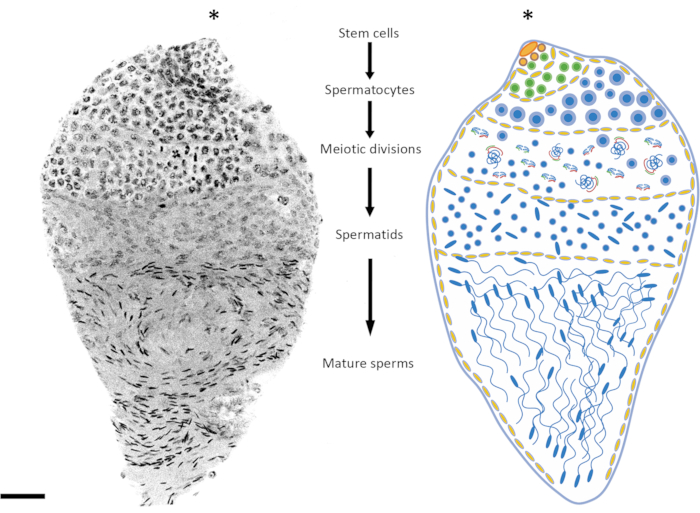
Abbildung 2: Darstellung der Spermatogenese in Anopheles gambiae. Das Bild links zeigt eine späte Puppe von An. gambiae nach Whole-Mount-DAPI-Färbung. Auf der rechten Seite befindet sich eine schematische Version zur besseren Visualisierung. Durch die Beobachtung der Kernform und des Kondensationsniveaus ist es relativ einfach, alle Stadien der Spermatogenese von diploiden Zellen bis hin zu haploiden Spermien zu verfolgen. Die Stammzellnische befindet sich am oberen Pol des Organs, wo die Differenzierung zu Spermatogonien beginnt. Die Anzahl der Spermatogonienzellen nimmt nach der mitotischen Teilung zu (grüne Zellen), und die Spermatozysten nehmen an Größe zu (gelbe Zellen). Die Spermatogonienzellen differenzieren sich nach mehreren mitotischen Teilungsrunden zu Spermatozyten (blaue Blutkörperchen). Die Spermatozyten, die sich durch relativ größere Zellkerne als die Zellen der anderen Phasen des Prozesses auszeichnen, sind die Zellen, die sich meiotisch teilen. Zellen, die sich in der Meiose befinden, können durch das Vorhandensein von Chromosomen in verschiedenen meiotischen Stadien nachgewiesen werden. Chiasmata und Metaphase-Chromosomen können auch bei geringer Vergrößerung nachgewiesen werden. Die prämeiotischen Stadien sind in Hoden, die im frühen Puppenstadium präpariert werden, überrepräsentiert. Nach der ersten und zweiten meiotischen Teilung werden Spermatiden produziert, die in der Regel in der Mitte des Hodens liegen. Die Zellkerne der Spermatiden weisen eine gewisse Variation ihrer Form auf, von einer runden zu einer pfeilartigen Form. Die Spermatiden treten in den Prozess der Spermiogenese ein, bei dem sich die Zellkerne zu verdichten beginnen und ihre Struktur sich in pfeilartige Punkte verwandelt. Wenn Stechmücken nach dem Schlüpfen geschlechtsreif werden, können Spermatozysten mit reifen Spermien den größten Teil des Hodenvolumens auf Kosten von Spermatozysten in einem anderen Entwicklungsstadium einnehmen. Maßstab: 20 μm. Das Sternchen (*) kennzeichnet den apikalen Teil des Hodens. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
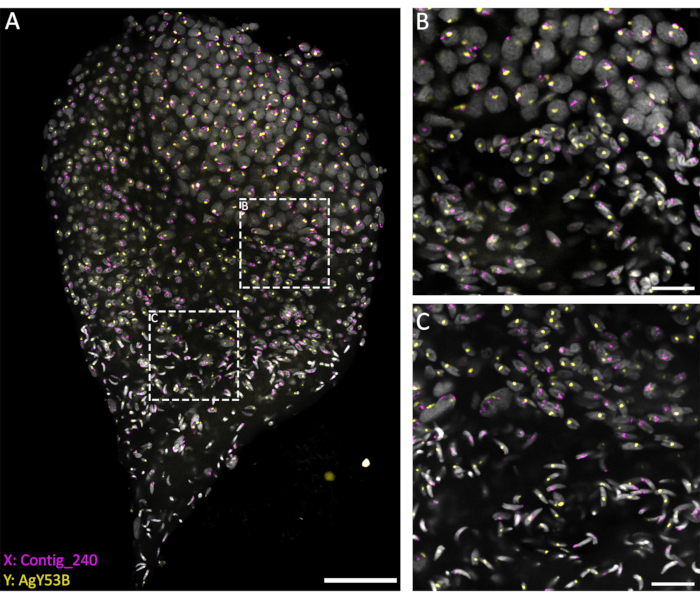
Abbildung 3: WFISH an einem An. gambiae testis, der aus dem späten Puppenstadium präpariert wurde. Die WFISH wurde mit Sonden durchgeführt, die spezifisch für die X- (Contig_240) und Y-Chromosomen (Oligosonde spezifisch für AgY53B) sind. (A) WFISH ermöglicht es, das Verhalten des Geschlechtschromosoms während der Spermatogenese von diploiden Zellen bis hin zu haploiden Spermien zu verfolgen. In diesem Bild kann man die dramatischen Veränderungen erkennen, die die Kerne während der Spermatogenese durchlaufen. Die Markierung der Geschlechtschromosomen ermöglicht die Unterscheidung zwischen diploiden und haploiden Zellen. In diploiden Zellen ist das Signal der Geschlechtschromosomen an dieselben Zellkerne gebunden. In haploiden Zellen (Spermatiden und Spermatozoen) ist das Signal der Geschlechtschromosomen aufgrund der meiotischen Reduktionsteilung nicht verknüpft. (B,C) Ein Bild des Hodens mit höherer Vergrößerung (63x) ist in (A) dargestellt. Sie wurden an verschiedenen Positionen entlang der Z-Achse aufgenommen. Die weiß gestrichelten Rahmen zeigen den Bereich der Aufnahme an. (B) Das Übergangsstadium zwischen Spermatozyten und Spermatiden, das die Bildung haploider Zellen und die Trennung der Signale von den Geschlechtschromosomen in getrennte Kerne zeigt. (C) Das Übergangsstadium zwischen haploiden Spermatiden und reifen Spermatozoen. Diese Phase zeigt die Veränderungen des Kernkondensationsniveaus; Reife Spermien weisen eine stärker verdichtete und länglichere Form auf als Spermatiden. Maßstabsleisten: (A), 30 μm; (B,C), 10 μm; Grau: DAPI. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Ziel-Sequenz | Primer-Sequenz und Oligo-Sonden-Konsens | Referenz |
| Contig_240 (X) | 5'-CAATAAATTTCCTTTTTAATGATGCC AAAATCTACGTCTCTCTAGC-3'-[Fluorochrom] | 19 |
| AgY53B (Y) | 5'AGAAGAATAGAATCAGAATAGTCGG TTTCTTCATCCTGAAAGCC-3'-[Fluorochrom] | Diese Studie |
| AgY477- AgY53B-KARTON Knotenpunkt Region (Y) | 5'-TTCTAAGTTTCTAGGCTTTAAGGAT GAAGAAACCGACTATTC-3'-[Fluorochrom] | 19 |
| 18S rDNA (X) | F: AACTGTGGAAAAGCCAGAGC R: TCCACTTGATCCTTGCAAAA | 19 |
| AgY53B (Y) | F: CCTTTAAACACATGCTCAAATT R: GTTTCTTCATCCTTAAAGCCTAG | 19 |
Tabelle 1: Liste der Spurensonden, die spezifisch für das X- oder Y-Chromosom in An. gambiae sind.
Video 1: Ein 3D-Stapel auf WFISH, durchgeführt an einem An. gambiae testis, der aus dem späten Puppenstadium präpariert wurde. Um eine 3D-Darstellung des Spermatogeneseprozesses zu erhalten, kann ein konfokaler 3D-Stapel an Hoden durchgeführt werden, die eine geringe Anzahl struktureller Veränderungen aufweisen. In dieser Studie wurden die Stapel mit einem Abstand von 1,25 μm zwischen zwei optischen Schnitten unter einer 63-fachen oder 40-fachen Öllinse durchgeführt, um Informationen über die räumliche 3D-Organisation der Zellen nicht zu verlieren. Grau: DAPI, Gelb: Contig_240 (X), Magenta: AgY53B (Y). Bitte klicken Sie hier, um dieses Video herunterzuladen.
Diskussion
In der Regel erfordern FISH-Protokolle das Zerquetschen des interessierenden Organs, um eine Chromosomenfärbung zu ermöglichen. Dies verursacht einen Informationsverlust bezüglich der räumlichen Anordnung der Zellen innerhalb dieses Organs33. Dieses Protokoll beschreibt, wie biologische Prozesse, wie z.B. die Spermatogenese, in situ untersucht werden können, während die intakte native Struktur des Hodens und seine interne zytologische Organisation erhalten bleiben. Sonden, die auf verschiedene sich wiederholende DNA-Elemente abzielen, die in den Geschlechtschromosomen besonders angereichert sind20, können gleichzeitig verwendet werden, um die Dynamik der Spermienreifung aufzudecken. Je nach Zeitpunkt der Hodendissektion bietet WFISH die Möglichkeit, verschiedene Stadien der Spermatogenese durch die Entwicklung der Stechmücke zu untersuchen. WFISH ist nützlich für die Untersuchung spezifischer Phänomene wie der Hybridinkompatibilität, die bei Anopheles-Mücken auf das Vorhandensein von meiotischen Defekten wie prämeiotischem Versagen und Nichtdisjunktion der Geschlechtschromosomen zurückzuführen ist 19,34,35. Neben dem biologischen Aspekt ist die Spermatogenese das Ziel einer Reihe von genetischen Strategien, die zur Bekämpfung von Schadinsekten wie Anopheles-Mücken entwickelt wurden. In diesem Zusammenhang wurde der X-chromosomale rDNA-Locus von An. gambiae als Ziel verwendet, um einen synthetischen Verzerrer des Geschlechterverhältnisses zu entwickeln, der durch die Schädigung von X-tragenden Spermien die Nachkommen in Richtung Männchen verzerrt 4,8,13.
Diese Technologie spiegelt die Wirkung der natürlichen meiotischen Triebe des Geschlechterverhältnisses wider, die in mehreren Taxa, einschließlich Stechmücken, identifiziert wurden, aber immer noch wenig verstanden sind 28,36,37,38,39,40,41. WFISH bietet die Möglichkeit, dieses Phänomen zu untersuchen und ebnet den Weg für die Verfeinerung oder Verbesserung genetischer Strategien, die auf Geschlechtsverzerrung basieren, indem es beispielsweise Informationen darüber liefert, wie die Zytologie der Spermienproduktion durch die Wahl der Zielorte beeinflusst wird, die für die Zerkleinerung der Geschlechtschromosomen verwendet werden. Obwohl WFISH unserer Erfahrung nach hohe Erfolgschancen aufweist, kann es dennoch zu einem Scheitern kommen. Dies könnte auf ein ineffizientes Maß an Gewebepermeabilisierung zurückzuführen sein, das durch eine Verlängerung der Inkubationszeit der eindringenden Lösung überwunden werden kann. Alternativ kann Proteinase K während des Permeabilisierungsschritts verwendet werden. In einigen Fällen stellten wir ein ungleichmäßiges Niveau der Sondenpenetration fest, mit einem höheren Signal in den Spermatozytenkernen und einem niedrigeren oder fehlenden Signal in den meiotischen und Spermiogenesestadien. Dies könnte auf einen Unterschied im Permeabilisierungsgrad je nach Zellstadium zurückzuführen sein. Darüber hinaus erwies sich WFISH als wertvoll bei der Verwendung von Fluoreszenzsonden, die auf DNA-Sequenzen abzielen, die in hohen Kopienzahlen vorhanden sind. Wenn man auf Einzelkopiengene abzielt, ist die Signaldetektion möglicherweise nicht ausreichend. In diesem Fall müssen Verfahren zur Signalverstärkung, wie z. B. die Tyramid-Signalverstärkung (TSA), integriert werden42.
Dieses Protokoll könnte mit Immunfärbung oder mit transgenen Reporterstämmen gekoppelt werden, die keimbahnspezifische Fluoreszenzmarkerenthalten 16,18, da dies Informationen über die Proteinlokalisierung und Genexpression in situ liefern würde.In dieser Arbeit wird WFISH als eine Technik zur Untersuchung der Spermatogenese in Anopheles-Mücken beschrieben; Aufgrund der gemeinsamen Anatomie der männlichen Fortpflanzungsorgane könnte dieses Protokoll jedoch auch auf andere Mückenarten angewendet werden, die bei der Übertragung von Krankheiten eine Rolle spielen. In ähnlicher Weise konnte die weibliche Gametogenese mit dieser Technik untersucht werden. Darüber hinaus könnten zytologische Untersuchungen an Organen oder Geweben von Interesse, wie z. B. dem Mitteldarm der Mücke, der ein Ziel für die Invasion von Parasiten ist, oder an atypischen genetischen Hintergründen, wie z. B. bei Hybridmücken, untersucht werden43. Darüber hinaus kann diese Technik möglicherweise auf andere Organismen innerhalb der Ordnung der Diptera übertragen werden.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Arbeit wurde durch ein Stipendium der Bill & Melinda Gates Foundation und Open Philanthropy unterstützt. Wir danken der Facility for Imaging by Light Microscopy (FILM) am Imperial College London für die mikroskopische Analyse. Abbildung 2 wurde mit Biorender.com erstellt.
Materialien
| Name | Company | Catalog Number | Comments |
| Amersham CyDye Fluorescent Nucleotides, Cy3-dUTP | Cytiva | PA53022 | |
| Amersham CyDye Fluorescent Nucleotides, Cy5-dUTP | Cytiva | PA55022 | |
| ART Wide Bore Filtered Pipette Tips | ThermoFisher Scientific | 2079GPK | |
| CytoBond Removable Coverslip Sealant | SciGene | 2020-00-1 | |
| Dextran sulfate sodium salt from Leuconostoc spp. | Sigma-Aldrich | D8906-5G | |
| DNeasy Blood & Tissue Kits | Qiagen | 69504 | |
| Embryo Dishes | VWR | 70543-30 | |
| Ethanol, molecular grade | Sigma-Aldrich | 51976 | |
| Formamide | ThermoFisher Scientific | 17899 | |
| GoTaq G2 DNA Polymerase | Promega | M7841 | |
| Hydrochloric acid, 37% | Sigma-Aldrich | 320331 | |
| Microscope slides, SuperFrost | VWR | 631-0114 | |
| PBS (10x), pH 7.4 | ThermoFisher Scientific | 70011044 | |
| Pierce 16% Formaldehyde (w/v), Methanol-free | ThermoFisher Scientific | 28906 | |
| ProLong Gold Antifade Mountant with DAPI | ThermoFisher Scientific | P36941 | |
| RNase A/T1 Mix | ThermoFisher Scientific | EN0551 | |
| Set of dATP, dCTP, dGTP, dTTP | Promega | U1330 | |
| Sodium Acetate Solution | ThermoFisher Scientific | R1181 | |
| SP8 inverted confocal microscope | Leica | ||
| Triton X-100 | Sigma-Aldrich | 9036-19-5 | |
| TWEEN 20 | Sigma-Aldrich | P1379 | |
| UltraPure Salmon Sperm DNA Solution | ThermoFisher Scientific | 15632011 | |
| UltraPure SSC 20x | ThermoFisher Scientific | 15557044 | |
| Primer sequences | |||
| 5’-CAATAAATTTCCTTTTTAATGATGC AAAATCTACGTCTCTAGC-3’-[Fluorochrome] | Eurofins Genomics | Contig_240 (X) | |
| 5’AGAAGAATAGAATCAGAATAGT CGG TTTCTTCATCCTGAAAGCC-3’-[Fluorochrome] | Eurofins Genomics | AgY53B (Y) | |
| 5’-TTCTAAGTTTCTAGGCTTTAAGGA T GAAGAAACCGACTATTC-3’-[Fluorochrome] | Eurofins Genomics | AgY477- AgY53B junction region (Y) | |
| F: AACTGTGGAAAAGCCAGAGC R: TCCACTTGATCCTTGCAAAA | Eurofins Genomics | 18S rDNA (X) | |
| F: CCTTTAAACACATGCTCAAATT R: GTTTCTTCATCCTTAAAGCCTAG | Eurofins Genomics | AgY53B (Y) |
Referenzen
- World Malaria Report. World Health Organization Available from: https://www.who.int/teams/global-malaria-programme/reports/world-malaria-report-2022 (2022)
- Bhatt, S., et al. The effect of malaria control on Plasmodium falciparum in Africa between 2000 and 2015. Nature. 526 (7572), 207-211 (2015).
- Hammond, A., et al. A CRISPR-Cas9 gene drive system targeting female reproduction in the malaria mosquito vector Anopheles gambiae. Nature Biotechnology. 34 (1), 78-83 (2016).
- Galizi, R., et al. A synthetic sex ratio distortion system for the control of the human malaria mosquito. Nature Communications. 5 (1), 3977 (2014).
- Kyrou, K., et al. A CRISPR-Cas9 gene drive targeting doublesex causes complete population suppression in caged Anopheles gambiae mosquitoes. Nature Biotechnology. 36 (11), 1062-1066 (2018).
- Simoni, A., et al. A male-biased sex-distorter gene drive for the human malaria vector Anopheles gambiae. Nature Biotechnology. 38 (9), 1054-1060 (2020).
- Gantz, V. M., et al. Highly efficient Cas9-mediated gene drive for population modification of the malaria vector mosquito Anopheles stephensi. Proceedings of the National Academy of Sciences of the United States of America. 112 (49), E6736-E6743 (2015).
- Bernardini, F., Kriezis, A., Galizi, R., Nolan, T., Crisanti, A. Introgression of a synthetic sex ratio distortion system from Anopheles gambiae into Anopheles arabiensis. Scientific Reports. 9 (1), 5158 (2019).
- Hammond, A. M., Galizi, R. Gene drives to fight malaria: Current state and future directions. Pathogens and Global Health. 111 (8), 412-423 (2017).
- Garrood, W. T., et al. Driving down malaria transmission with engineered gene drives. Frontiers in Genetics. 13, 891218 (2022).
- Hoermann, A., et al. Gene drive mosquitoes can aid malaria elimination by retarding Plasmodium sporogonic development. Science Advances. 8 (38), (2022).
- Nash, A., et al. Integral gene drives for population replacement. Biology Open. 8 (1), (2019).
- Galizi, R., et al. A CRISPR-Cas9 sex-ratio distortion system for genetic control. Scientific Reports. 6 (1), 31139 (2016).
- Terradas, G., Hermann, A., James, A. A., McGinnis, W., Bier, E. High-resolution in situ analysis of Cas9 germline transcript distributions in gene-drive Anopheles mosquitoes. G3: Genes, Genomes, Genetics. 12 (1), (2022).
- Durant, A. C., Donini, A. Ammonium transporter expression in sperm of the disease vector Aedes aegypti mosquito influences male fertility. Proceedings of the National Academy of Sciences of the United States of America. 117 (47), 29712-29719 (2020).
- Taxiarchi, C., et al. High-resolution transcriptional profiling of Anopheles gambiae spermatogenesis reveals mechanisms of sex chromosome regulation. Scientific Reports. 9 (1), 14841 (2019).
- Pompon, J., Levashina, E. A. A new role of the mosquito complement-like cascade in male fertility in Anopheles gambiae. PLoS Biology. 13 (9), e1002255 (2015).
- Papathanos, P. A., Windbichler, N., Menichelli, M., Burt, A., Crisanti, A. The vasa regulatory region mediates germline expression and maternal transmission of proteins in the malaria mosquito Anopheles gambiae: A versatile tool for genetic control strategies. BMC Molecular Biology. 10 (1), 13 (2009).
- Liang, J., Sharakhov, I. V. Premeiotic and meiotic failures lead to hybrid male sterility in the Anopheles gambiae complex. Proceedings of the Royal Society B. 286 (1906), 20191080 (2019).
- Hall, A. B., et al. Radical remodeling of the Y chromosome in a recent radiation of malaria mosquitoes. Proceedings of the National Academy of Sciences of the United States of America. 113 (15), E2114-E2123 (2016).
- Clements, A. N. . The Biology of Mosquitoes. Volume 1: Development, Nutrition and Reproduction. , (1992).
- Demarco, R. S., Eikenes, &. #. 1. 9. 7. ;. H., Haglund, K., Jones, D. L. Investigating spermatogenesis in Drosophila melanogaster. Methods. 68 (1), 218-227 (2014).
- Helinski, M. E., Parker, A. G., Knols, B. G. Radiation biology of mosquitoes. Malaria Journal. 8, S6 (2009).
- Huho, B. J., et al. A reliable morphological method to assess the age of male Anopheles gambiae. Malaria Journal. 5 (1), 62 (2006).
- Fabian, L., Brill, J. A. Drosophila spermiogenesis. Spermatogenesis. 2 (3), 197-212 (2012).
- Li, M., et al. Suppressing mosquito populations with precision guided sterile males. Nature Communications. 12 (1), 5374 (2021).
- Thailayil, J., Magnusson, K., Godfray, H. C., Crisanti, A., Catteruccia, F. Spermless males elicit large-scale female responses to mating in the malaria mosquito Anopheles gambiae. Proceedings of the National Academy of Sciences of the United States of America. 108 (33), 13677-13681 (2011).
- Haghighat-Khah, R. E., et al. Cellular mechanisms regulating synthetic sex ratio distortion in the Anopheles gambiae germline. Pathogens and Global Health. 114 (7), 370-378 (2020).
- Yamamoto, D. S., et al. A synthetic male-specific sterilization system using the mammalian pro-apoptotic factor in a malaria vector mosquito. Scientific Reports. 9 (1), 8160 (2019).
- Papathanos, P. A., Windbichler, N. Redkmer: An assembly-free pipeline for the identification of abundant and specific X-chromosome target sequences for X-shredding by CRISPR endonucleases. The CRISPR Journal. 1 (1), 88-98 (2018).
- Sharma, A., Kinney, N. A., Timoshevskiy, V. A., Sharakhova, M. V., Sharakhov, I. V. Structural variation of the X chromosome heterochromatin in the Anopheles gambiae complex. Genes. 11 (3), 327 (2020).
- Krzywinski, J., Sangaré, D., Besansky, N. J. Satellite DNA from the Y chromosome of the malaria vector Anopheles gambiae. Genetics. 169 (1), 185-196 (2005).
- Timoshevskiy, V. A., Sharma, A., Sharakhov, I. V., Sharakhova, M. V. Fluorescent in situ hybridization on mitotic chromosomes of mosquitoes. Journal of Visualized Experiments. (67), e4215 (2012).
- Liang, J., Hodge, J. M., Sharakhov, I. V. Asymmetric phenotypes of sterile hybrid males from reciprocal crosses between species of the Anopheles gambiae complex. Frontiers in Ecology and Evolution. 9, 660207 (2021).
- Slotman, M., Torre, A. D., Powell, J. R. The genetics of inviability and male sterility in hybrids between Anopheles gambiae and An. arabiensis. Genetics. 167 (1), 275-287 (2004).
- Wood, R. J., Newton, M. E. Sex-ratio distortion caused by meiotic drive in mosquitoes. The American Naturalist. 137 (3), 379-391 (1991).
- Cazemajor, M., Joly, D., Montchamp-Moreau, C. Sex-ratio meiotic drive in Drosophila simulans is related to equational nondisjunction of the Y chromosome. Genetics. 154 (1), 229-236 (2000).
- Jaenike, J. Sex chromosome meiotic drive. Annual Review of Ecology and Systematics. 32 (1), 25-49 (2001).
- Courret, C., Chang, C. H., Wei, K. H., Montchamp-Moreau, C., Larracuente, A. M. Meiotic drive mechanisms: Lessons from Drosophila. Proceedings of the Royal Society B. 286 (1913), 20191430 (2019).
- Zanders, S. E., Unckless, R. L. Fertility costs of meiotic drivers. Current Biology. 29 (11), R512-R520 (2019).
- Newton, M. E., Wood, R. J., Southern, D. I. A cytogenetic analysis of meiotic drive in the mosquito, Aedes aegypti (L.). Genetica. 46 (3), 297-318 (1976).
- Carabajal Paladino, L. Z., Nguyen, P., Šíchová, J., Marec, F. Mapping of single-copy genes by TSA-FISH in the codling moth, Cydia pomonella. BMC Genomic Data. 15, S15 (2014).
- Bernardini, F., et al. Cross-species Y chromosome function between malaria vectors of the Anopheles gambiae species complex. Genetics. 207 (2), 729-740 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten