Method Article
Yeni bir pompasız akışkan sistemi kullanarak gözün çeşitli doku ve hücre tiplerinin bakımı ve değerlendirilmesi
Bu Makalede
Özet
Canlı dokunun gerçek zamanlı analizi, önemli fonksiyonel ve mekanik veriler sağlar. Bu makale, çok çeşitli doku ve hücre modellerini koruyan ve değerlendiren yeni ve pompasız çok kanallı akışkan bir sistem tarafından doğru ve tekrarlanabilir veri üretimini sağlamak için protokolleri ve kritik değişkenleri açıklamaktadır.
Özet
Doku fonksiyonunu ve hücre biyolojisini araştırmak için kullanılan birçok in vitro model, fonksiyonun ve canlılığın sürdürülmesi için gerekli olan yeterli oksijenasyonu ve optimal hücre koşullarını sağlamak için bir ortam akışı gerektirir. Bu amaçla, doku ve hücreleri kültürde tutmak ve in-line sensörler ve/veya çıkış fraksiyonlarının toplanması yoluyla işlev ve canlılığı sürekli olarak değerlendirmek için çok kanallı bir akış kültürü sistemi geliştirdik. Sistem, metabolitlerin üretim hızlarını ve hormon salgısını aynı anda ölçmek için oksijen tüketim oranının 8 kanallı, sürekli optik algılamasını dahili bir fraksiyon toplayıcı ile birleştirir. Adacıklar, kas ve hipotalamus dahil olmak üzere çok çeşitli doku ve hücre modellerini koruyabilmesine ve değerlendirebilmesine rağmen, burada çalışma prensiplerini ve izole fare retinası, fare retina pigment epiteli (RPE)-koroid-sklera ve kültürlenmiş insan RPE hücrelerinin biyoenerjetik regülasyonunu araştırmak için kullandığımız deneysel preparatları/protokolleri açıklıyoruz. Pompasız sıvı akışı gibi sistemin tasarımındaki yenilikler, çok kanallı bir akış sisteminin büyük ölçüde basitleştirilmiş bir çalışmasını sağlamıştır. Cihazın nasıl birleştirileceğini, bir deney için nasıl hazırlanacağını ve farklı doku/hücre modellerinin perifüzyon odalarına nasıl yükleneceğini gösteren videolar ve görüntüler gösterilmektedir. Ek olarak, tutarlı ve stabil kültür koşulları elde etmek için doğru akış hızının doku oranının ayarlanması ve tüketim ve üretim oranlarının doğru belirlenmesi de dahil olmak üzere, protokol ve dokuya özgü deneyler için koşulların seçilmesine yönelik kılavuzlar tanımlanmış ve tartışılmıştır. Optimal doku bakımı ve birden fazla parametrenin gerçek zamanlı değerlendirmesinin kombinasyonu, göz fizyolojisi araştırmaları ve görme bozukluğunun tedavisi için ilaç keşfi için büyük fayda sağlayacak son derece bilgilendirici veri setleri sağlar.
Giriş
Perifüzyon sistemlerinin yaşam bilimlerinde uzun bir geçmişi vardır. Özellikle, adacıklar tarafından salgı fonksiyonunun incelenmesi için, sekretagoglara yanıt olarak insülin sekresyonunun kinetiğini karakterize etmek için kullanılmıştır1. Hormonların ve metabolitlerin müteakip tahlili için çıkış fraksiyonlarının toplanmasına ek olarak, ağırlıklı olarak oksijen tüketiminin tespiti için gerçek zamanlı sensörlerdahil edilmiştir 2,3,4. Göz hastalıklarına aracılık eden mekanizmaları daha iyi anlamaya yönelik yaygın çabalar, retina, retina pigment epitelyal (RPE)-koroid-sklera ve kültürlenmiş RPE hücreleri dahil olmak üzere gözün çeşitli izole bileşenlerinin metabolik regülasyonunu ve düzensizliğini değerlendirmek için fizyolojik olarak ilgili yöntemlerin eksikliği nedeniyle sınırlandırılmıştır. Kültürlenmiş hücreler için tasarlanmış statik sistemler doku5 için uyarlanmıştır, ancak doku yeterli oksijenasyon için akışa ihtiyaç duyar. Akış sistemleri, retina ve RPE-koroid-sklera tarafından oksijen tüketim oranındaki (OCR) gerçek zamanlı yanıtları doğru ve tekrarlanabilir bir şekilde ölçmede başarılı olmuştur ve dokular 8 saatten fazla metabolik olarak stabil kalarak birden fazla test bileşiğiiçeren son derece bilgilendirici protokollere izin verir 4,6,7,8,9. Bununla birlikte, akışkan sistemlerin işletilmesi, tarihsel olarak özel yapım bir aparat ve standartlaştırılmamış metodolojilerde eğitimli teknik personel gerektirmiştir. Bu tür sistemler çoğu laboratuvarda standart metodoloji olarak benimsenmemiştir. BaroFuse, pompalara değil, birden fazla kanal ve doku odasından akışı sağlamak için gaz basıncına dayanan yeni geliştirilmiş bir akışkan sistemidir (Şekil 1). Her kanal OCR için sürekli olarak izlenir ve çıkış, daha sonra içeriğin tahlili için plaka bazlı bir fraksiyon toplayıcı ile toplanır. Daha da önemlisi, alet için doku perifüzyon odaları, çeşitli geometri ve boyutlardaki dokuları barındıracak şekilde tasarlanmıştır.
Cihazın kalbi, akışın kapalı, basınçlı bir rezervuardan küçük iç çaplı (ID) borulardan (sıvı devresindeki en önemli akış direncine katkıda bulunan) dokuyu barındıran cam doku odalarına sürüldüğü akışkan sistemidir. Medya rezervuar modülüne (MRM) basınç, bir gaz karışımı (tipik olarak %21 O 2,% 5 CO 2, denge N 2) içeren bir gaz silindirine bağlı düşük basınçlı ve yüksek basınçlı regülatörler tarafından sağlanır ve rezervuar, doku odası tertibatlarını (TCA'lar) tutan perifüzyon odası modülü (PCM) tarafından üstten kapatılır. Akış hızı, direnç borularının uzunluğu ve kimliği ve düşük basınç regülatörünün basınç ayarı ile kontrol edilir. Doku odalarının tepesine bağlanan çıkış tüpleri, sıvıyı ya bir atık kabına (akış hızının otomatik olarak belirlenmesi için sürekli olarak tartılır) ya da fraksiyon toplayıcı tarafından kontrol edilen 96 oyuklu bir plakanın kuyularına iletir. O 2 algılama sistemi, dokunun akış aşağısındaki cam doku odalarının her birinin içine boyanmış O2'ye duyarlı bir boyanın ömrünü ölçer. Bu bilgiler daha sonra OCR'yi sürekli olarak hesaplamak için kullanılır. Tüm akışkan sistemi, sıcaklık kontrollü bir muhafaza içinde bulunur ve gaz tankı, fraksiyon toplayıcı ve bilgisayar, cihazın ana bileşenleridir (Şekil 2A). Son olarak, cihazı çalıştıran yazılım, çalışmasını kontrol etmeye (enjekte edilen test bileşiklerinin hazırlanması ve zamanlaması, akış ölçüm sistemi ve fraksiyon toplayıcı zamanlaması dahil) ve ayrıca OCR verilerinin ve diğer ek ölçümlerin işlenmesine ve grafiğinin çizilmesine hizmet eder.
Bu yazıda, gözün çeşitli izole bileşenleri için OCR ve laktat üretim hızını (LPR) perifüze etmek ve değerlendirmek için akışkan sistemi kullanma protokollerini açıklıyoruz. LPR, çiftinhücre 10'daki karbonhidratlardan enerji üretiminin iki ana dalını açıkladığı OCR'yi oldukça tamamlayıcı olan glikolitik hızı yansıtan bir parametredir. Dokunun hazırlanması ve doku odalarına yüklenmesi en iyi prosedürü izleyerek öğrenildiğinden, video, kurulum ve çalıştırma sırasında gerçekleştirilen ve yalnızca metinle kolayca aktarılamayan kritik adımların birçoğunu göstermeye yardımcı olacaktır.
Protokolün açıklaması, deneyin farklı aşamalarına karşılık gelen 8 bölüme ayrılmıştır (Şekil 2B): 1. deney öncesi hazırlık; 2. perifusatın hazırlanması / dengelenmesi; 3. enstrüman kurulumu; 4. doku dengesi; 5. Deney protokolü; 6. enstrüman arızası; 7. Veri işleme; ve 8. çıkış fraksiyonlarının tahlilleri.
Protokol
Sıçanlardan ve farelerden doku toplanması için tüm prosedürler Washington Üniversitesi Kurumsal Hayvan Bakım ve Kullanım Komitesi tarafından onaylandı.
1. Deney öncesi hazırlık
NOT: Aşağıdaki görevler denemeden en az bir gün önce tamamlanır.
- Deneysel protokolün tasarlanması
- Kanallara doku yerleşiminin atanması: MRM'nin her iki tarafındaki 4 kanaldan 3'üne yerleştirilecek doku veya hücre modelini seçin. Her iki taraftaki bir doku odası, taban çizgisi düzeltmesi için kullanılacak doku olmadan çalıştırılır.
- Numuneleri iki tipik tasarımdan birini kullanarak düzenleyin - her iki tarafta farklı test bileşiği protokolleri (örneğin, MRM'nin bir tarafındaki kanallar test bileşiklerini alırken diğer taraftaki kanallar bir kontrol görevi görür); MRM'nin her iki tarafında aynı test bileşiği enjeksiyon protokolü, ancak MRM'nin her iki tarafında kontrole karşı farklı dokular veya doku modeli.
- Optimum OCR ölçümü için akış hızı ve doku miktarı seçimi: Kullanım ömrü oranındaki değişim çarpı 100 yaklaşık 3 olana kadar akış hızını ayarlayın.
NOT: Tipik doku miktarları ve karşılık gelen akış hızları, cihazın en iyi 6-80 μL/dak/kanal arasındaki akış hızlarında en iyi şekilde çalıştığı göz bileşenleri için Tablo 1'de gösterilmiştir. - Gerekli ortam/arabellek hacminin hesaplanması: Denemenin başında her bir MRM ekine eklenecek ortam hacmini şu şekilde hesaplayın:
HacimMRM = 30 mL + Protokol Süresi (dakika olarak) x Akış Hızı (mL/dk olarak) x 4 kanal (Eşitlik 1)
Örneğin, 0.01 mL / dk'da, 60 mL'lik bir başlangıç Hacmi MRM'si 12.5 saatlik bir protokole izin verecektir (burada 30 mL tükenirken, 30 mL kalacaktır), 0.04 mL / dk'da, 90 mL başlangıç HacmiMRM, 6 saatlik bir protokole izin verecektir (30 mL kalan). - Test bileşikleri enjeksiyon protokolü: Değerlendirilecek test bileşiklerini, test edilecek konsantrasyonu (tipik olarak maksimum yanıta yakın veya konsantrasyon bağımlılıkları olarak seçilir) ve maruz kalma süresini seçin. Çözünürlüğü göz önünde bulundurun ve su, DMSO veya etanol gibi istenen çözücüde stoklar oluşturun.
- Sonraki bir ajan eklemeden önce yanıtın sabit bir duruma ulaşması için enjeksiyonların ve sonraki enjeksiyonların zamanlamasını seçin. Protokolleri tekrarlarken, enjeksiyonların zamanlamasını eşleştirin, böylece birden fazla zaman kursunun ortalaması alınabilir.
NOT: Burada kullanılan bileşikler, önceki bir mitokondriyal (Mito) stres testinden 11 alınmıştır ve hem oligomisin hem de karbonil siyanür 4- (triflorometoksi) fenilhidrazon (FCCP), hem stok çözeltilerinde hem de nihai perifusatta DMSO gerektirir. - Çıkış örnekleme süreleri: Hızlı değişiklikler için daha hızlı örnekleme hızlarının seçildiği ve kararlı duruma yaklaşıldığında daha uzun zaman aralıklarının seçildiği istenen fraksiyon toplama aralıklarını (1-60 dakika/örnek arasında) seçin. Örnekleme aralığı sırasında taşmayı önlemek için yeterli kuyu hacimleri (0,3 ila 1,5 mL) kullanın (akış hızı x zaman aralığından daha büyük hacimleri seçin).
NOT: Örnekleme süreleri protokol seçimine göre değişecektir, ancak bir Mito stres testi için, başlangıç sırasında 5 dakikalık aralıklar ve enjeksiyonlar sırasında 15 dakikalık aralıklar kullandık (-15, -10, -5, 0, 15, 30, 45, 60, 75, 90, 105, burada her zaman örnekleme aralığının başlangıcıdır). - Yukarıda açıklanan test bileşikleri ve fraksiyon toplama için seçilen değerleri, bu bilgilerin grafiksel temsillerini oluşturan kullanıcı arayüzüne (UI) girin. Grup değerlendirmesi ve tartışmaları için dosyaları dışa aktarın ve dağıtın (Ek Şekil 1).
- Aksesuarları ve sarf malzemelerini belirleyin
- Üretici tarafından sağlanan ve aseptik olarak önceden paketlenen malzemeleri belirleyin: TCA'lar (8'li paket), çıkış borusu tertibatları (8'li tüplü paket), test bileşiği enjeksiyon hortumu (2), forseps, boru kelepçeleri (3), MRM, MRM ekleri (2), karıştırma çubukları (2) ve boşaltma borusu tertibatı (biyolojik güvenlik kabinine yerleştirilmiş).
- Sıvı ile temas eden tek kullanımlık parçaları tekrar kullanmayın, çünkü bu deneysel arızada artışa neden olur. Forsepsleri ve karıştırma çubuklarını deneyler arasında temizleyerek ve otoklavlayarak tekrar kullanın.
2. Perifusatın hazırlanması ve dengelenmesi (Süre: 30 dk inkübasyon süresi hariç)
- Denklem 1'deki hesaplamalara dayanarak, tipik olarak 200 mL'lik bir gün önce ortamı veya Krebs-Ringer bikarbonat tamponunu (KRB) hazırlayın ve daha sonra her şişede 90 mL'den fazla olmayan T225 doku kültürü şişelerinde 39 °C /% 5CO2 inkübatörde gece boyunca inkübe edin.
- Ticari olarak hazırlanmış KRB veya ortam (oda sıcaklığına ısıtılmış) kullanılıyorsa, deney sabahı perifüzyonu hazırlayın ve% 5 CO2 inkübatöründe en az 1 saat bekletin. Tüm çözeltileri aseptik olarak hazırlayın.
NOT: Sıvı ile temas eden tüm sıvılar ve akışkan sistemin parçaları deneyin başlangıcında sterildir. Ancak sistemin montajı ve dokunun yüklenmesi havaya açık olarak gerçekleştirilir.
3. Cihazı kurmak için sıcaklık ve çözünmüş gazın dengelenmesi (Süre: 75 dk)
- Boru tertibatlarının MRM'ye bağlanması
- MRM'yi ve bir akışkan paketini cihazın yanındaki tezgahın üzerine yerleştirin. Boru kelepçelerinin (3), karıştırma çubuklarının (2) ve forsepslerin alet tepsisinde olduğundan emin olun.
- MRM'nin her iki tarafına karıştırma çubuğu olan kullanılmayan bir MRM eki yerleştirin (bkz. Şekil 3).
- TCA'ları, borunun ucu doğrudan karıştırma çubuğunun üzerine yerleştirilecek şekilde MRM'nin her iki ucundaki enjeksiyon portlarına takın. İki test bileşiği enjeksiyon düzeneğinden daha uzun olanın MRM'nin arkasında olduğundan emin olun.
- Ardından, gaz giriş besleme hattını ve boşaltma borusu tertibatını sırasıyla arka ve ön boş bağlantı noktalarına takın (bkz. Şekil 4A).
- MRM/boru tertibatlarının muhafazaya yerleştirilmesi
- MRM'yi (boru tertibatları takılıyken) MRM ısıtıcısına yerleştirin (Şekil 4B).
- Dört boru tertibatını, muhafazanın tabanındaki duvarların oluklarına (her iki tarafta ikişer tane) yerleştirin, böylece orta muhafaza yerleştirildikten sonra muhafazanın dışına doğru çıkıntı yapacaklardır.
- MRM'yi cl arasına sabitleyinampdedektör standındaki iki tekerleği sıkarak streçler.
- Muhafazanın arkasından çıkıntı yapan daha uzun test bileşiği enjeksiyon düzeneğini, muhafazanın yan tarafındaki iki tüp kılavuzundan, tüplerin açıklığı öne bakacak şekilde besleyin (Şekil 4C).
- Kapalı test bileşiği enjeksiyon düzeneklerinin her birini sıkıştırın.
- Muhafazanın montajı ve sıcaklık kontrol cihazlarının etkinleştirilmesi
- Muhafaza içindeki tüm elektrikli cihazlara güç sağlayan anahtarlı uzatma kablosunu AÇIK konuma getirin. Dedektör standındaki fan AÇILACAK ve MRM sıcaklık kontrol cihazı 38 °C'lik bir ayar değeri gösterecek şekilde yanmalıdır (Şekil 5).
- Karıştırma çubuklarının düzgün döndüğünden emin olmak için kullanıcı arayüzünü kullanarak karıştırıcıları 70 rpm'ye AÇIN. Uygun karıştırma gözlemlendiğinde, karıştırıcıları kapatın.
- Muhafazanın orta kısmını tabanın üstüne yerleştirin.
- Ortam sıcaklığı kontrol kolu anahtarına güç sağlamak ve ortam sıcaklığı ısıtıcısına güç sağlamak için muhafazanın orta kısmındaki kabloyu elektrik kutusundan gelen kabloya bağlayın.
- Kapağı muhafazanın üzerine yerleştirin ve üst sıcaklık kontrol cihazının (ortam sıcaklığı kontrolörü) ekranı yanacak ve 36 °C okuyacaktır. MRM ısıtıcısının ayar noktası sıcaklığına ulaşması için geçen süre olan 30 dakikalık bir zamanlayıcı başlatın.
- TCA'ların PCM'ye eklenmesi
- 8 TCA'nın her birini PCM deliklerine yerleştirmek için, doku odasının etrafına sarılmış boru manşonunun üst kısmı PCM'deki delikleri çevreleyen yüzeye temas edene kadar yerleştirme aletinin yüzüyle adaptöre sıkıca bastırarak TCA yerleştirme aracını kullanın.
- Bir sonrakini eklemeden önce bir TCA'yı tamamen yerleştirin. Kısmen monte edilmiş PCM'yi PCM desteğinin ve 6 vidanın yanına koyun.
NOT: TCA'nın eksik yerleştirilmesi, kafa boşluğunun basınç ayar noktasına ulaşmasını önleyecek ve perifüzyonat akmayacaktır.
- MRM'deki iki ek parçanın önceden dengelenmiş perifüzyon ile doldurulması
- Bunu yapmak için, muhafaza monte edildikten ve MRM sıcaklığa ulaştıktan 30 dakika sonra, 50 mL'lik bir pipet kullanarak sıvıyı yanlardan aşağı nazikçe dağıtarak önceden dengelenmiş perifusatı önceden ısıtılmış MRM ekine aktarın.
NOT: Bu adımlar ve bölüm 3.6'dakiler, MRM'deki perifüzyonat ile atmosfer arasında gaz transferini önlemek için hemen gerçekleştirilmelidir.
- Bunu yapmak için, muhafaza monte edildikten ve MRM sıcaklığa ulaştıktan 30 dakika sonra, 50 mL'lik bir pipet kullanarak sıvıyı yanlardan aşağı nazikçe dağıtarak önceden dengelenmiş perifusatı önceden ısıtılmış MRM ekine aktarın.
- Gaz geçirmez bir conta oluşturmak için MRM/PCM'nin montajı ve O2 dedektörünün konumlandırılması
- PCM'nin altından çıkan TCA'ların direnç tüplerini MRM Bölücünün her iki tarafında 4 adet olmak üzere MRM eklerine yerleştirerek PCM'yi MRM'ye yerleştirin. PCM'yi, yerleştirildikten sonra doku odaları O2 dedektörüne dayanacak şekilde yönlendirin.
- Elektrikli tornavidayı kullanarak PCM'yi ve PCM Destek Brace'i 6 vidayla sabitleyin.
- PCM destek kanatçıkları içindeki TCA'ları, lastik contalar seviyesinde PCM'nin kanatları etrafında gerilerek sağlanan elastik bant ile sabitleyin (Şekil 6).
- O2 Dedektörünü, yüzü PCM'nin kanatçıklarına dayanacak şekilde dedektör standına yerleştirin. LED/fotodetektör çiftlerinin doku odalarındakiO2'ye duyarlı boya ile aynı hizada olup olmadığını kontrol edin. Gerekirse, O 2 dedektör tutucusunun yan tarafındaki ayar vidalarını gevşettikten sonra O2 dedektörü yanal kılavuzlarını ayarlayın.
- Kapağı Muhafazanın üzerine yerleştirin.
- MRM'deki kafa boşluğundaki gazın perifusatat ile dengelenmesi
- Yüksek basınç valfi tamamen sabitlenmiş ve kapalıyken, tankın üstündeki silindir valfini saat yönünün tersine çevirerek gaz deposu valfini açın.
- Regülatör üzerindeki düğmeyi kullanarak yüksek basınç regülatörünü 10 psi basınca ayarlayın.
- Düşük basınç regülatörünü 1.0 psi'ye ayarlayarak MRM'ye basınç uygulayın (Şekil 7A).
- Tanktan gelen gazın MRM üst boşluğundaki havayı değiştirmesine izin vermek için boşaltma borusunu (Şekil 7B) açın.amp 15 dakika boyunca (test bileşiği enjektörleri kelepçeli kalır). Köpürmeyi gözlemlemek için boşaltma borusunun ucunu bir su kabına daldırarak gaz akışını onaylayın.
- Akış onaylandıktan sonra, aşağıda bölüm 2'de açıklandığı gibi O3.8 dedektörünü çalıştırın.
- 15 dakika sonra karıştırıcıyı 70 rpm'de açın ve deneyin geri kalanı için çalışır durumda bırakın. 15 dakika daha sonra, cl de: boşaltma borusu tertibatı (Şekil 7C).
- Düşük basınç regülatörü üzerindeki basıncı, istenen sıvı akış hızına ulaşan çalışma basıncına düşürün (deney paketinde belirtildiği gibi - genellikle yaklaşık 0,5-0,7 psi arasında). Akış hızı 20 μL/dk'nın üzerindeyse, odacıklar taşmadan dokuyu yüklemek için zaman tanımak için basıncı geçici olarak 0,3 psi'ye ayarlayın. Doku, kelepçe yerleştirildikten sonraki 15 dakika içinde yüklenirse bu gerekli değildir.
NOT: SıvıO2 algılamasını engelleyebileceğinden, tamponun doku odasının dışından aşağı akmasına izin vermeyin.
- O2 dedektörünün başlatılması
- Oksijen Dedektörü etiketli simgeye tıklayarak dizüstü bilgisayardaki O2 dedektör yazılımını etkinleştirin.
- Program açıldığında (Ek Şekil 2), doğru COM bağlantı noktasının seçildiğini onaylayın. Gerekirse, bağlantı noktası numarasının görüntülenmesi için O2 dedektörü bilgisayardan çıkarılıp takılarak COM bağlantı noktası tanımlanabilir. Uygulama çalışırken COM bağlantı noktası çıkarılırsa, kullanımdan önce uygulamanın kapatılması ve yeniden açılması gerekir.
- Başlat'a ve ardından Kaydet'e tıklayın (ve verileri yedekleme klasörüne kaydedin). Ardından, Grafik'i tıklayın.
- Yaşam süresi grafiğinin sol alt kısmındaki ortalama değeri 5 olarak değiştirin (bu, programa art arda 5 noktalı bir hareketli ortalama hesaplaması talimatını verir). Bir dakika geçtikten ve grafik ekranında ilk veri noktası görüntülendikten sonra, Otomatik Ölçekle'yi tıklatın.
4. Doku yükleme ve dengeleme süresi (Süre: 90 dk)
- Fritlerin doku odalarına yerleştirilmesi
- Kasanın kapağını ve orta kısımlarını çıkarın.
- Doku odalarındaki perifüzyon önceden konumlandırılmış fritin üst kısmının üzerine çıktıktan sonra, fritin altında veya içinde oluşan hava kabarcıklarını gidermek için fritin üstüne hafifçe vurarak frit işaretiyle friti aşağı doğru itin.
- Fritleri doku odasının tabanının yaklaşık 0,25 inç yukarısına yerleştirin.
- Doku odalarına doku yükleme
- Ortam seviyesi üstten 0,5 inç olduğunda, dokuyu hazneye yükleyin.
- Retina veya RPE-koroid-sklera yükleme: 6'da tarif edildiği gibi Retina veya RPE-koroid-sklera hasat edin. Dokuyu yüklemek için, doku odasından sıvının O2 sensörüne damlamasını önlemek için bir kağıt mendil kullanırken, dokuyu katlamamaya dikkat ederek dokuyu her bir bölmeye nazikçe yerleştirmek için ince uçlu forseps kullanın. Frit'e doğru ve üzerine batan dokuyu gözlemleyin.
NOT: Dokunun toplanması ve dokuların haznelere yüklenmesi arasında, dokuyu bikarbonat bazlı bir tampon/ortam içinde 10 dakikadan fazla inkübatörden dışarıda bırakmayarak ve dokunun hipoksik hale gelmesini ve havaya maruz kalmasını önlemek için yeterli tampon/ortam (en az 1 mL/10 mg doku) içinde yıkanmasını sağlayarak doku travmasının önlenmesini sağlayın. - RPE hücrelerinin transwell membranlarına yüklenmesi: RPE hücrelerini daha önce 12 ve Ek Dosya 1'de açıklandığı gibi hazırlayın. Polietilen tereftalat üzerinde %0,25 tripsin-EDTA ve tohum kullanan geçiş hücreleri, minimum 2,0 x 105 hücre/cm2'de iz kazınmış filtreler (hücre kültürü ekleri, gözenek boyutu 0,4 mm). Deney gününde, zarları eşit genişlikte üç şerit halinde kesin ve forseps ile doku odalarına yükleyin (bkz. Şekil 8A).
- Çıkış borusu tertibatlarının doku odalarına takılması
- Çıkış borusu tertibatlarını ambalajından çıkarın ve çıkış borusu ayırıcısını, çıkış borusu adaptörleri muhafazanın içinde olacak şekilde muhafazanın orta bölümünün dudağına yerleştirin (Şekil 8B,C).
- TCA'ları çok fazla itmemeye dikkat ederek (aksi takdirde MRM'den gevşerler), çıkış borusu adaptörlerini doku odalarının TCA'larının üstüne takın (Şekil 8D). Muhafazanın ortasını yerine takın ve ortam sıcaklığı kontrol kablosunu yeniden bağlayın.
- Muhafazanın kapağını değiştirmeden önce, O2 dedektörü, PCM, doku odaları, çıkış tüpleri, MRM ve ısıtıcı dahil olmak üzere muhafazanın içindeki akışkan sistem bileşenlerinin tümünün Şekil 8E'de gösterildiği gibi doğru şekilde yerleştirildiğini onaylayın.
- Kasanın kapağını yerine takın. Sekiz çıkış borusunu fraksiyon toplayıcı kılavuz kolundan geçirin.
- Kesir toplayıcının etkinleştirilmesi
- Fraksiyon toplayıcının muhafazanın sağ duvarına ve çıkış borusu tutucusuna göre ortalandığından emin olun: fraksiyon toplayıcı tabanının sol desteği, muhafaza duvarının kenarına dayanmalıdır.
- Dizüstü bilgisayarda, UI kısayoluna tıklayın ve deneysel bilgi sayfası açılacaktır (Ek Şekil 3 Üst).
- Deney bilgi sayfasındaki uygun kutulardaki bilgileri doldurun (bu, deney başlamadan önce yapılabilir) ve ardından üstteki Akış ve Kesir Toplayıcı sayfasına tıklayın (Ek Şekil 3 Alt).
- Otomatik akış hızı ölçümü için parametrelerin ayarlanması
- İstenen doğruluğu (entegrasyon süresiyle orantılıdır) ve zamansal çözünürlüğü dengeleyen üst ortadaki örnek alma süresi açılır menüsünde istenen entegrasyon süresini seçin.
- Denemede herhangi bir çıkış fraksiyonu toplanmayacaksa Başlat'a tıklayın ve bölüm 4.7'ye gidin. Çıkış fraksiyonları toplanacaksa, bölüm 4.6'daki adımları uygulayın.
- Çıkış fraksiyonlarının toplanması
- UI yazılımında, Kesirler toplansın mı? Deney Bilgileri sayfasındaki veya Akış ve Kesir toplayıcı sayfasındaki kutu. Ardından FC Ayarlarını Hesapla düğmesine tıklayın.
- Yeni pencere açıldığında, protokoldeki ilk enjeksiyonun zamanını (zaman = 0 olarak tanımlanır) ve kanal başına akış hızını ve ayrıca her numune için zaman aralıklarını doldurun. Ardından, İşlem'e tıklayın.
- Koleksiyonun aralıkları doğrulandıktan sonra Oluştur ve Başlat'a tıklayın.
- Münferit kanallar için debi ölçümü (Opsiyonel)
- Tek tek kanalların akış hızları ölçülecekse (normal koşullar altında sadece yüzde birkaç oranında değişir), sekiz (veya daha az) mikrosantrifüj tüpünü tartın ve ağırlıklarını kaydedin.
- Önceden tartılmış mikrosantrifüj tüplerini içeren tüp tutucuyu plaka taşıyıcısına yerleştirin. Diğer yardımcı programlar bölümünde Akış Hızını Manuel Olarak Ölç'e tıklayın.
- Ölçüm süresini seçin ve ardından Şablon Oluştur'a tıklayın. Pencereyi kapatın ve Başlat'a tıklayın. Fraksiyon toplayıcı, ölçüm süresi boyunca çıkış tüplerinden sıvı toplayacak ve ardından kol ana konumuna geri dönecektir.
- Mikrofüj tüplerini topladıktan sonra tartın ve akış hızını hesaplamak için ağırlık farkının ölçüm süresine bölünmesiyle elde edin (burada 1 mg = 1 μL).
- Temel stabilizasyon
- Doku ve/veya hücreler doku odalarına yüklendikten sonra,O2 tüketiminin düz bir taban çizgisini oluşturmak için sistemin 90 dakika boyunca dengelenmesine izin verin, bu sırada ilk test bileşiği enjekte edilebilir (zaman = 0 olarak kabul edilir).
- İlk enjeksiyondan 30 dakika önce, test bileşiği enjeksiyonlarını hazırlamak için enjeksiyon sayfasına kanal başına ortalama son 3 FR değerini girin.
5. Deneysel protokol (Süre: 2-6 saat)
NOT: Temel stabilizasyon başladıktan sonra, sonraki görevler test bileşiklerini enjekte etmek ve birden fazla kullanılacaksa fraksiyon toplayıcı üzerindeki plakaları değiştirmektir.
- Test bileşiği enjeksiyonunun hazırlanması
- Bileşiklerin adlarını, istenen konsantrasyonları (nihai ve stok çözeltileri) ve test bileşiklerinin enjeksiyon sürelerini Enjeksiyon sayfasındaki kullanıcı arayüzündeki tabloya girin. Enjeksiyonlar sırasında kalan MRM'deki hacimler ve istenen konsantrasyonları elde etmek için ne kadar stok çözeltisinin enjekte edileceği dahil olmak üzere programda görüntülenen bilgileri onaylayın (Ek Şekil 4).
- Enjeksiyon için ne kadar perifüzyon ve stok gerektiğini hesaplamak için, enjeksiyon tablosunun beyaz kutularını doldurun ve Hesapla'ya tıklayın. Hesaplanan değerleri kullanarak, enjekte edilen hacim, enjeksiyondan sonra MRM'deki hacmin% 5'i olacak şekilde enjeksiyondan önce test bileşiği stok çözeltisini perifusatın ile seyreltin.
- Her bir test bileşiğini, stok çözeltisini ve perifusatı karıştırarak hazırlayın. Şırıngaları enjeksiyon zamanından en az 10 dakika önce yükleyin ve enjekte etmeye hazır olana kadar bir CO2 inkübatöründe (37-40 ° C arasındaki sıcaklıklarda tutulur) tutun.
- Test bileşiklerinin enjekte edilmesi
- Test bileşiğini içeren şırıngayı enjeksiyon hatlarına bağlayın (Şekil 9A). Enjeksiyon hattına giden yumuşak duvarlı pharmed boruyu açın ve test bileşiklerini (Şekil 9B) yaklaşık 3 mL/dk hızında yavaşça enjekte edin. Boruyu enjeksiyon hattına yeniden sıkıştırın ve ardından şırıngayı çıkarın (Şekil 9C); MRM'nin diğer tarafı için tekrarlayın.
- Her bir test bileşiğini enjekte ettikten sonra, UI enjeksiyon sayfasına göre enjekte edilecek sonraki her bir test bileşiğini hazırlayın.
- Her kanal için giriş O2 sinyalinin belirlenmesi
- Her deneyin sonunda, temel sensör ömründeki ve mitokondriyal olmayan oksijen tüketimindeki değişimi düzeltmek için kullanılan her kanal için giriş ömrü sinyalini belirlemek için solunum inhibitörü KCN'yi (3 mM) enjekte edin.
6. Deneyin sonlandırılması ve sistemin parçalanması (Süre: 30 dk.)
- Oksijen verilerinin kaydedilmesi
- Oksijen dedektörü yazılımındaki grafik penceresinin sol üst köşesindeki Kaydet düğmesine tıklayın; Dosyayı adlandırın ve dosyanın tutulacağı klasörde saklayın. Tıkla Kaydetmeyi bırak Yedekleme dosyasını kaydetmek için ana penceredeki düğmesine basın.
- UI deneysel bilgi dosyasını kaydetme
- Kullanıcı arayüzünün genel sayfasının sol üst köşesindeki Profili kaydet düğmesini tıklayın; Dosyayı adlandırın ve dosyanın tutulacağı klasöre kaydedin. Kullanıcı arabiriminin kesir ve akış sayfasında, Araçlar açılır menüsüne ve ardından Kaydet'e tıklayın. Oluşturulan adı koruyun veya başka bir ad seçin ve dosyayı istediğiniz yerde saklayın. Gerekirse, erişilebilen ve kaydedilebilen yedekleme dosyaları vardır.
- Enstrümanı parçalamak
- KCN uçucu olduğundan, akışkan tertibatlarını bir davlumbaz içine atın; MRM ve FC atık tepsisindeki ortamı bir atık kabına dökün ve MRM eklerini ve karıştırma çubuklarını suyla iyice durulayın. Atık kabının içeriğini (KCN içeren) daha sonra kimyasal güvenlik kapsamında bertaraf edilmek üzere etiketli bir kimyasal atık kabına dökün. Bir sonraki deneyden önce, karıştırma çubuklarını ve forsepsleri iyice temizleyin ve otoklavlayın.
7. Veri işleme (Süre: 15-45 dk)
- Veri işlemcisi uygulamasını bir Mac veya PC bilgisayarda açın. Bir deneme tarafından oluşturulan .csv veri dosyasını seçin. Bu denemenin protokolü daha önce analiz edilen bir denemeye benziyorsa, bu ayar dosyasını seçin ve Sonraki Adım'a tıklayın. Aksi takdirde, denemenin ayarlarına girmeye başlamak için Sonraki Adım'ı tıklamanız yeterlidir.
- Denemenin çeşitli ayarlarını doldurun. Referans zaman noktasının belirlenmesinde, KCN'nin yürürlüğe girmesinden ve Yaşam Süresi değerlerinin düşmesinden hemen önceki zaman noktasını seçin. Kaydırıcıyı kullanarak veya kutuya zaman değerini yazarak bu noktayı seçin.
- Denklem 2'ye göre OCR grafikleri oluşturmak için Hesapla'ya tıklayın:
OCR = ([O 2]giriş- [O 2]çıkış) x FR = (217 nmol/mL - [O 2]çıkış) x FR/doku bazında (Eşitlik 2)
37 °C'de %21O2 ile dengede olduğunda KRB'dekiO2 konsantrasyonu 217 nmol/mL, FR akış hızı (mL/dak cinsinden), doku bazında odaya yüklenen doku miktarıdır (yani retina sayısı, RPE-koroid-sklera veya RPE hücreleri). - Grafiği Dışa Aktar düğmesine basarak grafikleri .pdf dosyaları olarak kaydedin. Ayarları düzenleme sayfasında 1 olarak ayarlanacak test bileşiğine karşılık gelen kutuları işaretleyerek OCR'yi mutlak değerler olarak veya kararlı durum değerinin bir kesri olarak grafiklendirin.
8. Çıkış fraksiyonlarının tahlilleri
- Numuneler deneyden hemen sonra test edilemiyorsa, ertesi gün test edilirse plakaları 4 °C'ye yerleştirin veya daha uzun süre saklanırsa dondurun. Plakalar donmuşsa, numuneleri 4 °C'de çözün (numunelerin soğuk kalması için).
- Seçilen çıkış fraksiyonları üzerinde tahliller yapıldıktan sonra, veri sütunları (kanal başına bir tane), en soldaki sütunda zaman (dakika cinsinden) ve sağda konsantrasyon (nmol/mL veya ng/mL cinsinden) ile bir .csv dosyasına girilir; Veri işleme programındaki bir bağlantı, basıldığında bir şablon yükler.
- Verileri hesaplamak ve çizmek için bu dosyayı veri işlemcisine yükleyin.
Sonuçlar
Gözün izole bileşenlerinden üretilen verilerin çözünürlüğünü göstermek için, OCR ve LPR, yaygın olarak kullanılan bir protokol (mitokondriyal stres testi10; Şekil 10, Şekil 11 ve Şekil 12). Her doku için kullanılan doku miktarı Tablo 1'de gösterilmiştir. Veriler, akışkan sistem için geliştirilen yazılım paketi kullanılarak işlendi ve grafiklendirildi. Retina ve RPE-koroid-skleranın hazırlanması nispeten basittir ve her doku tipi için 20 dakikadan az sürer. OCR, test bileşiklerinin enjekte edildiği süre boyunca sabitti, bu da dokunun stabil sağlığını ve işlevini gösterir ve yöntemin geçerliliğini destekler (Şekil 10). Her doku tipi için doğrulandıktan sonra, her deney için hiçbir test bileşiğinin enjekte edilmediği kontrollerin çalıştırılmasını gerekli bulmadık. Daha konvansiyonel perifüzyon yöntemleri kullanılarak elde edilen verilerle tutarlı6,8,13, oligomisin yanıtında OCR azalması ve FCCP'ye yanıt olarak OCR'de artış olması. LPR'deki değişiklikler, OCR için gözlemlenenlerin tersi yöndeydi: oligomisin, LPR'yi arttırdı, bu daha sonra FCCP'ye yanıt olarak azaldı (ancak sadece biraz) (Şekil 11). Her bir sıralı test bileşiğinin etkisinin istatistiksel anlamlılığını karşılaştırmak için, t-testleri yapıldı (cihazla birlikte gelen yazılım tarafından otomatik olarak hesaplanan). Makalenin amacı, yöntemin nasıl uygulanacağını açıklamak olduğundan, taşınan kopyaların sayısı her zaman istatistiksel anlamlılık üretecek kadar yüksek değildi. Bununla birlikte, genel olarak, kopya sayısı 3 veya daha fazla olduğunda, FCCP ve oligomisinin hem OCR hem de LPR üzerindeki etkileri önemliydi.
RPE hücreleri daha önce akış sistemleriyle analiz edilmemiştir, ancak RPE-koroid-skleraya benzer şekilde yanıt vermiştir (OCR'nin büyük bir kısmının RPE hücrelerine bağlı olduğu görüşüyle tutarlıdır; Şekil 11). Bu açıklayıcı örnekler, kontrol kanallarında OCR'nin stabilitesi ve 100'e 1'den fazla olan oligomisin ve FCCP tarafından indüklenen büyüklükteki OCR'deki değişiklikler için yüksek sinyal-gürültü oranı ile yansıtıldığı gibi sistemin doku canlılığını sürdürme yeteneğini vurgulamaktadır. Ek olarak, hücre dışı sıvı ile değiş tokuş edilen çok çeşitli bileşiklerin alım veya üretim hızını ilişkilendirmek için çıkış fraksiyonlarının tahlilleri kullanılabilir, OCR'yi (bu durumda LPR) tamamlayıcı niteliktedir. Cihazın bu özellikleri, paralel olarak gerçekleştirilen doku tipleri arasındaki doku tepkilerindeki karakteristik farklılıkların doğru bir şekilde ölçülmesine izin verdi. RPE-koroid-sklera ve RPE hücreleri tarafından OCR, oligomisin'e retinadan sürekli olarak daha duyarlıdır (Şekil 11 ve Şekil 12), ancak RPE-koroid-sklera için FCCP'ye maruz kalma süresi kararlı duruma ulaşmak için yeterince uzun değildi. DMSO'yu çözücü olarak kullanırken dikkate alınması gereken bir nokta ortaya çıktı. Daha yüksek konsantrasyonlarda, (% 0.2) DMSO, retina tarafından OCR üzerinde geçici bir etkiye sahipti (muhtemelen DMSO'nun membran geçirgenliği üzerindeki etkisinin neden olduğu ozmotik basınçtaki bir değişikliğin etkisini yansıtıyordu).
KCN'nin sitokrom c oksidaz üzerindeki doğrudan etkisiyle solunumu tamamen inhibe ettiği varsayımına dayanarak, KCN maruziyetinin sonundaki OCR 0 olarak ayarlanır ve tüm OCR değerleri KCN değerine göre değişime göre hesaplanır. OCR, solunum zincirinden ve sitokrom c oksidazdan bağımsız olarak ortaya çıkabilir. Bununla birlikte, genel OCR'ye bu katkının büyüklüğü genellikle yüzde birkaçından fazla değildir (veriler gösterilmemiştir) ve dokunun KCN'ye maruz kaldığı sürenin uzaması, elektron taşıma zincirinin bir parçası olmayan oksidaz substratlarının tükenmesini sağlar.
İstatistiksel analiz
Tekli deneyler şekillerde gösterildiği gibi, ancak ortalaması alınan çoklu kanallarla gösterilmiştir. Veriler daha sonra standart hatanın ortalaması ± grafiklendirildi (SE; SD / √n olarak hesaplandı).
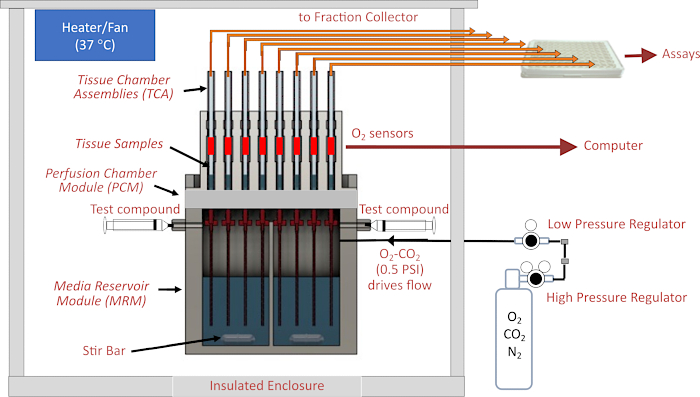
Şekil 1. Akışkanlar/değerlendirme sisteminin şeması. Başlıca bileşenler arasında muhafaza, sıcaklık kontrol elemanları, akışkanlar ve doku odası sistemleri, perifüzyonatın üzerindeki kafa boşluğundaki gaz basıncının düzenlenmesi, fraksiyon toplayıcı/akış hızı izleme veO2 dedektörleri bulunur. Kısaltmalar: MRM = Medya Rezervuar Modülü, PCM = Perifüzyon Odası Modülü, TCA = Doku Odası Montajları. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2. (A) Cihazın ana bileşenlerinin resmi. Ana bileşenler gaz tankı (basınç regülatörleri), muhafaza, fraksiyon toplayıcı ve bilgisayardan oluşur. (B) Ana adım kategorilerini ve bunları tamamlamak için gereken süreyi gösteren deneysel akış şeması. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3. MRM'nin görünümü. MRM, MRM eklerinin altına (MRM Bölücünün her iki tarafına yerleştirilmiş) yerleştirilmiş bir MRM eki (solda) ve karıştırma çubukları (sağda) ile gösterilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4. MRM'de boru montajı ve boşaltma borusu tertibatı. (A) MRM'deki bağlantı noktalarına bağlı bileşik enjeksiyon borusu tertibatını ve boşaltma borusu tertibatını test edin. (İ.Ö.) Test bileşiği enjeksiyon tertibatı ve boşaltma borusu tertibatı (B), Muhafazanın (C) önündeki oluğa yerleştirilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5. MRM sıcaklık kontrol cihazını çalıştırma. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 6. Doku odaları ve gaz tankı. O2 dedektörünün dedektör standına yerleştirilmesi (MRM ve PCM'yi de destekler) ve bandın doku odalarını yerinde sabitlemeye yardımcı olan PCM kanatçıklarının etrafına yerleştirilmesi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 7. (A) Benzin deposundaki yüksek ve alçak basınç regülatörleri. (İ.Ö.) Temizleme tüpü. Boşaltma borusu, MRM'deki üst boşluğun havadan temizlenmesini ve besleme tankından gazla doldurulmasını sağlar. Açık boşaltma tüpünü (B) ve kapalı boşaltma borusunu (C) gösteren resimler. Test bileşiği enjeksiyon düzeneği, temizleme işlemi boyunca kapalı kalır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 8. Doku odası ve çıkış ayarı. (A) Transwell membranının eşit genişlikte üç şerit halinde kesildikten sonraki boyutları. (B) Çıkış çoklu tüp desteği. (C) Doku odalarının yakınındaki boru adaptörleri ile muhafazanın dudağına yerleştirilmiş çıkış çoklu tüp desteği. (D) Doku odalarına bağlı çıkış borusu tertibatlarının resmi. (E) Kapaksız muhafazanın havadan görünümü. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 9. MRM'de bileşik enjeksiyonu. 5 mL'lik bir şırınga kullanarak enjeksiyon portundan MRM'ye bir test bileşiğinin enjekte edilmesi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
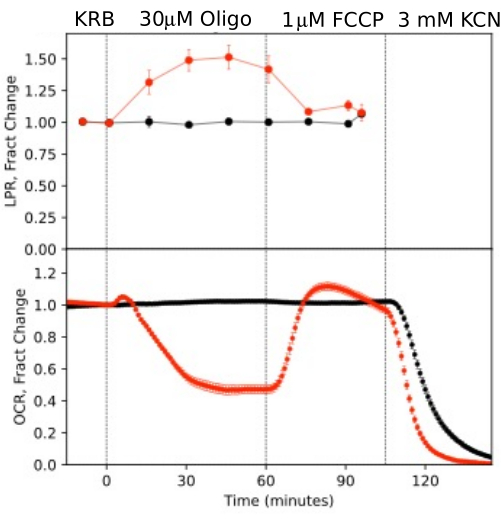
Şekil 10. Test bileşiklerine yanıt olarak OCR ve LPR eğrileri. Belirtildiği gibi test bileşiklerinin varlığına veya yokluğuna (kontrolüne) yanıt olarak farelerden (1 retina / kanal) izole edilen retina tarafından OCR ve LPR. Her eğri, tek bir deneyden 6 kopyanın ortalamasıdır (hata çubukları SE'dir; p-değerleri, her test aracısı için kararlı durum değerlerini önceki test aracısınınkiyle karşılaştıran eşleştirilmiş t-testleri gerçekleştirilerek hesaplanır). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
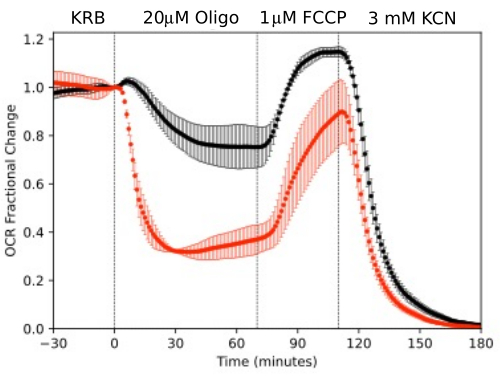
Şekil 11. OCR eğrileri. Farelerden (1 retina veya 2 RPE-koroid-sklera / kanal) izole edilen RPE-koroid-sklera ve retina ile OCR, belirtildiği gibi test bileşiklerine yanıt olarak paralel olarak ölçülür. Veriler, tek bir deneyden elde edilen kopyaların ortalamasıdır (RPE-koroid-sklera ve retina için sırasıyla n = 2 ve 4; p değerleri, her bir test ajanı için kararlı durum değerlerini önceki test ajanınınkiyle karşılaştıran eşleştirilmiş t-testleri gerçekleştirilerek hesaplanır). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
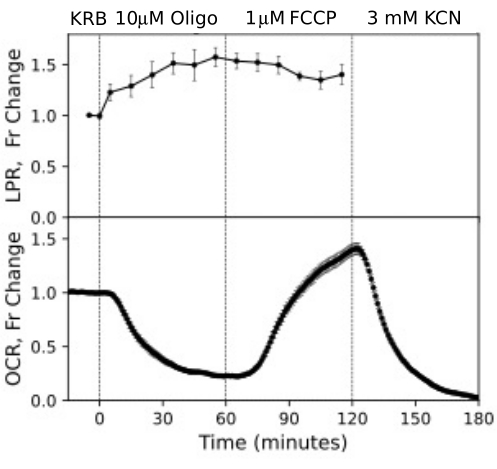
Şekil 12. RPE hücrelerinden OCR ve LPR eğrileri. Şeritler halinde kesilen ve perifüzyon odalarına yüklenen transwell membranlarına bağlanan RPE hücrelerinden OCR ve LPR. Veriler, tek bir deneyden elde edilen kopyaların ortalamasıdır (n = 3, 1.5 membran/kanal (360.000 hücre/kanal); p-değerleri, her bir test aracısı için kararlı durum değerlerini önceki test aracısınınkiyle karşılaştıran eşleştirilmiş t-testleri gerçekleştirilerek hesaplanır). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| DOKU/HÜCRE | Miktar/Kanal | AKIŞ HIZI: mL/dak |
| Retina (fare) | 1 | 0.025 |
| RPE-koroid-sklera (fare) | 2 | 0.02 |
| Transwell Membranları Üzerindeki RPE Hücreleri | 360.000 Hücre (4 x 1/3 filtre şeridi) | 0.016 |
Tablo 1. Farklı dokular için önerilen çalışma özellikleri.
Ek Şekil 1. Deneysel tasarımın grafiksel gösterimi. Test bileşiklerine maruz kalmanın zamanlaması ve bileşimi ve fraksiyon toplama zamanlaması. Konsantrasyon artışı (Conc Inc), uygulanacak konsantrasyondaki değişikliktir. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Ek Şekil 2. Başlangıçta kullanıcı arayüzü. PCM'ye yerleştirilen doku odalarındaki O 2'yi izleyen O2 algılama yazılımının başlangıç penceresinin kullanıcı arayüzü. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Ek Şekil 3. Deneme ayarları için kullanıcı arabirimi. Deneysel bilgilerin girilmesi (solda) ve çıkış fraksiyonlarının toplanması için zamanları seçmek (sağda) için kullanıcı arayüzü. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Ek Şekil 4. Enjeksiyon sayfasının kullanıcı arayüzü. İstenen test bileşiği konsantrasyonlarına ve MRM'de kalan hacme göre enjeksiyon hacimlerini hesaplayan enjeksiyon sayfası. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 1: Doku örneği hazırlama yöntemleri. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Biyoenerjetiklerin hücre fonksiyonunun tüm yönlerinde ve gözün çeşitli bileşenlerinin korunmasındaki önemi nedeniyle, regülasyonunu incelemek için yöntemlere kritik bir ihtiyaç vardır. Özellikle, nöral retina ve RPE, hem enerji üretimi hem de hücre içi ve hücreler arası sinyalleşme için metabolizmaya bağlıdır14,15,16,17. Yüksek oksidatif kapasiteleri nedeniyle, gözün izole edilmiş dokuları statik koşullar altında iyi korunmaz18,19 ve bu nedenle gözün izole bileşenlerinin incelenmesi, metabolik süreçleri hem koruyabilen hem de değerlendirebilen akış sistemleri gerektirir. Fluidics sistemi, çok çeşitli doku tiplerinden OCR ve LPR verileri üretmek için geliştirilmiştir ve bu yazıda optimal sonuçlar verdiği tespit edilen ayrıntılı protokolleri sunduk.
Akış sistemini kullanarak sağlam veriler üretmek için ana belirleyici, 39 °C'de CO2 bazlı ortamın/tamponun ön denkleştirilmesini içerir (perifüzyonatın deney sırasında gazı giderecek çözünmüş gazla aşırı doymamış olmasını sağlamak için). Özellikle, 4 °C'de depolanan ortam veya KRB tamponu, 37 °C'ye göre aşırı doymuş olacak ve ön dengeleme süreleri yetersizse deney sırasında gazı giderecektir. Ek olarak, doku odacıklarına yüklenen doku, yırtılma veya tam ayrılma nedeniyle dokunun uygun olmayan şekilde izole edilmesi veya düşük miktarda bikarbonat bazlı tampon içindeki dokunun çok uzun süre atmosferik havaya maruz bırakılması ile travmatize edilmemelidir. O2 algılamanın sıcaklık kontrolü, akış kararlılığı ve güvenilirliği çok az değişkenliğe sahiptir ve bu faktörler arıza oranına önemli ölçüde katkıda bulunmaz.
Cihaz, her rezervuar için dört doku odası olmak üzere iki rezervuardan perifüzyon ile beslenen aynı anda çalışan sekiz akış kanalına/doku odasına sahiptir. OCR'nin en doğru zaman rotalarını elde etmek için, kinetik eğriler, doku yüklü olmayan odalar tarafından düzeltilir. Bu nedenle, tipik bir deneysel protokol, üç doku odasından oluşan iki grubu içerecektir. Protokoller genel olarak iki kategoriye ayrılır: biri her iki taraftaki farklı test bileşiği protokolleridir (örneğin, MRM'nin bir tarafında ilaç/araç ve diğer tarafında sadece araç); ikincisi, MRM'nin her iki tarafında aynı test bileşiği enjeksiyon protokolüdür, ancak MRM'nin her iki tarafında farklı doku veya doku modelidir. Bu yazıda, oligomisin ve FCCP'nin retina üzerindeki etkileri, herhangi bir test bileşiğine maruz kalmayan dokular tarafından OCR ile karşılaştırıldı ve dokuya özgü davranışı belirlemek için iki doku aynı protokol ve koşullar altında eşzamanlı olarak değerlendirildi. İkincisi, bu çalışmada, aynı deneyde paralel olarak retinaya göre RPE-koroid-sklera tarafından artan dinamik metabolik hız aralığı gösterilerek gösterilmiştir. Diğer raporlar, OCR ve LPR üzerindeki değişen O2 seviyelerinin etkilerinin ölçülmesi ve yakıtların, ilaçların ve toksinlerin konsantrasyon bağımlılıklarının ölçülmesi de dahil olmak üzere daha geniş bir çalışma tasarımı yelpazesini tanımlamıştır20,21. Ek olarak, çıkış fraksiyonlarının analizini laktat ölçümü ve LPR'nin hesaplanması ile sınırlamış olsak da, hücrelerden çıkabilen hormonlar, nörotransmiterler, hücre sinyalleri ve metabolitler gibi çıkış fraksiyonlarındaki birden fazla bileşik ve bileşik sınıfı test edilirse, bir deneyin bilgi içeriği büyük ölçüde artar20,22, 23.
İzole retina veya RPE-koroid-skleranın yüklenmesi basittir ve izole edildikten sonra bu dokular forseps ile doku odalarının tepesine yerleştirilir ve frite batmasına izin verilir. Filtre eklerinde kültürlenen RPE hücreleri, kültürde 4-8 hafta sonra uygun polarizasyon ve RPE olgunluğu belirteçleri geliştirir. RPE olgunluğu ve polarizasyonu korunacaksa, transwell membranına bağlandıktan sonra canlı hücre analizi için RPE'nin çıkarılması mümkün değildir24. Perifüzyon odası, tampona daldırılırken bir neşter ile kesilen ve doku odalarına hızla yerleştirilen transwell membran şeritlerini barındırabilir. Kesme filtre şeritleri statik bir sisteme24 yerleştirilmiş olmasına rağmen, bu önemli hücre tiplerini değerlendirmek için başka bir akışkan yöntemi mevcut değildir. RPE hücrelerinin tepkileri, retina veya RPE-koroid-skleradan daha hızlı ve daha dinamikti, muhtemelen kısmen, membran eki üzerinde tek tabaka olarak yapılandırılmış RPE hücrelerinin hem apikal hem de bazal yönlerine anında erişim nedeniyle.
Verilerin gürültüye karşı en yüksek sinyale sahip olmasını sağlamada bir başka faktör, akış hızına göre perifüzyon odalarına yüklenen dokunun optimal oranını seçmektir. Akış hızına göre çok az doku, giriş ve çıkış arasında çok küçük ve güvenilir bir şekilde ölçülmesi zor olan çözünmüşO2 konsantrasyonu farkına neden olur. Buna karşılık, akış çok yavaşsa,O2 konsantrasyonu o kadar düşük olur ki, doku hipoksiden etkilenir. Bununla birlikte, gaz basıncıyla çalışan sıvı akışı, doğru OCR ve LPR ölçümleri için yalnızca az miktarda doku gerektiren 5 mL/dk'ya kadar akış hızlarında tutulabilir. Burada gösterilen deneylerde, bir retina, iki RPE-koroid-sklera veya 360.000 RPE hücresi için uygun olan yaklaşık 20 mL / dak / kanal kullanıldı. Dokunun enjekte edilen test bileşiğine maruz kalmasını geciktiren ve dağıtan sistem etkilerini en aza indirmek için, doku miktarının (ve akış hızının) odanın uygun boyutuyla eşleşmesi için birden fazla boyutta doku odası sağlanır.
Bu yazıda gösterilen analizlerden elde edilen veriler iki şekilde temsil edilmiştir: orana göre mutlak büyüklük veya kararlı duruma veya taban çizgisine göre kesirli değişiklikler. Odak noktası, test bileşiklerine verilen yanıtların ölçümünün gösterilmesiydi. Bununla birlikte, akışkan sistemi, genetik modifikasyonlar gibi perifüzyon analizinden önce doku tedavisinin etkilerini değerlendirmek ve karşılaştırmak için çok uygundur. Bir tedavinin kontrolden farklı olup olmadığının test edilmesi, tedavinin test bileşiklerinin normalleştirilmiş yanıtları üzerindeki etkileri analiz edilirse en sağlamdır. Analiz mutlak büyüklükler gerektiriyorsa, ön işleme tabi tutulan örneklerin analizlerinin istatistiksel gücü, değerlendirme ve kontrolleri aynı perifüzyon deneyinde gerçekleştirilirse en üst düzeye çıkarılır.
Karıştırıcı haricinde sıvı ile temas eden tüm parçalar üretici firma tarafından sarf malzemesi olarak temin edilmekte ve sterilize edilmektedir. Eksik temizlik ve kirlenmiş yüzeyler nedeniyle deneyler zaman zaman kaybolacağından bu parçalar tekrar kullanılmamalıdır. Kurulumun başlangıcındaki sistem sterildir. Bununla birlikte, MRM'ye ortam eklenir ve steril olmayan koşullar altında dokular odalara yüklenir. OCR'yi steril olan parçalarla bir araya getirilen, ancak deneyin kendisinin steril olmayan koşullar altında gerçekleştirildiği sistemde ölçtük. Bakterilerin ölçülebilir OCR'ye (yayınlanmamış sonuçlar) sahip olma noktasına kadar birikmesi yaklaşık 14 saat sürer. 10 saatten daha kısa protokoller kullanılırsa, bakteri birikimi ve bunlardan kaynaklanan etkiler ihmal edilebilir olacaktır.
Birçok araştırmacı, nispeten yüksek bir verime sahip tek katmanlı bir hücrenin statik inkübasyonu altında OCR'yi ölçmek için tasarlanmış araçlar kullanır25,26. Buna karşılık, bu yazıda test ettiğimiz ve tarif ettiğimiz akışkan alet, doku örneklerinde bulunan daha büyük difüzyon mesafeleri için kritik olan yeterliO2 iletimini sağlayarak dokuyu korur. Ek olarak, OCR ile paralel olarak birden fazla parametrenin değerlendirilmesine izin veren kesirleri toplayabilir ve bu da aralarındaki ilişkileri inceleme yeteneğini büyük ölçüde geliştirir. Son olarak, çözünmüş gaz konsantrasyonları (O2 ve CO2 gibi) kontrol edilebilir, bu da bikarbonat bazlı ortam ve tampon ile yapılan deneylerin süresini artırarak kullanıcınınO2'nin etkilerini incelemesini sağlar. Belirtmek gerekir ki, her iki metodoloji için de bir sınırlama, diğer perifüzyon sistemlerinin sahip olduğu bir işlevsellikolan test bileşiklerinin yıkanmasını inceleyememektir 4,27,28. Optimal analiz yöntemini belirlerken göz önünde bulundurulması gereken bir diğer husus, akışkan sistemlerin statik sistemlere göre daha fazla ortam ve test bileşiği kullanmasıdır. Mevcut akışkan sistemleri ile ekstra masraf, sistemin kullanılabileceği düşük akış hızları nedeniyle en aza indirilmiştir.
Genel olarak, yeni bir akış/değerlendirme aracıyla deneyler yapmak için protokollerin ayrıntılı bir açıklaması açıklanmaktadır. Retina ve RPE-koroid-sklera ile elde edilen veriler, kullanımı çok daha zor olan (ve kolayca bulunamayan) sistemlerle elde edilen önceki sonuçları özetledi. Ayrıca sistemin, hücrelerin kırılganlığı nedeniyle daha önce akış sistemleriyle analiz edilmemiş çok önemli bir hücresel model olan transwell membranlarına bağlı RPE hücrelerini koruyabildiğini ve değerlendirebildiğini gösterdi. Protokolün ana bölümleri, 75 dakikalık bir kurulum süresi, ardından 90 dakikalık bir dengeleme süresi ve akışkan sistemlerinin işletiminde uzmanlaşmamış laboratuvarlar tarafından rutin kullanıma uygun hale getirilen deneysel protokolden oluşur. Dokunun test bileşiklerine akut tepkisini ölçmeye odaklanmış olsak da, sistem, hayvan modelleri veya genetiği değiştirilmiş veya test tedavileri/koşulları uygulanmış hücre modelleri gibi çeşitli kaynaklardan alınan dokuları karşılaştırmak için çok uygundur. Ek olarak, çıkış fraksiyonları üzerinde gerçekleştirilebilecek testlerin kapsamı geniş kapsamlıdır ve metabolitleri, hücre sinyal moleküllerini ve salgılanan hormonları/nörotransmiterleri ve ayrıca fraksiyonlar ve doku üzerinde kütle spektrometrisi ile oluşturulan çok bileşenli analizleri içerir.
Açıklamalar
I.R.S., M.G. ve K.B.'nin bu çalışmada açıklanan BaroFuse perifüzyon sisteminin üreticisi/distribütörü olan EnTox Sciences, Inc. (Mercer Island, WA) ile finansal bağları vardır. Diğer tüm yazarlar herhangi bir çıkar çatışması beyan etmezler.
Teşekkürler
Bu araştırma, Ulusal Sağlık Enstitüleri (R01 GM148741 IRS), U01 EY034591, R01 EY034364, BrightFocus Vakfı, Körlüğü Önleme Araştırmaları (JRC) ve R01 EY006641, R01 EY017863 ve R21 EY032597 (JBH) tarafından finanse edilmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| BIOLOGICAL SAMPLES | |||
| C57BL/6J mice | Envigo Harlan (Indianapolis, IN) | N/A | |
| REAGENTS | |||
| FCCP | Sigma-Aldrich | C2920L9795 | |
| Glucose | Sigma-Aldrich | G8270G | |
| KCN | Sigma-Aldrich | 60178 | |
| Lactate | MilliporeSigma | L6661 | |
| Oliigomycin A | Sigma-Aldrich | 75351L9795 | |
| CELL CULTURE AND TISSUE HARVESTING | |||
| Beuthanasia-D | Schering-Plough Animal Health Corp., Union, NJ | N/A | |
| Bovine serum albumin | Sigma-Aldrich | A3059 | |
| Euthasol, 390 mg/ml sodium pentobarbital | Virbac | RXEUTHASOL | |
| Fetal bovine serum | Sigma-Aldrich | 12303C | |
| Hank’s Buffered Salt Solution | GIBCO | 14065056 | |
| Krebs Ringer Bicarbonate (KRB) | Thermo Fisher Scientific | J67795L9795 | |
| Matrigel | ThermoFisher | #CB-40230 | |
| Penicillin-streptomycin | ThermoFisher Scientific | 15140122 | |
| ROCKi | Selleck Chemicals | Y-27632 | |
| Trypsin-EDTA | ThermoFisher | #25-200-072 | |
| SUPPLIES | |||
| Gas Cylinders: 21% O2/5% CO2/balance N2 | Praxair Distribution, Inc | N/A | |
| Transwell filters | MilliporeSigma | 3470 | |
| COMMERCIAL ASSAYS | |||
| Amplex Red Glucose/Glucose Oxidase Assay Kit | ThermoFisher | A22189 | |
| Glucose Oxidase from Aerococcus viridans | Invitrogen (Carlsbad, CA) | A22189L9795 | |
| Lactate Oxidase | Sigma-Aldrich | L9795 | |
| EQUIPMENT | |||
| BaroFuse Multi-Channel Perifusion system | EnTox Sciences, Inc (Mercer Island, WA | Model 001-08 | |
| Synergy 4 Fluorometer | BioTek (Winooski, VT) | S4MLFPTA |
Referanslar
- Lacy, P. E., Walker, M. M., Fink, C. J. Perifusion of isolated rat islets in vitro: Participation of the microtubular system in the biphasic release of insulin. Diabetes. 21 (10), 987-998 (1972).
- Doliba, N. M., et al. Metabolic and ionic coupling factors in amino acid-stimulated insulin release in pancreatic beta-HC9 cells. American Journal of Physiology. Endocrinology and Metabolism. 292 (6), E1507-E1519 (2007).
- Sweet, I. R., et al. Regulation of ATP/ADP in pancreatic islets. Diabetes. 53 (2), 401-409 (2004).
- Chertov, A. O., et al. Roles of glucose in photoreceptor survival. The Journal of Biological Chemistry. 286 (40), 34700-34711 (2011).
- Kooragayala, K., et al. Quantification of Oxygen Consumption in Retina Ex Vivo Demonstrates Limited Reserve Capacity of Photoreceptor Mitochondria. Investigative Ophthalmology & Visual Science. 56 (13), 8428-8436 (2015).
- Bisbach, C. M., et al. Succinate Can Shuttle Reducing Power from the Hypoxic Retina to the O2-Rich Pigment Epithelium. Cell Reports. 31 (5), 107606(2020).
- Du, J., et al. Inhibition of mitochondrial pyruvate transport by zaprinast causes massive accumulation of aspartate at the expense of glutamate in the retina. The Journal of Biological Chemistry. 288 (50), 36129-36140 (2013).
- Hass, D. T., et al. Succinate metabolism in the retinal pigment epithelium uncouples respiration from ATP synthesis. Cell Reports. 39 (10), 110917(2022).
- Kamat, V., et al. Fluidics system for resolving concentration-dependent effects of dissolved gases on tissue metabolism. Elife. 10, e66716(2021).
- Stryer, L. Biochemistry. , 4th edn, Freeman and Company, New York. (1995).
- Gu, X., Ma, Y., Liu, Y., Wan, Q. Measurement of mitochondrial respiration in adherent cells by Seahorse XF96 Cell Mito Stress Test. STAR Protocols. 2 (1), 100245(2021).
- Engel, A. L., et al. Extracellular matrix dysfunction in Sorsby patient-derived retinal pigment epithelium. Experimental Eye Research. 215, 108899(2022).
- Zhang, R., et al. Inhibition of Mitochondrial Respiration Impairs Nutrient Consumption and Metabolite Transport in Human Retinal Pigment Epithelium. Journal of Proteome Research. 20 (1), 909-922 (2021).
- Hurley, J. B. Retina Metabolism and Metabolism in the Pigmented Epithelium: A Busy Intersection. Annual Review of Vision Science. 7, 665-692 (2021).
- Xiao, J., et al. Autophagy activation and photoreceptor survival in retinal detachment. Experimental Eye Research. 205, 108492(2021).
- Okawa, H., Sampath, A. P., Laughlin, S. B., Fain, G. L. ATP consumption by mammalian rod photoreceptors in darkness and in light. Current Biology. 18 (24), 1917-1921 (2008).
- Lakkaraju, A., et al. The cell biology of the retinal pigment epithelium. Progress in Retinal and Eye Research. , 100846(2020).
- Yu, J., et al. Emerging strategies of engineering retinal organoids and organoid-on-a-chip in modeling intraocular drug delivery: Current progress and future perspectives. Advanced Drug Delivery Reviews. 197, 114842(2023).
- Arjamaa, O., Nikinmaa, M. Oxygen-dependent diseases in the retina: role of hypoxia-inducible factors. Experimental Eye Research. 83 (3), 473-483 (2006).
- Kamat, V., et al. A Versatile Multi-Channel Fluidics System for the Maintenance and Real-Time Metabolic and Functional Assessment of Tissue or Cells. Cell Reports Methods. In Press. , (2023).
- Neal, A., et al. Quantification of Low-Level Drug Effects Using Real-Time, in vitro Measurement of Oxygen Consumption Rate. Toxicological Sciences. 148 (2), 594-602 (2015).
- Jung, S. R., et al. Reduced cytochrome C is an essential regulator of sustained insulin secretion by pancreatic islets. The Journal of Biological Chemistry. 286 (20), 17422-17434 (2011).
- Rountree, A. M., et al. Control of insulin secretion by cytochrome C and calcium signaling in islets with impaired metabolism. The Journal of Biological Chemistry. 289 (27), 19110-19119 (2014).
- Calton, M. A., Beaulieu, M. O., Benchorin, G., Vollrath, D. Method for measuring extracellular flux from intact polarized epithelial monolayers. Molecular Vision. 24, 425-433 (2018).
- Jarrett, S. G., Rohrer, B., Perron, N. R., Beeson, C., Boulton, M. E. Assessment of mitochondrial damage in retinal cells and tissues using quantitative polymerase chain reaction for mitochondrial DNA damage and extracellular flux assay for mitochondrial respiration activity. Methods in Molecular Biology. 935, 227-243 (2013).
- Perron, N. R., Beeson, C., Rohrer, B. Early alterations in mitochondrial reserve capacity; a means to predict subsequent photoreceptor cell death. Journal of Bioenergetics and Biomembranes. 45 (1-2), 101-109 (2013).
- Cabrera, O., et al. high-throughput assays for evaluation of human pancreatic islet function. Cell Transplantation. 16 (10), 1039-1048 (2008).
- Doliba, N. M., Qin, W., Vinogradov, S. A., Wilson, D. F., Matschinsky, F. M. Palmitic acid acutely inhibits acetylcholine- but not GLP-1-stimulated insulin secretion in mouse pancreatic islets. American Journal of Physiology. Endocrinology and Metabolism. 299 (3), E475-E485 (2010).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır