Method Article
Mantenimento e valutazione di vari tipi di tessuti e cellule dell'occhio utilizzando un nuovo sistema di fluidica senza pompa
In questo articolo
Riepilogo
L'analisi in tempo reale dei tessuti vivi fornisce importanti dati funzionali e meccanicistici. Questo documento descrive i protocolli e le variabili critiche per garantire una generazione accurata e riproducibile di dati da parte di un nuovo sistema fluidico multicanale senza pompe che mantiene e valuta un'ampia gamma di modelli di tessuti e cellule.
Abstract
Molti modelli in vitro utilizzati per studiare la funzione tissutale e la biologia cellulare richiedono un flusso di terreni per fornire un'adeguata ossigenazione e condizioni cellulari ottimali necessarie per il mantenimento della funzione e della vitalità. A tal fine, abbiamo sviluppato un sistema di coltura a flusso multicanale per mantenere i tessuti e le cellule in coltura e valutare continuamente la funzione e la vitalità mediante sensori in linea e/o raccolta di frazioni di deflusso. Il sistema combina il rilevamento ottico continuo a 8 canali del tasso di consumo di ossigeno con un collettore di frazioni incorporato per misurare simultaneamente i tassi di produzione di metaboliti e secrezione ormonale. Sebbene sia in grado di mantenere e valutare un'ampia gamma di modelli di tessuti e cellule, tra cui isole, muscoli e ipotalamo, qui descriviamo i suoi principi di funzionamento e i preparati/protocolli sperimentali che abbiamo utilizzato per studiare la regolazione bioenergetica della retina isolata del topo, dell'epitelio pigmentato retinico del topo (RPE)-coroide-sclera e delle cellule RPE umane in coltura. Le innovazioni nella progettazione del sistema, come il flusso del fluido senza pompa, hanno prodotto un funzionamento notevolmente semplificato di un sistema di flusso multicanale. Vengono mostrati video e immagini che illustrano come assemblare, preparare lo strumento per un esperimento e caricare i diversi modelli di tessuto/cellula nelle camere di perifusione. Inoltre, vengono delineate e discusse le linee guida per la selezione delle condizioni per gli esperimenti specifici del protocollo e del tessuto, compresa l'impostazione del corretto rapporto portata/tessuto per ottenere condizioni di coltura coerenti e stabili e determinazioni accurate dei tassi di consumo e produzione. La combinazione di mantenimento ottimale dei tessuti e valutazione in tempo reale di più parametri produce set di dati altamente informativi che avranno una grande utilità per la ricerca nella fisiologia dell'occhio e la scoperta di farmaci per il trattamento della vista compromessa.
Introduzione
I sistemi di perifusione hanno una lunga storia nelle scienze della vita. In particolare, per lo studio della funzione secretoria da parte delle isole, sono stati utilizzati per caratterizzare la cinetica della secrezione di insulina in risposta ai secretagoghi1. Oltre a raccogliere le frazioni di deflusso per il successivo dosaggio di ormoni e metaboliti, sono stati incorporati sensori in tempo reale, principalmente per la rilevazione del consumo di ossigeno 2,3,4. Gli sforzi diffusi per comprendere meglio i meccanismi che mediano le malattie dell'occhio sono stati limitati dalla mancanza di metodi fisiologicamente rilevanti per valutare la regolazione metabolica e la disregolazione dei vari componenti isolati dell'occhio, tra cui la retina, l'epiteliale pigmentato retinico (RPE)-coroide-sclera e le cellule RPE in coltura. I sistemi statici progettati per le cellule in coltura sono stati adattati per il tessuto5, ma il tessuto richiede un flusso per un'adeguata ossigenazione. I sistemi di flusso sono riusciti a misurare in modo accurato e riproducibile le risposte in tempo reale del tasso di consumo di ossigeno (OCR) da parte della retina e dell'RPE-coroide-sclera, e i tessuti rimangono metabolicamente stabili per più di 8 ore, consentendo protocolli altamente informativi che coinvolgono più composti di prova 4,6,7,8,9 . Ciononostante, il funzionamento dei sistemi fluidici ha storicamente richiesto un apparato su misura e personale tecnico formato in metodologie non standardizzate. Tali sistemi non sono stati adottati come metodologia standard nella maggior parte dei laboratori. Il BaroFuse è un sistema fluidico di nuova concezione che non si basa su pompe, ma piuttosto sulla pressione del gas per guidare il flusso attraverso più canali e camere tissutali (Figura 1). Ogni canale viene continuamente monitorato per l'OCR e il deflusso viene raccolto con un raccoglitore di frazioni a piastre per la successiva analisi del contenuto. È importante sottolineare che le camere di perifusione tissutale per lo strumento sono progettate per ospitare tessuti di varie geometrie e dimensioni.
Il cuore dello strumento è il sistema fluidico, in cui il flusso viene guidato da un serbatoio sigillato e pressurizzato attraverso un tubo di piccolo diametro interno (ID) (che contribuisce alla resistenza al flusso più significativa nel circuito del fluido) fino alle camere di vetro che ospitano il tessuto. La pressione al modulo serbatoio del fluido (MRM) è fornita da regolatori di bassa e alta pressione collegati a una bombola di gas contenente una miscela di gas (tipicamente 21% O 2, 5% CO 2, bilanciamento N2 ) e il serbatoio è sigillato dall'alto dal modulo camera di perifusione (PCM) che contiene i gruppi camera tissutale (TCA). La portata è controllata dalla lunghezza e dall'ID dei tubi di resistenza e dall'impostazione della pressione di un regolatore di bassa pressione. I tubi di deflusso collegati alla parte superiore delle camere tissutali trasportano il fluido in un recipiente di scarto (che viene continuamente pesato per la determinazione automatica della portata) o nei pozzetti di una piastra a 96 pozzetti controllata dal raccoglitore di frazioni. Il sistema di rilevamento dell'O 2 misura la durata di un colorante sensibile all'O2 dipinto all'interno di ciascuna delle camere tissutali in vetro a valle del tessuto. Queste informazioni vengono quindi utilizzate per calcolare continuamente l'OCR. L'intero sistema fluidico risiede in un involucro a temperatura controllata e il serbatoio del gas, il collettore di frazioni e il computer sono i componenti principali dello strumento (Figura 2A). Infine, il software che esegue lo strumento serve a controllarne il funzionamento (compresa la preparazione e la temporizzazione dei composti di prova iniettati, il sistema di misurazione del flusso e la temporizzazione del collettore di frazioni), nonché l'elaborazione e la rappresentazione grafica dei dati OCR e di altre misurazioni supplementari.
In questo articolo descriviamo i protocolli per l'utilizzo del sistema fluidico per perifondere e valutare l'OCR e il tasso di produzione di lattato (LPR) per vari componenti isolati dell'occhio. L'LPR è un parametro che riflette il tasso glicolitico che è altamente complementare all'OCR, dove la coppia rappresenta i due rami principali della generazione di energia dai carboidrati nella cellula10. Poiché la preparazione del tessuto e il suo caricamento nelle camere tissutali si apprendono meglio guardando la procedura, il video aiuterà a illustrare molti dei passaggi critici che vengono eseguiti durante l'impostazione e il funzionamento che non sono facilmente trasparenti dal solo testo.
La descrizione del protocollo è suddivisa in 8 sezioni che corrispondono a diverse fasi dell'esperimento (Figura 2B): 1. preparazione pre-sperimentale; 2. preparazione/equilibratura del perifusato; 3. messa a punto dello strumento; 4. equilibrio tissutale; 5. protocollo sperimentale; 6. rottura dello strumento; 7. trattamento dei dati; e 8. saggi delle frazioni di deflusso.
Protocollo
Tutte le procedure per la raccolta di tessuti da ratti e topi sono state approvate dal Comitato Istituzionale per la Cura e l'Uso degli Animali dell'Università di Washington.
1. Preparazione pre-sperimentale
NOTA: le seguenti attività vengono completate almeno un giorno prima dell'esperimento.
- Progettazione del protocollo sperimentale
- Assegnazione del posizionamento del tessuto nei canali: scegliere il modello di tessuto o cellula da posizionare in 3 dei 4 canali su ciascun lato dell'MRM. Una camera tissutale su ciascun lato viene eseguita senza tessuto da utilizzare per la correzione basale.
- Disporre i campioni utilizzando uno dei due design tipici: diversi protocolli di composti di prova su ciascun lato (ad esempio, i canali su un lato dell'MRM ricevono i composti di prova mentre i canali sull'altro lato fungono da controllo); stesso protocollo di iniezione del composto in esame su entrambi i lati dell'MRM, ma tessuti o modello tissutale diversi rispetto al controllo su entrambi i lati dell'MRM.
- Selezione della portata e della quantità di tessuto per una misurazione OCR ottimale: regolare la portata fino a quando la variazione del rapporto di durata per 100 è di circa 3.
NOTA: Le quantità tipiche di tessuto e le corrispondenti portate sono mostrate nella Tabella 1 per i componenti dell'occhio, dove lo strumento funziona meglio a velocità di flusso comprese tra 6-80 μL/min/canale. - Calcolo del volume di terreno/buffer richiesto: calcolare il volume di terreno da aggiungere a ciascun inserto di MRM all'inizio dell'esperimento come
VolumeMRM = 30 mL + Durata del protocollo (in min) x Portata (in mL/min) x 4 canali (Eq.1)
Ad esempio, a 0,01 mL/min, un MRM a volume iniziale da 60 mL consentirà un protocollo di 12,5 ore (in cui 30 mL saranno esauriti, mentre 30 mL saranno rimanenti), mentre a 0,04 mL/min, 90 mL diMRM a volume iniziale consentiranno un protocollo di 6 ore (con 30 mL rimanenti). - Protocollo di iniezione dei composti in esame: selezionare i composti in esame da valutare, la concentrazione da testare (in genere scelta per ottenere una risposta prossima alla massima o come dipendenza dalla concentrazione) e la durata dell'esposizione. Considerare la solubilità e preparare le scorte nel solvente desiderato come acqua, DMSO o etanolo.
- Selezionare la tempistica delle iniezioni e delle iniezioni successive in modo che la risposta raggiunga uno stato stazionario prima di aggiungere un agente successivo. Quando si ripetono i protocolli, abbinare la tempistica delle iniezioni in modo da poter calcolare la media di più cicli temporali.
NOTA: I composti qui utilizzati provengono da un precedente stress test mitocondriale (Mito) 11 e sia l'oligomicina che il cianuro di carbonile 4-(trifluorometossi)fenilidrazone (FCCP) richiedono DMSO sia nelle soluzioni madri, sia nel perifusibile finale. - Tempi di campionamento in uscita: selezionare gli intervalli di raccolta delle frazioni desiderati (da 1 a 60 min/campione), in cui vengono scelte frequenze di campionamento più elevate per cambiamenti rapidi e intervalli di tempo più lunghi man mano che ci si avvicina allo stato stazionario. Utilizzare volumi di pozzetto adeguati (da 0,3 a 1,5 mL) per evitare il trabocco durante l'intervallo di campionamento (scegliere volumi superiori alla portata x l'intervallo di tempo).
NOTA: I tempi di campionamento variano a seconda della scelta del protocollo, ma per un test da sforzo Mito, abbiamo comunemente utilizzato intervalli di 5 minuti durante il basale e intervalli di 15 minuti durante le iniezioni (-15, -10, -5, 0, 15, 30, 45, 60, 75, 90, 105, dove ogni volta è l'inizio dell'intervallo di campionamento). - Immettere i valori selezionati per i composti di prova e la raccolta delle frazioni descritti in precedenza nell'interfaccia utente (UI), che genera rappresentazioni grafiche di queste informazioni. Esportare e diffondere file per la valutazione e le discussioni di gruppo (Figura 1 supplementare).
- Disporre gli accessori e le parti di consumo
- Indicare i materiali di consumo forniti e preconfezionati in modo asettico dal produttore, che includono: TCA (confezione da 8), tubi di deflusso (confezione da 8), tubi per iniezione del composto in esame (2), pinze, morsetti per tubi (3), MRM, inserti MRM (2), ancorette (2) e gruppo tubi di spurgo (collocati in un armadio di sicurezza biologica).
- Non riutilizzare le parti monouso che entrano in contatto con liquidi, poiché ciò comporterebbe un aumento del fallimento sperimentale. Riutilizza le pinze e le barre di agitazione pulendole e sterilizzandole in autoclave tra un esperimento e l'altro.
2. Preparazione ed equilibratura del perifusato (Tempo: 30 min escluso il tempo di incubazione)
- Preparare il terreno o il tampone di bicarbonato Krebs-Ringer (KRB) il giorno prima in base ai calcoli dell'equazione 1, in genere 200 mL, quindi incubare per una notte in un incubatore a 39 °C/5% di CO2 in matracci per colture tissutali T225 con non più di 90 mL in ciascun pallone.
- Se si utilizza KRB o terreni preparati in commercio (riscaldati a temperatura ambiente), preparare il perifosfato la mattina dell'esperimento e metterlo nell'incubatore al 5% di CO2 per almeno 1 ora. Preparare tutte le soluzioni in modo asettico.
NOTA: Tutti i liquidi e le parti del sistema fluidico che entrano in contatto con il liquido sono sterili all'inizio dell'esperimento. Tuttavia, l'assemblaggio del sistema e il caricamento del tessuto vengono eseguiti all'aperto.
3. Equilibratura della temperatura e del gas disciolto per impostare lo strumento (Tempo: 75 min)
- Collegamento di gruppi di tubi alla gestione record di messaggistica
- Posizionare l'MRM e un pacchetto fluidico sul banco accanto allo strumento. Assicurarsi che i morsetti per tubi (3), le barre di ancoraggio (2) e le pinze siano già sul vassoio degli attrezzi.
- Posizionare un inserto di Gestione messaggi di messaggistica inutilizzato con una barra di agitazione su ciascun lato della gestione messaggi di messaggistica (vedere la Figura 3).
- Collegare i TCA alle porte di iniezione su entrambe le estremità dell'MRM in modo che l'estremità del tubo sia posizionata direttamente sopra l'ancoretta. Assicurarsi che il più lungo dei due gruppi di iniezione del composto di prova si trovi sul retro della gestione record di messaggistica.
- Quindi, collegare la linea di alimentazione dell'afflusso di gas e il gruppo del tubo di spurgo rispettivamente alle porte libere posteriore e anteriore (vedere la Figura 4A).
- Posizionamento dei gruppi MRM/tubi nell'involucro
- Posizionare l'MRM (con i gruppi di tubi collegati) nel riscaldatore MRM (Figura 4B).
- Posizionare i quattro gruppi di tubi nelle scanalature delle pareti alla base dell'involucro (due per lato) in modo che sporgano verso l'esterno dell'involucro una volta posizionato l'involucro centrale.
- Fissare l'MRM tra i morsetti serrando le due ruote sul supporto del rilevatore.
- Far passare il gruppo di iniezione del composto di prova più lungo che sporge dal retro della custodia attraverso le due guide delle provette sul lato della custodia in modo che l'apertura delle provette sia rivolta in avanti (Figura 4C).
- Clamp ciascuno dei gruppi chiusi di iniezione del composto di prova.
- Montaggio dell'involucro e attivazione dei termoregolatori
- Portare la ciabatta che alimenta tutti i dispositivi elettrici all'interno dell'involucro in posizione ON. La ventola sul supporto del rilevatore si accenderà e il regolatore di temperatura MRM dovrebbe accendersi visualizzando un valore impostato di 38 °C (Figura 5).
- Accendere gli agitatori a 70 giri/min utilizzando l'interfaccia utente per assicurarsi che le barre di agitazione ruotino senza intoppi. Una volta osservata la corretta agitazione, spegnere gli agitatori.
- Posizionare la sezione centrale dell'involucro sopra la base.
- Collegare il cavo sulla sezione centrale dell'involucro al cavo dalla scatola elettrica per inserire l'alimentazione all'interruttore a leva del regolatore della temperatura ambiente e fornire alimentazione al riscaldatore a temperatura ambiente.
- Posizionare il coperchio sull'involucro e il display del regolatore di temperatura superiore (il regolatore della temperatura ambiente) si illuminerà e leggerà 36 °C. Avviare un timer per 30 minuti, il tempo necessario al riscaldatore MRM per raggiungere la temperatura impostata.
- Inserimento dei TCA nel PCM
- Utilizzare lo strumento di inserimento TCA per inserire ciascuno degli 8 TCA nei fori PCM premendo con decisione sull'adattatore con la faccia dello strumento di inserimento fino a quando la parte superiore del manicotto del tubo avvolto attorno alla camera del tessuto tocca la superficie che circoscrive i fori nel PCM.
- Inserire completamente un TCA prima di inserire quello successivo. Mettere da parte il PCM parzialmente assemblato accanto al supporto PCM e alle 6 viti.
NOTA: L'inserimento incompleto di un TCA impedirà allo spazio di testa di raggiungere il set point di pressione e il perifuso non fluirà.
- Riempimento dei due inserti nell'MRM con perifusato pre-equilibrato
- A tale scopo, 30 minuti dopo che l'involucro è stato assemblato e l'MRM ha raggiunto la temperatura, trasferire il perifusibile pre-equilibrato nell'inserto MRM preriscaldato erogando delicatamente il liquido lungo i lati utilizzando una pipetta da 50 mL.
NOTA: Questi passaggi, così come quelli descritti nella sezione 3.6, devono essere eseguiti immediatamente per evitare il trasferimento di gas tra il perifusibile nell'MRM e l'atmosfera.
- A tale scopo, 30 minuti dopo che l'involucro è stato assemblato e l'MRM ha raggiunto la temperatura, trasferire il perifusibile pre-equilibrato nell'inserto MRM preriscaldato erogando delicatamente il liquido lungo i lati utilizzando una pipetta da 50 mL.
- Assemblaggio dell'MRM/PCM per creare una tenuta stagna al gas e posizionamento del rivelatore di O2
- Posizionare il PCM sull'MRM inserendo i tubi di resistenza dei TCA che emanano dalla parte inferiore del PCM negli inserti MRM, 4 su ciascun lato del divisore MRM. Orientare il PCM in modo che le camere tissutali possano appoggiarsi contro il rilevatore di O2 una volta posizionato.
- Fissare il PCM e il supporto PCM con le 6 viti utilizzando il cacciavite elettrico.
- Fissare i TCA all'interno delle alette di supporto del PCM con l'elastico in dotazione allungandolo attorno alle alette del PCM a livello delle guarnizioni in gomma (Figura 6).
- Posizionare il rilevatore O2 sul supporto del rilevatore in modo che la sua faccia poggi contro le alette del PCM. Verificare che le coppie LED/fotorivelatore siano allineate con il colorante sensibile all'O2 nelle camere dei tessuti. Se necessario, regolare le guide laterali del rilevatore di O 2 dopo aver allentato le viti di fermo sul lato del supporto del rilevatore di O2.
- Posizionare il coperchio sopra l'involucro.
- Equilibrare il gas nello spazio di testa nell'MRM con il perifosfato
- Con la valvola ad alta pressione completamente fissata e chiusa, aprire la valvola del serbatoio del gas ruotando la valvola della bombola sulla parte superiore del serbatoio in senso antiorario.
- Regolare il regolatore di alta pressione a una pressione di 10 psi utilizzando la manopola sul regolatore.
- Pressurizzare l'MRM impostando il regolatore di bassa pressione su 1,0 psi (Figura 7A).
- Sbloccate il tubo di spurgo (Figura 7B) per consentire al gas del serbatoio di sostituire l'aria nello spazio di testa MRM (gli iniettori del composto di prova rimangono bloccati) per 15 minuti. Confermare il flusso di gas immergendo l'estremità del tubo di spurgo in un bicchiere d'acqua per osservare il gorgogliamento.
- Una volta confermato il flusso, avviare il rilevatore di O2 come descritto di seguito nella sezione 3.8.
- Dopo 15 minuti, accendere l'agitatore a 70 giri/min e lasciare in funzione per il resto dell'esperimento. Dopo altri 15 minuti, clamp il gruppo del tubo di spurgo (Figura 7C).
- Abbassare la pressione sul regolatore di bassa pressione alla pressione di esercizio che raggiunge la portata del liquido desiderata (come specificato dal pacco sperimentale, di solito tra circa 0,5-0,7 psi). Se la portata è superiore a 20 μL/min, impostare temporaneamente la pressione a 0,3 psi per dare il tempo di caricare il tessuto senza che le camere trabocchino. Questo non è necessario se il tessuto viene caricato entro 15 minuti dal posizionamento della pinza.
NOTA: Non lasciare che il tampone scorra all'esterno della camera del tessuto, poiché il fluido può interferire con il rilevamento dell'O2 .
- Avvio del rilevatore di O2
- Attivare il software del rilevatore O2 sul laptop facendo clic sull'icona denominata Rilevatore di ossigeno.
- Una volta aperto il programma (Figura 2 supplementare), verificare che sia selezionata la porta COM corretta. Se necessario, la porta COM può essere identificata scollegando e collegando il rilevatore O2 dal computer in modo che venga visualizzato il numero della porta. Se la porta COM viene scollegata mentre l'applicazione è in esecuzione, l'applicazione deve essere chiusa e riaperta prima dell'uso.
- Fare clic su Start , quindi su Registra (e salvare i dati nella cartella di backup). Quindi, fai clic su Grafico.
- Modificare il valore medio in basso a sinistra del grafico della durata in 5 (che indica al programma di calcolare una media mobile con 5 punti consecutivi). Dopo che è trascorso un minuto e il primo punto dati viene visualizzato nella schermata grafica, fare clic su Scala automatica.
4. Periodo di carico ed equilibrio dei tessuti (Tempo: 90 min)
- Posizionamento delle fritte nelle camere dei tessuti
- Rimuovere il coperchio e le sezioni centrali dell'involucro.
- Dopo che il perifusato nelle camere tissutali è salito sopra la parte superiore della fritta preposizionata, spingere la fritta verso il basso con la stecca della fritta picchiettando leggermente sulla parte superiore della fritta per rimuovere eventuali bolle d'aria che si sono formate sotto o all'interno della fritta.
- Posizionare le fritte a circa 0.25 pollici sopra il fondo della camera del tessuto.
- Caricamento del tessuto nelle camere tissutali
- Una volta che il livello del terreno è di 0,5 pollici dall'alto, caricare il tessuto nella camera.
- Caricamento della retina o della scorza coroide RPE: Raccogliere la retina o la sclera coroide RPE come descritto al punto 6. Per caricare il tessuto, utilizzare una pinza a punta fine per posizionare delicatamente il tessuto in ciascuna camera, facendo attenzione a non piegare il tessuto, mentre si utilizza una salvietta per tessuti per evitare che il liquido dalla camera del tessuto goccioli sul sensore O2 . Osserva il tessuto che affonda verso e sulla fritta.
NOTA: Tra il momento del prelievo del tessuto e il caricamento del tessuto nelle camere, assicurarsi che il trauma al tessuto sia evitato non lasciando il tessuto in un tampone/terreno a base di bicarbonato fuori dall'incubatrice per più di 10 minuti e assicurandosi che il tessuto sia immerso in un tampone/terreno sufficiente (almeno 1 ml/10 mg di tessuto) per evitare che il tessuto diventi ipossico e prevenga l'esposizione all'aria. - Caricamento delle cellule RPE sulle membrane del transwell: Preparare le cellule RPE come descritto in precedenza 12 e nel file supplementare 1. Cellule di passaggio che utilizzano tripsina-EDTA allo 0,25% e seme su filtri di polietilene tereftalato (inserti per colture cellulari, dimensione dei pori 0,4 mm) ad un minimo di 2,0 x 105 cellule/cm2. Il giorno dell'esperimento, tagliare le membrane in tre strisce di uguale larghezza e caricare con una pinza nelle camere tissutali (vedi Figura 8A).
- Collegamento dei gruppi di tubi di deflusso alle camere dei tessuti
- Rimuovere i gruppi di tubi di deflusso dall'imballaggio e posizionare il separatore dei tubi di deflusso sul bordo della sezione centrale dell'involucro in modo che gli adattatori dei tubi di deflusso si trovino all'interno dell'involucro (Figura 8B,C).
- Facendo attenzione a non spingere troppo forte sui TCA (altrimenti si staccheranno dall'MRM), collegare gli adattatori dei tubi di deflusso sulla parte superiore dei TCA delle camere tissutali (Figura 8D). Riposizionare la parte centrale dell'involucro e ricollegare il cavo di controllo della temperatura ambiente.
- Prima di sostituire il coperchio dell'involucro, verificare che i componenti del sistema fluidico all'interno dell'involucro, inclusi il rivelatore di O2 , il PCM, le camere tissutali, i tubi di deflusso, l'MRM e il riscaldatore, siano tutti posizionati correttamente come mostrato nella Figura 8E.
- Riposizionare il coperchio dell'involucro. Far passare gli otto tubi di deflusso attraverso il braccio di guida del collettore di frazioni.
- Attivazione del raccoglitore di frazioni
- Assicurarsi che il raccoglitore di frazioni sia centrato rispetto alla parete destra dell'involucro e al supporto del tubo di deflusso: il supporto sinistro della base del raccoglitore di frazioni deve poggiare contro il bordo della parete dell'involucro.
- Sul laptop, fare clic sul collegamento dell'interfaccia utente e si aprirà la pagina delle informazioni sperimentali (Figura 3 supplementare in alto).
- Compilare le informazioni nelle caselle appropriate nella pagina delle informazioni sperimentali (questa operazione può essere eseguita prima dell'inizio dell'esperimento) e quindi fare clic sulla pagina Flow & Fraction Collector in alto (Figura 3 supplementare in basso).
- Impostazione dei parametri per la misurazione automatica della portata
- Selezionare il tempo di integrazione desiderato nel menu a discesa del tempo di acquisizione del campione in alto al centro che bilancia l'accuratezza desiderata (che è proporzionale al tempo di integrazione) e la risoluzione temporale.
- Se nell'esperimento non verranno raccolte frazioni di deflusso, fare clic su Avvia e andare alla sezione 4.7. Se si desidera raccogliere le frazioni di deflusso, eseguire le operazioni descritte nella sezione 4.6.
- Raccolta delle frazioni in uscita
- Nel software dell'interfaccia utente, seleziona l'opzione Raccogli frazioni? nella pagina Informazioni sull'esperimento o nella pagina del raccoglitore Flusso e frazione. Quindi fare clic sul pulsante Impostazioni FC di calcolo .
- Quando si apre la nuova finestra, inserire l'ora della prima iniezione nel protocollo (definita come tempo = 0) e la portata per canale, nonché gli intervalli di tempo per ciascun campione. Quindi, fai clic su Calcola.
- Una volta verificati gli intervalli della raccolta, fare clic su Genera e avvia.
- Misurazione delle portate per i singoli canali (opzionale)
- Se si devono misurare le portate dei singoli canali (che in condizioni normali variano solo di pochi punti percentuali), pesare otto (o meno) provette per microcentrifuga e registrarne il peso.
- Posizionare il portaprovette contenente le provette per microcentrifuga pre-pesate sul carrello portapiastre. Fare clic su Misura portata manualmente nella sezione Altre utilità.
- Selezionare la durata della misurazione, quindi fare clic su Genera modello. Chiudere la finestra e fare clic su Avvia. Il collettore di frazioni raccoglierà il fluido dai tubi di deflusso per la durata della misurazione, quindi il braccio tornerà alla sua posizione iniziale.
- Pesare le provette di microfuge dopo la raccolta e utilizzare la differenza di peso divisa per la durata della misurazione per calcolare la portata (dove 1 mg = 1 μL).
- Stabilizzazione della linea di base
- Una volta che il tessuto e/o le cellule sono stati caricati nelle camere tissutali, lasciare che il sistema si equilibri per 90 minuti per stabilire una linea di base piatta del consumo di O2 , momento in cui il primo composto in esame può essere iniettato (considerato tempo = 0).
- A 30 minuti prima della prima iniezione, inserire il valore medio degli ultimi 3 FR per canale nella pagina di iniezione per la preparazione delle iniezioni del composto in esame.
5. Protocollo sperimentale (Durata: 2-6 h)
NOTA: Una volta che la stabilizzazione della linea di base è in corso, le attività successive sono l'iniezione dei composti di prova e la sostituzione delle piastre sul collettore di frazioni se ne verrà utilizzata più di una.
- Preparazione dell'iniettato di composti in esame
- Immettere i nomi dei composti, le concentrazioni desiderate (soluzioni finali e madri) e i tempi di iniezione dei composti in esame nella tabella nell'interfaccia utente nella pagina Iniezione. Confermare le informazioni visualizzate nel programma, compresi i volumi nell'MRM rimasti al momento delle iniezioni e la quantità di soluzione madre da iniettare per ottenere le concentrazioni desiderate (Figura 4 supplementare).
- Per calcolare la quantità di perifosso e di scorta necessaria per l'iniezione, compilare le caselle bianche della tabella di iniezione e fare clic su Calcola. Utilizzando i valori calcolati, diluire la soluzione madre del composto in esame con perifuso prima dell'iniezione in modo che il volume iniettato sia pari al 5% del volume nell'MRM dopo l'iniezione.
- Preparare ciascun composto in esame mescolando la soluzione madre e il perifusato. Caricare le siringhe per almeno 10 minuti prima del momento di iniezione e conservarle in un incubatore di CO2 (mantenuto a temperature comprese tra 37-40 °C) fino al momento dell'iniezione.
- Iniezione di composti di prova
- Collegare la siringa contenente il composto in esame alle linee di iniezione (Figura 9A). Sbloccare il tubo di phaking a parete morbida che porta alla linea di iniezione e iniettare lentamente i composti di prova (Figura 9B) a una velocità di circa 3 mL/min. Serrare nuovamente il tubo sulla linea di iniezione, quindi rimuovere la siringa (Figura 9C); ripetere l'operazione per l'altro lato della Gestione record di messaggistica.
- Dopo aver iniettato ciascun composto di prova, preparare ogni composto di prova successivo da iniettare in base alla pagina di iniezione dell'interfaccia utente.
- Determinazione del segnale di afflusso O2 per ciascun canale
- Alla fine di ogni esperimento, iniettare l'inibitore respiratorio KCN (3 mM) per determinare il segnale di durata dell'afflusso per ciascun canale che viene utilizzato per correggere la variazione della durata del sensore basale e del consumo di ossigeno non mitocondriale.
6. Terminare l'esperimento e smontare il sistema (Tempo: 30 min)
- Salvataggio dei dati sull'ossigeno
- Fare clic sul pulsante Salva in alto a sinistra della finestra grafica sul software del rilevatore di ossigeno; Assegna un nome al file e archivialo nella cartella in cui verrà conservato il file. Fare clic sul pulsante Interrompi registrazione nella finestra principale per salvare il file di backup.
- Salvataggio del file di informazioni sperimentali dell'interfaccia utente
- Fai clic sul pulsante Salva profilo in alto a sinistra nella pagina generale dell'interfaccia utente; Assegna un nome al file e archivialo nella cartella in cui verrà conservato il file. Nella pagina frazione e flusso dell'interfaccia utente, fare clic sul menu a discesa Strumenti e quindi su Salva. Mantieni il nome generato o scegline un altro e memorizza il file dove desideri. Se necessario, sono disponibili file di backup a cui è possibile accedere e salvare.
- Scomposizione dello strumento
- Poiché KCN è volatile, smaltire i gruppi fluidici in una cappa aspirante; versare i supporti dal vassoio dei rifiuti MRM e FC in un contenitore dei rifiuti, quindi sciacquare accuratamente gli inserti MRM e mescolare le barre con acqua. Versare il contenuto del contenitore dei rifiuti (contenente KCN) in un contenitore per rifiuti chimici etichettato per il successivo smaltimento mediante sicurezza chimica. Prima dell'esperimento successivo, pulire accuratamente e sterilizzare in autoclave le ancorette e le pinze.
7. Elaborazione dei dati (Tempo: 15-45 min)
- Aprire l'applicazione del processore dati su un computer Mac o PC. Selezionare il file di dati .csv generato da un esperimento. Se il protocollo di questo esperimento è simile a un esperimento analizzato in precedenza, selezionare il file di impostazioni e fare clic su Passaggio successivo. In caso contrario, fai clic su Passaggio successivo per iniziare a inserire le impostazioni dell'esperimento.
- Compila le varie impostazioni dell'esperimento. Nella determinazione del punto temporale di riferimento, selezionare il punto temporale immediatamente prima dell'entrata in vigore della KCN e della diminuzione dei valori di durata. Selezionare questo punto con l'uso di un dispositivo di scorrimento o digitando il valore dell'ora nella casella.
- Fare clic su Calcola per generare grafici OCR in base all'equazione 2:
OCR = ([O 2]in- [O 2]out) x FR = (217 nmol/mL - [O 2]out) x FR/base tissutale (Eq. 2)
dove la concentrazione di O 2 in KRB quando è in equilibrio con il 21% di O2 a 37 °C è 217 nmol/mL, FR è la velocità di flusso (in mL/min), la base tissutale è la quantità di tessuto caricato nella camera (cioè il numero di retine, cellule RPE-coroidi-sclera o RPE). - Salvare i grafici come file .pdf premendo il pulsante Esporta grafico . Rappresentare graficamente l'OCR come valori assoluti o come frazione di un valore stazionario selezionando le caselle corrispondenti al composto di prova da impostare su 1 nella pagina di modifica delle impostazioni.
8. Saggi delle frazioni in uscita
- Se i campioni non possono essere analizzati immediatamente dopo l'esperimento, posizionare le piastre a 4 °C se analizzate il giorno successivo o congelate se conservate più a lungo. Se le piastre sono congelate, scongelare i campioni a 4 °C (in modo che i campioni rimangano freddi).
- Una volta eseguiti i saggi sulle frazioni di deflusso selezionate, le colonne di dati (una per canale) vengono inserite in un file .csv con il tempo (in min) nella colonna più a sinistra e la concentrazione a destra (in nmol/mL o ng/mL); Un collegamento nel programma di elaborazione dati, quando viene premuto, carica un modello.
- Caricare questo file nell'elaboratore di dati per calcolare e tracciare i dati.
Risultati
Per illustrare la risoluzione dei dati generati da componenti isolati dell'occhio, OCR e LPR sono stati misurati con tre tipi di tessuto (retina, cellule RPE-coroide-sclera e cellule RPE) seguendo un protocollo comunemente usato (il test da sforzo mitocondriale10; Figura 10, Figura 11 e Figura 12). La quantità di tessuto utilizzata per ciascun tessuto è indicata nella Tabella 1. I dati sono stati elaborati e rappresentati graficamente utilizzando il pacchetto software sviluppato per il sistema fluidico. La preparazione della retina e dell'RPE-coroide-sclera è relativamente semplice e richiede meno di 20 minuti per ogni tipo di tessuto. L'OCR è rimasto costante durante il periodo in cui sono stati iniettati i composti in esame, indicando la salute e la funzione stabili del tessuto e supportando la validità del metodo (Figura 10). Una volta convalidato per ogni tipo di tessuto, non è stato necessario eseguire controlli in cui non vengono iniettati composti di prova per ogni esperimento. Coerentemente con i dati ottenuti utilizzando i metodi di perifusione più convenzionali 6,8,13, l'OCR diminuisce in risposta all'oligomicina e aumenta l'OCR in risposta alla FCCP. I cambiamenti nell'LPR erano nella direzione opposta a quelli osservati per l'OCR: l'oligomicina aumentava l'LPR, che poi diminuiva (ma solo leggermente) in risposta all'FCCP (Figura 11). Per confrontare la significatività statistica dell'effetto di ciascun composto sequenziale, sono stati eseguiti test t (che vengono calcolati automaticamente dal software fornito con lo strumento). Poiché l'obiettivo dell'articolo era quello di descrivere come eseguire il metodo, il numero di repliche trasportate non era sempre abbastanza alto da produrre significatività statistica. In generale, tuttavia, quando il numero di repliche era 3 o più, gli effetti di FCCP e oligomicina sia sull'OCR che sull'LPR erano significativi.
Le cellule RPE non sono state precedentemente analizzate con sistemi di flusso, ma hanno risposto in modo simile a RPE-coroide-sclera (coerentemente con l'idea che una grande frazione di OCR sia dovuta alle cellule RPE; Figura 11). Questi esempi illustrativi evidenziano la capacità del sistema di mantenere la vitalità tissutale, come si evince dalla stabilità dell'OCR nei canali di controllo e dall'elevato rapporto segnale/rumore per le variazioni dell'OCR dell'entità indotta dall'oligomicina e dalla FCCP, che era superiore a 100 a 1. Inoltre, i saggi delle frazioni di deflusso possono essere utilizzati per correlare il tasso di assorbimento o produzione di un'ampia gamma di composti scambiati con il fluido extracellulare sono complementari all'OCR (in questo caso, LPR). Queste caratteristiche dello strumento hanno permesso una quantificazione accurata delle differenze caratteristiche nelle risposte tissutali tra i tipi di tessuto eseguite in parallelo. L'OCR da parte di RPE-coroide-sclera e le cellule RPE sono costantemente più sensibili all'oligomicina rispetto alla retina (Figura 11 e Figura 12), sebbene per RPE-coroide-sclera la durata dell'esposizione a FCCP non sia stata sufficiente per raggiungere lo stato stazionario. Un punto da considerare è sorto quando si utilizza il DMSO come solvente. A concentrazioni più elevate, (0,2%) il DMSO ha avuto un effetto transitorio sull'OCR da parte della retina (presumibilmente riflettendo un effetto di un cambiamento nella pressione osmotica determinato dall'effetto del DMSO sulla permeabilità della membrana).
Sulla base dell'ipotesi che la KCN inibisca completamente la respirazione per la sua azione diretta sulla citocromo c ossidasi, l'OCR al termine dell'esposizione alla KCN è impostato a 0 e tutti i valori dell'OCR sono calcolati in base alla variazione relativa al valore della KCN. L'OCR può verificarsi indipendentemente dalla catena respiratoria e dalla citocromo c ossidasi. Tuttavia, l'entità di questo contributo all'OCR complessivo non è generalmente superiore a pochi punti percentuali (dati non mostrati) e il lungo periodo di tempo in cui il tessuto è esposto a KCN assicura che i substrati di ossidasi che non fanno parte della catena di trasporto degli elettroni siano stati esauriti.
Analisi statistica
I singoli esperimenti sono stati mostrati come indicato nelle figure, ma con più canali di cui è stata calcolata la media. I dati sono stati quindi rappresentati graficamente come media ± l'errore standard (SE; calcolato come SD/√n).
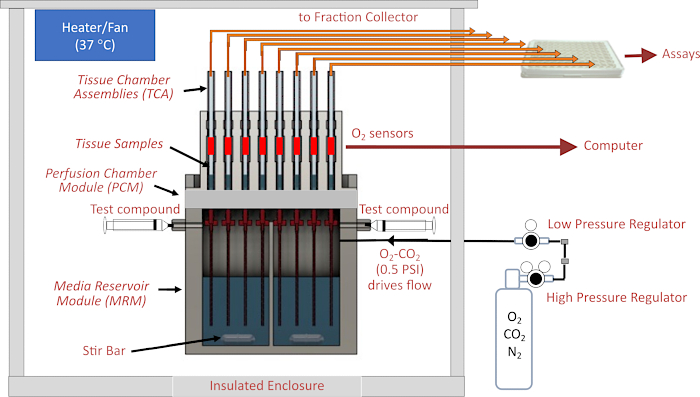
Figura 1. Schema del sistema fluidico/di valutazione. I componenti principali includono l'involucro, gli elementi di controllo della temperatura, i sistemi fluidici e di camera tissutale, la regolazione della pressione del gas nello spazio di testa sopra il perifusato, il monitoraggio del collettore di frazioni/portata e i rilevatori di O2 . Abbreviazioni: MRM = Media Reservoir Module, PCM = Perifusion Chamber Module, TCA= Tissue Chamber Assemblies. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2. (A) Immagine dei principali componenti dello strumento. I componenti principali sono costituiti da serbatoio del gas (regolatori di pressione), involucro, collettore di frazioni e computer. (B) Diagramma di flusso sperimentale che mostra le principali categorie di passaggi e il tempo necessario per completarli. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3. Vista della Gestione record di messaggistica. La gestione record di messaggistica viene visualizzata con un inserto di gestione record di messaggistica (a sinistra) e barre di agitazione (a destra) posizionate nella parte inferiore degli inserti di gestione record di messaggistica (posizionate su ciascun lato del divisore di gestione record di messaggistica). Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4. Assemblaggio dei tubi e assemblaggio dei tubi di spurgo nella gestione record di messaggistica. (A) Testare il gruppo del tubo di iniezione del composto e il gruppo del tubo di spurgo collegato alle porte dell'MRM. (B-C) Il gruppo di iniezione del composto di prova e il gruppo del tubo di spurgo (B) sono posizionati nella scanalatura nella parte anteriore dell'involucro (C). Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5. Accensione del regolatore di temperatura MRM. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 6. Camere tissutali e serbatoio del gas. Posizionamento del rivelatore di O2 sul supporto del rivelatore (che supporta anche MRM e PCM) e posizionamento della fascia attorno alle alette del PCM che aiutano a fissare le camere tissutali in posizione. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 7. (A) Regolatori di alta e bassa pressione sul serbatoio del gas. (B-C) Tubo di spurgo. Il tubo di spurgo consente allo spazio di testa nell'MRM di liberarsi dall'aria e riempirsi di gas dal serbatoio di alimentazione. Immagini che mostrano il tubo di spurgo aperto (B) e il tubo di spurgo chiuso (C). Il gruppo di iniezione del composto di prova rimane chiuso durante il processo di spurgo. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 8. Camera tissutale e configurazione del deflusso. (A) Dimensioni della membrana Transwell dopo che è stata tagliata in tre strisce di uguale larghezza. (B) Supporto multitubo di deflusso. (C) Supporto multitubo di deflusso posizionato sul labbro dell'involucro con gli adattatori per tubi vicino alle camere tissutali. (D) Immagine dei gruppi di tubi di deflusso attaccati alle camere dei tessuti. (E) Vista aerea dell'involucro senza coperchio. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 9. Iniezione di composto in MRM. Iniezione di un composto di prova attraverso la porta di iniezione nell'MRM utilizzando una siringa da 5 ml. Fare clic qui per visualizzare una versione più grande di questa figura.
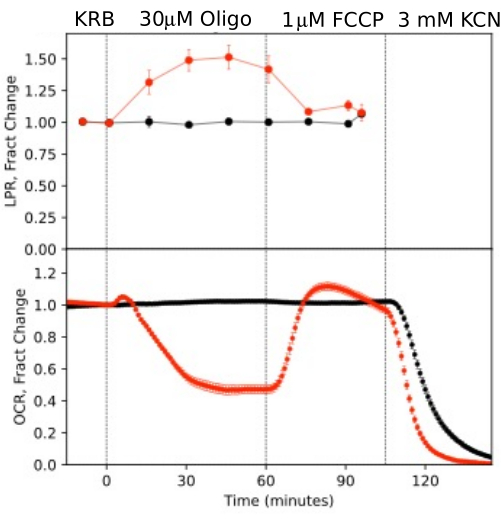
Figura 10. Curve OCR e LPR in risposta ai composti di prova. OCR e LPR mediante retina isolata da topi (1 retina/canale) in risposta alla presenza o assenza (controllo) di composti in esame come indicato. Ogni curva è la media di 6 repliche di un singolo esperimento (le barre di errore sono SE; i valori p sono calcolati eseguendo test t accoppiati confrontando i valori di stato stazionario di ciascun agente di test con quelli dell'agente di test precedente). Fare clic qui per visualizzare una versione più grande di questa figura.
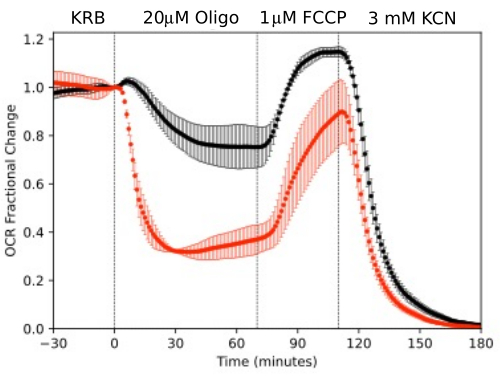
Figura 11. Curve OCR. OCR mediante RPE-coroide-sclera e retina isolati da topi (1 retina o 2 RPE-coroide-sclera/canale) misurati in parallelo in risposta ai composti in esame come indicato. I dati sono la media delle repliche di un singolo esperimento (n = 2 e 4 rispettivamente per RPE-coroide-sclera e retina; i valori p sono calcolati eseguendo test t accoppiati confrontando i valori di stato stazionario per ciascun agente di test con quelli dell'agente di test precedente). Fare clic qui per visualizzare una versione più grande di questa figura.
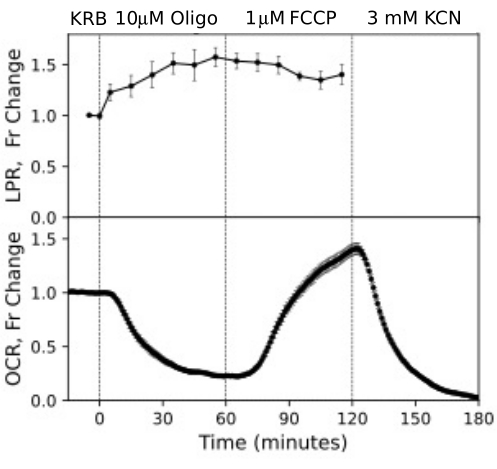
Figura 12. Curve OCR e LPR da celle RPE. OCR e LPR da cellule RPE attaccate a membrane transwell che sono state tagliate in strisce e caricate nelle camere di perifusione. I dati sono la media delle repliche di un singolo esperimento (n = 3, con 1,5 membrane/canale (360.000 cellule/canale); i valori p sono calcolati eseguendo test t accoppiati confrontando i valori allo stato stazionario di ciascun agente di test con quelli dell'agente di test precedente). Fare clic qui per visualizzare una versione più grande di questa figura.
| TESSUTO/CELLULA | Importo/Canale | PORTATA: mL/min |
| Retina (topo) | 1 | 0.025 |
| RPE-coroide-sclera (topo) | 2 | 0.02 |
| Cellule RPE su membrane Transwell | 360.000 celle (4 strisce filtranti da 1/3) | 0.016 |
Tabella 1. Specifiche operative consigliate per i diversi tessuti.
Figura supplementare 1. Rappresentazione grafica del disegno sperimentale. Tempi e composizione dell'esposizione ai composti in esame e tempi di raccolta delle frazioni. L'incremento di concentrazione (Conc Inc) è la variazione di concentrazione da implementare. Fare clic qui per scaricare il file.
Figura 2 supplementare. Interfaccia utente all'avvio. Interfaccia utente della finestra di avvio del software di rilevamento dell'O 2 che monitora l'O2 nelle camere tissutali inserite nel PCM. Fare clic qui per scaricare il file.
Figura supplementare 3. Interfaccia utente per le impostazioni dell'esperimento. Interfaccia utente per l'immissione di informazioni sperimentali (a sinistra) e la selezione dei tempi per la raccolta delle frazioni in uscita (a destra). Fare clic qui per scaricare il file.
Figura supplementare 4. Interfaccia utente della pagina di iniezione. Pagina di iniezione che calcola i volumi di iniezione in base alle concentrazioni desiderate del composto in esame e al volume rimasto nell'MRM. Fare clic qui per scaricare il file.
Fascicolo supplementare 1: Metodi per la preparazione dei campioni di tessuto. Fare clic qui per scaricare il file.
Discussione
A causa dell'importanza della bioenergetica in tutti gli aspetti della funzione cellulare e del mantenimento di vari componenti dell'occhio, c'è un bisogno critico di metodi per studiarne la regolazione. In particolare, la retina neurale e l'RPE dipendono dal metabolismo sia per la generazione di energia che per la segnalazione intra e intercellulare14,15,16,17. A causa della loro elevata capacità ossidativa, i tessuti isolati dell'occhio non sono ben mantenuti in condizioni statiche18,19 e quindi lo studio di componenti isolati dell'occhio richiede sistemi di flusso in grado di mantenere e valutare i processi metabolici. Il sistema fluidico è stato sviluppato per generare dati OCR e LPR da un'ampia gamma di tipi di tessuto e in questo documento abbiamo presentato protocolli dettagliati che si sono rivelati in grado di produrre risultati ottimali.
Il principale fattore determinante per la generazione di dati robusti utilizzando il sistema di flusso include il pre-equilibrio del fluido/tampone a base di CO2 a 39 °C (per garantire che il perifusato non sia sovrasaturo di gas disciolto che degasserebbe durante l'esperimento). In particolare, il terreno o il tampone KRB conservato a 4 °C sarà sovrasaturo rispetto a 37 °C e degasserà durante l'esperimento se i tempi di pre-equilibrazione sono insufficienti. Inoltre, il tessuto caricato nelle camere tissutali non deve essere traumatizzato da un isolamento improprio del tessuto a causa di lacerazione o separazione incompleta del tessuto, o dall'esposizione del tessuto in una bassa quantità di tampone a base di bicarbonato all'aria atmosferica per troppo tempo. Il controllo della temperatura, la stabilità del flusso e l'affidabilità del rilevamento di O2 hanno poca variabilità e questi fattori non contribuiscono in modo significativo al tasso di guasto.
Lo strumento è dotato di otto canali di flusso/camere tissutali che funzionano simultaneamente e che sono alimentati con perifusato da due serbatoi, quattro camere tissutali per ogni serbatoio. Per ottenere l'andamento temporale più accurato dell'OCR, le curve cinetiche vengono corrette in base da camere che non sono caricate con tessuto. Pertanto, un tipico protocollo sperimentale coinvolgerebbe due gruppi di tre camere tissutali. I protocolli in generale si dividono in due categorie: uno è costituito dai diversi protocolli dei composti in esame su ciascun lato (ad esempio farmaco/veicolo su un lato dell'MRM e solo veicolo sull'altro); il secondo è lo stesso protocollo di iniezione del composto di prova su entrambi i lati dell'MRM, ma tessuto diverso o modello di tessuto su ciascun lato dell'MRM. In questo documento, gli effetti dell'oligomicina e della FCCP sulla retina sono stati confrontati con l'OCR da parte di tessuti che non sono stati esposti ad alcun composto di prova e due tessuti sono stati valutati contemporaneamente con lo stesso protocollo e le stesse condizioni per identificare il comportamento tessuto-specifico. Quest'ultimo è stato illustrato in questo studio mostrando un aumento della gamma dinamica del tasso metabolico da parte di RPE-coroide-sclera rispetto alla retina in parallelo nello stesso esperimento. Altri rapporti hanno descritto una gamma più ampia di disegni di studio, tra cui la misurazione degli effetti che variano i livelli di O2 su OCR e LPR e le dipendenze dalla concentrazione di combustibili, farmaci e tossine20,21. Inoltre, sebbene abbiamo limitato l'analisi delle frazioni di deflusso alla misurazione del lattato e al calcolo dell'LPR, il contenuto informativo di un esperimento aumenta notevolmente se vengono analizzati più composti e classi di composti nelle frazioni di deflusso come ormoni, neurotrasmettitori, segnali cellulari e metaboliti che possono uscire dalle cellule20,22, 23.
Il caricamento della retina isolata o dell'RPE-coroide-sclera è semplice e, una volta isolati, questi tessuti vengono semplicemente posizionati nella parte superiore delle camere tissutali con una pinza e lasciati affondare fino alla fritta. Le cellule RPE coltivate su inserti filtranti sviluppano una polarizzazione appropriata e marcatori di maturità RPE dopo 4-8 settimane di coltura. Non è possibile rimuovere l'RPE per l'analisi su cellule vive una volta attaccato alla membrana del transwell, se si vuole mantenere la maturità e la polarizzazione dell'RPE24. La camera di perifusione può ospitare strisce della membrana del transwell che vengono tagliate con un bisturi mentre sono immerse nel tampone e inserite rapidamente nelle camere tissutali. Sebbene il taglio delle strisce filtranti sia stato inserito in un sistema statico24, non sono disponibili altri metodi fluidici per valutare questi importanti tipi di cellule. Le risposte delle cellule RPE sono state rapide e più dinamiche rispetto alla retina o alla RPE-coroide-sclera, probabilmente in parte a causa dell'accesso immediato sia all'aspetto apicale che a quello basale delle cellule RPE configurate come un monostrato sull'inserto di membrana.
Un altro fattore per garantire che i dati abbiano il rapporto segnale/rumore più elevato è la selezione del rapporto ottimale di tessuto caricato nelle camere di perifusione rispetto alla portata. Una quantità insufficiente di tessuto rispetto alla portata si traduce in una differenza di concentrazione di O2 disciolto tra afflusso e deflusso, molto piccola e difficile da misurare in modo affidabile. Al contrario, se il flusso è troppo lento, la concentrazione di O2 diventa così bassa che il tessuto è colpito dall'ipossia. Ciononostante, il flusso di liquido guidato dalla pressione del gas può essere mantenuto a velocità di flusso fino a 5 mL/min, richiedendo solo piccole quantità di tessuto per misurazioni OCR e LPR accurate. Negli esperimenti qui mostrati, sono stati utilizzati circa 20 ml/min/canale, adatti per una retina, due scleras coroidi RPE o 360.000 cellule RPE. Per ridurre al minimo gli effetti del sistema che ritardano e disperdono l'esposizione del tessuto al composto di prova iniettato, vengono fornite più dimensioni delle camere tissutali, in modo che la quantità di tessuto (e la portata) corrisponda alla dimensione appropriata della camera.
I dati delle analisi mostrate in questo articolo sono stati rappresentati in due modi: magnitudine assoluta rispetto al tasso, o variazioni frazionarie rispetto a uno stato stazionario o di base. L'attenzione si è concentrata sull'illustrazione della misurazione delle risposte ai composti in esame. Tuttavia, il sistema fluidico è adatto per valutare e confrontare gli effetti del trattamento tissutale prima dell'analisi della perifusione, come le modificazioni genetiche. Testare se un trattamento è diverso dal controllo è più efficace se vengono analizzati gli effetti del trattamento sulle risposte normalizzate dei composti in esame. Se l'analisi richiede magnitudini assolute, la potenza statistica delle analisi dei campioni pretrattati è massimizzata se la loro valutazione e i controlli vengono effettuati nello stesso esperimento di perifusione.
Ad eccezione dell'agitatore, tutte le parti che vengono a contatto con il liquido sono fornite dal produttore come materiali di consumo e sono state sterilizzate. Queste parti non devono essere riutilizzate, poiché gli esperimenti andranno occasionalmente persi a causa di una pulizia incompleta e di superfici contaminate. Il sistema all'inizio dell'installazione è sterile. Tuttavia, i terreni vengono aggiunti all'MRM e il tessuto viene caricato nelle camere in condizioni non sterili. Abbiamo misurato l'OCR nel sistema assemblato con parti sterili, ma in cui l'esperimento stesso viene eseguito in condizioni non sterili. Ci vogliono circa 14 ore perché i batteri si accumulino al punto da avere OCR misurabili (risultati non pubblicati). Se vengono utilizzati protocolli che durano meno di 10 ore o giù di lì, l'accumulo di batteri e gli eventuali effetti dovuti a questi saranno trascurabili.
Molti ricercatori utilizzano strumenti progettati per misurare l'OCR in incubazione statica di un monostrato di cellule con una produttività relativamente elevata25,26. Al contrario, lo strumento di fluidica che abbiamo testato e descritto in questo articolo mantiene il tessuto garantendo un'adeguata erogazione di O2 che è fondamentale per le maggiori distanze di diffusione presenti nei campioni di tessuto. Inoltre, è in grado di raccogliere frazioni che consentono la valutazione di più parametri in parallelo con l'OCR, il che migliora notevolmente la capacità di studiare le relazioni tra di loro. Infine, le concentrazioni di gas disciolti (come O 2 e CO 2 ) possono essere controllate, aumentando la durata degli esperimenti con mezzi e tamponi a base di bicarbonato, consentendo all'utente di studiare gli effetti dell'O2 . Va sottolineato che un limite per entrambe le metodologie è l'incapacità di studiare il washout dei composti in esame, una funzionalità che altri sistemi di perifusione hanno 4,27,28. Un'altra considerazione da fare quando si determina la modalità di analisi ottimale è il fatto che i sistemi fluidici utilizzano più mezzi e composti di prova rispetto ai sistemi statici. La spesa extra è ridotta al minimo con gli attuali sistemi fluidici grazie alle basse portate che il sistema può essere utilizzato.
Nel complesso, viene descritta una descrizione dettagliata dei protocolli per eseguire esperimenti con un nuovo strumento di flusso/valutazione. I dati generati con retina e RPE-coroide-sclera hanno ricapitolato i risultati ottenuti in precedenza con sistemi molto più difficili da usare (e non prontamente disponibili). È stato inoltre dimostrato che il sistema è in grado di mantenere e valutare le cellule RPE attaccate alle membrane transwell, un modello cellulare molto importante che non è stato precedentemente analizzato con i sistemi di flusso a causa della fragilità delle cellule. Le parti principali del protocollo consistono in un tempo di configurazione di 75 minuti, seguito da un periodo di equilibratura di 90 minuti e dal protocollo sperimentale che lo rende adatto all'uso di routine da parte di laboratori non specializzati nel funzionamento di sistemi fluidici. Sebbene ci siamo concentrati sulla misurazione della risposta acuta del tessuto ai composti testati, il sistema è molto adatto per confrontare tessuti provenienti da varie fonti, come modelli animali o modelli cellulari che sono stati geneticamente modificati o sottoposti a trattamenti/condizioni di prova. Inoltre, la portata dei saggi che possono essere condotti sulle frazioni in uscita è ampia e comprende metaboliti, molecole di segnalazione cellulare e ormoni/neurotrasmettitori secreti, nonché analisi multicomponente generate dalla spettrometria di massa sulle frazioni e sul tessuto.
Divulgazioni
I.R.S., M.G. e K.B. hanno legami finanziari con EnTox Sciences, Inc. (Mercer Island, WA), il produttore/distributore del sistema di perifusione BaroFuse descritto in questo studio. Tutti gli altri autori dichiarano di non avere conflitti di interesse.
Riconoscimenti
Questa ricerca è stata finanziata da sovvenzioni del National Institutes of Health (R01 GM148741 I.R.S.), U01 EY034591, R01 EY034364, BrightFocus Foundation, Research to Prevent Blindness (J.R.C.) e R01 EY006641, R01 EY017863 e R21 EY032597 (J.B.H.).
Materiali
| Name | Company | Catalog Number | Comments |
| BIOLOGICAL SAMPLES | |||
| C57BL/6J mice | Envigo Harlan (Indianapolis, IN) | N/A | |
| REAGENTS | |||
| FCCP | Sigma-Aldrich | C2920L9795 | |
| Glucose | Sigma-Aldrich | G8270G | |
| KCN | Sigma-Aldrich | 60178 | |
| Lactate | MilliporeSigma | L6661 | |
| Oliigomycin A | Sigma-Aldrich | 75351L9795 | |
| CELL CULTURE AND TISSUE HARVESTING | |||
| Beuthanasia-D | Schering-Plough Animal Health Corp., Union, NJ | N/A | |
| Bovine serum albumin | Sigma-Aldrich | A3059 | |
| Euthasol, 390 mg/ml sodium pentobarbital | Virbac | RXEUTHASOL | |
| Fetal bovine serum | Sigma-Aldrich | 12303C | |
| Hank’s Buffered Salt Solution | GIBCO | 14065056 | |
| Krebs Ringer Bicarbonate (KRB) | Thermo Fisher Scientific | J67795L9795 | |
| Matrigel | ThermoFisher | #CB-40230 | |
| Penicillin-streptomycin | ThermoFisher Scientific | 15140122 | |
| ROCKi | Selleck Chemicals | Y-27632 | |
| Trypsin-EDTA | ThermoFisher | #25-200-072 | |
| SUPPLIES | |||
| Gas Cylinders: 21% O2/5% CO2/balance N2 | Praxair Distribution, Inc | N/A | |
| Transwell filters | MilliporeSigma | 3470 | |
| COMMERCIAL ASSAYS | |||
| Amplex Red Glucose/Glucose Oxidase Assay Kit | ThermoFisher | A22189 | |
| Glucose Oxidase from Aerococcus viridans | Invitrogen (Carlsbad, CA) | A22189L9795 | |
| Lactate Oxidase | Sigma-Aldrich | L9795 | |
| EQUIPMENT | |||
| BaroFuse Multi-Channel Perifusion system | EnTox Sciences, Inc (Mercer Island, WA | Model 001-08 | |
| Synergy 4 Fluorometer | BioTek (Winooski, VT) | S4MLFPTA |
Riferimenti
- Lacy, P. E., Walker, M. M., Fink, C. J. Perifusion of isolated rat islets in vitro: Participation of the microtubular system in the biphasic release of insulin. Diabetes. 21 (10), 987-998 (1972).
- Doliba, N. M., et al. Metabolic and ionic coupling factors in amino acid-stimulated insulin release in pancreatic beta-HC9 cells. American Journal of Physiology. Endocrinology and Metabolism. 292 (6), E1507-E1519 (2007).
- Sweet, I. R., et al. Regulation of ATP/ADP in pancreatic islets. Diabetes. 53 (2), 401-409 (2004).
- Chertov, A. O., et al. Roles of glucose in photoreceptor survival. The Journal of Biological Chemistry. 286 (40), 34700-34711 (2011).
- Kooragayala, K., et al. Quantification of Oxygen Consumption in Retina Ex Vivo Demonstrates Limited Reserve Capacity of Photoreceptor Mitochondria. Investigative Ophthalmology & Visual Science. 56 (13), 8428-8436 (2015).
- Bisbach, C. M., et al. Succinate Can Shuttle Reducing Power from the Hypoxic Retina to the O2-Rich Pigment Epithelium. Cell Reports. 31 (5), 107606(2020).
- Du, J., et al. Inhibition of mitochondrial pyruvate transport by zaprinast causes massive accumulation of aspartate at the expense of glutamate in the retina. The Journal of Biological Chemistry. 288 (50), 36129-36140 (2013).
- Hass, D. T., et al. Succinate metabolism in the retinal pigment epithelium uncouples respiration from ATP synthesis. Cell Reports. 39 (10), 110917(2022).
- Kamat, V., et al. Fluidics system for resolving concentration-dependent effects of dissolved gases on tissue metabolism. Elife. 10, e66716(2021).
- Stryer, L. Biochemistry. , 4th edn, Freeman and Company, New York. (1995).
- Gu, X., Ma, Y., Liu, Y., Wan, Q. Measurement of mitochondrial respiration in adherent cells by Seahorse XF96 Cell Mito Stress Test. STAR Protocols. 2 (1), 100245(2021).
- Engel, A. L., et al. Extracellular matrix dysfunction in Sorsby patient-derived retinal pigment epithelium. Experimental Eye Research. 215, 108899(2022).
- Zhang, R., et al. Inhibition of Mitochondrial Respiration Impairs Nutrient Consumption and Metabolite Transport in Human Retinal Pigment Epithelium. Journal of Proteome Research. 20 (1), 909-922 (2021).
- Hurley, J. B. Retina Metabolism and Metabolism in the Pigmented Epithelium: A Busy Intersection. Annual Review of Vision Science. 7, 665-692 (2021).
- Xiao, J., et al. Autophagy activation and photoreceptor survival in retinal detachment. Experimental Eye Research. 205, 108492(2021).
- Okawa, H., Sampath, A. P., Laughlin, S. B., Fain, G. L. ATP consumption by mammalian rod photoreceptors in darkness and in light. Current Biology. 18 (24), 1917-1921 (2008).
- Lakkaraju, A., et al. The cell biology of the retinal pigment epithelium. Progress in Retinal and Eye Research. , 100846(2020).
- Yu, J., et al. Emerging strategies of engineering retinal organoids and organoid-on-a-chip in modeling intraocular drug delivery: Current progress and future perspectives. Advanced Drug Delivery Reviews. 197, 114842(2023).
- Arjamaa, O., Nikinmaa, M. Oxygen-dependent diseases in the retina: role of hypoxia-inducible factors. Experimental Eye Research. 83 (3), 473-483 (2006).
- Kamat, V., et al. A Versatile Multi-Channel Fluidics System for the Maintenance and Real-Time Metabolic and Functional Assessment of Tissue or Cells. Cell Reports Methods. In Press. , (2023).
- Neal, A., et al. Quantification of Low-Level Drug Effects Using Real-Time, in vitro Measurement of Oxygen Consumption Rate. Toxicological Sciences. 148 (2), 594-602 (2015).
- Jung, S. R., et al. Reduced cytochrome C is an essential regulator of sustained insulin secretion by pancreatic islets. The Journal of Biological Chemistry. 286 (20), 17422-17434 (2011).
- Rountree, A. M., et al. Control of insulin secretion by cytochrome C and calcium signaling in islets with impaired metabolism. The Journal of Biological Chemistry. 289 (27), 19110-19119 (2014).
- Calton, M. A., Beaulieu, M. O., Benchorin, G., Vollrath, D. Method for measuring extracellular flux from intact polarized epithelial monolayers. Molecular Vision. 24, 425-433 (2018).
- Jarrett, S. G., Rohrer, B., Perron, N. R., Beeson, C., Boulton, M. E. Assessment of mitochondrial damage in retinal cells and tissues using quantitative polymerase chain reaction for mitochondrial DNA damage and extracellular flux assay for mitochondrial respiration activity. Methods in Molecular Biology. 935, 227-243 (2013).
- Perron, N. R., Beeson, C., Rohrer, B. Early alterations in mitochondrial reserve capacity; a means to predict subsequent photoreceptor cell death. Journal of Bioenergetics and Biomembranes. 45 (1-2), 101-109 (2013).
- Cabrera, O., et al. high-throughput assays for evaluation of human pancreatic islet function. Cell Transplantation. 16 (10), 1039-1048 (2008).
- Doliba, N. M., Qin, W., Vinogradov, S. A., Wilson, D. F., Matschinsky, F. M. Palmitic acid acutely inhibits acetylcholine- but not GLP-1-stimulated insulin secretion in mouse pancreatic islets. American Journal of Physiology. Endocrinology and Metabolism. 299 (3), E475-E485 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon