Method Article
Erhaltung und Beurteilung verschiedener Gewebe- und Zelltypen des Auges mit einem neuartigen pumpenlosen Fluidiksystem
In diesem Artikel
Zusammenfassung
Die Echtzeitanalyse von lebendem Gewebe liefert wichtige funktionelle und mechanistische Daten. In diesem Artikel werden die Protokolle und kritischen Variablen beschrieben, um eine genaue und reproduzierbare Generierung von Daten durch ein neuartiges und pumpenfreies Mehrkanal-Fluidiksystem zu gewährleisten, das eine breite Palette von Gewebe- und Zellmodellen pflegt und bewertet.
Zusammenfassung
Viele In-vitro-Modelle , die zur Untersuchung der Gewebefunktion und Zellbiologie verwendet werden, benötigen einen Medienfluss, um eine ausreichende Sauerstoffversorgung und optimale Zellbedingungen zu gewährleisten, die für die Aufrechterhaltung von Funktion und Lebensfähigkeit erforderlich sind. Zu diesem Zweck haben wir ein Mehrkanal-Durchflusskultursystem entwickelt, um Gewebe und Zellen in Kultur zu halten und die Funktion und Lebensfähigkeit entweder durch Inline-Sensoren und/oder die Sammlung von Abflussfraktionen kontinuierlich zu bewerten. Das System kombiniert eine kontinuierliche optische 8-Kanal-Messung der Sauerstoffverbrauchsrate mit einem eingebauten Fraktionssammler, um gleichzeitig die Produktionsraten von Metaboliten und die Hormonsekretion zu messen. Obwohl es in der Lage ist, eine breite Palette von Gewebe- und Zellmodellen, einschließlich Inselzellen, Muskeln und Hypothalamus, zu erhalten und zu beurteilen, beschreiben wir hier seine Funktionsprinzipien und die experimentellen Vorbereitungen/Protokolle, die wir verwendet haben, um die bioenergetische Regulation von isolierter Maus-Retina, Maus-Retinal-Pigmentepithel (RPE)-Aderhaut-Lederhaut-Sklera und kultivierten menschlichen RPE-Zellen zu untersuchen. Innovationen in der Konstruktion des Systems, wie z. B. der pumpenlose Flüssigkeitsfluss, haben zu einer stark vereinfachten Bedienung eines Mehrkanal-Strömungssystems geführt. Es werden Videos und Bilder gezeigt, die veranschaulichen, wie das Instrument zusammengebaut, für ein Experiment vorbereitet und die verschiedenen Gewebe-/Zellmodelle in die Perifusionskammern geladen werden. Darüber hinaus werden Richtlinien für die Auswahl von Bedingungen für protokoll- und gewebespezifische Experimente beschrieben und diskutiert, einschließlich der Einstellung des richtigen Verhältnisses von Flussrate zu Gewebe, um konsistente und stabile Kulturbedingungen und genaue Bestimmungen von Verbrauch und Produktionsraten zu erhalten. Die Kombination aus optimaler Gewebeerhaltung und Echtzeit-Bewertung mehrerer Parameter liefert hochinformative Datensätze, die für die Erforschung der Physiologie des Auges und die Arzneimittelforschung zur Behandlung von Sehstörungen von großem Nutzen sein werden.
Einleitung
Perifusionssysteme haben eine lange Geschichte in den Biowissenschaften. Insbesondere für die Untersuchung der sekretorischen Funktion von Inselzellen wurden sie verwendet, um die Kinetik der Insulinsekretion als Reaktion auf Sekretagogen zu charakterisieren1. Neben der Erfassung von Abflussfraktionen für die anschließende Bestimmung von Hormonen und Metaboliten wurden Echtzeitsensoren integriert, hauptsächlich zur Detektion des Sauerstoffverbrauchs 2,3,4. Weit verbreitete Bemühungen, die Mechanismen, die Erkrankungen des Auges vermitteln, besser zu verstehen, wurden durch einen Mangel an physiologisch relevanten Methoden zur Beurteilung der metabolischen Regulation und Dysregulation der verschiedenen isolierten Komponenten des Auges, einschließlich der Netzhaut, des retinalen Pigmentepithels (RPE), der Aderhaut-Sklera und der kultivierten RPE-Zellen, eingeschränkt. Statische Systeme, die für kultivierte Zellen entwickelt wurden, wurden für Gewebe5 angepasst, aber das Gewebe benötigt einen Fluss für eine ausreichende Sauerstoffversorgung. Flow-Systeme haben sich als erfolgreich bei der genauen und reproduzierbaren Messung von Echtzeitreaktionen der Sauerstoffverbrauchsrate (OCR) durch die Netzhaut und die RPE-Aderhaut-Sklera erwiesen, und das Gewebe bleibt metabolisch länger als 8 Stunden stabil, was hochinformative Protokolle mit mehreren Testverbindungen ermöglicht 4,6,7,8,9 . Nichtsdestotrotz erforderte der Betrieb von Fluidiksystemen in der Vergangenheit eine maßgeschneiderte Apparatur und geschultes technisches Personal in nicht standardisierten Methoden. Solche Systeme haben sich in den meisten Laboratorien nicht als Standardmethodik durchgesetzt. Die BaroFuse ist ein neu entwickeltes Fluidiksystem, das nicht auf Pumpen, sondern auf Gasdruck angewiesen ist, um den Durchfluss durch mehrere Kanäle und Gewebekammern anzutreiben (Abbildung 1). Jeder Kanal wird kontinuierlich auf OCR überwacht, und der Abfluss wird mit einem plattenbasierten Fraktionssammler für die anschließende Analyse des Inhalts gesammelt. Wichtig ist, dass die Gewebeperifusionskammern für das Instrument so konzipiert sind, dass sie Gewebe unterschiedlicher Geometrien und Größen aufnehmen können.
Das Herzstück des Instruments ist das Fluidiksystem, bei dem der Durchfluss von einem abgedichteten, unter Druck stehenden Reservoir durch Schläuche mit kleinem Innendurchmesser (ID) (die den größten Strömungswiderstand im Flüssigkeitskreislauf ausmachen) in die Glasgewebekammern geleitet wird, in denen sich das Gewebe befindet. Der Druck auf das Medienreservoirmodul (MRM) wird von Niederdruck- und Hochdruckreglern geliefert, die an eine Gasflasche angeschlossen sind, die ein Gasgemisch enthält (typischerweise 21 % O2, 5 %CO2, Rest N2), und das Reservoir wird von oben durch das Perifusionskammermodul (PCM) abgedichtet, das die Gewebekammerbaugruppen (TCAs) enthält. Die Durchflussmenge wird durch die Länge und den Innendurchmesser der Widerstandsrohre und die Druckeinstellung eines Niederdruckreglers gesteuert. Ausflussrohre, die mit der Oberseite der Gewebekammern verbunden sind, fördern die Flüssigkeit entweder in einen Abfallbehälter (der zur automatischen Bestimmung der Durchflussrate kontinuierlich gewogen wird) oder in die Vertiefungen einer 96-Well-Platte, die vom Fraktionssammler gesteuert wird. Das O2-Detektionssystem misst die Lebensdauer einesO2-empfindlichen Farbstoffs, der auf die Innenseite jeder der dem Gewebe nachgeschalteten Glasgewebekammern aufgetragen ist. Diese Informationen werden dann verwendet, um die OCR kontinuierlich zu berechnen. Das gesamte Fluidiksystem befindet sich in einem temperaturgeregelten Gehäuse, und der Gastank, der Fraktionssammler und der Computer sind die Hauptkomponenten des Instruments (Abbildung 2A). Schließlich dient die Software, die das Gerät betreibt, zur Steuerung des Betriebs (einschließlich der Vorbereitung und des Timings der injizierten Testverbindungen, des Durchflussmesssystems und des Zeitpunkts des Fraktionssammlers) sowie zur Verarbeitung und grafischen Darstellung der OCR-Daten und anderer ergänzender Messungen.
In diesem Artikel beschreiben wir die Protokolle für die Verwendung des Fluidiksystems zur Perifation und Bewertung der OCR und der Laktatproduktionsrate (LPR) für verschiedene isolierte Komponenten des Auges. LPR ist ein Parameter, der die glykolytische Rate widerspiegelt und in hohem Maße komplementär zur OCR ist, wobei das Paar die beiden Hauptzweige der Energieerzeugung aus Kohlenhydraten in der Zelle ausmacht10. Da die Vorbereitung des Gewebes und das Einlegen in die Gewebekammern am besten durch das Beobachten des Verfahrens erlernt wird, hilft das Video, einige der kritischen Schritte zu veranschaulichen, die während der Einrichtung und des Betriebs durchgeführt werden und die nicht einfach durch Text allein vermittelt werden können.
Die Beschreibung des Protokolls ist in 8 Abschnitte unterteilt, die verschiedenen Phasen des Experiments entsprechen (Abbildung 2B): 1. Vorbereitung vor dem Versuch; 2. Herstellung/Äquilibrierung des Perifusats; 3. Einrichtung des Instruments; 4. Gewebeäquilibrierung; 5. Versuchsprotokoll; 6. Ausfall des Instruments; 7. Datenverarbeitung; und 8. Proben von Abflussfraktionen.
Protokoll
Alle Verfahren zur Entnahme von Gewebe von Ratten und Mäusen wurden vom Institutional Animal Care and Use Committee der University of Washington genehmigt.
1. Vorexperimentelle Vorbereitung
HINWEIS: Die folgenden Aufgaben werden mindestens einen Tag vor dem Experiment abgeschlossen.
- Gestaltung des Versuchsprotokolls
- Zuweisung der Gewebeplatzierung in Kanälen: Wählen Sie das Gewebe- oder Zellmodell aus, das in 3 der 4 Kanäle auf jeder Seite des MRM platziert werden soll. Eine Gewebekammer auf jeder Seite wird ohne Gewebe betrieben, das für die Baseline-Korrektur verwendet werden soll.
- Ordnen Sie die Proben mit einem der beiden typischen Designs an - unterschiedliche Testverbindungsprotokolle auf jeder Seite (z. B. nehmen Kanäle auf der einen Seite des MRM Testverbindungen auf, während die Kanäle auf der anderen Seite als Kontrolle dienen); das gleiche Injektionsprotokoll für die Testsubstanz auf beiden Seiten des MRM, aber unterschiedliche Gewebe oder Gewebemodelle im Vergleich zur Kontrolle auf beiden Seiten des MRM.
- Auswahl der Durchflussrate und der Gewebemenge für eine optimale OCR-Messung: Passen Sie die Durchflussrate an, bis die Änderung des Lebensdauerverhältnisses mal 100 etwa 3 beträgt.
HINWEIS: Typische Gewebemengen und entsprechende Flussraten sind in Tabelle 1 für Komponenten des Auges aufgeführt, bei denen das Gerät bei Flussraten zwischen 6 und 80 μl/min/Kanal am besten funktioniert. - Berechnung des erforderlichen Medien-/Puffervolumens: Berechnen Sie das Volumen der Medien, die zu Beginn des Experiments zu jedem MRM-Einsatz hinzugefügt werden sollen, wie
VolumenMRM = 30 ml + Dauer des Protokolls (in min) x Flussrate (in ml/min) x 4 Kanäle (Gl.1)
Bei 0,01 ml/min ermöglicht beispielsweise eine 60-ml-MRM mit Startvolumen ein 12,5-Stunden-Protokoll (wobei 30 ml aufgebraucht sind, während 30 ml verbleiben), während bei 0,04 ml/min eineMRM mit einem Startvolumen von 90 ml ein 6-Stunden-Protokoll (mit 30 ml verbleibender Menge) ermöglicht. - Injektionsprotokoll für Testverbindungen: Wählen Sie die zu bewertenden Testverbindungen, die zu testende Konzentration (in der Regel so gewählt, dass sie eine nahezu maximale Reaktion oder Konzentrationsabhängigkeiten liefert) und die Dauer der Exposition aus. Achten Sie auf die Löslichkeit und füllen Sie die Vorräte in den gewünschten Lösungsmitteln wie Wasser, DMSO oder Ethanol auf.
- Wählen Sie den Zeitpunkt der Injektionen und nachfolgenden Injektionen so aus, dass die Reaktion einen stabilen Zustand erreicht, bevor ein nachfolgender Wirkstoff hinzugefügt wird. Passen Sie bei der Wiederholung von Protokollen den Zeitpunkt der Injektionen an, so dass mehrere Zeitverläufe gemittelt werden können.
HINWEIS: Die hier verwendeten Verbindungen stammen aus einem früheren mitochondrialen (Mito) Stresstest 11 und sowohl Oligomycin als auch Carbonylcyanid 4-(Trifluormethoxy)phenylhydrazon (FCCP) erfordern DMSO sowohl in den Stammlösungen als auch im endgültigen Perifusat. - Abfluss-Probenahmezeiten: Wählen Sie die gewünschten Fraktionssammelintervalle (von 1-60 min/Probe), wobei schnellere Abtastraten für schnelle Änderungen und längere Zeitintervalle gewählt werden, wenn sich der stationäre Zustand nähert. Verwenden Sie ausreichende Well-Volumina (0,3 bis 1,5 ml), um ein Überlaufen während des Probenahmeintervalls zu vermeiden (wählen Sie Volumina, die größer als die Durchflussrate x das Zeitintervall sind).
HINWEIS: Die Probenahmezeiten variieren je nach Wahl des Protokolls, aber für einen Mito-Stresstest haben wir üblicherweise 5-Minuten-Intervalle während der Baseline und 15-Minuten-Intervalle während der Injektionen verwendet (-15, -10, -5, 0, 15, 30, 45, 60, 75, 90, 105, wobei jedes Mal der Beginn des Probenahmeintervalls ist). - Geben Sie die oben beschriebenen ausgewählten Werte für die Testverbindungen und die Fraktionssammlung in die Benutzeroberfläche (UI) ein, die grafische Darstellungen dieser Informationen generiert. Exportieren und Verteilen von Dateien für Gruppenbewertungen und Diskussionen (ergänzende Abbildung 1).
- Legen Sie das Zubehör und die Verschleißteile fest
- Geben Sie die vom Hersteller gelieferten und aseptisch vorverpackten Verbrauchsmaterialien an, darunter: TCAs (Packung mit 8 Stück), Ausflussschlauchbaugruppen (Packung mit 8 Röhrchen), Injektionsschläuche für Testmischungen (2), Pinzetten, Schlauchklemmen (3), MRM, MRM-Einsätze (2), Rührstäbchen (2) und Spülschläuche (in einer biologischen Sicherheitswerkbank).
- Verwenden Sie keine Einwegteile, die mit Flüssigkeit in Berührung kommen, da dies zu einer Zunahme des Versuchsversagens führt. Verwenden Sie die Pinzette und die Rührstäbe wieder, indem Sie sie zwischen den Experimenten reinigen und autoklavieren.
2. Herstellung und Äquilibrierung von Perifusat (Zeit: 30 min ohne Inkubationszeit)
- Bereiten Sie das Medium oder den Krebs-Ringer-Bikarbonatpuffer (KRB) am Vortag auf der Grundlage von Berechnungen aus Gleichung 1 vor, in der Regel 200 ml, und inkubieren Sie dann über Nacht in einem 39 °C/5 % CO2 - Inkubator in T225-Gewebekulturflaschen mit nicht mehr als 90 ml in jedem Kolben.
- Bei Verwendung von handelsüblich hergestelltem KRB oder Medien (auf Raumtemperatur erwärmt) das Perifusat am Morgen des Experiments vorbereiten und mindestens 1 Stunde lang in den 5%igen CO2 -Inkubator geben. Bereiten Sie alle Lösungen aseptisch vor.
HINWEIS: Alle Flüssigkeiten und Teile des Fluidiksystems, die mit Flüssigkeit in Berührung kommen, sind zu Beginn des Experiments steril. Der Aufbau des Systems und die Beladung des Gewebes erfolgen jedoch offen an der Luft.
3. Äquilibrierung von Temperatur und gelöstem Gas zum Aufbau des Instruments (Zeit: 75 min)
- Befestigung von Schlauchbaugruppen am MRM
- Legen Sie das MRM und ein Fluidikpaket auf den Tisch neben dem Gerät. Stellen Sie sicher, dass sich die Schlauchklemmen (3), Rührstäbchen (2) und Pinzetten bereits in der Werkzeugablage befinden.
- Setzen Sie einen unbenutzten MRM-Einsatz mit einem Rührstab in jede Seite des MRM ein (siehe Abbildung 3).
- Befestigen Sie die TCAs an den Injektionsöffnungen an beiden Enden des MRM, so dass das Ende des Schlauchs direkt über dem Rührstab positioniert ist. Stellen Sie sicher, dass sich die längere der beiden Injektionsbaugruppen für die Prüfmasse auf der Rückseite des MRM befindet.
- Befestigen Sie als Nächstes die Gaszuflussleitung und die Spülschlauchbaugruppe an den hinteren bzw. vorderen freien Anschlüssen (siehe Abbildung 4A).
- Platzieren der MRM-/Schlauchbaugruppen im Gehäuse
- Setzen Sie das MRM (mit den angeschlossenen Schlauchbaugruppen) in die MRM-Heizung ein (Abbildung 4B).
- Positionieren Sie die vier Rohrbaugruppen in den Rillen der Wände im Boden des Gehäuses (zwei auf jeder Seite), so dass sie nach dem Einbau des mittleren Gehäuses nach außen herausragen.
- Befestigen Sie das MRM zwischen den Klemmen, indem Sie die beiden Räder am Detektorständer festziehen.
- Die längere Injektionsbaugruppe für die Prüfmasse, die von der Rückseite des Gehäuses herausragt, wird durch die beiden Rohrführungen an der Seite des Gehäuses geführt, so dass die Öffnung der Schläuche nach vorne zeigt (Abbildung 4C).
- Klemmen Sie jede der geschlossenen Prüfmasse-Injektionsbaugruppen ein.
- Zusammenbau des Gehäuses und Ansteuerung der Temperaturregler
- Schalten Sie die Steckdosenleiste, die alle elektrischen Geräte im Gehäuse mit Strom versorgt, in die Position ON. Der Lüfter am Detektorständer schaltet sich ein und der MRM-Temperaturregler sollte mit einem Sollwert von 38 °C aufleuchten (Abbildung 5).
- Schalten Sie die Rührstäbchen mit der Benutzeroberfläche auf 70 U/min ein, um sicherzustellen, dass sich die Rührstäbchen reibungslos drehen. Sobald das richtige Rühren beobachtet wurde, schalten Sie die Rührer aus.
- Platzieren Sie den mittleren Teil des Gehäuses auf dem Sockel.
- Verbinden Sie das Kabel im mittleren Teil des Gehäuses mit dem Kabel vom Schaltkasten, um den Hebelschalter des Umgebungstemperaturreglers mit Strom zu versorgen und die Umgebungstemperaturheizung mit Strom zu versorgen.
- Setzen Sie den Deckel auf das Gehäuse und das Display des oberen Temperaturreglers (Umgebungstemperaturregler) leuchtet auf und zeigt 36 °C an. Starten Sie einen Timer für 30 Minuten, die Zeit, die die MRM-Heizung benötigt, um die Solltemperatur zu erreichen.
- Einfügen der TCAs in das PCM
- Verwenden Sie das TCA-Einführwerkzeug, um jeden der 8 TCAs in die PCM-Löcher einzuführen, indem Sie mit der Vorderseite des Einführwerkzeugs fest auf den Adapter drücken, bis die Oberseite der Schlauchhülse, die um die Gewebekammer gewickelt ist, die Oberfläche berührt, die die Löcher im PCM umschreibt.
- Setzen Sie einen TCA vollständig ein, bevor Sie den nächsten einsetzen. Legen Sie das teilmontierte PCM neben die PCM-Strebe und 6 Schrauben beiseite.
HINWEIS: Das unvollständige Einführen eines TCA verhindert, dass der Kopfraum den Drucksollwert erreicht, und Perifusat fließt nicht.
- Befüllung der beiden Einsätze im MRM mit voräquilibriertem Perifusat
- Übertragen Sie dazu 30 Minuten, nachdem das Gehäuse zusammengebaut wurde und das MRM die Temperatur erreicht hat, das voräquilibrierte Perifusat in den vorgewärmten MRM-Einsatz, indem Sie die Flüssigkeit mit einer 50-ml-Pipette vorsichtig an den Seiten verteilen.
ANMERKUNG: Diese Schritte sowie die Schritte in Abschnitt 3.6 sollten sofort durchgeführt werden, um eine Gasübertragung zwischen dem Perifusat im MRM und der Atmosphäre zu vermeiden.
- Übertragen Sie dazu 30 Minuten, nachdem das Gehäuse zusammengebaut wurde und das MRM die Temperatur erreicht hat, das voräquilibrierte Perifusat in den vorgewärmten MRM-Einsatz, indem Sie die Flüssigkeit mit einer 50-ml-Pipette vorsichtig an den Seiten verteilen.
- Montage des MRM/PCM zu einer gasdichten Abdichtung und Positionierung des O2 - Detektors
- Platzieren Sie das PCM auf dem MRM, indem Sie die Widerstandsrohre der TCAs, die von der Unterseite des PCM ausgehen, in die MRM-Einsätze einführen, 4 auf jeder Seite des MRM-Teilers. Richten Sie das PCM so aus, dass die Gewebekammern nach der Positionierung am O2-Detektor anliegen können.
- Befestigen Sie das PCM und die PCM-Stützstrebe mit den 6 Schrauben mit dem elektrischen Schraubendreher.
- Befestigen Sie die TCAs in den PCM-Stützrippen mit dem bereitgestellten Gummiband, indem Sie es auf Höhe der Gummidichtungen um die Lamellen des PCM spannen (Abbildung 6).
- Positionieren Sie den O2-Detektor so auf dem Detektorständer, dass die Vorderseite des Detektors an den Lamellen des PCM anliegt. Überprüfen Sie, ob die LED/Photodetektor-Paare mit demO2-empfindlichen Farbstoff in den Gewebekammern übereinstimmen. Passen Sie bei Bedarf die seitlichen Führungen des O 2-Melders an, nachdem Sie die Stellschrauben an der Seite des O2-Melderhalters gelöst haben.
- Setzen Sie den Deckel auf das Gehäuse.
- Äquilibrierung des Gases im Kopfraum im MRM mit dem Perifusat
- Wenn das Hochdruckventil vollständig gesichert und geschlossen ist, öffnen Sie das Gastankventil, indem Sie das Flaschenventil auf der Oberseite des Tanks gegen den Uhrzeigersinn drehen.
- Stellen Sie den Hochdruckregler mit dem Knopf am Regler auf einen Druck von 10 psi ein.
- Setzen Sie das MRM unter Druck, indem Sie den Niederdruckregler auf 1,0 psi einstellen (Abbildung 7A).
- Lösen Sie das Spülrohr (Abbildung 7B), damit das Gas aus dem Tank 15 Minuten lang die Luft im MRM-Kopfraum ersetzen kann (die Injektoren der Testmischung bleiben eingespannt). Bestätigen Sie den Gasfluss, indem Sie das Ende des Spülrohrs in ein Becherglas mit Wasser tauchen, um die Blasenbildung zu beobachten.
- Sobald der Durchfluss bestätigt wurde, ist der O2-Detektor wie in Abschnitt 3.8 beschrieben in Betrieb zu nehmen.
- Schalten Sie den Rührer nach 15 Minuten bei 70 U/min ein und lassen Sie ihn für den Rest des Experiments laufen. Nach weiteren 15 Minuten klemmen Sie die Spülschlauchbaugruppe fest (Abbildung 7C).
- Senken Sie den Druck am Niederdruckregler auf den Betriebsdruck, der die gewünschte Durchflussrate der Flüssigkeit erreicht (wie in der Versuchspackung angegeben - normalerweise zwischen etwa 0,5 und 0,7 psi). Wenn die Durchflussrate über 20 μl/min liegt, stellen Sie den Druck vorübergehend auf 0,3 psi ein, um Zeit zu haben, das Gewebe zu belasten, ohne dass die Kammern überlaufen. Dies ist nicht erforderlich, wenn das Gewebe innerhalb von 15 Minuten nach dem Einsetzen der Klemme belastet wird.
HINWEIS: Lassen Sie den Puffer nicht an der Außenseite der Gewebekammer herunterlaufen, da die Flüssigkeit dieO2-Messung beeinträchtigen kann.
- Starten desO2-Detektors
- Aktivieren Sie die O 2-Detektor-Software auf dem Laptop, indem Sie auf das Symbol mit der Bezeichnung Sauerstoffdetektor klicken.
- Vergewissern Sie sich nach dem Öffnen des Programms (ergänzende Abbildung 2), dass der richtige COM-Port ausgewählt ist. Bei Bedarf kann der COM-Port identifiziert werden, indem derO2-Melder vom Computer getrennt und eingesteckt wird, so dass die Portnummer angezeigt wird. Wenn der COM-Port während der Ausführung der Anwendung abgezogen wird, muss die Anwendung vor der Verwendung geschlossen und erneut geöffnet werden.
- Klicken Sie auf Start und dann auf Aufzeichnen (und speichern Sie die Daten im Sicherungsordner). Klicken Sie anschließend auf Diagramm.
- Ändern Sie den Durchschnittswert unten links im Lebensdauerdiagramm in 5 (wodurch das Programm angewiesen wird, einen gleitenden Durchschnitt mit 5 aufeinanderfolgenden Punkten zu berechnen). Nachdem eine Minute vergangen ist und der erste Datenpunkt auf dem Diagrammbildschirm angezeigt wird, klicken Sie auf Automatisch skalieren.
4. Gewebebelastung und Äquilibrierungszeit (Zeit: 90 min)
- Positionierung der Fritten in den Gewebekammern
- Entfernen Sie den Deckel und die Mittelteile des Gehäuses.
- Nachdem das Perifusat in den Gewebekammern über die Oberseite der vorpositionierten Fritte gestiegen ist, drücken Sie die Fritte mit dem Frittensignal nach unten, indem Sie leicht auf die Oberseite der Fritte klopfen, um alle Luftblasen zu entfernen, die sich unter oder innerhalb der Fritte gebildet haben.
- Positionieren Sie die Fritten etwa 0,25 Zoll über dem Boden der Gewebekammer.
- Laden von Gewebe in die Gewebekammern
- Sobald der Füllstand des Mediums 0,5 Zoll von der Oberseite entfernt ist, legen Sie das Gewebe in die Kammer.
- Belastung der Netzhaut oder RPE-Aderhaut-Sklera: Entnahme von Netzhaut oder RPE-Aderhaut-Sklera wie in 6. beschrieben. Um das Gewebe zu laden, verwenden Sie eine feine Pinzette, um das Gewebe vorsichtig in jede Kammer zu legen, wobei Sie darauf achten müssen, dass das Gewebe nicht gefaltet wird, während Sie ein Tuchtuch verwenden, um zu verhindern, dass Flüssigkeit aus der Gewebekammer auf den O2-Sensor tropft. Beobachte, wie das Gewebe auf die Fritte zu- und absinkt.
HINWEIS: Stellen Sie zwischen dem Zeitpunkt der Entnahme des Gewebes und dem Einlegen des Gewebes in die Kammern sicher, dass ein Trauma des Gewebes vermieden wird, indem Sie das Gewebe nicht länger als 10 Minuten in einem Puffer/Medium auf Bikarbonatbasis außerhalb des Inkubators lassen und sicherstellen, dass das Gewebe in genügend Puffer/Medien (mindestens 1 ml/10 mg Gewebe) gebadet wird, um zu verhindern, dass das Gewebe hypoxisch wird und der Luft ausgesetzt wird. - Laden von RPE-Zellen auf Transwell-Membranen: Bereiten Sie RPE-Zellen vor, wie zuvor 12 und in Ergänzungsdatei 1 beschrieben. Passagezellen mit 0,25 % Trypsin-EDTA und Seed auf Polyethylenterephthalat, spurgeätzte Filter (Zellkultureinsätze, Porengröße 0,4 mm) mit mindestens 2,0 x 105 Zellen/cm2. Am Tag des Versuchs werden die Membranen in drei gleich breite Streifen geschnitten und mit einer Pinzette in die Gewebekammern geladen (siehe Abbildung 8A).
- Befestigen der Abflussschlauchbaugruppen an Gewebekammern
- Entfernen Sie die Abflussschlauchbaugruppen aus der Verpackung und platzieren Sie den Abscheider für die Abflussschläuche auf der Lippe des mittleren Teils des Gehäuses, so dass sich die Abflussschlauchadapter auf der Innenseite des Gehäuses befinden (Abbildung 8B, C).
- Achten Sie darauf, nicht zu stark auf die TCAs zu drücken (da sie sich sonst vom MRM lösen), und befestigen Sie die Abflussschlauchadapter an der Oberseite der TCAs der Gewebekammern (Abbildung 8D). Setzen Sie die Mitte des Gehäuses wieder ein, und schließen Sie das Kabel zur Steuerung der Umgebungstemperatur wieder an.
- Vergewissern Sie sich vor dem Ersetzen des Deckels des Gehäuses, dass die Komponenten des Fluidiksystems im Inneren des Gehäuses, einschließlich desO2-Detektors , des PCM, der Gewebekammern, der Ausflussrohre, des MRM und der Heizung, ordnungsgemäß positioniert sind, wie in Abbildung 8E dargestellt.
- Setzen Sie den Deckel des Gehäuses wieder auf. Führen Sie die acht Abflussrohre durch den Führungsarm des Fraktionssammlers.
- Fraktionssammler aktivieren
- Stellen Sie sicher, dass der Fraktionssammler relativ zur rechten Wand des Gehäuses und des Ausflussrohrhalters zentriert ist: Die linke Stütze des Fraktionssammlerbodens sollte an der Kante der Gehäusewand anliegen.
- Klicken Sie auf dem Laptop auf die Verknüpfung der Benutzeroberfläche , und die experimentelle Infoseite wird geöffnet (ergänzende Abbildung 3 oben).
- Füllen Sie die Informationen in die entsprechenden Felder auf der experimentellen Infoseite aus (dies kann vor dem Start des Experiments erfolgen) und klicken Sie dann oben auf die Seite Flow & Fraction Collector (Ergänzende Abbildung 3 unten).
- Einstellen von Parametern für die automatisierte Durchflussmessung
- Wählen Sie die gewünschte Integrationszeit im Dropdown-Menü für die Probenerfassungszeit oben in der Mitte aus, um die gewünschte Genauigkeit (die proportional zur Integrationszeit ist) und die zeitliche Auflösung auszugleichen.
- Wenn im Experiment keine Abflussfraktionen erfasst werden, klicken Sie auf Start und fahren Sie mit Abschnitt 4.7 fort. Wenn Abflussfraktionen gesammelt werden sollen, sind die Schritte in Abschnitt 4.6 durchzuführen.
- Sammeln von Abflussfraktionen
- Aktivieren Sie in der UI-Software die Option Brüche sammeln? auf der Seite "Experiment-Info" oder auf der Seite "Flow & Fraction Collector". Klicken Sie dann auf die Schaltfläche FC-Einstellungen berechnen .
- Wenn sich das neue Fenster öffnet, geben Sie die Zeit der ersten Injektion in das Protokoll (definiert als Zeit = 0) und die Durchflussrate pro Kanal sowie die Zeitintervalle für jede Probe ein. Klicken Sie dann auf Compute.
- Sobald die Intervalle der Sammlung überprüft wurden, klicken Sie auf Generieren und Starten.
- Messung von Durchflussraten für einzelne Kanäle (optional)
- Sollen die Durchflussraten einzelner Kanäle gemessen werden (die unter normalen Bedingungen nur um wenige Prozent variieren), müssen acht (oder weniger) Mikrozentrifugenröhrchen gewogen und deren Gewicht aufgezeichnet werden.
- Setzen Sie den Röhrchenhalter mit den vorgewogenen Mikrozentrifugenröhrchen auf den Plattenschlitten. Klicken Sie im Abschnitt "Andere Dienstprogramme" auf " Durchflussrate manuell messen" .
- Wählen Sie die Messdauer aus und klicken Sie dann auf Vorlage generieren. Schließen Sie das Fenster und klicken Sie auf Start. Der Fraktionssammler sammelt für die Messdauer Flüssigkeit aus den Ausflussrohren und kehrt dann in seine Ausgangsposition zurück.
- Wiegen Sie die Mikrofugenröhrchen nach der Entnahme und verwenden Sie die Gewichtsdifferenz geteilt durch die Messdauer, um die Durchflussrate zu berechnen (wobei 1 mg = 1 μl ist).
- Baseline-Stabilisierung
- Sobald das Gewebe und/oder die Zellen in die Gewebekammern geladen wurden, lässt man das System 90 Minuten lang ausgleichen, um eine flache Basislinie desO2-Verbrauchs zu ermitteln, zu welchem Zeitpunkt die erste Testverbindung injiziert werden kann (betrachtet als Zeit = 0).
- Geben Sie 30 Minuten vor der ersten Injektion den durchschnittlichen Wert der letzten 3 FR pro Kanal in die Injektionsseite ein, um die Injektionen der Testverbindung vorzubereiten.
5. Versuchsprotokoll (Zeit: 2-6 h)
HINWEIS: Sobald die Basislinienstabilisierung im Gange ist, bestehen die nächsten Aufgaben darin, die Testverbindungen zu injizieren und die Platten auf dem Fraktionssammler zu wechseln, wenn mehr als eine verwendet wird.
- Vorbereiten des Injektats der Testverbindung
- Geben Sie die Namen der Verbindungen, die gewünschten Konzentrationen (End- und Stammlösungen) und die Injektionszeiten der Testverbindungen in die Tabelle in der Benutzeroberfläche auf der Seite Injektion ein. Bestätigen Sie die im Programm angezeigten Informationen, einschließlich der Volumina im MRM, die zum Zeitpunkt der Injektionen noch vorhanden sind, und der Menge der Stammlösung, die injiziert werden muss, um die gewünschten Konzentrationen zu erreichen (Ergänzende Abbildung 4).
- Um zu berechnen, wie viel Perifusat und Vorrat für die Injektion benötigt werden, füllen Sie die weißen Kästchen der Injektionstabelle aus und klicken Sie auf Berechnen. Unter Verwendung der berechneten Werte wird die Stammlösung der Testverbindung vor der Injektion mit Perifusat verdünnt, so dass das injizierte Volumen 5 % des Volumens im MRM nach der Injektion beträgt.
- Bereiten Sie jede Testverbindung vor, indem Sie die Stammlösung und das Perifusat mischen. Laden Sie die Spritzen mindestens 10 Minuten vor der Injektion und bewahren Sie sie in einem CO2 - Inkubator (bei Temperaturen zwischen 37 und 40 °C) auf, bis sie zur Injektion bereit sind.
- Injektion von Testverbindungen
- Schließen Sie die Spritze mit der Testverbindung an die Injektionsleitungen an (Abbildung 9A). Lösen Sie den weichwandigen Pharmed Schlauch, der zur Injektionsleitung führt, und injizieren Sie die Testverbindungen (Abbildung 9B) langsam mit einer Geschwindigkeit von ca. 3 ml/min. Klemmen Sie den Schlauch wieder in die Injektionsleitung und entfernen Sie dann die Spritze (Abbildung 9C). Wiederholen Sie den Vorgang für die andere Seite des MRM.
- Bereiten Sie nach der Injektion jeder Testverbindung jede nachfolgende Testverbindung für die Injektion gemäß der UI-Injektionsseite vor.
- Bestimmung desZufluss-O2-Signals für jeden Kanal
- Am Ende jedes Experiments wird der Ateminhibitor KCN (3 mM) injiziert, um das Einflusslebensdauersignal für jeden Kanal zu bestimmen, das zur Korrektur der Variation der Lebensdauer des Ausgangssensors und des nicht-mitochondrialen Sauerstoffverbrauchs verwendet wird.
6. Beenden des Experiments und Zerlegen des Systems (Zeit: 30 min)
- Speichern von Sauerstoffdaten
- Klicken Sie auf die Schaltfläche Speichern oben links im Grafikfenster der Sauerstoffdetektor-Software. Benennen Sie die Datei und speichern Sie sie in dem Ordner, in dem die Datei aufbewahrt wird. Klicken Sie im Hauptfenster auf die Schaltfläche Aufnahme beenden , um die Sicherungsdatei zu speichern.
- Speichern der experimentellen Infodatei für die Benutzeroberfläche
- Klicken Sie auf die Schaltfläche Profil speichern oben links auf der allgemeinen Seite der Benutzeroberfläche. Benennen Sie die Datei und speichern Sie sie in dem Ordner, in dem die Datei aufbewahrt wird. Klicken Sie auf der Seite "Bruch und Fluss" der Benutzeroberfläche auf das Dropdown-Menü " Tools " und dann auf "Speichern". Behalten Sie den generierten Namen bei oder wählen Sie einen anderen und speichern Sie die Datei an der gewünschten Stelle. Bei Bedarf gibt es Backup-Dateien, auf die zugegriffen und die gespeichert werden können.
- Zerlegung des Instruments
- Da KCN flüchtig ist, entsorgen Sie die Fluidikbaugruppen in einem Abzug. Gießen Sie Medien aus der MRM- und FC-Abfallwanne in einen Abfallbehälter und spülen Sie die MRM-Einsätze und Stangen gründlich mit Wasser um. Gießen Sie den Inhalt des Abfallbehälters (KCN-haltig) in einen beschrifteten Chemikalienabfallbehälter für die anschließende Entsorgung durch die Chemikaliensicherheit. Reinigen und autoklavieren Sie die Rührstäbe und Pinzetten vor dem nächsten Experiment gründlich.
7. Datenverarbeitung (Zeit: 15-45 min)
- Öffnen Sie die Datenverarbeitungsanwendung auf einem Mac- oder PC-Computer. Wählen Sie die CSV-Datendatei aus, die von einem Experiment generiert wurde. Wenn das Protokoll dieses Experiments einem zuvor analysierten Experiment ähnelt, wählen Sie diese Einstellungsdatei aus, und klicken Sie auf Nächster Schritt. Andernfalls klicken Sie einfach auf Nächster Schritt , um mit der Eingabe der Einstellungen des Experiments zu beginnen.
- Geben Sie die verschiedenen Einstellungen des Experiments ein. Wählen Sie bei der Bestimmung des Referenzzeitpunkts den Zeitpunkt aus, der unmittelbar vor dem Inkrafttreten der KCN und der Verringerung der Lebensdauerwerte liegt. Wählen Sie diesen Punkt mit Hilfe eines Schiebereglers aus oder geben Sie den Zeitwert in das Feld ein.
- Klicken Sie auf Berechnen , um OCR-Diagramme gemäß Gleichung 2 zu generieren:
OCR = ([O 2]in- [O 2]out) x FR = (217 nmol/mL - [O 2]out) x FR/Gewebebasis (Gl. 2)
wobei die O2-Konzentration in KRB im Gleichgewicht mit 21 %O2 bei 37 °C 217 nmol/ml beträgt, FR die Flussrate (in ml/min) ist, die Gewebebasis die Menge des in die Kammer geladenen Gewebes ist (d. h. Anzahl der Netzhaut-, RPE-Aderhaut-Sklera- oderRPE-Zellen). - Speichern Sie die Diagramme als .pdf-Dateien, indem Sie auf die Schaltfläche Diagramm exportieren klicken. Stellen Sie die OCR entweder als absolute Werte oder als Bruchteil eines stationären Wertes dar, indem Sie die Kontrollkästchen aktivieren, die der Testverbindung entsprechen, die auf der Seite "Einstellungen bearbeiten" auf 1 gesetzt werden soll.
8. Proben von Abflussfraktionen
- Wenn die Proben nicht unmittelbar nach dem Experiment untersucht werden können, werden die Platten bei 4 °C gelagert, wenn sie am nächsten Tag untersucht werden, oder eingefroren, wenn sie länger gelagert werden. Wenn die Platten eingefroren sind, tauen Sie die Proben bei 4 °C auf (damit die Proben kalt bleiben).
- Sobald Assays an den ausgewählten Abflussfraktionen durchgeführt wurden, werden die Datenspalten (eine pro Kanal) in eine .csv Datei mit Zeit (in min) in der Spalte ganz links und Konzentration in der rechten Spalte (entweder in nmol/mL oder ng/ml) eingegeben. Ein Link im Datenverarbeitungsprogramm lädt beim Drücken eine Vorlage hoch.
- Laden Sie diese Datei in den Datenprozessor hoch, um die Daten zu berechnen und darzustellen.
Ergebnisse
Um die Auflösung der Daten zu veranschaulichen, die aus isolierten Komponenten des Auges generiert wurden, wurden OCR und LPR mit drei Gewebetypen (Netzhaut, RPE-Aderhaut-Sklera und RPE-Zellen) nach einem häufig verwendeten Protokoll (dem mitochondrialen Stresstest10; Abbildung 10, Abbildung 11 und Abbildung 12). Die Menge an Gewebe, die für jedes Gewebe verwendet wird, ist in Tabelle 1 dargestellt. Die Daten wurden mit dem Softwarepaket, das für das Fluidiksystem entwickelt wurde, verarbeitet und grafisch dargestellt. Die Präparation von Netzhaut und RPE-Aderhaut-Sklera ist relativ einfach und dauert für jeden Gewebetyp weniger als 20 Minuten. Die OCR war während der Zeit, in der die Testsubstanzen injiziert wurden, konstant, was auf eine stabile Gesundheit und Funktion des Gewebes hinweist und die Gültigkeit der Methode unterstützt (Abbildung 10). Nach der Validierung für jeden Gewebetyp haben wir es nicht für notwendig befunden, Kontrollen durchzuführen, bei denen für jedes Experiment keine Testverbindungen injiziert werden. In Übereinstimmung mit Daten, die mit konventionellerenPerifusionsmethoden 6,8,13 gewonnen wurden, verringerte sich die OCR als Reaktion auf Oligomycin und erhöhte OCR als Reaktion auf FCCP. Die Veränderungen der LPR verliefen in die entgegengesetzte Richtung zu denen, die für OCR beobachtet wurden: Oligomycin erhöhte die LPR, die dann als Reaktion auf FCCP (aber nur geringfügig) abnahm (Abbildung 11). Um die statistische Signifikanz der Wirkung jeder sequentiellen Testverbindung zu vergleichen, wurden t-Tests durchgeführt (die automatisch von der mit dem Gerät gelieferten Software berechnet werden). Da das Ziel der Arbeit darin bestand, die Durchführung der Methode zu beschreiben, war die Anzahl der durchgeführten Replikate nicht immer hoch genug, um eine statistische Signifikanz zu erzielen. Im Allgemeinen jedoch, wenn die Anzahl der Replikate 3 oder mehr betrug, waren die Auswirkungen von FCCP und Oligomycin sowohl auf OCR als auch auf LPR signifikant.
RPE-Zellen wurden bisher nicht mit Flow-Systemen analysiert, reagierten aber ähnlich wie RPE-Aderhaut-Sklera (konsistent mit der Ansicht, dass ein großer Teil der OCR auf RPE-Zellen zurückzuführen ist; Abbildung 11). Diese anschaulichen Beispiele unterstreichen die Fähigkeit des Systems, die Lebensfähigkeit des Gewebes aufrechtzuerhalten, was sich in der Stabilität der OCR in den Kontrollkanälen widerspiegelt, und das hohe Signal-Rausch-Verhältnis für Änderungen der OCR in der Größenordnung, die durch Oligomycin und FCCP induziert werden, das mehr als 100 zu 1 betrug. Darüber hinaus können Assays von Abflussfraktionen verwendet werden, um die Aufnahme- oder Produktionsrate einer Vielzahl von Verbindungen zu korrelieren, die mit der extrazellulären Flüssigkeit ausgetauscht werden, die komplementär zur OCR (in diesem Fall LPR) sind. Diese Eigenschaften des Instruments ermöglichten eine genaue Quantifizierung der charakteristischen Unterschiede in den Gewebeantworten zwischen den parallel durchgeführten Gewebetypen. OCR durch RPE-Aderhaut-Sklera und RPE-Zellen sind durchweg empfindlicher gegenüber Oligomycin als auf der Netzhaut (Abbildung 11 und Abbildung 12), obwohl die Dauer der Exposition gegenüber FCCP für die RPE-Aderhaut-Sklera nicht lang genug war, um einen Steady State zu erreichen. Ein Punkt, der bei der Verwendung von DMSO als Lösungsmittel zu beachten ist, ergab sich. Bei höheren Konzentrationen (0,2 %) hatte DMSO eine vorübergehende Wirkung auf die OCR durch die Netzhaut (vermutlich eine Änderung des osmotischen Drucks, die durch die Wirkung von DMSO auf die Membranpermeabilität hervorgerufen wurde).
Basierend auf der Annahme, dass KCN die Atmung durch seine direkte Wirkung auf die Cytochrom-c-Oxidase vollständig hemmt, wird die OCR am Ende der KCN-Exposition auf 0 gesetzt und alle OCR-Werte werden basierend auf der Änderung relativ zum KCN-Wert berechnet. OCR kann unabhängig von der Atmungskette und der Cytochrom-c-Oxidase auftreten. Die Größenordnung dieses Beitrags zur Gesamt-OCR beträgt jedoch im Allgemeinen nicht mehr als ein paar Prozent (Daten nicht gezeigt), und die längere Zeitspanne, in der das Gewebe KCN ausgesetzt ist, stellt sicher, dass Substrate von Oxidasen, die nicht Teil der Elektronentransportkette sind, erschöpft sind.
Statistische Analyse
Einzelne Experimente wurden wie in den Abbildungen gezeigt gezeigt, jedoch mit mehreren Kanälen, die gemittelt wurden. Die Daten wurden dann als Mittelwert ± Standardfehlers (SE; berechnet als SD/√n) grafisch dargestellt.
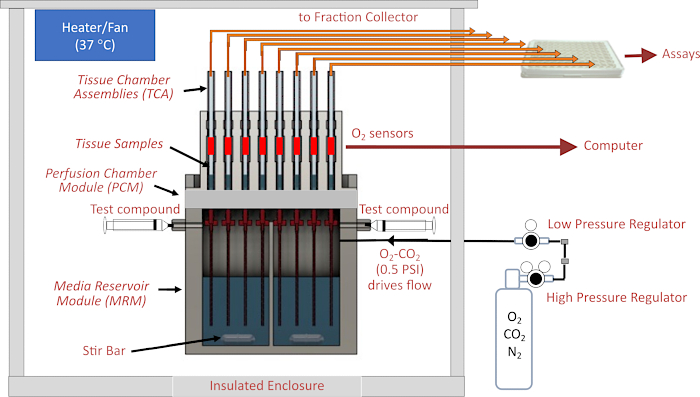
Abbildung 1. Schematische Darstellung des Fluidik-/Bewertungssystems. Zu den Hauptkomponenten gehören das Gehäuse, die Temperierelemente, die Fluidik- und Gewebekammersysteme, die Regelung des Gasdrucks im Kopfraum über dem Perifusat, die Überwachung des Fraktionssammlers/der Durchflussrate und dieO2-Detektoren . Abkürzungen: MRM = Media Reservoir Module, PCM = Perifusion Chamber Module, TCA = Tissue Chamber Assemblies. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2. (A) Abbildung der Hauptkomponenten des Instruments. Die Hauptkomponenten bestehen aus dem Gastank (Druckregler), dem Gehäuse, dem Fraktionssammler und dem Computer. (B) Experimentelles Flussdiagramm mit den wichtigsten Kategorien von Schritten und der Zeit, die für ihre Durchführung benötigt wird. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3. Ansicht des MRM. Das MRM wird mit einem MRM-Einsatz (links) und Rührstäbchen (rechts) dargestellt, die in der Unterseite der MRM-Einsätze (auf jeder Seite des MRM-Trennteilers) platziert sind. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4. Schlauchbaugruppe und Spülschlauchbaugruppe im MRM. (A) Prüfen Sie die Injektionsschlauchbaugruppe und die Spülschlauchbaugruppe, die an den Anschlüssen des MRM angebracht sind. (B-C) Die Injektionsbaugruppe für die Prüfmasse und die Spülschlauchbaugruppe (B) werden in die Nut an der Vorderseite des Gehäuses (C) eingesetzt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5. Einschalten des MRM-Temperaturreglers. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6. Gewebekammern und Gastank. Positionieren des O2-Detektors auf dem Detektorständer (der auch MRM und PCM unterstützt) und Platzieren des Bandes um die Lamellen des PCM, die helfen, die Gewebekammern an Ort und Stelle zu sichern. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 7. (A) Hoch- und Niederdruckregler am Gastank. (B-C) Spülrohr ausspülen. Durch das Spülrohr kann der Kopfraum im MRM entlüftet und mit Gas aus dem Vorratstank gefüllt werden. Bilder zeigen offenes Spülrohr (B) und geschlossenes Spülrohr (C). Die Prüfmasse-Injektionsbaugruppe bleibt während des Spülvorgangs geschlossen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 8. Gewebekammer und der Abflussaufbau. (A) Abmessungen der Transwell-Membran nach dem Schneiden in drei gleich breite Streifen. (B) Abfluss-Mehrrohrstütze. (C) Abflusshalterung mit mehreren Röhrchen, die an der Lippe des Gehäuses mit den Schlauchadaptern in der Nähe der Gewebekammern positioniert ist. (D) Bild der an den Gewebekammern befestigten Abflussschlauchbaugruppen. (E) Luftaufnahme des Gehäuses ohne Deckel. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 9. Injektion der Verbindung in MRM. Injektion einer Testverbindung durch die Injektionsöffnung in das MRM mit einer 5-ml-Spritze. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
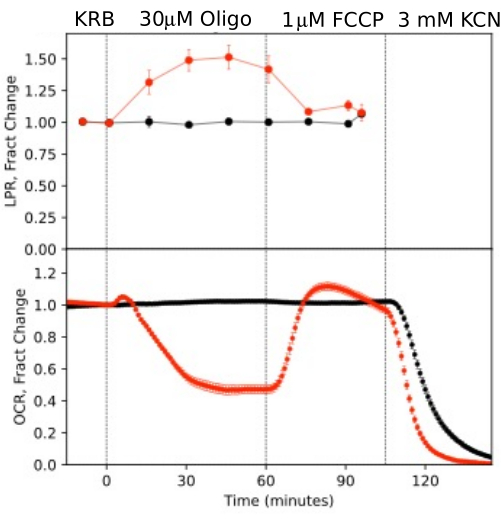
Abbildung 10. OCR- und LPR-Kurven als Reaktion auf Testverbindungen. OCR und LPR durch Netzhaut, die aus Mäusen isoliert wurden (1 Netzhaut/Kanal) als Reaktion auf das Vorhandensein oder Fehlen (Kontrolle) von Testverbindungen, wie angegeben. Jede Kurve ist der Durchschnitt von 6 Wiederholungen aus einem einzelnen Experiment (Fehlerbalken sind SE; p-Werte werden berechnet, indem gepaarte t-Tests durchgeführt werden, bei denen die stationären Werte für jeden Testagenten mit denen des vorherigen Testagenten verglichen werden). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
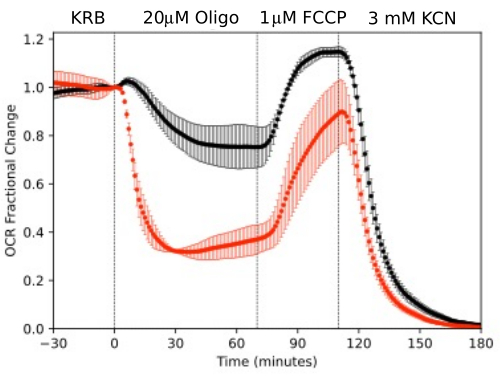
Abbildung 11. OCR-Kurven. OCR durch RPE-Aderhaut-Sklera und Retina, isoliert von Mäusen (1 Netzhaut oder 2 RPE-Aderhaut-Sklera/Kanal), die parallel als Reaktion auf Testverbindungen wie angegeben gemessen wurden. Die Daten sind der Durchschnitt der Replikate aus einem einzelnen Experiment (n = 2 bzw. 4 für RPE-Aderhaut-Sklera bzw. Netzhaut; die p-Werte werden berechnet, indem gepaarte t-Tests durchgeführt werden, bei denen die stationären Werte für jeden Testagenten mit denen des vorherigen Testagenten verglichen werden). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
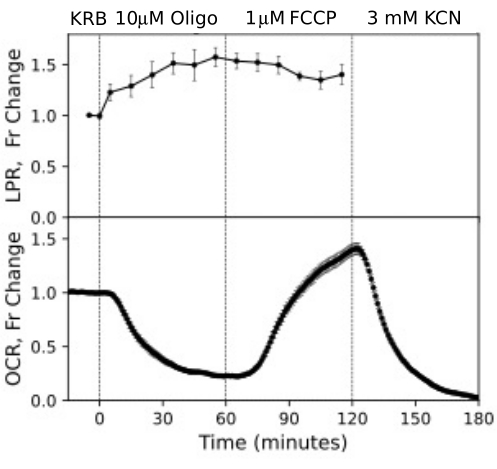
Abbildung 12. OCR- und LPR-Kurven von RPE-Zellen. OCR und LPR von RPE-Zellen, die an Transwell-Membranen gebunden waren, die in Streifen geschnitten und in die Perifusionskammern geladen wurden. Die Daten sind der Durchschnitt der Replikate aus einem einzelnen Experiment (n = 3, mit 1,5 Membranen/Kanal (360.000 Zellen/Kanal); die p-Werte werden berechnet, indem gepaarte t-Tests durchgeführt werden, bei denen die stationären Werte für jeden Testagenten mit denen des vorherigen Testagenten verglichen werden). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| GEWEBE/ZELLE | Betrag/Kanal | DURCHFLUSSRATE: ml/min |
| Netzhaut (Maus) | 1 | 0.025 |
| RPE-Aderhaut-Sklera (Maus) | 2 | 0.02 |
| RPE-Zellen auf Transwell-Membranen | 360.000 Zellen (4 x 1/3 Filterstreifen) | 0.016 |
Tabelle 1. Empfohlene Betriebsspezifikationen für unterschiedliche Gewebe.
Ergänzende Abbildung 1. Grafische Darstellung der Versuchsplanung. Zeitpunkt und Zusammensetzung der Exposition gegenüber Testverbindungen und Zeitpunkt der Fraktionssammlung. Das Konzentrationsinkrement (Conc Inc) ist die Änderung der Konzentration, die implementiert werden soll. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 2. Benutzeroberfläche beim Start. Benutzeroberfläche des Startfensters der O2-Detektionssoftware, die dasO2 in den in das PCM eingeführten Gewebekammern überwacht. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 3. Benutzeroberfläche für Experimenteinstellungen. Benutzeroberfläche für die Eingabe von experimentellen Informationen (links) und die Auswahl der Zeiten für die Erfassung von Abflussfraktionen (rechts). Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 4. Benutzeroberfläche der Injektionsseite. Injektionsseite, die das Injektionsvolumen auf der Grundlage der gewünschten Konzentrationen der Testverbindung und des im MRM verbleibenden Volumens berechnet. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzungsdatei 1: Verfahren zur Vorbereitung von Gewebeproben. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Aufgrund der Bedeutung der Bioenergetik in allen Aspekten der Zellfunktion und der Aufrechterhaltung verschiedener Komponenten des Auges besteht ein dringender Bedarf an Methoden, um ihre Regulation zu untersuchen. Insbesondere die neuronale Netzhaut und RPE sind sowohl für die Energieerzeugung als auch für die intra- und interzelluläre Signalübertragung vom Stoffwechsel abhängig14,15,16,17. Aufgrund ihrer hohen oxidativen Kapazität werden isolierte Gewebe des Auges unter statischen Bedingungen nicht gut gepflegt18,19, und daher erfordert die Untersuchung isolierter Komponenten des Auges Strömungssysteme, die Stoffwechselprozesse sowohl aufrechterhalten als auch bewerten können. Das Fluidiksystem wurde entwickelt, um OCR- und LPR-Daten aus einer Vielzahl von Gewebetypen zu generieren, und in dieser Arbeit haben wir detaillierte Protokolle vorgestellt, die optimale Ergebnisse liefern.
Die wichtigste Determinante für die Generierung robuster Daten mit dem Durchflusssystem ist die Voräquilibrierung von CO2 -basierten Medien/Puffern bei 39 °C (um sicherzustellen, dass Perifusat nicht mit gelöstem Gas übersättigt wird, das während des Experiments entgasen würde). Insbesondere bei 4 °C gelagerte Medien oder KRB-Puffer sind relativ zu 37 °C übersättigt und entgasen während des Experiments, wenn die Voräquilibrierungszeiten nicht ausreichen. Darüber hinaus darf Gewebe, das in die Gewebekammern geladen wird, nicht durch unsachgemäße Isolierung von Gewebe aufgrund von Rissen oder unvollständiger Trennung von Gewebe oder durch zu lange Exposition von Gewebe in geringer Menge an Puffer auf Bikarbonatbasis gegenüber atmosphärischer Luft traumatisiert werden. Die Temperaturregelung, die Durchflussstabilität und die Zuverlässigkeit derO2-Detektion weisen eine geringe Variabilität auf und diese Faktoren tragen nicht wesentlich zur Ausfallrate bei.
Das Gerät verfügt über acht gleichzeitig laufende Strömungskanäle/Gewebekammern, die aus zwei Reservoirs, vier Gewebekammern für jedes Reservoir, mit Perifusat versorgt werden. Um die genauesten Zeitverläufe der OCR zu erhalten, werden kinetische Kurven durch Kammern korrigiert, die nicht mit Gewebe belastet sind. Ein typisches experimentelles Protokoll würde also zwei Gruppen von drei Gewebekammern umfassen. Protokolle lassen sich im Allgemeinen in zwei Kategorien einteilen: Die eine sind die unterschiedlichen Testverbindungsprotokolle auf jeder Seite (z. B. Medikament/Vehikel auf der einen Seite des MRM und nur Vehikel auf der anderen); Das zweite ist das gleiche Testverbindungsinjektionsprotokoll auf beiden Seiten des MRM, aber ein anderes Gewebe oder Gewebemodell auf jeder Seite des MRM. In dieser Arbeit wurden die Wirkungen von Oligomycin und FCCP auf die Netzhaut mit der OCR von Gewebe verglichen, das keiner Testverbindung ausgesetzt war, und zwei Gewebe wurden gleichzeitig unter demselben Protokoll und denselben Bedingungen bewertet, um gewebespezifisches Verhalten zu identifizieren. Letzteres wurde in dieser Studie veranschaulicht, indem im selben Experiment ein erhöhter dynamischer Bereich der Stoffwechselrate von RPE-Aderhaut-Sklera im Vergleich zur Netzhaut gezeigt wurde. In anderen Berichten wurde ein breiteres Spektrum an Studiendesigns beschrieben, einschließlich der Messung der Auswirkungen unterschiedlicherO2-Spiegel auf OCR und LPR sowie der Konzentrationsabhängigkeiten von Kraftstoffen, Medikamenten und Toxinen20,21. Obwohl wir die Analyse der Abflussfraktionen auf die Messung von Laktat und die Berechnung von LPR beschränkt haben, nimmt der Informationsgehalt eines Experiments stark zu, wenn mehrere Verbindungen und Klassen von Verbindungen in den Abflussfraktionen wie Hormone, Neurotransmitter, Zellsignale und Metaboliten, die die Zellen verlassen können, untersucht werden20,22, 23. S.
Das Laden von isolierter Netzhaut oder RPE-Aderhaut-Sklera ist einfach, und sobald diese Gewebe isoliert sind, werden sie einfach mit einer Pinzette in die Oberseite der Gewebekammern eingeführt und bis zur Fritte sinken gelassen. RPE-Zellen, die auf Filtereinsätzen kultiviert werden, entwickeln nach 4-8 Wochen in Kultur eine geeignete Polarisation und Marker für die RPE-Reife. Es ist nicht möglich, das RPE für die Lebendzellanalyse zu entfernen, sobald es an die Transwell-Membran gebunden ist, wenn die RPE-Reife und Polarisation aufrechterhalten werden sollen24. Die Perifusionskammer kann Streifen der Transwell-Membran aufnehmen, die mit einem Skalpell geschnitten werden, während sie in Puffer eingetaucht sind, und schnell in die Gewebekammern eingeführt werden. Obwohl das Schneiden von Filterstreifen in ein statisches System24 eingebracht wurde, ist kein anderes fluidisches Verfahren zur Beurteilung dieser wichtigen Zelltypen verfügbar. Die Reaktionen der RPE-Zellen waren schneller und dynamischer als die der Netzhaut oder der RPE-Aderhaut-Sklera, was wahrscheinlich zum Teil auf den unmittelbaren Zugang sowohl der apikalen als auch der basalen Aspekte der RPE-Zellen zurückzuführen ist, die als Monoschicht auf dem Membraneinsatz konfiguriert sind.
Ein weiterer Faktor, um sicherzustellen, dass die Daten das höchste Signal-Rausch-Verhältnis aufweisen, ist die Auswahl des optimalen Verhältnisses von Gewebe, das in die Perifusionskammern geladen wird, im Verhältnis zur Flussrate. Zu wenig Gewebe im Verhältnis zur Durchflussrate führt zu einer Differenz der gelöstenO2-Konzentration zwischen Zu- und Abfluss, die sehr gering und schwer zuverlässig zu messen ist. Ist der Fluss hingegen zu langsam, dann wird die Konzentration vonO2 so niedrig, dass das Gewebe von Hypoxie betroffen ist. Nichtsdestotrotz kann der gasdruckgetriebene Flüssigkeitsfluss bei Durchflussraten von bis zu 5 ml/min aufrechterhalten werden, wobei nur geringe Mengen an Gewebe für genaue OCR- und LPR-Messungen erforderlich sind. In den hier gezeigten Experimenten wurden etwa 20 ml/min/Kanal verwendet, die entweder für eine Netzhaut, zwei RPE-Aderhaut-Skleras oder 360.000 RPE-Zellen geeignet waren. Um die Systemeffekte zu minimieren, die die Exposition des Gewebes gegenüber der injizierten Testverbindung verzögern und dispergieren, werden mehrere Größen der Gewebekammern geliefert, so dass die Gewebemenge (und die Flussrate) auf die geeignete Größe der Kammer abgestimmt ist.
Die Daten aus den in dieser Arbeit gezeigten Analysen wurden auf zwei Arten dargestellt: als absolute Größe in Bezug auf die Rate oder als fraktionelle Änderungen relativ zu einem stationären Zustand oder einer Basislinie. Der Schwerpunkt lag auf der Darstellung der Messung von Reaktionen auf Testverbindungen. Das Fluidik-System ist jedoch gut geeignet, um die Auswirkungen der Gewebebehandlung vor der Perifusionsanalyse, wie z. B. genetische Veränderungen, zu beurteilen und zu vergleichen. Die Prüfung, ob sich eine Behandlung von der Kontrolle unterscheidet, ist am robustesten, wenn die Auswirkungen der Behandlung auf normalisierte Reaktionen von Testsubstanzen analysiert werden. Wenn die Analyse absolute Größen erfordert, wird die statistische Aussagekraft der Analysen von vorbehandelten Proben maximiert, wenn ihre Beurteilung und Kontrolle im selben Perifusionsexperiment durchgeführt wird.
Bis auf den Rührer werden alle Teile, die mit Flüssigkeit in Berührung kommen, vom Hersteller als Verbrauchsmaterial geliefert und sind sterilisiert. Diese Teile sollten nicht wiederverwendet werden, da Experimente gelegentlich durch unvollständige Reinigung und verunreinigte Oberflächen verloren gehen. Das System ist zu Beginn der Einrichtung steril. Dem MRM werden jedoch Medien zugeführt, und das Gewebe wird unter nicht sterilen Bedingungen in die Kammern geladen. Wir haben OCR in dem System gemessen, das aus sterilen Teilen zusammengesetzt ist, bei dem das Experiment selbst jedoch unter nicht sterilen Bedingungen durchgeführt wird. Es dauert etwa 14 Stunden, bis sich die Bakterien so weit angesammelt haben, dass sie eine messbare OCR aufweisen (unveröffentlichte Ergebnisse). Wenn Protokolle verwendet werden, die weniger als 10 Stunden dauern, sind die Ansammlung von Bakterien und die daraus resultierenden Auswirkungen vernachlässigbar.
Viele Forscher verwenden Instrumente, die für die Messung der OCR unter statischer Inkubation einer Monoschicht von Zellen mit einem relativ hohen Durchsatz ausgelegt sind25,26. Im Gegensatz dazu hält das Fluidik-Instrument, das wir in diesem Artikel getestet und beschrieben haben, das Gewebe aufrecht, indem es eine ausreichendeO2-Abgabe gewährleistet, was für die größeren Diffusionsabstände, die in Gewebeproben vorhanden sind, entscheidend ist. Darüber hinaus ist es in der Lage, Brüche zu sammeln, die die Bewertung mehrerer Parameter parallel zur OCR ermöglichen, was die Fähigkeit, Beziehungen zwischen ihnen zu untersuchen, erheblich verbessert. Schließlich können die Konzentrationen gelöster Gase (wie O2 und CO2) gesteuert werden, wodurch die Dauer von Experimenten mit Medien und Puffern auf Bikarbonatbasis verlängert wird, so dass der Benutzer die Auswirkungen vonO2 untersuchen kann. Es sollte darauf hingewiesen werden, dass eine Einschränkung für beide Methoden die Unfähigkeit ist, das Auswaschen von Testverbindungen zu untersuchen, eine Funktionalität, die andere Perifusionssysteme haben 4,27,28. Eine weitere Überlegung bei der Bestimmung der optimalen Analysemodalität ist die Tatsache, dass Fluidiksysteme mehr Medien und Testverbindungen verbrauchen als statische Systeme. Der Mehraufwand wird bei den aktuellen Fluidiksystemen jedoch aufgrund der geringen Durchflussraten, die das System verwenden kann, minimiert.
Insgesamt wird eine detaillierte Beschreibung der Protokolle zur Durchführung von Experimenten mit einem neuen Durchfluss-/Bewertungsinstrument beschrieben. Daten, die mit Netzhaut und RPE-Aderhaut-Sklera generiert wurden, rekapitulierten frühere Ergebnisse, die mit Systemen erzielt wurden, die viel schwieriger zu bedienen (und nicht ohne weiteres verfügbar sind). Es wurde auch gezeigt, dass das System RPE-Zellen, die an Transwell-Membranen gebunden sind, erhalten und bewerten kann, ein sehr wichtiges zelluläres Modell, das aufgrund der Fragilität der Zellen bisher nicht mit Flow-Systemen analysiert wurde. Die Hauptbestandteile des Protokolls bestehen aus einer 75-minütigen Aufbauzeit, gefolgt von einer 90-minütigen Äquilibrierungszeit und dem experimentellen Protokoll, wodurch es für den Routineeinsatz in Labors geeignet ist, die nicht auf den Betrieb von Fluidiksystemen spezialisiert sind. Obwohl wir uns auf die Messung der akuten Reaktion von Gewebe auf Testverbindungen konzentriert haben, eignet sich das System sehr gut für den Vergleich von Gewebe aus verschiedenen Quellen wie Tiermodellen oder Zellmodellen, die genetisch verändert oder Testbehandlungen/-bedingungen unterzogen wurden. Darüber hinaus ist der Umfang der Assays, die an den Ausflussfraktionen durchgeführt werden können, breit gefächert und umfasst Metaboliten, Zellsignalmoleküle und sezernierte Hormone/Neurotransmitter sowie Mehrkomponentenanalysen, die durch Massenspektrometrie an den Fraktionen sowie am Gewebe erzeugt werden.
Offenlegungen
I.R.S., M.G. und K.B. unterhalten finanzielle Verbindungen zu EnTox Sciences, Inc. (Mercer Island, WA), dem Hersteller/Vertreiber des in dieser Studie beschriebenen BaroFuse-Perifusionssystems. Alle anderen Autoren erklären, dass keine Interessenkonflikte vorliegen.
Danksagungen
Diese Forschung wurde durch Zuschüsse der National Institutes of Health (R01 GM148741 I.R.S.), U01 EY034591, R01 EY034364, BrightFocus Foundation, Research to Prevent Blindness (J.R.C.) und R01 EY006641, R01 EY017863 und R21 EY032597 (J.B.H.) finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| BIOLOGICAL SAMPLES | |||
| C57BL/6J mice | Envigo Harlan (Indianapolis, IN) | N/A | |
| REAGENTS | |||
| FCCP | Sigma-Aldrich | C2920L9795 | |
| Glucose | Sigma-Aldrich | G8270G | |
| KCN | Sigma-Aldrich | 60178 | |
| Lactate | MilliporeSigma | L6661 | |
| Oliigomycin A | Sigma-Aldrich | 75351L9795 | |
| CELL CULTURE AND TISSUE HARVESTING | |||
| Beuthanasia-D | Schering-Plough Animal Health Corp., Union, NJ | N/A | |
| Bovine serum albumin | Sigma-Aldrich | A3059 | |
| Euthasol, 390 mg/ml sodium pentobarbital | Virbac | RXEUTHASOL | |
| Fetal bovine serum | Sigma-Aldrich | 12303C | |
| Hank’s Buffered Salt Solution | GIBCO | 14065056 | |
| Krebs Ringer Bicarbonate (KRB) | Thermo Fisher Scientific | J67795L9795 | |
| Matrigel | ThermoFisher | #CB-40230 | |
| Penicillin-streptomycin | ThermoFisher Scientific | 15140122 | |
| ROCKi | Selleck Chemicals | Y-27632 | |
| Trypsin-EDTA | ThermoFisher | #25-200-072 | |
| SUPPLIES | |||
| Gas Cylinders: 21% O2/5% CO2/balance N2 | Praxair Distribution, Inc | N/A | |
| Transwell filters | MilliporeSigma | 3470 | |
| COMMERCIAL ASSAYS | |||
| Amplex Red Glucose/Glucose Oxidase Assay Kit | ThermoFisher | A22189 | |
| Glucose Oxidase from Aerococcus viridans | Invitrogen (Carlsbad, CA) | A22189L9795 | |
| Lactate Oxidase | Sigma-Aldrich | L9795 | |
| EQUIPMENT | |||
| BaroFuse Multi-Channel Perifusion system | EnTox Sciences, Inc (Mercer Island, WA | Model 001-08 | |
| Synergy 4 Fluorometer | BioTek (Winooski, VT) | S4MLFPTA |
Referenzen
- Lacy, P. E., Walker, M. M., Fink, C. J. Perifusion of isolated rat islets in vitro: Participation of the microtubular system in the biphasic release of insulin. Diabetes. 21 (10), 987-998 (1972).
- Doliba, N. M., et al. Metabolic and ionic coupling factors in amino acid-stimulated insulin release in pancreatic beta-HC9 cells. American Journal of Physiology. Endocrinology and Metabolism. 292 (6), E1507-E1519 (2007).
- Sweet, I. R., et al. Regulation of ATP/ADP in pancreatic islets. Diabetes. 53 (2), 401-409 (2004).
- Chertov, A. O., et al. Roles of glucose in photoreceptor survival. The Journal of Biological Chemistry. 286 (40), 34700-34711 (2011).
- Kooragayala, K., et al. Quantification of Oxygen Consumption in Retina Ex Vivo Demonstrates Limited Reserve Capacity of Photoreceptor Mitochondria. Investigative Ophthalmology & Visual Science. 56 (13), 8428-8436 (2015).
- Bisbach, C. M., et al. Succinate Can Shuttle Reducing Power from the Hypoxic Retina to the O2-Rich Pigment Epithelium. Cell Reports. 31 (5), 107606(2020).
- Du, J., et al. Inhibition of mitochondrial pyruvate transport by zaprinast causes massive accumulation of aspartate at the expense of glutamate in the retina. The Journal of Biological Chemistry. 288 (50), 36129-36140 (2013).
- Hass, D. T., et al. Succinate metabolism in the retinal pigment epithelium uncouples respiration from ATP synthesis. Cell Reports. 39 (10), 110917(2022).
- Kamat, V., et al. Fluidics system for resolving concentration-dependent effects of dissolved gases on tissue metabolism. Elife. 10, e66716(2021).
- Stryer, L. Biochemistry. , 4th edn, Freeman and Company, New York. (1995).
- Gu, X., Ma, Y., Liu, Y., Wan, Q. Measurement of mitochondrial respiration in adherent cells by Seahorse XF96 Cell Mito Stress Test. STAR Protocols. 2 (1), 100245(2021).
- Engel, A. L., et al. Extracellular matrix dysfunction in Sorsby patient-derived retinal pigment epithelium. Experimental Eye Research. 215, 108899(2022).
- Zhang, R., et al. Inhibition of Mitochondrial Respiration Impairs Nutrient Consumption and Metabolite Transport in Human Retinal Pigment Epithelium. Journal of Proteome Research. 20 (1), 909-922 (2021).
- Hurley, J. B. Retina Metabolism and Metabolism in the Pigmented Epithelium: A Busy Intersection. Annual Review of Vision Science. 7, 665-692 (2021).
- Xiao, J., et al. Autophagy activation and photoreceptor survival in retinal detachment. Experimental Eye Research. 205, 108492(2021).
- Okawa, H., Sampath, A. P., Laughlin, S. B., Fain, G. L. ATP consumption by mammalian rod photoreceptors in darkness and in light. Current Biology. 18 (24), 1917-1921 (2008).
- Lakkaraju, A., et al. The cell biology of the retinal pigment epithelium. Progress in Retinal and Eye Research. , 100846(2020).
- Yu, J., et al. Emerging strategies of engineering retinal organoids and organoid-on-a-chip in modeling intraocular drug delivery: Current progress and future perspectives. Advanced Drug Delivery Reviews. 197, 114842(2023).
- Arjamaa, O., Nikinmaa, M. Oxygen-dependent diseases in the retina: role of hypoxia-inducible factors. Experimental Eye Research. 83 (3), 473-483 (2006).
- Kamat, V., et al. A Versatile Multi-Channel Fluidics System for the Maintenance and Real-Time Metabolic and Functional Assessment of Tissue or Cells. Cell Reports Methods. In Press. , (2023).
- Neal, A., et al. Quantification of Low-Level Drug Effects Using Real-Time, in vitro Measurement of Oxygen Consumption Rate. Toxicological Sciences. 148 (2), 594-602 (2015).
- Jung, S. R., et al. Reduced cytochrome C is an essential regulator of sustained insulin secretion by pancreatic islets. The Journal of Biological Chemistry. 286 (20), 17422-17434 (2011).
- Rountree, A. M., et al. Control of insulin secretion by cytochrome C and calcium signaling in islets with impaired metabolism. The Journal of Biological Chemistry. 289 (27), 19110-19119 (2014).
- Calton, M. A., Beaulieu, M. O., Benchorin, G., Vollrath, D. Method for measuring extracellular flux from intact polarized epithelial monolayers. Molecular Vision. 24, 425-433 (2018).
- Jarrett, S. G., Rohrer, B., Perron, N. R., Beeson, C., Boulton, M. E. Assessment of mitochondrial damage in retinal cells and tissues using quantitative polymerase chain reaction for mitochondrial DNA damage and extracellular flux assay for mitochondrial respiration activity. Methods in Molecular Biology. 935, 227-243 (2013).
- Perron, N. R., Beeson, C., Rohrer, B. Early alterations in mitochondrial reserve capacity; a means to predict subsequent photoreceptor cell death. Journal of Bioenergetics and Biomembranes. 45 (1-2), 101-109 (2013).
- Cabrera, O., et al. high-throughput assays for evaluation of human pancreatic islet function. Cell Transplantation. 16 (10), 1039-1048 (2008).
- Doliba, N. M., Qin, W., Vinogradov, S. A., Wilson, D. F., Matschinsky, F. M. Palmitic acid acutely inhibits acetylcholine- but not GLP-1-stimulated insulin secretion in mouse pancreatic islets. American Journal of Physiology. Endocrinology and Metabolism. 299 (3), E475-E485 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten