Method Article
İlaç Etkinliği Çalışmaları için Bir Chagas Hastalığı Fare Modelinin In Vivo Biyolüminesans Görüntülemesinin Gizeminin Çözülmesi
Bu Makalede
Özet
Burada sağlanan protokol, veri toplama, analiz ve yorumlamaya odaklanarak, Trypanosoma cruzi enfeksiyonunun biyolüminesans modelinde ilaç etkinliği çalışmaları gerçekleştirmek için ayrıntılı adımları açıklamaktadır. Teknik sorunları en aza indirmek için sorun giderme ve kalite kontrol prosedürleri de sağlanmaktadır.
Özet
Chagas hastalığı, leishmaniasis ve insan Afrika tripanozomiyazisi gibi insan protozoan hastalıklarının halk sağlığı üzerindeki etkisini kontrol etmek ve azaltmak için yeni ilaçların ve aşıların geliştirilmesini hızlandırmak gereklidir. Bununla birlikte, bu süreç, oldukça karmaşık parazit biyolojisi ve hastalık patogenezi gibi zorluklarla doludur ve ihmal edilen tropikal hastalıklar için tipik olarak, araştırma ve geliştirme için nispeten sınırlı fonlar. Bu nedenle, in vitro ve in vivo kaynakların rasyonel kullanımını sağlarken enfeksiyon ve hastalığın temel özelliklerini yeterince yeniden üretebilen modeller, bu koşullar için araştırmaları ilerletmek için gereklidir. Bir örnek, lusiferaz eksprese eden Trypanosoma cruzi parazitleri tarafından üretilen uzun dalga boylu ışığın oldukça hassas bir şekilde tespit edilmesini sağlayan Chagas hastalığı için in vivo biyolüminesans görüntüleme (BLI) fare modelidir. Bu tekniğin in vivo çalışmalarda ilaç etkinliği için standart yaklaşım haline gelmesine rağmen, araştırma grupları, uygun BLI ekipmanı hazır olsa bile, ekipman kullanımı ve kalite kontrol prosedürlerinin uygulanması konusunda uygun pratik eğitim eksikliği nedeniyle bunu uygulamakta hala zorlanabilir. Bu senaryo göz önüne alındığında, bu protokol, Chagas hastalığı veya diğer bulaşıcı hastalık fare modelleri için BLI ile çok az deneyimi olan veya hiç deneyimi olmayan araştırma gruplarında protokollerin uygulanmasını kolaylaştıran ayrıntılarla, deneylerin planlanmasından veri toplama ve analizine kadar rehberlik etmeyi amaçlamaktadır.
Giriş
Chagas hastalığı Latin Amerika'da endemiktir ve dünya çapında yaklaşık yedi milyon insanı etkilemektedir1. Her yıl 50.000'den fazla ölüm ve yaklaşık 7 milyar dolarlık ekonomik kayıp, bu hastalığın engelleyici doğasından kaynaklanmaktadır2. Chagas hastalığına, vektörel iletimin kurulduğu Amerika'da memelileri (vahşi ve evcil) ve triatomin vektörlerini (Hemiptera, Reduviidae)3 enfekte edebilen heteroksenik bir hemoflagellat parazit olan protozoan Trypanosoma cruzi neden olur. Diğer önemli enfeksiyon yolları arasında kan transfüzyonu, organ nakli, oral (enfekte bir triatomin ile kontamine olmuş gıdaların yutulmasıyla)4 ve konjenital bulaşma yer alır. Vektörel olmayan bulaşma yolları, Chagas hastalığının endemik olmayan bölgelere yayılmasına katkıda bulunmuştur 3,5.
Chagas hastalığı iki klinik aşamada kendini gösterir. Akut faz çoğu durumda asemptomatiktir. Semptomatik enfeksiyonlar genellikle ateş, yorgunluk, kas ağrısı, lenfadenopati, splenomegali ve hepatomegali gibi spesifik olmayan belirtilerle ilişkilidir. Akut faz ayrıca sıklıkla patent parazitemisi ve parazitlerin sistemik dolaşımı ile ilişkilidir. Teşhis edilen vakaların %10 kadarında, özellikle oral enfeksiyon olanlarda ölüm meydana gelebilir6. Kronik faz genellikle herhangi bir semptomun uzun süre yokluğu ile karakterizedir. Zamanla, onlarca yıl önce enfekte olan hastaların yaklaşık üçte biri, genellikle fibroz ve miyokard iltihabının eşlik ettiği kardiyak bulgular ve/veya çoğunlukla megaözofagus ve/veya megakolon sendromlarının gelişimi ile ilişkili gastrointestinal bozukluklar sergiler 3,5,6.
Chagas hastalığının etiyolojik tedavisi sadece iki ilaçtan oluşur: benznidazol ve nifurtimox. Bu antiparaziter ajanlar 50 yılı aşkın bir süredir mevcuttur ve önemli toksisiteye ve sınırlı etkinliğesahiptir 5,7,8. Sonuç olarak, Chagas hastalığı hastaları için yeni, güvenli ve daha etkili tedaviler geliştirmeye acil bir ihtiyaç vardır.
Daha sofistike ve doğru teknikler, Chagas hastalığı için yeni tedaviler arayışında ilerlemelere izin veren eski soruların cevaplarını elde etmeyi mümkün kılmaktadır. Bu anlamda, bilim camiası, enfeksiyonun seyri ve ilaç etkinliğinin değerlendirilmesi üzerine in vivo çalışmalar için genetiği değiştirilmiş parazitlerden büyük ölçüde yararlanmaktadır 9,10,11,12. Biyolüminesans görüntüleme (BLI) sistemine dayalı uzunlamasına bir test, tedavi rejimi sırasında ve sonrasında etkinlik değerlendirmesine izin vererek, tripanosidal aktiviteye sahip bileşiklerin tanımlanmasına yol açar10,13. BLI yöntemi, genetik olarak değiştirilmiş T. cruzi CL Brener Luc::Neon soyu11 tarafından üretilen ışığın nicelleştirilmesi yoluyla hem dolaşımda hem de doku ve organlarda parazit yükünün doğrudan ölçümünü sağlar ve bu da kırmızıya kaymış ateşböceği lusiferaz12'yi yapısal olarak ifade eder.
Bununla birlikte, Chagas hastalığı BLI hayvan modelinin ve ilaç etkinliği çalışmalarının kurulmasından yaklaşık 10 yıl sonra, sadece birkaç araştırma grubu bu tekniğe hakimdir. Bu gerçek, yalnızca uygun görüntüleme ekipmanına erişimin azalmasından değil, aynı zamanda eğitim eksikliğinden ve yapılandırılmış, ayrıntılı protokollerin mevcudiyetinden de kaynaklanmaktadır. Bu yöntem, parazit DNA tespiti için mikroskopi, seroloji veya qPCR ile organ/doku enfeksiyonu değerlendirmesi ile paraziteminin değerlendirilmesine dayanan diğer yaklaşımlara göre çeşitli avantajlar sunar, çünkü farelerin refahını iyileştirir ve daha sağlam ve entegre in vivo veri üretme olasılığı ile hayvan kullanımının azaltılmasına izin verir. Ayrıca, bu yöntem, ilaç tedavisinden sonra iç organlardaki parazit odaklarının hazır tespitini sağladığı için tartışmasız daha hassastır10,12. Bu nedenle, bu protokol, Parazitoloji ve diğer enfeksiyon hastalıkları ile ilgili araştırma gruplarına, teknik prosedürleri detaylandırarak laboratuvarlarında bu metodolojiyi kurmaları için rehberlik etmeyi amaçlamaktadır. Burada, İhmal Edilen Hastalıklar için İlaçlar girişimi (DNDi) tarafından koordine edilen ilaç keşif çabalarının bir parçası olarak, Latin Amerika'da türünün ilk örneği olan Chagas hastalığı BLI modelinin Brezilya'da uygulanmasıyla elde edilen deneyimi paylaşıyoruz.
Protokol
Bu protokolde açıklanan tüm prosedürler, Universidade de São Paulo'daki Instituto de Ciências Biomédicas Hayvan Etik Komitesi tarafından önceden belirlenenyönergelere 14 göre sunulmuş, onaylanmış ve yürütülmüştür: protokol CEUA ICB/USP no 5787250522.
1. Çözümler
NOT: 10 mL/kg'lık önceden uygulanan hacmi göz önünde bulundurun (20 g ağırlığında bir fare için 20 μL)15,16. Örneğin, 150 mg / kg hayvan dozuna ulaşmak için 15 mg / mL'lik bir çalışma çözeltisi hazırlayın.
- Hidroksipropilmetilselüloz süspansiyonlu araç (HPMC-SV)
NOT: Gerekli reaktifler %0,5 (a/h) Hidroksipropilmetilselüloz (HPMC), %0,4 (h/h) Tween 80 ve %0,5 (h/h) Benzil alkoldür.- 200 mL araç çözeltisi için 1 g HPMC'yi tartın ve 64 mL sıcak ultra saf suda çözün. 2 dakika karıştırın.
- 120 mL buz gibi ultra saf su ekleyin ve 1 saat karıştırın. 1 mL benzil alkol ekleyin.
- Ardından, ters pipetleme tekniğini kullanarak 0,8 mL Tween 80 ekleyin ve çözelti şeffaf hale gelene kadar karıştırmaya devam edin.
- Çözeltiyi 200 mL'lik son hacim için ayarlayın. HPMC-SV'yi buzdolabında (4 °C) en fazla 3 ay saklayın.
- benznidazol
- Gerekli bileşik çözelti miktarını aşağıdaki gibi hesaplayın:
Bileşik çözelti hacmi = (her gündeki doz sayısı x gün sayısı x tedavi edilecek fare sayısı x her farede uygulanan hacim) +% 30 ekstra. - İstenilen dozu göz önünde bulundurarak gerekli miktarda benznidazol (BZ) tartın. İyileştirici tedavi için, 10 gün boyunca günde bir kez 100 mg / kg'lık bir oral doz, CD kronik modelinde100% 100 iyileşme sağlar 17.
- İstenen nihai hacim göz önüne alındığında,% 5 (h / h) DMSO konsantrasyonuna ulaşmak için uygun miktarı hesaplayın ve BZ'yi saf DMSO'da tamamen çözün.
- %95 (h/h) HPMC-SV konsantrasyonuna ulaşmak için aracın uygun hacmini bir cam tüpe ekleyin. DMSO'da çözünen BZ'yi HPMC-SV içeren cam tüpe aktarın. Süspansiyonu kuvvetlice homojenize edin ve 4 °C'de saklayın.
Örneğin: BZ formülasyonunun son hacmi = 10 mL (adım 1.2.1)
BZ miktarı = 100 mg (adım 1.2.2)
% 5 DMSO = 0.5 mL (adım 1.2.3) ve% 95 HPMC-SV = 9.5 mL (adım 1.2.4) - Her ilaç uygulamasından önce, formülasyonlar 37 ° C'de 5 dakika boyunca ultrasonik bir su banyosuna yerleştirilir ve hayvan dozlamasından önce kuvvetli bir şekilde homojenize edilir.
- Gerekli bileşik çözelti miktarını aşağıdaki gibi hesaplayın:
- Siklofosfamid
- 12.5 mg / mL'lik bir çözelti elde etmek için gerekli miktarda siklofosfamid ultra saf suda çözün.
- Solüsyonu filtreleyerek sterilize edin ve 4 °C'de saklayın.
- Giemsa lekesi
- 0.6 mg Giemsa toz reaktifini 50 mL metanol içinde çözün. 25 mL gliserol ekleyin ve karıştırın. Filtre kağıdı ve bir huni kullanarak çökeltileri çıkarın. Stok çözeltisini ışıktan koruyarak oda sıcaklığında (RT) saklayın.
- 10 mL Giemsa çözeltisini 90 mL Karışım-Fosfat Tamponunda (pH 7.2'de 20.5 MNa2HPO4, 65.4 M KH2PO4) seyrelterek çalışan bir çözelti hazırlayın.
2. Trypanosoma cruzi kültürü
- Biyolojik güvenlik kabininde (BSC) çalışarak, 4 x 106 epimastigot/mL T. cruzi CL Brener Luc::Neon11'i LIT ortamında (68.44 mM NaCl, 5.36 mM KCl, 112.7 mM Na2HPO4, 5 g/L tripton, 5 g/L karaciğer infüzyon suyu, 0.03 M hemin, 4.16 mM glikoz), %10 (h/h) Fetal Sığır Serumu (FBS) ile desteklenmiş, 28 ° C'de seçici ilaç olarak 100 μg / mL penisilin, 100 U / mL streptomisin ve 150 μg / mL higromisin. Parazitler tipik olarak 3-4 gün içinde durağan bir faza ulaşır.
- 10 mL Grace's Insect besiyerinde 3 x 108 epimastigotu 15 mL konik tüplerde 15 mL konik tüplerde 7-10 gün boyunca inkübe ederek 8 x 10 8 epimastigotu inkübe ederek bulaşıcı parazitleri indükleyerek metasiklogenezi indükleyin.
- Giemsa boyama smear ile farklılaşma oranını değerlendirin. Bunun için 20 μL farklılaşmış parazitleri bir cam slayta yayın ve 10 dakika kurumaya bırakın.
- Çeker ocakta, cam sürgüyü temiz metanol ile kaplayarak numune sabitlemesine devam edin ve tamamen kurumasını bekleyin (1-2 dakika). Cam kaydırağı 20 dakika boyunca Giemsa çalışma solüsyonu ile örtün.
- Cam sürgüyü damıtılmış suyla nazikçe yıkayın. Mikroskopta, metasiklik tripomastigotların yüzdesini sayın. En az yüzde 10'luk bir farklılaşma oranı elde edilirse, bir sonraki adıma geçin.
- Parazitleri santrifüjleyin (10 dakika boyunca 120 x g ) ve peleti 10 mL DPBS ile yeniden süspanse edin. Bir kez daha santrifüjleyin ve parazitleri% 10 (h / v) FBS, 100 μg / mL penisilin ve 100 U / mL streptomisin ile desteklenmiş 5 mL DMEM'de yeniden süspanse edin.
- 25cm2'lik bir kültür şişesinde, nemlendirilmiş bir inkübatörde 1.66 x 105 LLC-MK2 hücrelerinin ( Macaca mulatta'dan böbrek epitel hücreleri) 37 ° C'de% 5 CO2 içinde enfeksiyonunu gerçekleştirin18.
- Doku kültürü tripomastigotları (TCT'ler) 8-9 gün sonra besiyerinde salınır. Taze LLC-MK2 hücrelerinin tek katmanlarını TCT'lerle 1:40'lık bir enfeksiyon çokluğunda (MOI) enfekte edin.
3. Trypanosoma cruzi popülasyon homojenliğinin akış sitometresi ile analizi
- CL Brener Luc::Neon ve CL Brener vahşi tip suşlarının TCT'lerini toplayın, 10 dakika boyunca 120 x g'da santrifüjleyin ve TCT'leri DPBS'de yeniden askıya alın. 1 x 106 / mL elde etmek için parazit yoğunluğunu ayarlayın.
- mNeonGreen floresansına (örn. 506/em. 517 nm)19 dayalı akış sitometresi ile popülasyon analizine devam edin ve her numune için en az 20.000 olay elde edin.
NOT: Floresan popülasyon yüzdesi, vahşi türün transfekte edilmiş parazitle karşılaştırılmasıyla elde edilir. Fare enfeksiyonuna devam etmek için, CL Brener Luc::Neon soyunun floresan parazit popülasyonunun en az% 95'i elde edilmelidir (Ek Şekil 1).
4. Fareler deneysel enfeksiyon
NOT: Parazit miktarını artırmak için, kan dolaşımındaki tripomastigotlar (BT) sıklıkla immün yetmezliği olan farelerdenelde edilir 10,13. Burada, BT elde etmek için BALB/C farelerinin kimyasal immünosupresyonu kullanılır. Bunun için, T. cruzi enfeksiyonuna eş zamanlı olarak gerçekleştirilen 96 saat aralıklarla 62.5 mg / kg'da dört intraperitoneal siklofosfamid (CTX) enjeksiyonu ile hafif immünosupresyon sağlanır.
- T . cruzi enfeksiyonundan 1 gün önce intraperitoneal enjeksiyon (i.p.) ile 62.5 mg / kg steril siklofosfamid uygulayın.
- Her fareyi intraperitoneal yol boyunca 0,2 mL DPBS'de 1 x10 4 TCT ile enfekte edin. Patojenler ve iğnelerle çalışırken yüksek kaza riskine dikkat edin. Enfeksiyonu bir BSC'de, tüm prosedür boyunca eldiven ve yüz siperi giyerek gerçekleştirin.
- Kandaki BT'nin doğrudan gözlemlenmesiyle parazitemiyi günlük olarak izleyin (Pizzi-Brener yöntemi)20. Parazitemi zirvesinde, enfeksiyondan yaklaşık 13-17 gün sonra (dpi), kan alımını gerçekleştirin. Bunun için fareleri 100 mg/kg ketamin ve 10 mg/kg ksilazin ile uyuşturun.
- Fareler tamamen anestezi altına alındığında21, 50 μL %3,8 (a/h) sodyum sitrat içeren 24 G X3/4 iğneye bağlı 1 mL'lik bir şırınga kullanarak kardiyak ponksiyona devam edin. İğneyi fişten çekin ve kanı nazikçe bir santrifüj tüpüne yerleştirin.
- Bir BSC'de, amonyum-klorür-potasyum (ACK) lizis tamponunda bir kan alikotunun seyreltilmesini gerçekleştirin ve Neubauer odasındaki parazitleri sayın. Küçük kan pıhtıları parazit sayımını etkilediği için bu işlemi en az iki kez tekrarlayın.
NOT: Sayım hatalarını önlemek için, Neubauer odasında 30'dan düşük ve 300'den yüksek tripomastigot sayımlarını önlemek için seyreltme faktörünü ayarlayın. - DPBS'de gerekli miktarda saf kanı karıştırarak parazit yoğunluğunu 5 x 103 BT/mL'ye ayarlayın.
- İmmünsüprese olmayan BALB/c farelerini fare başına 0.2 mL DPBS'de (5 x 103 BT/mL) 1 x 103 BT ile 26 G'lik bir iğne kullanarak intraperitoneal yolla enfekte edin (daha dar iğneler parazit lizizine yol açar)22. Hacmi intraperitoneal olarak enjekte ettikten sonra, geri akışı önlemek için iğneyi farenin içinde 5 saniye tutun.
- Olası sızıntı veya kanamayı belirlemek için enfekte fareleri geçici olarak bir kağıt havlu içeren bir kutuya koyun ve ardından fareleri kafeslerine geri koyun.
5. İn vivo görüntüleme
NOT: Burada kullanılan terimler sözlüğü aşağıdaki gibidir:
Görüntüleme seansı: Belirli bir günde belirli bir deneyin tüm gruplarında gerçekleştirilen biyolüminesans edinimi. Şekil 1A , prosedüre genel bir bakışı göstermektedir.
Görüntüleme turu: D-lusiferin enjeksiyonundan anestezi iyileşmesine kadar üç fareden oluşan alt gruplar halinde gerçekleştirilen prosedür. Farelerin parazit yükünün içsel değişkenliği ve aşağıda açıklanan BLI miktarını etkileyen diğer faktörler nedeniyle her deney grubunun 6 fare içermesi önerilir.
Görüntüleme elde edilmesi: Biyolüminesansı ölçmek için görüntüleme ekipmanı tarafından gerçekleştirilen fotoğraf çekimi, bu da bir fotoğrafın görüntü kaplaması ve niceliksel biyolüminesansın sahte renk ölçeği olarak gösterilmesiyle sonuçlanır.
Görüntüleme prosedürü: Protokolün bu oturumunda tartışılan tüm adımlar.
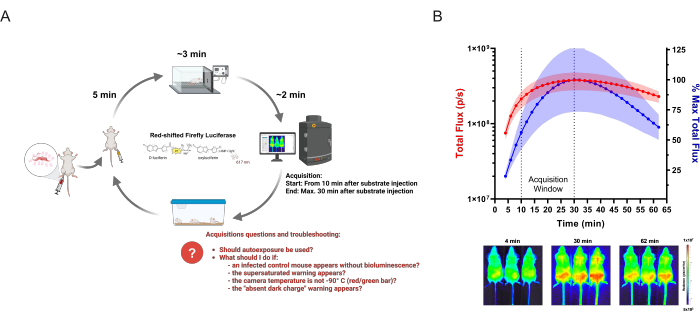
Şekil 1: BLI verilerinin elde edilmesi. (A) Örnek olarak Chagas hastalığı biyolüminesans fare modeli kullanılarak bulaşıcı hastalıklar çalışmaları için uygulanan edinim iş akışı şeması. Genetik olarak modifiye edilmiş T. cruzi ile enfekte olmuş fareler, belirlenen zaman noktalarında in vivo görüntüleme ile analiz edilir. Her görüntüleme turunda, en fazla üç fareden oluşan gruplara 150 mg / kg enzim-substrat (D-lusiferin) enjekte edilir. 5 dakika sonra oksijende %2.5 (h/h) izofluran anestezi uygulanır. Tamamen hareketsiz kaldıklarında, fareler bir görüntüleme sistemine yerleştirilir ve tanımlanan ayarlara göre alım başlatılır. Görüntülemeden sonra, fareler anesteziden kurtulur ve kafeslere geri gönderilir. Araştırmacıların edinme sırasında karşılaşabilecekleri ve karşılaşabilecekleri sık sorulan sorular ve sorunlar kırmızı renkle vurgulanmıştır. Bu şema Lewis ve ark. (2014)12 (BioRender.com: UD26KWEVS2 ile oluşturulmuştur). (B) D-lusiferin/kırmızıya kaymış ateşböceği lusiferazının (PpyRE9h) in vivo kinetiği. T. cruzi parazitemi zirvesindeki fareler (n = 3) anestezi altına alındı ve 150 mg / kg D-lusiferin enjekte edildi. Görüntüler 1 saat boyunca elde edildi (pozlama süresi: 2 dakika; gruplama: 4). Üst: ventral toplam akı (p/s) ölçümü (sol Y ekseni, kırmızı) ve en yüksek ortalama ölçümün yüzdesi olarak (sağ Y ekseni, mavi). Veriler ortalama (eğriler) ve standart sapma (gölgeli alan) olarak gösterilir. Alt: İlk (4 dakika), en yüksek BLI sinyali (30 dakika) ve son (62 dakika) zaman noktalarının elde edilen görüntüleri. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Şarj bağlantılı cihaz (CCD) kamerasının soğuk (-90 °C) olup olmadığını doğrulamak için Kayıt penceresindeki yeşil çubuğu kontrol edin. Sıcaklığı görselleştirmek için çubuğa (yeşil veya kırmızı) tıklayın.
NOT: Görüntüleme ekipmanı kılavuzuna göre, CCD'yi soğuk tutmak için görüntüleme ekipmanı ve yazılımı her zaman açık olmalıdır. - Otomatik arka plan ayarının yapılıp yapılmadığını doğrulayın. Bunu yapmak için, Mevcut Dark Charge'ı Görüntüle > Arka Plan > Edinme'ye tıklayın. Birkaç ayar kombinasyonu içeren bir liste görünecektir.
NOT: Bu prosedür lüminesans gürültüsünü azaltır. Seçilen konfigürasyon, "maruz kalma süresi x (gruplama²)" formülüne göre 1000'den daha yüksek bir değerle sonuçlanırsa, karanlık yük göz ardı edilmemelidir. Yazılım yapılandırmalarına bağlı olarak, gruplama bir sayı (gruplama faktörü) veya 'küçük' ile 'büyük' arasında bir aralık olarak gösterilebilir. Aralık ve gruplama faktörü arasındaki yazışma cihaz kılavuzunda bulunabilir. - Etkinlik Penceresi (yazılımın altındaki beyaz alan) gösterilmiyorsa, Etkinlik Penceresi Menü Görünümü'nde > etkinleştirin.
- Alım Penceresi > Görüş Alanı'na tıklayarak görüntüleme alanını ayarlayın. C şıkkı (13,2 cm) 3 fare, D şıkkı (22 cm) ise 5 fare alır.
- Edinme > Otomatik Kaydet'e tıklayarak otomatik kaydetme seçeneğini seçin ve her zaman noktası için yeni bir klasör seçin veya oluşturun.
- Görüntüleme alanına mat siyah bir kağıt yerleştirin ve bölme slaytlarını girişler arasına dik olarak yerleştirin. Üretici slaytları sağlamadıysa, parçalar halinde (3 cm x 15 cm) mat siyah kağıt kullanın.
- Cam burun konilerini anestezi girişlerine yerleştirmek için görüntüleme odasının iç alanını ayarlayın. Anestezi sistemini platforma (görüntü alanının dışında) takmak için küçük parçalar halinde siyah elektrik bandı kullanın.
NOT: Görüntüleme cihazlarının bazı versiyonlarında, bir lazer görüntüleme alanını tanımlar. Bu araç kullanılamıyorsa, görüntüleme alanındaki bölümleme slaytlarını kontrol etmek için yazılım aracılığıyla görüntüler alın. - İzofluran buharlaştırıcıyı görüntüleme ve indüksiyon odaları için oksijende %2,5'e (h/h) ayarlayın. Gazın sistemden geçip geçmediğini manometre ile kontrol edin21.
NOT: Görüntüleme cihazına bağlı bir inhalasyon anestezi sistemi yoksa, enjekte edilebilir ksilazin ve ketamin23 gibi diğer anestezi seçenekleri de mümkündür. Bu durumda, farelerin iyileşmesi yavaştır ve ölüm riski yüksektir24. - Şırıngaları (31 G iğneler) D-lusiferin ile doldurun (D-lusiferini hazırlamak için kapsamlı bir protokol farklı tedarikçiler tarafından sağlanır)25,26, doğrudan ışıktan koruyun ve içini bir kağıt havluyla kaplayarak birkaç plastik kap veya ekstra kafes hazırlayın.
- Zamanı kolayca takip etmek için yakınınızda bir saat/saat ve fare gruplarını, lusiferin enjeksiyon süresini ve işlem sırasındaki diğer bilgileri kaydetmek için bir laboratuvar defteri bulundurun.
- Tüm fareleri tartın ve ağırlıklarını kaydedin. Her fareyi kuyruğunda bir kalem işaretleyici veya dövme ile işaretleyin. Tüm deney boyunca fare tanımlamasını iyi bir şekilde görüntüleyin. Bu adım, satın alma işleminden önceki gün de gerçekleştirilebilir.
NOT: Mürekkep biyolüminesan sinyaliyle etkileşime girebileceğinden, işaret geniş bir gövde alanını kaplamamalıdır. Farklı renklerdeki kalıcı işaretleyiciler de grupları ayırt etmeye yardımcı olabilir. - Görüntüleme oturumunu başlatmak için bir arka plan ışıldayan görüntü kaydedin (ayarlar: Pozlama Süresi: 5 dk; Gruplama: 'büyük' veya '16', f/stop: 1) faresiz görüntüleme odasının. Bu prosedür, otomatik ışıldayan ışık kaynaklarının veya ekipmandaki istenmeyen sorunların belirlenmesine yardımcı olur.
NOT: BLI enzimatik reaksiyona dayandığından, zaman deneyin önemli bir özelliğidir. Hayvan işlemeye başlamadan önce yukarıda listelenen tüm öğeleri ve ekipman ayarlarını kontrol edin. - İç organlara ulaşmadan ilk 3 fareye 150 mg / kg (ip) D-lusiferin enjekte edin. D-lusiferin sızıntısı olup olmadığını değerlendirmek için fareleri kap kutusuna yerleştirin (parlak sarı çözelti). Böyle bir durumda not alın ve fare grubunu ve D-lusiferin enjeksiyon süresini kaydedin.
- 5 dakika bekleyin, ardından fareleri anestezi indüksiyon odasına aktarın. Sistemi açın. Farelerin tamamen anestezi alması yaklaşık 3 dakika sürer (bacak sallama, kuyruk vb. gibi tepkilerin olmaması) 21.
- Görüntüleme cihazının kapısını açın, görüntüleme odasına giden anestezik akışı açın ve aynı zamanda indüksiyon odasını kapatın.
- Her fareyi burun konileri konumuna yerleştirin: fare 1-3'ten soldan sağa doğru. Fareleri, ventral tarafı yukarı bakacak şekilde lazer tarafından gösterilen görüntüleme alanının içine nazikçe yerleştirin. Konaklama sırasında farelerin kimliğini ve konumunu doğrulayın. Burun konilerinde kısmen uyuşturulmuş farelerin girişini zorlamayın.
- Bölme slaytlarını fareler arasına yerleştirin ve görüntüleme ekipmanının kapısını kapatın.
- Yazılım Edinme penceresindeki alım ayarlarını aşağıdaki gibi yapın:
- Enfekte olmayan fareler için, Maruz Kalma Süresi = 5 dk / Binning = 'büyük' veya '16'
(eşik değerlerini ayarlamak için matematiksel olarak en hassas konfigürasyon seti). - Akut modeldeki enfekte fareler için: Maruz Kalma Süresi = 2 dk/ Binning = 'orta' veya '4'.
- Kronik modeldeki enfekte fareler için: Maruz Kalma Süresi = 5 dk/ Binning = 'büyük' veya '16'.
- Enfekte olmayan fareler için, Maruz Kalma Süresi = 5 dk / Binning = 'büyük' veya '16'
- Satın almaya başlamadan en az 10 dakika önce D-lusiferin enjeksiyon süresinin gerçekleştirilip gerçekleştirilmediğini doğrulayın. Değilse, lusiferaz sinyalinin zirvesi sırasında görüntüleri elde etmek için gerekli süreyi bekleyin (Şekil 1B); aksi takdirde, görüntüleme alımına başlamak için Al'a tıklayın.
- Görüntü Etiketleri penceresi, görüntüleme başladıktan sonra görünecektir. Kutuları, lusiferin enjeksiyon süresi, deney, fare tanımlaması, zaman noktası ve kayıt tutmaya yardımcı olabilecek diğer istenen bilgiler dahil olmak üzere her grup hakkında uygun bilgilerle doldurun. Bu bilgiler ölçümler tablosu dosyasına dahil edilecektir.
- Görüntüleme alımının sonunda Doygun Görüntü uyarı işaretinin gösterilip gösterilmediğini doğrulayın. Doygun görüntüler kabul edilemez. Böyle bir durumda, gruplamayı azaltın ve yeni bir görüntü elde edin. Analizde dikkate almak için notlar alın.
- Görüntü elde edildikten sonra, görüntüleme makinesinin kapısını açın ve fareleri sırt görünümüne çevirin (arka tarafı yukarı). Alımı yeniden gerçekleştirin ve uygun şekilde etiketleyin.
- Bu görüntüleme alımının sonunda, anestezik akışı kapatın. Fareleri görüntüleme odasından nazikçe çıkarın ve bir kaba koyun.
- Anestezi iyileşmesini gözlemlerken farelerin vücut ağırlığını kaydedin. İşlem sırasında bulunan herhangi bir anormal davranışı veya vücut anormalliğini kaydedin. Fareler hareket etmeye geri döndüklerinde, onları kafeslerine yerleştirin.
NOT: Alınan her görüntü için BLI yoğunluğunu doğrulayın. Çekim sona erdikten sonra, kaydedilen biyolüminesan görüntü ve fotoğraf, dikkate alınmaması gereken otomatik bir ölçek ile yazılım üzerinde görüntülenecektir. Araç Paleti penceresinde veri analizinde (aşağıda açıklanmıştır) tanımlanan ölçeği ayarlayın.
6. Veri analizi
NOT: Yukarıdaki protokol, ticari in vivo görüntüleme yazılımına dayanmaktadır. Ancak, yazılım lisanssız bir sürüm en temel analizi gerçekleştirebilir. Yazılım detaylarını Malzeme Tablosu'nda bulabilirsiniz.
- Dosyaları açın.
- Menü Dosya > Tarayıcı'yı seçerek > Klasörü seçerek belirli bir görüntüleme zaman noktasından alınan verileri içeren klasörü açın (Şekil 2A - Adım 1).
NOT: Alınan tüm verilerin seçilen dosyaya kaydedildiği bir tablo biçiminde yeni bir pencere açılacaktır. Yazılım tarafından otomatik olarak verilen görüntü kimliği (veri ve saat numaraları) olan Tıklama Numarası işaretini, edinme sırasında araştırmacı tarafından Görüntü Etiketleri penceresinde sağlanan bilgileri ve edinme ayarlarını görüntüler. Tüm bu veriler, doygun görüntülerin kullanılmaması gerektiği göz önüne alındığında, analizde kullanılabilecek görüntülerin sıralanmasına yardımcı olur. - Virüs bulaşmamış denetimler de dahil olmak üzere seçilen görüntülerle ilgili birden çok satır seçin. Görüntü kimliğini, görüntüleme oturumu sırasında kaydedilen bilgilerle birlikte laboratuvar not defterine yazın.
- Grup Olarak Yükle'ye tıklayarak seçilen görüntüleri birleştirin. Bu yordam yeni bir dizi görüntüsü oluşturur. Bu nedenle, tüm görüntüler için özellikleri aynı anda ayarlamak mümkündür. Gerekirse ham verilerin yeniden analizini kolaylaştırmak için yeni dizi görüntüsünü adım 6.1'de kullanılandan farklı bir klasöre kaydedin.
- Dizi görüntüsünde, Seçenekler > Görüntüle'ye tıklayarak > Gruplama Faktörünü Seçerek her görüntü için kullanılan gruplamayı belirleyin (Şekil 2A - Adım 2). Elde edilen gruplama faktörü, dizideki her görüntünün üst kısmında görüntülenecektir.
- Tüm gruplama faktörlerini aynı sayıya düzeltin. Bunu yapmak için, ayarlanacak görüntüye çift tıklayın. Araç Paleti penceresinde > Görüntü Ayarı bölümünde, uygun gruplama faktörünü seçin (Şekil 2A - Adım 3) - gruplama faktörü seçimi için adım 5.18'e bakın. Bu yordamı tüm farklı görüntülerde gerçekleştirin.
NOT: Bu prosedür, BLI nicelleştirmesini doğrudan etkiler (Tablo 1) ve Tartışma bölümünde daha ayrıntılı olarak ele alınmaktadır.
- Menü Dosya > Tarayıcı'yı seçerek > Klasörü seçerek belirli bir görüntüleme zaman noktasından alınan verileri içeren klasörü açın (Şekil 2A - Adım 1).
- Ölçeği ayarlayın.
- Enfekte olmayan kontrole dayalı olarak geçerli biyolüminesan sinyali (cihaz kılavuzuna göre 600'ün üzerinde sayım) ayırt edin. Bunun için, enfekte olmayan farelerin görüntüsüne çift tıklayın. Ardından, yeni pencerenin sol üst köşesinde, Birimler alanında Sayımlar seçeneğini belirleyin. Ardından, Renk Ölçeğini minimum 600 değerine ayarlayın. Ortaya çıkan görüntü, parlaklıkta minimum ölçeği ayarlamak için temel olacaktır.
- Sıra penceresi etkinken, Birimler alanında Parlaklık seçeneğini seçin. Araç paletinde renk ölçeğini ve renk tablosunu ayarlayın. Bunun için kutuyu devre dışı bırakın bireysel Renk Ölçeği Sınırları alanında.
- Kutuları işaretleyin Logaritmik Ölçek ve Manuel (Şekil 2A - Adım 4). Minimum ölçek numaralarını enfekte olmayan kontrole (adım 6.8'de gözlemlendiği gibi) ve en yüksek sinyale sahip alana (Şekil 2A'da oklarla gösterildiği gibi) göre ayarlayın.
NOT: İn vivo 2D ışık ölçümü, göreceli bir nicelleştirmedir. Her cihazın versiyonundaki ve kalibrasyonundaki farklılıklar nedeniyle farklı ölçek değerleri bulunabilir. Bu nedenle, temsili sonuçlarda gösterilen değerler, diğer cihazlarda gerçekleştirilen diğer deneylere uyamadı ve yine de dahili kontrollere göre (enfekte olmayan ve enfekte olmayan, tedavi edilmedi) eşit derecede geçerli olamadı. - Tüm görüntüler için aynı ölçeği ayarladıktan sonra, her görüntüye çift tıklayın, pencereyi büyütün ve Grafikleri Dışa Aktar düğmesini kullanarak görüntü görünümünü bir görüntü biçiminde (.jpg, .tiff vb.) dışa aktarın ve dosyaları treatment_miceID_time noktaya göre adlandırın. (Şekil 2A - Adım 5). Bu yordamı tüm görüntüler için gerçekleştirin.
- Ölçümler yapın.
- Diziden herhangi bir görüntü seçin ve üzerine çift tıklayın. ROI araçları bölümündeki Araç Paleti penceresinde >Kare düğmesine tıklayın (Şekil 2B- Adım 1) ve tüm fareyi kaplayan bir dikdörtgen çizin.
- Oluşturulan ROI'nin kenarlığına tıklayın ve her fare için aynı ROI'yi kopyalayıp yapıştırın (görüntüde üç ROI ile sonuçlanır). ROI Araçları Bölümünde kaydet'e tıklayarak ROI'leri kaydedin. Sıraya Uygula kutusunu seçerek tüm görüntüler için kaydedilen ROI'leri uygulayın ve ardından Yükle'ye tıklayın. Kaydedilen ROI'ler, deneyin tamamındaki tüm fareler için kullanılacaktır.
- Hayvanı ölçüm alanına daha iyi sığdırmak için her farenin ROI konumunu ayarlayın. Tüm fareler etiketlendiğinde, ROI'leri Ölç düğmesine tıklayın (Şekil 2B- Adım 2). ROI Ölçümleri Tablosu görünecektir. Ölçüm türlerini seçin: parlaklık; Görüntü özellikleri: tüm olası değerler; ROI Boyutları: cm. Ardından, Tümünü Seç düğmesine ve ardından Kopyala düğmesine tıklayın.
- Verileri doğrudan bir tablo analizi yazılımına (elektronik tablo) yapıştırın. Alternatif olarak, bir dosyayı .csv veya .txt biçiminde dışa aktarın.
- Veriler üzerinde çalışın.
- Tablo analizi yazılımında, verileri gruplara göre düzenleyin (tedavi, enfekte olmayan, tedavi edilmeyen kontrol vb.).
- Parazit yükü tüm vücut biyolüminesansı olarak gösterilir. Bu nedenle, verileri aynı farelerin ventral ve dorsal Toplam Akı değerleriyle eşleşecek şekilde düzenleyin ve toplayın.
- Her grubu göz önünde bulundurarak toplanan değerlerin ortalama ve standart sapmasını hesaplayın (örneğin: Ek Tablo 1). Verileri grafik ve istatistik yazılımına çizin.
- Bir görüntü veya slayt sunum yazılımında biyolüminesans görüntüler içeren bir panel hazırlayın. Verilerin görselleştirilmesini ve yorumlanmasını kolaylaştırmak için bir ilaç etkinliği matrisi oluşturmak için her fareyi bir sütuna ve satırdaki her zaman noktasına yerleştirin.
NOT: Adım 6.2.4'ü (Görüntü Düzeni Penceresini >Görüntüle) gerçekleştirmeden görüntüleri doğrudan görüntüleme yazılımına yerleştirme seçeneği vardır. Ancak, yazılım arayüzü ve araçları veri organizasyonunu sınırlar.
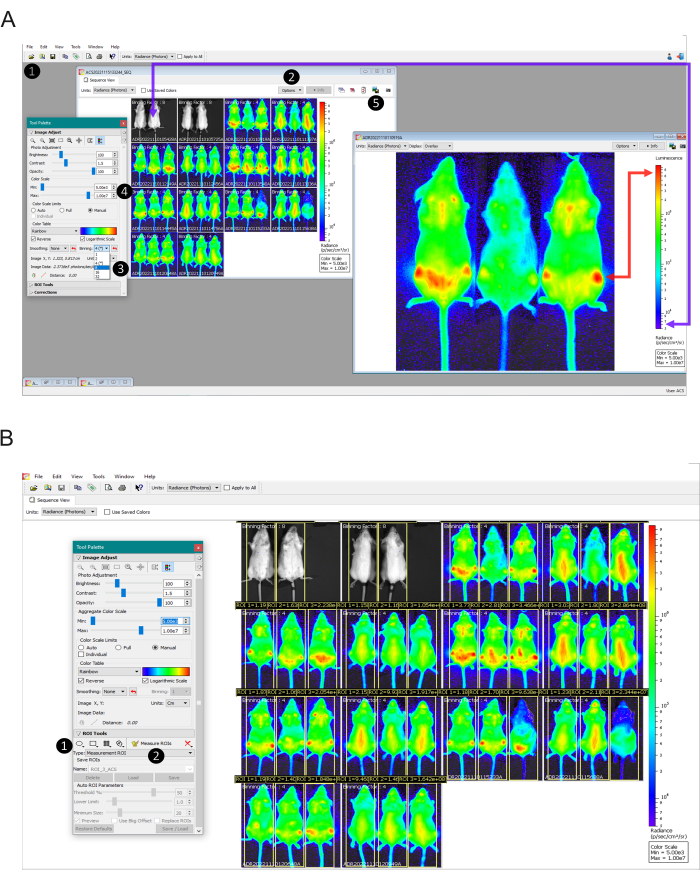
Şekil 2: Görüntü ölçeklerinin ayarlanmasından lüminesansın ölçülmesine kadar veri analizi adımları. (A) Görüntü verilerinin işlenmesi için Living Image Yazılımı görünümü. Adım 1: Elde edilen verileri Tarayıcı aracını kullanarak bir dizi olarak yükleyin. 2. Adım: Her alım için kullanılan gruplamayı tanımlayın (tek tek görüntülerin üstünde görünecektir). Adım 3: Enfekte farelerin tüm görüntülerini aynı gruplama faktörüne ayarlayın ve enfekte olmayan fareler için gruplama faktörü 16'yı uygulayın. Adım 4: Ekranda biyolüminesan olmayan olarak görülmesi gereken enfekte olmayan farelere (mor ok) ve kırmızı olarak görülmesi gereken en yüksek biyolüminesan odaklarda (kırmızı ok) enfekte olmuş ve tedavi edilmemiş farelere göre renk ölçeğini manuel olarak ayarlayın. Adım 5: Herhangi bir yazılı bilgi içermeyen bir görüntü elde etmek için, her bir görüntüye çift tıklayın ve Grafikleri Dışa Aktar düğmesini kullanarak görüntüyü dışa aktarın. (b) İlgi Bölgeleri (ROI) Araçlarının Görünümü. Adım 1: Tamamen bir fareyi kapsayan bir yatırım getirisi çizin ve her hayvan için aynı yatırım getirisini kopyalayıp yapıştırın. Ayarlanan ROI'leri kaydedin ve denemedeki tüm görüntülere uygulayın. Adım 2: .csv veya .txt olarak dışa aktarılacak tabloyu oluşturmak için ROI'leri Ölç düğmesine tıklayın. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
7. Ex vivo prosedür
- Fareye 150 mg / kg D-lusiferin i.p. enjekte edin ( ex vivo turda bir tane) ve 3 dakika bekleyin. Fareleri 100 mg / kg ketamin ve 10 mg / kg ksilazin ip kullanarak uyuşturun.
- Biyolojik bir güvenlik kabininde, fare pençelerin sıkışmasına tamamen tepki vermediğinde, peritonu (periton boşluğunu açmadan) ve sol taraftaki koltuk altı dokusunu ortaya çıkarmak için fare derisini kesin. Aksiller arteri ve damarı keserek kan kaybına devam edin.
- Tek kullanımlık bir Pasteur Pipeti kullanarak kanı toplayın. Daha sonra kalbin sol ventrikülünden DPBS çözeltisinde 10 mL 0.3 mg / mL D-lusiferin perfüze edin.
- Seçilen organları bir Petri kabı üzerinde önceden belirlenmiş noktalara yerleştirin ve 0.3 mg / mL d-lusiferin çözeltisine batırın. Bu işlem en fazla 30 dakika içinde yapılmalıdır.
- Eksize edilen organların (kalp, akciğerler, timus, karaciğer, kuadriseps kası, mezenter, dalak, böbrek, böbreküstü bezi, viseral yağ, yemek borusu, mide, ince bağırsak, çekum, kolon, beyin, deri altı yağ, uterus, gonadal yağ, mesane ve periton zarı) sinyal yoğunluğuna bağlı olarak 5 dakikalık maruz kalma süresi ve gruplama 16 kullanarak ışıldayan görüntüsünü elde edin (doymuş görüntüler kabul edilemez)22.
NOT: Eşiği ayarlamak için aynı prosedür, enfekte olmuş farelerden önce enfekte olmayan bir farede de gerçekleştirilmelidir.
Sonuçlar
Yapısal olarak lusiferazı eksprese eden transgenik parazitlere dayanan yeterli bir fare modeli kullanarak, konakçıya minimum zarara neden olan anahtar insan T. cruzi enfeksiyon özelliklerini yeniden üretmek mümkündür, bu da parazitlerin konakçının tüm vücut BLI'si ile uzunlamasına (ömür boyu) bir şekilde gerçek zamanlı olarak izlenmesine olanak tanır, birkaç aya kadar12.
Şekil 3 , BALB/c farelerinde enfeksiyondan sonraki 1. günden 150 dpi'ye kadar CL Brener Luc::Neon enfeksiyonu zaman seyrini gösteren bir pilot deneyi göstermektedir. İlk 20 dpi'de, parazitemi zirvesine özgü biyolüminesans ile çıkarılan parazit yükü artar, bunu farelerin bağışıklık kontrolüne bağlı olarak parazit yükünde keskin bir azalma izler. Bu nedenle, enfeksiyonun akut fazı ilk 50 dpi olarak kabul edilir. Kronik faz, enfeksiyon 100-150 dpi arasında sabit bir biyolüminesan hızına ulaştığında tanımlanır.
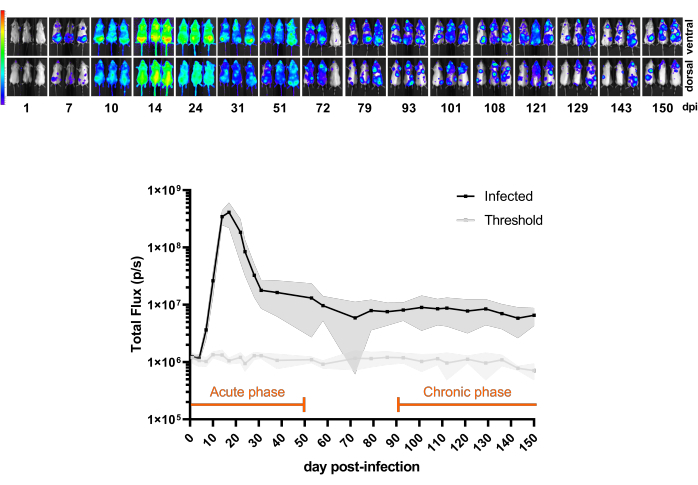
Şekil 3: Modeli anlama. Trypanosoma cruzi CL Brener Luc'un kinetiği::BALB/c farelerinde neon enfeksiyonu (n = 11). Üst panel: intraperitoneal enjeksiyon ile 1 x 10³ kan dolaşımı tripomastigotları ile enfeksiyon sonrası 150 gün (dpi) boyunca farklı zaman noktalarından ventral ve dorsal biyolüminesan görüntüler. Parlaklıkta (p/s/cm, 2/sr) biyolüminesan sinyalin ısı haritası ölçeği (Günlük10'da). Renk kodu: Mor = 5 x 103; kırmızı = 1 x 107. Alt panel: tüm vücut farelerinin Toplam Akısı (p/s) cinsinden biyolüminesan sinyal ölçümü. Veriler ortalamalar (çizgiler) ve standart sapmalar (gölgeli bölgeler) olarak ifade edilir. Bu fare modelinde enfeksiyonun akut ve kronik fazları için tanımlanan dönemler turuncu renkle vurgulanmıştır. Enfekte olmayan farelerin (n = 3) lüminesans ortalama değerleri eşik (açık gri çizgi) olarak gösterilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Enfeksiyonun ana fazları bir fare modelinde iyi bir şekilde yeniden üretildiği için terapötik sonuçlar da tahmin edilebilir. Bu nedenle, BLI artık bileşik etkinlik potansiyeli ve geliştirme hattındaki ilerleme hakkında karar vermeyi destekleyen kavram kanıtı çalışmaları yoluyla çeviri bilimine uygulanmaktadır10,27. Akut fare modelinde, enfeksiyon parazitemi zirvesine ulaştığında (yaklaşık 14-21 dpi) oral tedaviye başlanmalıdır, bu da kan dolaşımında yüksek sayıda tripomastigot (yaklaşık 1 x 105 tripomastigot/mL - veriler gösterilmemiştir) ve sistemik enfeksiyon ile karakterize edilir. Kronik fazda, fare tedavisi, parazit yükünün nispeten çok daha düşük olduğu 100 dpi'de başlar ve stabil alt patent parazitemisi vardır.
Antiparaziter ajanların değerlendirilmesinde yukarıda tarif edilen protokolün uygulanmasını göstermek için, Chagas hastalığının tedavisinde kullanılan standart ilaç olan benznidazol (BZ) ve Chagas hastalığı için klinik çalışmalarda başarısız olan ve ayrıca T. cruzi'ye karşı antiparaziter ajan olarak etkisiz olduğu gösterilen bir sterol 14α-demetilaz (CYP51) inhibitörü olan posakonazolün (Posa) tedavi etkinliğini karşılaştırdık , bu protokolde açıklanan BLI modeli de dahil olmak üzere 13,18,28,29,30.
Akut fare modeli için, grup başına 6 fareden oluşan kohortlar, günde bir kez 20 mg / kg'da Posa veya 100 mg / kg'da BZ ile 20 gün boyunca gavaj31 ile oral olarak tedavi edildi. Fareler ayrıca kısa tedavilerin etkisini değerlendirmek için günde bir kez 100 mg / kg'da 5 gün boyunca BZ ile tedavi edildi. Bileşik eliminasyondan sonra (tedavi sona erdikten 10 gün sonra), BLI negatif fareler immünosuprese edildi, bu da parazitolojik bir tedavi sağlanamadığında enfeksiyonun nüksetmesini teşvik eden bir durumdur (Şekil 4A). Posa tedavisi, tedavinin sonunda biyolüminesans ile çıkarılan parazit yükünde% 99.49 ±% 0.27 (ortalama ± standart sapma) azalma ile sonuçlandı ve ilaç bileşiği eliminasyon süresi boyunca enfekte olmayan farelerin benzer seviyelerinde kaldı (40 dpi'de geçici bir sinyal ile fare # 3 ve 44 dpi'de zayıf bir BLI noktası gösteren fare # 2 hariç). Tedavi edilmeyen grupla karşılaştırıldığında, 20 günlük BZ tedavisi, tedavi sonunda biyolüminesans ile ortaya çıkan parazit yükünü %100 ± %0.01 azalttı. Buna karşılık, BZ ile 5 günlük kısa tedavi, 19 dpi'de (eşik seviyesine benzer) %99,98 ± %0,03'lük bir azalmaya yol açtı. Bununla birlikte, bu durumda, BLI azalması geçiciydi ve sonraki edinimlerde, tüm fareler enfeksiyon reaktivasyonu gösterdi (Şekil 4B).
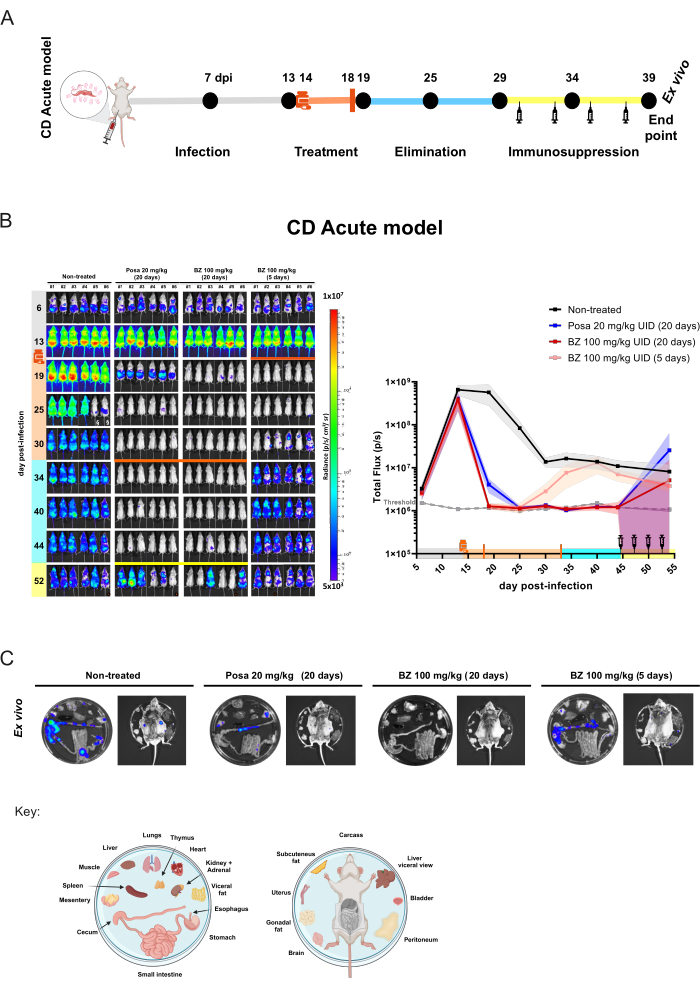
Şekil 4: Chagas hastalığı akut modelinde biyolüminesans görüntüleme ile elde edilen kavram kanıtı deney tasarımı ve sonuçları. (A) Bileşik etkinliğinin değerlendirilmesi için klinik öncesi çalışmalar için akut Chagas hastalığı fare modelinde zaman çizelgesi sürecinin şematik şeması. Siyah noktalar: zaman noktalarını görüntüleme. İlaç şişesi ve turuncu çubuk: sırasıyla tedavi başlangıcı ve bitişi. Şırınga simgesi: siklofosfamid enjeksiyonları. DPI: enfeksiyondan sonraki gün. Renk kodu: gri = tedavi edilmemiş enfeksiyon; turuncu = tedavi süresi; mavi = bileşik eliminasyon aşaması; Sarı = immünosupresyon dönemi. (B) Trypanosoma cruzi'nin tedavi süresi. Sol panel: BALB / c farelerinin ventral biyolüminesans görüntüleri (i) (ii) 20 mg / kg'da posakonazol (Posa), (iii) 20 gün boyunca tedavi edilmiş 100 mg / kg'da benznidazol (BZ) ve (iv) (n = 6 / grup) ile 5 gün boyunca tedavi edilmiş 100 mg / kg'da BZ. Tüm tedaviler günde bir kez gavaj (10 mL/kg) oral yoldan uygulandı. Log10 ölçekli ısı haritası, düşük seviyeden (mavi) yükseğe (kırmızı) kadar biyolüminesan sinyal yoğunluğunu gösterir. Sağdaki grafik: biyolüminesans görüntüleme verilerinin tüm vücut ölçümü. Veriler ortalamalar (çizgiler) ve standart sapmalar (gölgeli bölgeler) olarak ifade edilir. Anahtar: İlaç şişesi: tedavi başlangıcı (14 dpi); turuncu çubuk: tedavi sonu (18 dpi/33 dpi); şırınga simgesi siklofosfamid enjeksiyonları (44-53. günden itibaren); turuncu nokta: ex vivo prosedürle analiz edilen fare; § idrarda D-lusiferin sızıntısı nedeniyle hariç tutulan veriler. (C) Organ ve dokularda T. cruzi odaklarının tespiti için ex vivo prosedür. Plaka dağıtım anahtarı şeklin altında sunulmuştur (BioRender.com: ZY26LG8AOF ile oluşturulmuştur). İn vivo panelde gösterilenle aynı parlaklık ölçeği. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Bu modelde, antiparaziter tedavi, parazit yükünü 1000 parazitin BLI tespit sınırının altına düşürebilir. Böylece, fareler BLI negatif10 olarak görünür. Parazitolojik bir tedavinin elde edildiğinden emin olmak için, siklofosfamid tedavisi29,32 kullanılarak farelerin immünosupresyonunu teşvik etmek gerekir. İlaç tedavisinden sonra hala tespit edilemeyen bir parazit yüküne sahip olan fareler, immünosupresyondan sonra BLI pozitif hale gelecektir. Bu etki, parazit nüksetmesini teşvik eden akut modelde Posa tedavisi ile daha yaygın olarak gösterilmiştir. Bu deneyde, parazit dokusu tropizmini değerlendirmek için en düşük biyolüminesan sinyale sahip fareler üzerinde ex vivo prosedürü gerçekleştirildi (Şekil 4C). Tedavi edilmeyen fareler, özellikle gastrointestinal sistemde (TGI) ve viseral yağ ve mezenter gibi ilişkili dokularda güçlü biyolüminesan sinyaller gösterir. Ek olarak, cilt parazit kalıcılığı ile ilişkili bir bölgeydi. Posa ile tedavi edilen fareler, kolon, mezenter ve viseral yağ ile daha sınırlı olan daha düşük yoğunluklu biyolüminesan lekeler sundu. Öte yandan, 20 gün boyunca BZ 100 mg / kg olarak iyileştirici bir tedavi rejimi ile tedavi edilen farelerde, immünosupresyon altında bile biyolüminesan sinyal tespit edilmez. Bu nedenle, biyolüminesan sinyalin 1000 parazit10 eşik seviyesinin üzerine çıkması için koşulların teşvik edilmesinden ve iç organların açığa çıkarılmasıyla duyarlılığın arttırılmasından sonra, 20 gün boyunca BZ 100 mg / kg'ın steril kür sağladığı düşünülmektedir. Steril kürün değerlendirilmesi daha önce farklı tekniklerle doğrulanmıştır 10,13,17,33,34.
Benzer bir çalışma tasarımı, farelerin (n = 6 / grup) enfeksiyondan sonraki 100. günde tedavi edilmeye başlandığı kronik modele (Şekil 5A) uygulandı. Bu noktada, Posa 20 mg / kg, 100 mg / kg'da BZ veya günde bir kez 10 mg / kg 20 gün boyunca oral yoldan uygulandı. İlaç eliminasyon süresinden sonra, BLI negatif fareler immünosuprese edildi. Ek olarak, steril kürü değerlendirmek için, immünosupresyon fazının sonunda hala BLI negatif olan fareler ex vivo analize tabi tutuldu.
Kronik enfeksiyonda, 20 mg / kg'da Posa ile tedavi, tedavinin sonunda biyolüminesans ile indüklenen parazit yükünde% 95.03 ±% 6.18'lik bir azalmaya yol açtı ve ilaç eliminasyon süresi boyunca enfekte olmayan farelerin benzer seviyelerinde kaldı. İmmünosupresyondan sonra, farelerin çoğu değişken bir BLI sinyali ve dağılımı seviyesi gösterdi (Şekil 5B). Ex vivo prosedür, Posa ile tedavi edilen bir tüm vücut BLI negatif farenin, ex vivo muayene ile tespit edilebilen kolonda biyolüminesan bir noktaya sahip olduğunu ortaya koydu (Şekil 5C).
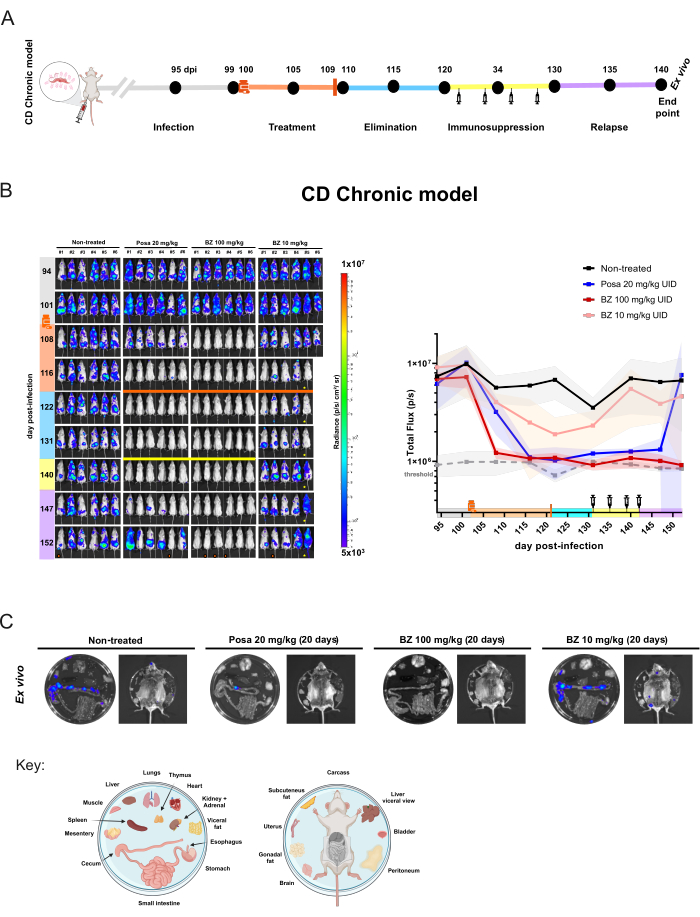
Şekil 5: Biyolüminesans görüntüleme ile Trypanosoma cruzi enfeksiyonunun kronik modelinde elde edilen ilaç değerlendirme deney tasarımı ve sonuçları. (A) Kronik Chagas hastalığı fare modelinin deney tasarımının şematik şeması. Siyah noktalar: zaman noktalarını görüntüleme. İlaç şişesi ve turuncu çubuk: sırasıyla tedavi başlangıcı ve bitişi. Şırınga simgesi: siklofosfamid enjeksiyonları. Dpi: enfeksiyondan sonraki gün. Renk kodu: Gri = tedavi edilmemiş enfeksiyon; turuncu = tedavi süresi; mavi = bileşik eliminasyon aşaması; sarı = immünosupresyon; leylak = nüks. (B) Chagas hastalığı kronik modelinde tedavi etkinliğinin boylamsal değerlendirmesi. Sol panel: BALB / c farelerinin ventral BLI'si (i) 20 mg / kg'da (ii) posakonazol (Posa) ile 20 gün boyunca tedavi edilmemiş veya tedavi edilmiş; (iii) 100 mg / kg'da benznidazol (BZ) ve (iv) 10 mg / kg'da BZ (n = 6 / grup). Tüm tedaviler günde bir kez gavaj ile oral yoldan uygulandı. Sağdaki grafik: ventral ve dorsal toplam akı ham verilerinin toplamı. Anahtar: ilaç şişesi: tedavi başlangıcı (102 dpi); turuncu çubuk: tedavi sonu (121 dpi); Sarı çubuk ve şırınga simgesi: siklofosfamid enjeksiyonları (131-142. günden itibaren). Turuncu nokta: ex vivo prosedürle analiz edilen fare. ! Fare anestezi sırasında öldü.  Fare abdominal anormallikler gösterir. Isı Haritası Ölçeği (Günlük10), düşük seviyeden (3 × 105 mavi) yüksek seviyeye (1 × 107 kırmızı olarak) kadar parlaklık birimindeki biyolüminesans yoğunluğunu gösterir. (C) Dokuda T. cruzi tropizminin ex vivo analizi. 100 mg / kg'da Posa ve BZ ile tedaviden sonra immünosuprese in vivo BLI negatif farelerden veya tedavi edilmemiş ve 10 mg / kg gruplarında BZ'de en düşük sinyale sahip farelerden eksize edilen organların biyolüminesans tespiti. Plaka dağıtım anahtarı şeklin alt kısmında gösterilmiştir (BioRender.com: ZY26LG8AOF ile oluşturulmuştur). Parlaklık ölçeği in vivo panele eşittir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Fare abdominal anormallikler gösterir. Isı Haritası Ölçeği (Günlük10), düşük seviyeden (3 × 105 mavi) yüksek seviyeye (1 × 107 kırmızı olarak) kadar parlaklık birimindeki biyolüminesans yoğunluğunu gösterir. (C) Dokuda T. cruzi tropizminin ex vivo analizi. 100 mg / kg'da Posa ve BZ ile tedaviden sonra immünosuprese in vivo BLI negatif farelerden veya tedavi edilmemiş ve 10 mg / kg gruplarında BZ'de en düşük sinyale sahip farelerden eksize edilen organların biyolüminesans tespiti. Plaka dağıtım anahtarı şeklin alt kısmında gösterilmiştir (BioRender.com: ZY26LG8AOF ile oluşturulmuştur). Parlaklık ölçeği in vivo panele eşittir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
100 mg / kg'da BZ ile tedavi, biyolüminesansı 122 dpi'de eşik seviyelerine (% 93.87 ±% 2.14) düşürdü ve deneyin sonuna kadar ileri sürdü. Ex vivo analiz göz önüne alındığında, BZ %100'lük bir kür oranı elde etti (6/6 fare), çünkü hiçbir fare, bağışıklığı baskılanmış ve iç organlar incelendiğinde bile biyolüminesan sinyalin geri dönüşünü göstermedi. Bu, nüks eksikliği anlamına gelir. Bununla birlikte, daha düşük bir konsantrasyona sahip BZ tedavi rejimi, biyolüminesansta hafif bir azalma (% 85.95 ±% 18.43) ile sonuçlandı, ancak fareler sonraki tüm zaman noktalarında saptanabilir biyolüminesan sinyal odakları göstermeye devam ettiğinden, tedavi olmadı. Bu nedenle, bu model etkisiz tedaviler (posakonazol ve benznidazol ile suboptimal tedavi) ve etkili tedaviler (benznidazol ile optimal dozlama ve tedavi uzunluğu) arasında kantitatif ayrıma izin verir.
Ek Şekil 1: Raportör gen mNeonGreen floresansının ölçümü ile lusiferazın T. cruzi popülasyon ekspresyonunun enfeksiyon öncesi analizi. CL Brener Luc::Neon paraziti tarafından yapısal olarak eksprese edilen mNeonGreen floresan proteininin akış sitometrisi. mNeonGreen floresan yoğunluğu (X ekseni) ile parazit sayısının (Y ekseni) normalleştirilmiş histogramı. Dahili gösterge, analiz edilen gerinim ve formu, floresan medyanını ve floresan popülasyonunun yüzdesini gösterir. Kapı hatları, CL Brener vahşi tip (WT) suşu ile floresan olmayan kontrol olarak tanımlanır. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Tablo 1: BLI ölçümünde analiz tablosu örneği. Biyolüminesans görüntülemeden elde edilen ham veriler, Şekil 4B'de gösterilen temsili sonuçlarda kullanılan akut modelde enfeksiyondan sonraki 19. günün nicelemesi. Grup tanımı: Enfekte olmayan fareler olarak kontrol (n = 3/grup); tedavi edilmemiş enfekte fareler olarak araç; 20 gün boyunca 20 mg / kg'da posakonazol (Posa); 20 gün boyunca 100 mg / kg'da benznidazol (BZ); 5 gün boyunca tedavi edilen 100 mg / kg'da BZ (n = 6 / grup). Bu dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Biyolüminesans görüntüleme, görünür ve kızılötesi bir elektromanyetik radyasyon spektrumu kullanarak bir rapor geninin tespit edilmesini sağlayan çığır açan bir yöntemdir. Bu nedenle, numunenizi35 izlemek için radyoaktif işaretli işaretleyicilere gerek yoktur. BLI, kemirgen modelleri ve diğer küçük türler için uygundur. Klinik öncesi çalışmalar için çok faydalıdır çünkü daha güvenlidir ve birkaç görüntü turuna izin vererek minimum hayvan rahatsızlığına neden olur. Ayrıca, biyolüminesans, floresan ve pozitron emisyon tomografisi gibi diğer tekniklerin birleştirilme olasılığı nedeniyle in vivo görüntüleme çok esnektir36.
Optik görüntüleme, absorpsiyon ve saçılma gibi optik fiziksel özellikler tarafından yönetilir. Tüm dokular, farklı dalga boylarındaki ışığı farklı şekilde emer ve saçar37. Kritik bir adım, kimyasal reaksiyon tarafından üretilen ışığın yayılan dalga boyunu hesaba katmadan bir raportör gen seçmektir. Raportör gen ekspresyon seviyesi biyolüminesan deneylerde in vitro olarak yüksek olabilirken, in vivo ortama ilerlerken aynı ekspresyon seviyeleri elde edilemeyebilir. Bu protokolde, in vivo çalışmalar için en uygun olanlardan biri olan 617 nm'de ışık yayan tripanosomatidler9 için kırmızıya kaymış Photinus pyralis luciferase (PpyRE9H)38 kodonu optimize edilmiş versiyon kullandık39. 600 nm'den daha uzun dalga boyları, özellikle hemoglobin ve melanin olmak üzere vücut endojen kromoforları tarafından daha az emilir ve saçılır. Böylece, kırmızı ışıklar birkaç santimetre dokudan iletilebilir ve fotonların iç organların içinden bile CCD kameraya ulaşmasını sağlar39,40.
Görüntüleme ayarlarındaki endişe alanlarından biri, işlevlerinin ve etkilerinin kapsamlı bir şekilde anlaşılmamasıdır. Bir ön işleme tekniği olan gruplama, bitişik dedektörler tarafından elde edilen bilgileri daha büyük bir pikselde birleştirir. Bu işlem, sinyal-gürültü oranını artırarak arka plan gürültüsünü azaltır ve hassasiyeti artırır. Bununla birlikte, uzamsal çözünürlük doğruluğunu azaltarak pikselli bir görüntüyeneden olur 41,42. Bu değiş tokuş, görüntüleme stratejinizde önemli bir husustur.
Chagas hastalığı34 için Hedef Ürün Profili ve Hedef Aday Profiline dayanarak, kavram kanıtlama çalışması, T. cruzi'yi tespit etme ve yeni bir ilaç adayının steril bir tedavi sağlayıp sağlayamayacağını belirlemeye yardımcı olma duyarlılığına odaklanmıştır (birkaç immünosupresyon turundan sonra nüks eksikliği ile temsil edilir). Bu nedenle, görüntüyü aşırı doygunlaştırmadan en yüksek gruplama faktörünü kullanarak BLI'yi yürütürüz. Görüntü aşırı doygunluğa ulaştığında, daha düşük bir gruplama faktörü kullanılarak yeni bir alım gerçekleştirilir. Analiz sırasında, farklı gruplama gerektiren görüntülere matematiksel bir düzeltme uygulanır. Bu şekilde, nihai veriler aynı gruplama kullanılarak sunulmalıdır. Tablo 1 , aynı görüntüde ve ROI'lerde farklı gruplama faktörleri uygulandığında elde edilen farklı değerleri göstermektedir.
Tablo 1: Gruplama ayarlarının BLI niceliği üzerindeki etkisi. Akut model (d13) ve kronik model (d118) görüntüsünde üç ROI'nin ölçülmesi, farklı gruplama faktörlerinde analiz edildi. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Klinikte Chagas hastalığının mevcut senaryosu nedeniyle, ilaç keşif çabaları parazitleri tamamen ortadan kaldırmayı amaçlamaktadır (parazitolojik tedavi)27,34. Bu nedenle, in vivo preklinik protokol, BLI teknik duyarlılığının sınırlamalarının üstesinden gelen yaklaşımları içerir. Yaklaşımlardan biri, parazit yükünü kontrol eden bağışıklık tepkisini azaltmak için fareleri siklofosfamid ile tedavi etmektir. Başka bir strateji, doku derinliğini azaltmak ve kameraya giden ışık yolunu engelleyen kas, deri ve kürk katmanlarını çıkarmaktır. Ex vivo prosedür sayesinde, Posa ile tedavi edilen farenin ex vivo sonucu Şekil 5C'de gösterildiği gibi, in vivo BLI eşiğinin altında parazit odaklarını ortaya çıkaran küçük biyolüminesan noktalar tespit edilebilir.
Modelin kendisini ve enfeksiyon dinamiklerini değerlendirmek için bir pilot deney tasarlamak, antiparaziter ilaç etkinliği değerlendirmesi için doğru bir deney oluşturmak için çok önemlidir. Bu nedenle, araştırmacı uygun BLI ayarlarını ve enfeksiyon zaman seyrini önceden tanımlayabilecektir. Keşif amaçlı bir deneyde, edinim ayarlarını tanımlamaya yardımcı olabilecek bir araç 'Otomatik Pozlama'dır. Bu araçla araştırmacı, mümkün olan en iyi görüntüyü elde etmek için üç ayarın (Pozlama süresi, Gruplama ve F/Stop) önceliğini belirler. Özellikle, araştırmacı, görüntülerin CCD kameranın dinamik aralığı içinde, aşırı doygunluk veya düşük pozlama olmadan, ölçeğin ve otomatik pozlama özelliğinin minimum ve maksimum sınırları aracılığıyla kontrol edilebilen, elde edilmesini sağlamalıdır (Menü Düzenleme > Tercihler > Sekme Alma > Sekme Otomatik Pozlama). Bu protokolde, kamera açıklığı maksimum değere (F/Stop: 1) ayarlandı ve akut ve kronik modeller için farklı pozlama süreleri ve gruplama faktörleri tanımlandı. Bu ayarlar, aynı anda farklı görüntü turları gerçekleştirmek için zaman öngörülebilirliği sağlar. Raportör yönteminin bir enzimatik reaksiyona dayandığı göz önüne alındığında, hem substratın fareye biyolojik dağılımı hem de lusiferaz kinetiği, biyolüminesan sinyalini ve dolayısıyla enfeksiyon miktarını etkiler (Şekil 1B). Sonuç olarak, enzimatik kinetik momentlerinde görüntü elde etmek, açıklanamayan veya düzeltilemeyen veri değişkenliğini ortaya çıkarır ve toplam akı (fotonlar/saniye) veya parlaklık (fotonlar/saniye/cm2/steradyan) hesaplamasını etkiler. Ayrıca, T. cruzi enfeksiyonu farelerde dinamik uzamsal konumlandırma gösterir (farklı alanlar ve dokular, derinlik ve parazit yükü). Bu nedenle, elde edilecek sayımların bir değerini belirlemek, başka bir daha güçlü sinyalin kaynağı tanımlanan otomatik maruz kalma kriterlerini karşılıyorsa, daha zayıf sinyal kaynaklarını (dokunun daha derin bir noktasında düşük sayıda parazit) gözden kaçırabilir.
Living Image yazılımının zor bir özelliği, elde edilen görüntüyü otomatik bir renk ölçeğinde görüntülemektir. Seçilen ölçek değerlerine göre otomatik olarak yepyeni bir edinilmiş görüntüyü gösterecek şekilde ölçeği önceden ayarlama seçeneği yoktur (bkz. protokol adımı 6.2). Bu durum, araştırmacıyı görüntüleri tek tek manuel olarak seçilen maksimum ve minimum değerlere değiştirmeye zorlar. Sonuç olarak, deneyimsiz ve iyi eğitimli olmayan kullanıcılar, edinme oturumu sırasında uygun okumaya sahip olamazlar ve o noktada verileri yanıltabilir veya önemli bilgileri kaybedebilirler. Bunun için pilot deney faydalıdır.
Kavram kanıtı deney tasarımı ile ilgili en yaygın sorulardan biri, tedavi süresinin ve dozunun nasıl seçileceğidir. Yeni kimyasal varlıklar için, bu parametreler genellikle, ilaç metabolizması ve farmakokinetiği (DMPK) tarafından oluşturulan veriler ve etkinlik için in vivo testlerden önce yürütülen tolere edilebilirlik çalışmaları ile kombinasyon halinde, in vitro bileşik potens ve seçicilik ile tanımlanır. Özetle, hücrelerin içindeki paraziti seçici olarak öldürebilen bileşikleri belirledikten sonra, ilk ADME deneyleri (absorpsiyon, dağılım, metabolizma ve atılım), diğer parametrelerin yanı sıra bileşiklerin suda çözünürlüğünü, hücre geçirgenliğini ve metabolik stabilitesini tahmin etmek için in vitro olarak gerçekleştirilir. Bileşikler in vitro özelliklerin iyi bir dengesini gösteriyorsa (genellikle hedef aday profillerinde tanımlanır), bu adaylar sağlıklı farelerde in vivo farmakokinetik (PK) çalışmalara ilerletilir, bu da kandaki (ve muhtemelen dokularda) bileşik maruziyetini ana hatlarıyla belirtir ve farklı doz seviyelerinde tolere edilebilirlik hakkında genel bir fikir verir17, 34,43. İdeal olarak, çoğu bulaşıcı hastalıkta PK değerlendirmesinin amacı, EC50/EC90 konsantrasyonlarının44 üzerindeki serbest plazma konsantrasyonlarına (plazma protein bağlanması için düzeltilmiş) ulaşmanın fizibilitesini belirlemektir - parazitlerin sırasıyla %50 veya %90'ını öldüren veya en azından büyümesini engelleyen etkili konsantrasyon - yeterince uzun bir süre boyunca. Belirli bir doz seviyesinde yeterli maruziyet elde edilirse, bu rejim Chagas BLI modeli kullanılarak yapılan etkinlik çalışmaları sırasında kullanılabilir. İlaç yeniden konumlandırma çalışmaları için in vitro ve in vivo PK verileri mevcut olmalıdır. İlacın yeniden profillenmesi için iyi bir başlangıç, test edilecek güvenli ve toksik olmayan tedavi rejimlerini tahmin etmek için allometrik ölçeklendirme46 kullanılarak farelere dönüştürülebilen tanınmış veriler sağlayan PubChem45 gibi kimyasal veri tabanlarıdır. Ancak, bu her zaman böyle değildir. PK çalışmaları, akademik bilimde hala göz ardı edilen bir alandır ve çok az ilaç şirketi PK sonuçlarını yayınlamaktadır. İlaç keşfi bilim topluluğu, in vivo PK değerlendirmesinin yanı sıra ilaç etkinliği deneyleri (farmakodinamik) dahil edilmesini önermektedir47. Bu nedenle, klinik öncesi görüntüleme, eş zamanlı olarak bileşik ölçümlerle uyumludur ve bu ilişkili yaklaşım, veri sağlamlığını artırır.
Ek olarak, farelerin kullanımı, ağırlığı ve sağlık koşulları tüm deney boyunca izlenir. Kamburlaşma, titreme, denge kaybı, hareket etme isteksizliği, beslenmeye veya içmeye isteksizlik, secde veya grupta veya bireysel fare koşullarında mevcut olan diğer anormallikler gibi toksisite belirtileri ve yan etkiler klinik öncesi çalışmalarda kaydedilmeli ve rapor edilmelidir. Optik görüntülemenin amaçlarından biri de hayvanların refahını sağlamaktır. Bu nedenle, 'Yüz buruşturma ölçeği48'de açıklanan ağrı belirtileri olan farelerde insancıl uç noktalar uygulanmalıdır. Ayrıca, fareler BLI alımı sırasında ve daha sık olarak ilaç dozu ve CTX tedavisi sırasında haftalık olarak tartıldı. Hayvan refahı düzenlemelerine göre, vücut ağırlığının %20'sinden fazlasını kaybeden fareler derhal insancıl bir şekilde ötenazi yapılmalıdır.
T. cruzi biyolüminesan modeli, Chagas hastalığı için yeni tedavilerin keşfedilmesi ve geliştirilmesi için son teknoloji deneysel modeldir. T. cruzi enfeksiyonu ve Chagas hastalığı49'un temel özelliklerini çoğaltan, paraziteminin gerçek zamanlı izlenmesine ve bilinen etki modlarıyla ilişkili çeşitli etkinlik profillerine sahip bileşiklerin farklılaşmasına izin veren bir model. BLI, enfekte olmuş dokuları tanımlamada atılganlığı artıran bir tekniktir. Enfekte dokuların hassas seçiminin, T. cruzi araştırmasında50,51 halihazırda uygulanmış olan tüm klasik yöntemler de dahil olmak üzere çok çeşitli yaklaşımlarda kullanılmasını sağlar. Ek olarak, araştırmacıların en son teknolojileri keşfetmelerine ve yenilerini geliştirmelerine olanak tanır33. Ek olarak, BLI, aynı anda 3R ilkelerine10,35 göre hayvan refahının iyileştirilmesini ve daha rasyonel kullanımını sağlar.
İhmal edilen tropikal hastalıklara odaklanan birçok araştırma grubu, in vivo görüntüleme cihazlarının bulunmadığı ülkelerde yer almaktadır. Mevcut senaryonun üstesinden gelmek için, Global BioImaging ve ilgili konsorsiyumları gibi yeni uluslararası ağlar, görüntüleme çekirdek tesislerine açık erişim sağlamak ve personel ile görüntüleme bilimcilerinin eğitimini iyileştirmek için eylemleri teşvik etmektedir 52,53. Bu girişimler, bunun gibi kullanıcı dostu protokollerle birlikte, tüm araştırmacılar için üst düzey teknolojileri demokratikleştiren koşulları karşılayabilir. Bu yöntemin klinik öncesi ilaç keşfinde uygulanması, Chagas hastalığı için ilaç keşfini kolaylaştıran sağlam bir etkinlik okuması ve klinik sonucun prediktif değerini sunmuştur.
Açıklamalar
Yazarların beyan edebilecekleri herhangi bir çıkar çatışması yoktur.
Teşekkürler
Yazarlar, ilaç etkinliği deneyleri konusunda BLI eğitimi ve desteği sağladıkları için Amanda Franscisco, John Kelly ve Fanny Escudié'ye, parazitler sağladıkları için John Kelly ve Simone Calderano'ya ve hayvan çalışmalarına destek için Gabriel Padilla'ya teşekkür eder. A.C.S, London School of Hygiene and Tropical Medicine'de (Birleşik Krallık) eğitim almak için CAPES PSDE Bursu aldı. Yazarlar ayrıca, IVIS Spektrum ekipman analiziyle ilgili teknik destek için Sao Paulo Üniversitesi (CEFAP-USP) Bilimsel Araştırma Çekirdek Tesisi'ndeki Akış Sitometrisi ve Görüntüleme Araştırmaları (FLUIR) Platformuna ve Genetik ve Sıhhi Kontrol Laboratuvarı'na teşekkür etmek isterler. Bu proje DNDi tarafından finanse edilmiştir. DNDi, 2003 yılındaki kuruluşundan bu yana tüm DNDi faaliyetleri için finansman sağlayan kamu ve özel bağışçılarına minnettardır. DNDi'nin bağışçılarının tam listesi https://dndi.org/about/donors/ adresinde bulunabilir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| BD LSRFortessa™ X-20 Cell Analyzer | BD Biosciences | ||
| Weighing Balance (animal facility) | Available from several suppliers | ||
| IVIS Spectrum In Vivo Imaging System | Revvity (former PerkinElmer) | ||
| FlowJ Software v10.7.1 | BD Biosciences | ||
| Living Image Software for Spectrum v4.7.1 | Revvity (former PerkinElmer) | License Free Analysis Software called 'Aura Imaging' could be used for the most basic features provided by Spectral Instruments Imaging (Bruker company) (https://spectralinvivo.com/software/) | |
| Microsoft Office software | Microsoft | ||
| GraphPad Prism v8.4.0 | GraphPad Software Inc. | ||
| DMEM Low Glucose | Vitrocell | D0025 | |
| Sodium bicarbonate | Sigma-Aldrich | S5761-500G | |
| Foetal Bovine Serum (FBS) | Gibco | 16000-044 | |
| Penicillin-Streptomycin | Gibco | 15140-122 | |
| Trypsin 0.5% EDTA | Gibco | 25300-062 | |
| LIT medium | In house | ||
| Hygromycin B (50 mg/mL) | Gibco | 10687010 | |
| Grace′s Insect Medium | Sigma-Aldrich | G9771 | |
| HEPES | Sigma-Aldrich | 54457 | |
| IVISBrite d-luciferin potassium salt | Revvity (former PerkinElmer) | 122799 | Also could be used: VivoGlo Luciferin, in vivo grade (Promega/P1043); D-Luciferin, Monopotassium Salt (Thermo Scientific/88293) or PierceD-Luciferin, Monosodium* Salt (Thermo Scientific/88291); D-Luciferin, Potassium Salt (GoldBio/LUCK or eLUCK); D-Luciferin, Sodium* Salt (GoldBio/LUCNA or eLUCNA) *Sodium or potassium salt differences relies minimal chances on solubility, however do not affect in vivo performance. |
| DPBS | Gibco | 21600-044 | |
| Cyclophosphamide (CTX) | Sigma-Aldrich | C0768-5g | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D5879 | |
| (Hydroxypropyl)methyl cellulose (HPMC) | Sigma-Aldrich | 09963-25G | |
| Benzyl alcohol | Sigma-Aldrich | 402834 | |
| Tween 80 | Sigma-Aldrich | P1754-1L | |
| Benznidazole | ELEA | ||
| Posaconazole (Noxafil commercial formulation) | Schering-Phough | ||
| Giemsa | Available from several suppliers | ||
| gavage needle (stainless-steel straight) - 22GA | Aton | CA2003 | |
| 1 mL Syringe and 31G needle | Available from several suppliers | ||
| 1 mL Syringe and removable 26G needle | Available from several suppliers | ||
| 1 mL Syringe and removable 24G X¾ needle | Available from several suppliers | ||
| Sterile Syringe Filter 0.2 µm | Available from several suppliers | ||
| A4 Matte Black paper 120gr or thicker | Paper Color/ Canson (Available from several suppliers) | ||
| aluminum foil | Available from several suppliers | ||
| Neubauer chamber | Available from several suppliers |
Referanslar
- WHO fact sheet. Chagas disease (also known as American trypanosomiasis). WHO, World Health Organization. , Available from: https://www.who.int/news-room/fact-sheets/detail/chagas-disease-(american-trypanosomiasis) (2023).
- Lee, B. Y., Bacon, K. M., Bottazzi, M. E., Hotez, P. J. Global economic burden of Chagas disease: a computational simulation model. Lancet Infect Dis. 13 (4), 342-348 (2013).
- Bern, C. Chagas' disease. N Engl J Med. 373 (5), 456-466 (2015).
- Shikanai-Yasuda, M. A., Carvalho, N. B. Oral transmission of Chagas disease. Clin Infect Dis. 54 (6), 845-852 (2012).
- Lidani, K. C. F., et al. Chagas disease: From discovery to a worldwide health problem. Front Public Health. 7, 166(2019).
- Perez-Molina, J. A., Molina, I. Chagas disease. Lancet. 391 (10115), 82-94 (2018).
- Field, M. C., et al. Anti-trypanosomatid drug discovery: An ongoing challenge and a continuing need. Nat Rev Microbiol. 15 (7), 447(2017).
- Kratz, J. M. Drug discovery for chagas disease: A viewpoint. Acta Trop. 198, 105107(2019).
- McLatchie, A. P., et al. Highly sensitive in vivo imaging of Trypanosoma brucei expressing 'red-shifted' luciferase. PLoS Negl Trop Dis. 7 (11), e2571(2013).
- Lewis, M. D., Francisco, A. F., Taylor, M. C., Kelly, J. M. A new experimental model for assessing drug efficacy against Trypanosoma cruzi infection based on highly sensitive in vivo imaging. J Biomol Screen. 20 (1), 36-43 (2015).
- Costa, F. C., et al. Expanding the toolbox for Trypanosoma cruzi: A parasite line incorporating a bioluminescence-fluorescence dual reporter and streamlined CRISPR/Cas9 functionality for rapid in vivo localisation and phenotyping. PLoS Negl Trop Dis. 12 (4), e0006388(2018).
- Lewis, M. D., et al. Bioluminescence imaging of chronic Trypanosoma cruzi infections reveals tissue-specific parasite dynamics and heart disease in the absence of locally persistent infection. Cell Microbiol. 16 (9), 1285-1300 (2014).
- Francisco, A. F., et al. Limited ability of posaconazole to cure both acute and chronic Trypanosoma cruzi infections revealed by highly sensitive in vivo imaging. Antimicrob Agents Chemother. 59 (8), 4653-4661 (2015).
- du Sert, N. P., et al. The arrive guidelines 2.0: Updated guidelines for reporting animal research. PLoS Biol. 18 (7), e3000410(2020).
- Turner, P. V., Brabb, T., Pekow, C., Vasbinder, M. A. Administration of substances to laboratory animals: routes of administration and factors to consider. J Am Assoc Lab Anim Sci. 50 (5), 600-613 (2011).
- Turner, P. V., Pekow, C., Vasbinder, M. A., Brabb, T. Administration of substances to laboratory animals: equipment considerations, vehicle selection, and solute preparation. J Am Assoc Lab Anim Sci. 50 (5), 614-627 (2011).
- Francisco, A. F., et al. Nitroheterocyclic drugs cure experimental Trypanosoma cruzi infections more effectively in the chronic stage than in the acute stage. Sci Rep. 6, 35351(2016).
- Moraes, C. B., et al. Nitroheterocyclic compounds are more efficacious than CYP51 inhibitors against Trypanosoma cruzi: implications for Chagas disease drug discovery and development. Sci Rep. 4, 4703(2014).
- Shaner, N. C., et al. A bright monomeric green fluorescent protein derived from Branchiostoma lanceolatum. Nat Methods. 10 (5), 407-409 (2013).
- de Araújo-Jorge, T. C., de Castro, S. L. Chagas Disease: Manual for Animal Experimentation. , FIOCRUZ Publisher. Rio de Janeiro. (2000).
- JoVE. JoVE Science Education Database. Anesthesia Induction and Maintenance. JoVE. , (2023).
- Taylor, M. C., et al. Exploiting genetically modified dual-reporter strains to monitor experimental Trypanosoma cruzi infections and host-parasite interactions. Methods Mol Biol. 1955, 147-163 (2019).
- Keyaerts, M., et al. Inhibition of firefly luciferase by general anesthetics: effect on in vitro and in vivo bioluminescence imaging. PLoS One. 7 (1), e30061(2012).
- Jiron, J. M., et al. Comparison of isoflurane, ketamine-dexmedetomidine, and ketamine-xylazine for general anesthesia during oral Procedures in rice rats (Oryzomys palustris). J Am Assoc Lab Anim Sci. 58 (1), 40-49 (2019).
- GoldBio. GoldBio Luciferin In Vivo Handbook - a detailed method for Luciferin preparation and administration for model animals. GoldBio Protocol. , Available from: https://goldbio.com/documents/1068/Luciferin%20in%20vivo%20handbook.pdf (2013).
- Revity. Preparation of IVISbriteTM D-Luciferin for in vitro and in vivo bioluminescent assays. Revvity Standard Operate Procedure (Tech Notes). , Available from: https://resources.perkinelmer.com/lab-solutions/resources/docs/SOP_LuciferinPrep_InVitroInVivo_BLI-Assays.pdf (2023).
- Chatelain, E., Scandale, I. Animal models of Chagas disease and their translational value to drug development). Expert Opin Drug Discov. 15 (12), 1381-1402 (2020).
- Khare, S., et al. Antitrypanosomal treatment with benznidazole is superior to posaconazole regimens in mouse models of Chagas disease. Antimicrob Agents Chemother. 59 (10), 6385-6394 (2015).
- Bustamante, J. M., Craft, J. M., Crowe, B. D., Ketchie, S. A., Tarleton, R. L. New, combined, and reduced dosing treatment protocols cure Trypanosoma cruzi infection in mice. J Infect Dis. 209 (1), 150-162 (2014).
- Molina, I., et al. Randomized trial of posaconazole and benznidazole for chronic Chagas' disease. N Engl J Med. 370 (20), 1899-1908 (2014).
- JoVE. Science Education Database. Compound Administration II. JoVE. , (2023).
- Pukhalsky, A. L., Toptygina, A. P., Viktorov, V. V. Immunosuppressive action of cyclophosphamide in mice: Contribution of some factors to determination of strain differences. Int J Immunopharmacol. 15 (4), 509-514 (1993).
- Francisco, A. F., et al. Comparing in vivo bioluminescence imaging and the Multi-Cruzi immunoassay platform to develop improved Chagas disease diagnostic procedures and biomarkers for monitoring parasitological cure. PLoS Negl Trop Dis. 16 (10), e0010827(2022).
- Kratz, J. M., et al. The translational challenge in Chagas disease drug development. Mem Inst Oswaldo Cruz. 117, e200501(2022).
- Youn, H., Hong, K. -J. In vivo noninvasive small animal molecular imaging. Osong Public Health Res Perspect. 3 (1), 48-59 (2012).
- Refaat, A., et al. In vivo fluorescence imaging: success in preclinical imaging paves the way for clinical applications. J Nanobiotechnology. 20 (1), 450(2022).
- Pirovano, G., Roberts, S., Kossatz, S., Reiner, T. Optical imaging modalities: Principles and applications in preclinical research and clinical settings. J Nucl Med. 61 (10), 1419-1427 (2020).
- Branchini, B. R., Southworth, T. L., Khattak, N. F., Michelini, E., Roda, A. Red- and green-emitting firefly luciferase mutants for bioluminescent reporter applications. Anal Biochem. 345 (1), 140-148 (2005).
- Zhao, H., et al. Emission spectra of bioluminescent reporters and interaction with mammalian tissue determine the sensitivity of detection in vivo. J Biomed Opt. 10 (4), 041210(2005).
- O'Neill, K., Lyons, S. K., Gallagher, W. M., Curran, K. M., Byrne, A. T. Bioluminescent imaging: a critical tool in pre-clinical oncology research. J Pathol. 220 (3), 317-327 (2010).
- Mennel, L., et al. A photosensor employing data-driven binning for ultrafast image recognition. Sci Rep. 12 (1), 14441(2022).
- Yoo, Y., Im, J., Paik, J. Low-light image enhancement using adaptive digital pixel binning. Sensors. 15 (7), 14917-14931 (2015).
- Moraes, C. B., et al. Accelerating drug discovery efforts for trypanosomatidic infections using an integrated transnational academic drug discovery platform. SLAS Discov. 24 (3), 346-361 (2019).
- Sebaugh, J. L. Guidelines for accurate EC50/IC50 estimation. Pharm Stat. 10 (2), 128-134 (2011).
- Kim, S., et al. PubChem 2023 update. Nucleic Acids Res. 51, D1 D1373-D1380 (2023).
- Sharma, V., McNeill, J. H. To scale or not to scale: the principles of dose extrapolation. Br J Pharmacol. 157 (6), 907-921 (2009).
- Barrow, J. C., Lindsley, C. W. The importance of PK-PD. J Med Chem. 66 (7), 4273-4274 (2023).
- Langford, D. J., et al. Coding of facial expressions of pain in the laboratory mouse. Nat Methods. 7 (6), 447-449 (2010).
- Lewis, M. D., Kelly, J. M. Putting infection dynamics at the heart of Chagas disease. Trends Parasitol. 32 (11), 899-911 (2016).
- Brener, Z. Therapeutic activity and criterion of cure on mice experimentally infected with Trypanosoma cruzi. Rev Inst Med Trop Sao Paulo. 4, 389-396 (1962).
- Cummings, K. L., Tarleton, R. L. Rapid quantitation of Trypanosoma cruzi in host tissue by real-time PCR. Mol Biochem Parasitol. 129 (1), 53-59 (2003).
- Keppler, A., Grebnev, G., Reis, Y. Global BioImaging. , . (2024).
- Pfander, C., et al. Euro-BioImaging - Interdisciplinary research infrastructure bringing together communities and imaging facilities to support excellent research. iScience. 25 (2), 103800(2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır