Method Article
Entmystifizierung der In-vivo-Biolumineszenz-Bildgebung eines Mausmodells für die Chagas-Krankheit für Wirksamkeitsstudien von Arzneimitteln
In diesem Artikel
Zusammenfassung
Das hier bereitgestellte Protokoll beschreibt die detaillierten Schritte zur Durchführung von Arzneimittelwirksamkeitsstudien in einem biolumineszierenden Modell der Trypanosoma cruzi-Infektion , wobei der Schwerpunkt auf der Datenerfassung, -analyse und -interpretation liegt. Fehlerbehebungs- und Qualitätskontrollverfahren zur Minimierung technischer Probleme werden ebenfalls bereitgestellt.
Zusammenfassung
Um die Auswirkungen menschlicher Protozoenkrankheiten wie der Chagas-Krankheit, der Leishmaniose und der menschlichen afrikanischen Trypanosomiasis auf die öffentliche Gesundheit zu kontrollieren und zu verringern, ist es notwendig, die Entwicklung neuer Medikamente und Impfstoffe zu beschleunigen. Dieser Prozess ist jedoch mit Schwierigkeiten wie der hochkomplexen Parasitenbiologie und Krankheitspathogenese verbunden und, wie für vernachlässigte Tropenkrankheiten typisch, mit vergleichsweise begrenzten Mitteln für Forschung und Entwicklung. Daher sind In-vitro - und In-vivo-Studienmodelle , die die Schlüsselmerkmale von Infektionen und Krankheiten ausreichend reproduzieren können und gleichzeitig eine rationale Nutzung der Ressourcen ermöglichen, für den Fortschritt der Forschung zu diesen Erkrankungen unerlässlich. Ein Beispiel ist das in vivo Biolumineszenz-Imaging (BLI) Mausmodell für die Chagas-Krankheit, das eine hochempfindliche Detektion von langwelligem Licht ermöglicht, das von Trypanosoma cruzi-Parasiten erzeugt wird, die Luciferase exprimieren. Obwohl diese Technik zum Standardansatz für In-vivo-Studien zur Wirksamkeit von Arzneimitteln geworden ist, könnten Forschungsgruppen immer noch Schwierigkeiten haben, sie umzusetzen, da es an einer angemessenen praktischen Ausbildung in der Handhabung von Geräten und der Anwendung von Qualitätskontrollverfahren mangelt, selbst wenn geeignete BLI-Geräte leicht verfügbar sind. Unter Berücksichtigung dieses Szenarios zielt dieses Protokoll darauf ab, von der Planung von Experimenten bis zur Datenerfassung und -analyse zu führen, mit Details, die die Implementierung von Protokollen in Forschungsgruppen mit wenig oder keiner Erfahrung mit BLI erleichtern, entweder für die Chagas-Krankheit oder für andere Mausmodelle für Infektionskrankheiten.
Einleitung
Die Chagas-Krankheit ist in Lateinamerika endemisch und betrifft weltweit etwa sieben Millionen Menschen1. Jährlich resultieren mehr als 50.000 Todesfälle und wirtschaftliche Verluste von rund 7 Milliarden Dollar aus der Behinderung dieser Krankheit2. Die Chagas-Krankheit wird durch das Protozoon Trypanosoma cruzi verursacht, einen heteroxenischen Hämoflagellaten-Parasiten, der in der Lage ist, Säugetiere (wild und domestiziert) und Triatomin-Vektoren (Hemiptera, Reduviidae)3 in Nord- und Südamerika zu infizieren, wo die vektorielle Übertragung nachgewiesen ist. Weitere wichtige Infektionswege sind Bluttransfusionen, Organtransplantationen, orale (durch die Aufnahme von Lebensmitteln, die mit einem infizierten Triatomin kontaminiert sind)4 und angeborene Übertragung. Nicht-vektorielle Übertragungswege haben zur Ausbreitung der Chagas-Krankheit in nicht-endemische Gebiete beigetragen 3,5.
Die Chagas-Krankheit manifestiert sich in zwei klinischen Phasen. Die akute Phase verläuft in den meisten Fällen asymptomatisch. Symptomatische Infektionen sind in der Regel mit unspezifischen Anzeichen wie Fieber, Müdigkeit, Myalgie, Lymphadenopathie, Splenomegalie und Hepatomegalie verbunden. Die akute Phase ist auch oft mit einer offenen Parasitämie und einer systemischen Zirkulation von Parasiten verbunden. In bis zu 10 % der diagnostizierten Fälle kann es zum Tod kommen, insbesondere bei oralen Infektionen6. Die chronische Phase ist oft durch eine lange Zeit der Abwesenheit von Symptomen gekennzeichnet. Im Laufe der Zeit zeigt etwa ein Drittel der Patienten, die sich Jahrzehnte zuvor infiziert haben, kardiale Manifestationen, die in der Regel von Fibrose und Myokardentzündungen begleitet werden, und/oder gastrointestinale Erkrankungen, die meist mit der Entwicklung von Megaösophagus- und/oder Megakolonsyndromen zusammenhängen 3,5,6.
Die ätiologische Behandlung der Chagas-Krankheit besteht nur aus zwei Medikamenten: Benznidazol und Nifurtimox. Diese Antiparasitika sind seit über 50 Jahren verfügbar und haben eine beträchtliche Toxizität und eine begrenzte Wirksamkeit 5,7,8. Folglich besteht ein dringender Bedarf, neue, sichere und wirksamere Behandlungen für Patienten mit Chagas-Krankheit zu entwickeln.
Ausgefeiltere und genauere Techniken ermöglichen es nun, Antworten auf alte Fragen zu erhalten, die Fortschritte bei der Suche nach neuen Behandlungen für die Chagas-Krankheit ermöglichen. In diesem Sinne profitiert die wissenschaftliche Gemeinschaft stark von gentechnisch veränderten Parasiten für In-vivo-Studien zum Infektionsverlauf und zur Bewertung der Wirksamkeit von Arzneimitteln 9,10,11,12. Ein longitudinaler Assay, der auf dem Biolumineszenz-Bildgebungssystem (BLI) basiert, ermöglicht die Bewertung der Wirksamkeit während und nach dem Behandlungsschema, was zur Identifizierung von Verbindungen mit trypanozider Aktivität führt10,13. Die BLI-Methode ermöglicht eine direkte Messung der Parasitenbelastung, sowohl im Blutkreislauf als auch in Geweben und Organen, durch die Quantifizierung des Lichts, das von der genetisch veränderten T. cruzi CL Brener Luc::Neon-Linie11 produziert wird, die konstitutiv die rotverschobene Glühwürmchen-Luziferase12 exprimiert.
Nichtsdestotrotz dominieren fast 10 Jahre nach der Etablierung des BLI-Tiermodells für die Chagas-Krankheit und der Arzneimittelwirksamkeitsstudien nur wenige Forschungsgruppen diese Technik. Diese Tatsache ist nicht nur auf den eingeschränkten Zugang zu geeigneten bildgebenden Geräten zurückzuführen, sondern auch auf den Mangel an Schulungen und die Verfügbarkeit strukturierter, detaillierter Protokolle. Diese Methode bietet mehrere Vorteile gegenüber anderen Ansätzen, die auf der Beurteilung von Parasitämie durch Mikroskopie, Serologie oder der Bewertung von Organ-/Gewebeinfektionen durch qPCR für den Nachweis von Parasiten-DNA beruhen, da sie ein verbessertes Wohlbefinden von Mäusen und eine Reduzierung des Tierverbrauchs durch die Möglichkeit der Generierung robusterer und integrierter Daten in vivo ermöglicht. Darüber hinaus ist diese Methode wohl sensitiver, da sie eine schnelle Detektion von Parasitenherden in viszeralen Organen nach medikamentöser Behandlung ermöglicht10,12. Daher zielt dieses Protokoll darauf ab, Forschungsgruppen auf dem Gebiet der Parasitologie und anderer Infektionskrankheiten bei der Etablierung dieser Methodik in ihren Laboratorien zu unterstützen, indem die technischen Verfahren detailliert beschrieben werden. Hier teilen wir die Erfahrungen, die wir bei der Implementierung des BLI-Modells für die Chagas-Krankheit in Brasilien gesammelt haben, dem ersten seiner Art in Lateinamerika, im Rahmen der von der Initiative "Drugs for Neglected Diseases" (DNDi) koordinierten Wirkstoffforschung.
Protokoll
Alle in diesem Protokoll beschriebenen Verfahren wurden gemäß den Richtlinien14 eingereicht, genehmigt und durchgeführt, die von der Tierethikkommission des Instituto de Ciências Biomédicas an der Universidade de São Paulo erstellt wurden: Protokoll CEUA ICB/USP no 5787250522.
1. Lösungen
HINWEIS: Berücksichtigen Sie das vorkonisierte verabreichte Volumen von 10 ml/kg (200 μl für eine Maus mit einem Gewicht von 20 g)15,16. Bereiten Sie beispielsweise eine Arbeitslösung von 15 mg/ml vor, um eine Tierdosierung von 150 mg/kg zu erreichen.
- Hydroxypropylmethylcellulose-Federungsfahrzeug (HPMC-SV)
HINWEIS: Die erforderlichen Reagenzien sind 0,5 % (w/v) Hydroxypropylmethylcellulose (HPMC), 0,4 % (v/v) Tween 80 und 0,5 % (v/v) Benzylalkohol.- Für 200 ml Vehikellösung 1 g HPMC wiegen und in 64 ml heißem Reinstwasser auflösen. 2 Min. rühren.
- 120 mL eiskaltes Reinstwasser zugeben und 1 h rühren. Fügen Sie 1 ml Benzylalkohol hinzu.
- Fügen Sie dann 0,8 ml Tween 80 mit der umgekehrten Pipettiertechnik hinzu und rühren Sie weiter, bis die Lösung transparent wird.
- Passen Sie die Lösung auf das endgültige Volumen von 200 ml an. Lagern Sie den HPMC-SV maximal 3 Monate im Kühlschrank (4 °C).
- Benznidazol
- Berechnen Sie die erforderliche Menge an zusammengesetzter Lösung wie folgt:
Volumen der zusammengesetzten Lösung = (Anzahl der Dosen pro Tag x Anzahl der Tage x Anzahl der zu behandelnden Mäuse x verabreichtes Volumen in jeder Maus) + 30% extra. - Wiegen Sie die notwendige Menge an Benznidazol (BZ) unter Berücksichtigung der gewünschten Dosis. Für die kurative Behandlung erreicht eine orale Dosis von 100 mg/kg einmal täglich über 10 Tage eine 100%ige Heilung im chronischen Zöliakie-Modell17.
- Berechnen Sie unter Berücksichtigung des gewünschten Endvolumens die richtige Menge, um eine Konzentration von 5 % (v/v) DMSO zu erreichen und BZ vollständig in reinem DMSO aufzulösen.
- Geben Sie das richtige Volumen des Fahrzeugs in ein Glasröhrchen, um eine Konzentration von 95 % (v/v) HPMC-SV zu erreichen. Übertragen Sie das in DMSO gelöste BZ in das Glasröhrchen mit HPMC-SV. Die Suspension wird kräftig homogenisiert und bei 4 °C gelagert.
Beispiel: Endvolumen der BZ-Formulierung = 10 mL (Schritt 1.2.1)
Menge an BZ = 100 mg (Schritt 1.2.2)
5 % DMSO = 0,5 mL (Schritt 1.2.3) und 95 % HPMC-SV = 9,5 mL (Schritt 1.2.4) - Vor jeder Arzneimittelverabreichung werden die Formulierungen für 5 min bei 37 °C in ein Ultraschall-Wasserbad gelegt und vor der Tierdosierung kräftig homogenisiert.
- Berechnen Sie die erforderliche Menge an zusammengesetzter Lösung wie folgt:
- Cyclophosphamid
- Lösen Sie die erforderliche Menge Cyclophosphamid in Reinstwasser, um eine Lösung von 12,5 mg/ml zu erhalten.
- Die Lösung durch Filtration sterilisieren und bei 4 °C lagern.
- Giemsa-Beize
- 0,6 mg Giemsa-Pulverreagenz in 50 ml Methanol auflösen. 25 ml Glycerin hinzufügen und mischen. Ausfällungen mit Filterpapier und einem Trichter entfernen. Lagern Sie die Stammlösung bei Raumtemperatur (RT) und vor Licht geschützt.
- Bereiten Sie eine Arbeitslösung vor, indem Sie 10 ml Giemsa-Lösung in 90 ml Mischphosphatpuffer (20,5 M Na2HPO4, 65,4 M KH2PO4 bei pH 7,2) verdünnen.
2. Kultur von Trypanosoma cruzi
- In einer biologischen Sicherheitswerkbank (BSC) werden 4 x 106 Epimastigoten/ml T . cruzi CL Brener Luc::Neon11 in LIT-Medien kultiviert (68,44 mM NaCl, 5,36 mM KCl, 112,7 mM Na2HPO4, 5 g/L Trypton, 5 g/L Leberinfusionsbrühe, 0,03 M Hämin, 4,16 mM Glukose), ergänzt mit 10 % (v/v) fötalem Rinderserum (FBS), 100 μg/ml Penicillin, 100 μg/ml Streptomycin und 150 μg/ml Hygromycin als selektives Arzneimittel bei 28 °C. Die Parasiten erreichen typischerweise innerhalb von 3-4 Tagen eine stationäre Phase.
- Induzieren Sie die Metazyklogenese, um infektiöse Parasiten zu erhalten, indem Sie 3 x 108 Epimastigoten in 10 mL Grace's Insect Medium mit 10% (v/v) FBS in 15 mL konischen Röhrchen bei 28 °C für 7-10 Tage inkubieren.
- Bestimmen Sie die Differenzierungsrate durch Giemsa-Färbeabstriche. Dafür 20 μL der differenzierten Parasiten in einem Objektträger verteilen und 10 min trocknen lassen.
- Fahren Sie mit der Probenfixierung in einem Abzug fort, indem Sie den Objektträger mit sauberem Methanol abdecken und vollständig trocknen lassen (1-2 min). Decken Sie den Objektträger 20 Minuten lang mit der Giemsa-Arbeitslösung ab.
- Waschen Sie den Objektträger vorsichtig mit destilliertem Wasser. Zählen Sie im Mikroskop den prozentualen Anteil metazyklischer Trypomastigoten. Wenn eine Differenzierungsrate von mindestens 10 Prozent erreicht wird, fahren Sie mit dem nächsten Schritt fort.
- Zentrifugieren Sie die Parasiten (120 x g für 10 min) und resuspendieren Sie das Pellet mit 10 mL DPBS. Zentrifugieren Sie erneut und resuspendieren Sie die Parasiten in 5 ml DMEM, ergänzt mit 10 % (v/v) FBS, 100 μg/ml Penicillin und 100 μg/ml Streptomycin.
- In einem 25 cm2 Kulturkolben wird die Infektion von 1,66 x 105 LLC-MK2-Zellen (Nierenepithelzellen von Macaca mulatta) bei 37 °C in 5 % CO2 in einem befeuchteten Inkubator18 durchgeführt.
- Gewebekultur-Trypomastigoten (TCTs) werden nach 8-9 Tagen im Medium freigesetzt. Infizieren Sie frische LLC-MK2-Zell-Monolayer mit TCTs bei einer Multiplizität der Infektion (MOI) von 1:40.
3. Analyse der Homogenität der Trypanosoma cruzi-Population mittels Durchflusszytometer
- Sammeln Sie TCTs von CL Brener Luc::Neon und CL Brener Wildtyp-Stämmen, zentrifugieren Sie 10 min lang bei 120 x g und resuspendieren Sie die TCTs in DPBS. Passen Sie die Parasitendichte an, um 1 x 106/ml zu erreichen.
- Fahren Sie mit der Populationsanalyse mit einem Durchflusszytometer auf der Grundlage der mNeonGreen-Fluoreszenz (z. B. 506/em. 517 nm)19 fort und erfassen Sie mindestens 20.000 Ereignisse für jede Probe.
HINWEIS: Der Prozentsatz der fluoreszierenden Population wird durch den Vergleich des Wildtyps mit dem transfizierten Parasiten ermittelt. Um mit der Mäuseinfektion fortzufahren, sollten mindestens 95% der fluoreszierenden Parasitenpopulation der CL Brener Luc::Neon-Linie erreicht werden (Ergänzende Abbildung 1).
4. Experimentelle Infektion von Mäusen
HINWEIS: Um die Menge an Parasiten zu erhöhen, werden Blutbahn-Trypomastigoten (BT) häufig aus immundefizienten Mäusen gewonnen10,13. Hierbei wird eine chemische Immunsuppression von BALB/C-Mäusen zur Gewinnung von BT eingesetzt. Dazu wird eine milde Immunsuppression mit vier intraperitonealen Injektionen von Cyclophosphamid (CTX) in 62,5 mg/kg im Abstand von 96 h erreicht, die parallel zur T. cruzi-Infektion durchgeführt wird.
- Verabreichen Sie 62,5 mg/kg steriles Cyclophosphamid durch intraperitoneale Injektion (i.p.) 1 Tag vor der T. cruzi-Infektion .
- Infizieren Sie jede Maus mit 1 x 104 TCTs in 0,2 ml DPBS auf intraperitonealem Weg. Achten Sie auf das hohe Risiko von Zwischenfällen beim Umgang mit Krankheitserregern und Nadeln. Führen Sie die Infektion in einem BSC durch und tragen Sie während des gesamten Eingriffs Handschuhe und einen Gesichtsschutz.
- Überwachen Sie die Parasitämie täglich durch direkte Beobachtung des BT im Blut (Pizzi-Brener-Methode)20. Am Höhepunkt der Parasitämie, etwa 13-17 Tage nach der Infektion (dpi), führen Sie die Blutentnahme durch. Dazu werden Mäuse mit 100 mg/kg Ketamin und 10 mg/kg Xylazin betäubt.
- Wenn Mäuse vollständig anästhesiert sind21, fahren Sie mit der Herzpunktion fort, indem Sie eine 1-ml-Spritze verwenden, die an einer 24 G X3/4-Nadel befestigt ist, die 50 μl 3,8 % (w/v) Natriumcitrat enthält. Ziehen Sie den Stecker aus der Steckdose und geben Sie das Blut vorsichtig in ein Zentrifugenröhrchen.
- Führen Sie in einer BSC eine Verdünnung eines Aliquots des Blutes in Ammoniumchlorid-Kalium (ACK)-Lysepuffer durch und zählen Sie die Parasiten in der Neubauer-Kammer. Wiederholen Sie diesen Vorgang mindestens zweimal, da kleine Blutgerinnsel die Parasitenzählung beeinflussen.
HINWEIS: Um Zählfehler zu vermeiden, passen Sie den Verdünnungsfaktor an, um Zählungen von weniger als 30 und mehr als 300 Trypomastigoten in der Neubauer-Kammer zu vermeiden. - Stellen Sie die Parasitendichte auf 5 x 103 BT/ml ein, indem Sie die erforderliche Menge reines Blut in DPBS mischen.
- Infizieren Sie nicht-immunsupprimierte BALB/c-Mäuse mit 1 x 103 BT in 0,2 mL DPBS pro Maus (5 x 103 BT/ml) auf intraperitonealem Weg mit einer 26-G-Nadel (schmalere Nadeln führen zur Parasitenlyse)22. Halten Sie die Nadel nach der intraperitonealen Injektion des Volumens 5 s lang in der Maus, um einen Rückfluss zu vermeiden.
- Legen Sie die infizierten Mäuse vorübergehend mit einem Papiertuch in eine Box, um mögliche Leckagen oder Blutungen zu erkennen, und bringen Sie die Mäuse dann wieder in ihre Käfige zurück.
5. In-vivo-Bildgebung
HINWEIS: Das Glossar der hier verwendeten Begriffe lautet wie folgt:
Bildgebungssitzung: Biolumineszenz-Erfassung, die in allen Gruppen eines bestimmten Experiments an einem bestimmten Tag durchgeführt wird. Abbildung 1A zeigt einen Überblick über das Vorgehen.
Bildgebende Runde: Verfahren, das in Untergruppen von drei Mäusen durchgeführt wurde, von der D-Luciferin-Injektion bis zur Wiederherstellung der Anästhesie. Es wird empfohlen, dass jede Versuchsgruppe 6 Mäuse umfasst, aufgrund der intrinsischen Variabilität der Parasitenlast der Mäuse und anderer Faktoren, die die unten beschriebene BLI-Quantifizierung beeinflussen.
Bildaufnahme: Fotoaufnahme, die von den bildgebenden Geräten durchgeführt wird, um die Biolumineszenz zu quantifizieren, was zu einer Bildüberlagerung eines Fotos führt und die quantifizierte Biolumineszenz als Pseudofarbskala dargestellt wird.
Bildgebendes Verfahren: Alle Schritte, die in dieser Sitzung des Protokolls besprochen werden.
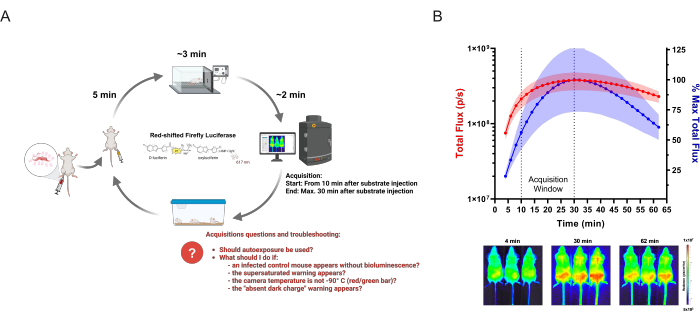
Abbildung 1: Erfassung von BLI-Daten. (A) Diagramm des Erfassungsablaufs für Studien zu Infektionskrankheiten am Beispiel des biolumineszierenden Mausmodells der Chagas-Krankheit. Mäuse, die mit gentechnisch verändertem T. cruzi infiziert sind, werden durch in vivo Bildgebung zu den festgelegten Zeitpunkten analysiert. In jeder Bildgebungsrunde werden Gruppen von bis zu drei Mäusen 150 mg/kg Enzymsubstrat (D-Luciferin) injiziert. Nach 5 Minuten wird die Anästhesie mit 2,5 % (v/v) Isofluran in Sauerstoff verabreicht. Wenn die Mäuse völlig bewegungslos sind, werden sie in ein Bildgebungssystem gelegt, und die Aufnahme wird gemäß den definierten Einstellungen gestartet. Nach der Bildgebung erholen sich die Mäuse von der Narkose und werden in Käfige zurückgebracht. Häufige Fragen und Probleme, die die Forscher während der Akquise haben könnten und mit denen sie konfrontiert sind, sind rot hervorgehoben. Dieses Schema wurde von Lewis et al. (2014)12 (erstellt mit BioRender.com: UD26KWEVS2) modifiziert. (B) In-vivo-Kinetik von D-Luciferin/Rotverschiebungs-Glühwürmchen-Luziferase (PpyRE9h). Mäuse am T. cruzi-Parasitämie-Peak (n = 3) wurden anästhesiert und mit 150 mg/kg D-Luciferin injiziert. Die Bilder wurden für 1 h aufgenommen (Belichtungszeit: 2 min; Binning: 4). Oben: Quantifizierung des ventralen Gesamtflusses (p/s) (linke Y-Achse, in rot) und als Prozentsatz der höchsten mittleren Messung (rechte Y-Achse, in blau). Die Daten werden als Mittelwert (Kurven) und Standardabweichung (schattierter Bereich) dargestellt. Unten: Aufgenommene Bilder des ersten (4 min), des höchsten BLI-Signals (30 min) und des letzten (62 min) Zeitpunkts. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Überprüfen Sie den grünen Balken im Erfassungsfenster , um zu überprüfen, ob die CCD-Kamera (Charge-Coupled Device) kalt ist (-90 °C). Klicken Sie auf den Balken (grün oder rot), um die Temperatur zu visualisieren.
HINWEIS: Gemäß dem Handbuch des bildgebenden Geräts sollten das bildgebende Gerät und die Software ständig eingeschaltet sein, um den CCD kalt zu halten. - Überprüfen Sie, ob die automatische Hintergrundanpassung durchgeführt wurde. Klicken Sie dazu auf Erfassung > Hintergrund > verfügbaren Dark Charge anzeigen. Es erscheint eine Liste mit mehreren Einstellungskombinationen.
HINWEIS: Dieses Verfahren reduziert das Lumineszenzrauschen. Wenn die gewählte Konfiguration einen Wert über 1000 ergibt, basierend auf der Formel "Belichtungszeit x (Binning²)", sollte die Dunkelladung nicht ignoriert werden. Abhängig von den Softwarekonfigurationen kann das Binning als Zahl (Binning-Faktor) oder als Bereich von "klein" bis "groß" angezeigt werden. Die Entsprechung zwischen dem Bereich und dem Binning-Faktor finden Sie im Gerätehandbuch. - Wenn das Aktivitätsfenster (weißer Bereich am unteren Rand der Software) nicht angezeigt wird, aktivieren Sie es in der Menüansicht > Aktivitätsfenster.
- Stellen Sie den Bildbereich ein, indem Sie auf Aufnahmefenster > Sichtfeld klicken. Option C (13,2 cm) erhält 3 Mäuse und Option D (22 cm) 5 Mäuse.
- Wählen Sie die Option "Automatisches Speichern" aus, indem Sie auf "Erfassung" > "Automatisches Speichern" klicken und wählen Sie für jeden Zeitpunkt einen neuen Ordner aus oder erstellen Sie einen neuen Ordner.
- Legen Sie ein mattschwarzes Papier auf den Bildbereich und platzieren Sie die Trennfolien senkrecht zwischen den Einlässen. Wenn der Hersteller die Folien nicht zur Verfügung gestellt hat, verwenden Sie Stücke (3 cm x 15 cm) mattschwarzes Papier.
- Passen Sie den Innenbereich der Bildgebungskammer so an, dass die Glasnasenkegel an den Anästhesieeinlässen befestigt sind. Verwenden Sie kleine Stücke schwarzes Isolierband, um das Anästhesiesystem an der Plattform (außerhalb des Bildbereichs) zu befestigen.
HINWEIS: In einigen Versionen von Bildgebungsgeräten definiert ein Laser den Bildgebungsbereich. Wenn dieses Werkzeug nicht verfügbar ist, erfassen Sie Bilder über die Software, um die Partitionierungsfolien im Bildgebungsbereich zu überprüfen. - Stellen Sie den Isofluran-Verdampfer für die Bildgebungs- und Induktionskammer auf 2,5 % (v/v) Sauerstoff ein. Mit dem Manometer ist zu prüfen, ob das Gas durch das System21 strömt.
HINWEIS: Wenn an das bildgebende Gerät kein Inhalationsanästhesiesystem angeschlossen ist, sind andere Anästhesieoptionen möglich, wie z. B. injizierbares Xylazin und Ketamin23. In diesem Fall erholt sich die Maus nur langsam und das Sterberisiko ist hoch24. - Füllen Sie Spritzen (31-G-Nadeln) mit D-Luciferin (ein umfassendes Protokoll zur Herstellung des D-Luciferins wird von verschiedenen Anbietern zur Verfügung gestellt)25,26, schützen Sie sie vor direktem Licht und bereiten Sie einige Plastikbehälter oder zusätzliche Käfige vor, indem Sie den Innenraum mit einem Papiertuch abdecken.
- Halten Sie eine Uhr in der Nähe, um die Zeit leicht zu verfolgen, und ein Labornotizbuch, um Mäusegruppen, Luciferin-Injektionszeit und alle anderen Informationen während des Eingriffs zu registrieren.
- Wiegen Sie alle Mäuse und registrieren Sie ihr Gewicht. Markieren Sie jede Maus mit einem Stiftmarker oder einer Tätowierung auf dem Schwanz. Halten Sie die Mäuseidentifikation während des gesamten Experiments gut sichtbar. Dieser Schritt kann auch am Tag vor der Akquisition durchgeführt werden.
HINWEIS: Die Markierung sollte keinen großen Körperbereich einnehmen, da die Tinte das Biolumineszenzsignal beeinträchtigen kann. Auch verschiedenfarbige Permanentmarker können helfen, die Gruppen zu unterscheiden. - Um die Imaging-Sitzung zu starten, registrieren Sie ein lumineszierendes Hintergrundbild (Einstellungen: Belichtungszeit: 5 min; Binning: 'groß' oder '16', f/stop: 1) der Bildgebungskammer ohne Mäuse. Dieses Verfahren hilft bei der Identifizierung von automatisch lumineszierenden Lichtquellen oder unerwünschten Problemen am Gerät.
HINWEIS: Da BLI auf einer enzymatischen Reaktion basiert, ist die Zeit ein wesentliches Merkmal des Experiments. Überprüfen Sie alle oben aufgeführten Punkte und Geräteeinstellungen, bevor Sie mit dem Umgang mit Tieren beginnen. - Injizieren Sie 150 mg/kg (i.p.) D-Luciferin in die ersten 3 Mäuse, ohne die inneren Organe zu erreichen. Legen Sie die Mäuse in die Behälterbox, um zu beurteilen, ob D-Luciferin austritt (hellgelbe Lösung). Machen Sie sich in diesem Fall Notizen und registrieren Sie die Mäusegruppe und die D-Luciferin-Injektionszeit.
- Warten Sie 5 Minuten und bringen Sie die Mäuse dann in die Anästhesie-Induktionskammer. Schalten Sie das System ein. Es dauert etwa 3 Minuten, bis die Mäuse vollständig betäubt sind (keine Reaktionen wie zitternde Beine, Schwanz usw.) 21. Urheberrecht
- Öffnen Sie die Tür des bildgebenden Geräts, schalten Sie den Anästhesiefluss zur Bildgebungskammer ein und schalten Sie gleichzeitig die Induktionskammer aus.
- Platzieren Sie jede Maus in der Position der Nasenkegel: von Maus 1-3, von links nach rechts. Platzieren Sie die Mäuse vorsichtig mit der Bauchseite nach oben in dem vom Laser gezeigten Bildgebungsbereich. Überprüfen Sie während der Unterbringung die ID und Position der Mäuse. Erzwingen Sie nicht den Eintritt von Mäusen, die teilweise in Nasenkegeln betäubt sind.
- Platzieren Sie die Trennschieber zwischen den Mäusen und schließen Sie die Tür des bildgebenden Geräts.
- Passen Sie die Erfassungseinstellungen im Erfassungsfenster der Software wie folgt an:
- Für nicht infizierte Mäuse Expositionszeit = 5 min / Binning = "groß" oder "16"
(mathematisch empfindlichster Satz von Konfigurationen zum Festlegen der Schwellenwerte). - Für infizierte Mäuse im Akutmodell: Expositionszeit = 2 min/ Binning = 'mittel' oder '4'.
- Für infizierte Mäuse im chronischen Modell: Expositionszeit = 5 min/ Binning = 'groß' oder '16'.
- Für nicht infizierte Mäuse Expositionszeit = 5 min / Binning = "groß" oder "16"
- Vergewissern Sie sich, dass die D-Luciferin-Injektionszeit mindestens 10 Minuten vor Beginn der Einnahme durchgeführt wurde. Wenn nicht, warten Sie die erforderliche Zeit, um die Bilder während des Höhepunkts des Luziferase-Signals zu erhalten (Abbildung 1B). Andernfalls klicken Sie auf Erfassen , um die Bildaufnahme zu starten.
- Das Fenster "Bildbeschriftungen " wird nach dem Start des Imaging angezeigt. Füllen Sie die Felder mit den entsprechenden Informationen zu jeder Gruppe aus, einschließlich Luciferin-Injektionszeitpunkt, Experiment, Mäuseidentifikation, Zeitpunkt und alle anderen gewünschten Informationen, die bei der Aufzeichnung hilfreich sein können. Diese Informationen werden in die Datei mit der Messtabelle aufgenommen.
- Vergewissern Sie sich, dass am Ende der Bildaufnahme das Warnzeichen "Gesättigtes Bild" angezeigt wird. Gesättigte Bilder sind nicht akzeptabel. Wenn dies der Fall ist, verringern Sie die Klassierung und erfassen Sie ein neues Bild. Machen Sie sich Notizen, die Sie bei der Analyse berücksichtigen sollten.
- Sobald das Bild aufgenommen wurde, öffnen Sie die Tür des Bildgebungsgeräts und drehen Sie die Mäuse in die Rückenansicht (Rückseite nach oben). Führen Sie die Erfassung erneut durch und beschriften Sie sie entsprechend.
- Schalten Sie am Ende dieser Bildaufnahme den Anästhesiefluss aus. Nehmen Sie die Mäuse vorsichtig aus der Bildgebungskammer und legen Sie sie in einen Behälter.
- Erfassen Sie das Körpergewicht der Mäuse, während Sie die Wiederherstellung der Narkose beobachten. Notieren Sie alle abnormalen Verhaltensweisen oder Körperanomalien, die während des Eingriffs festgestellt wurden. Sobald sich die Mäuse wieder bewegen, setzen Sie sie in ihre Käfige.
HINWEIS: Überprüfen Sie die BLI-Intensität für jedes aufgenommene Bild. Nach Beendigung der Erfassung werden das aufgenommene biolumineszierende Bild und das Foto in der Software mit einer automatischen Skala angezeigt, die nicht berücksichtigt werden sollte. Legen Sie den in der Datenanalyse (siehe unten) definierten Maßstab im Fenster Werkzeugpalette fest.
6. Datenanalyse
HINWEIS: Das obige Protokoll basiert auf kommerzieller In-vivo-Bildgebungssoftware . Eine softwarelizenzfreie Version kann jedoch die grundlegendste Analyse durchführen. Details zur Software finden Sie in der Materialtabelle.
- Öffnen Sie Dateien.
- Öffnen Sie den Ordner, der die erfassten Daten zu einem bestimmten Imaging-Zeitpunkt enthält, indem Sie > Browser auf Menü Datei > auf Wählen Sie den Ordner aus (Abbildung 2A , Schritt 1).
HINWEIS: Es öffnet sich ein neues Fenster in einem Tabellenformat, in dem alle erfassten Daten in der ausgewählten Datei gespeichert sind. Es wird das Klicknummernzeichen angezeigt, bei dem es sich um die Bild-ID handelt, die von der Software automatisch vergeben wird (Daten und Stundennummern), die Informationen, die der Forscher während der Aufnahme im Fenster "Bildbeschriftungen " bereitgestellt hat, und die Aufnahmeeinstellungen. All diese Daten helfen bei der Sortierung der Bilder, die in der Analyse verwendet werden können, da gesättigte Bilder nicht verwendet werden dürfen. - Wählen Sie mehrere Zeilen aus, die sich auf die ausgewählten Bilder beziehen, einschließlich der nicht infizierten Steuerelemente. Notieren Sie sich die Bild-ID zusammen mit den Informationen, die während der Bildgebungssitzung registriert wurden, in das Labornotizbuch.
- Stellen Sie die ausgewählten Bilder zusammen, indem Sie auf Als Gruppe laden klicken. Mit dieser Prozedur wird ein neues Sequenzbild erstellt. Daher ist es möglich, die Funktionen für alle Bilder gleichzeitig anzupassen. Speichern Sie das neue Sequenzbild in einem neuen Ordner, der sich von dem in Schritt 6.1 verwendeten unterscheidet, um bei Bedarf die erneute Analyse der Rohdaten zu erleichtern.
- Identifizieren Sie im Sequenzbild das für jedes Bild verwendete Binning, indem Sie auf Optionen > Anzeigen > Binning-Faktor auswählen klicken (Abbildung 2A – Schritt 2). Der erfasste Binning-Faktor wird oben in jedem Bild in der Sequenz angezeigt.
- Korrigieren Sie alle Binning-Faktoren auf die gleiche Zahl. Doppelklicken Sie dazu auf das Bild, das angepasst werden soll. Wählen Sie im Fenster Werkzeugpalette > Abschnitt Bildanpassung den entsprechenden Binning-Faktor aus (Abbildung 2A - Schritt 3) - siehe Schritt 5.18 für die Auswahl des Binning-Faktors. Führen Sie diesen Vorgang in allen divergierenden Bildern aus.
HINWEIS: Dieses Verfahren wirkt sich direkt auf die BLI-Quantifizierung aus (Tabelle 1) und wird im Abschnitt "Diskussion" näher erläutert.
- Öffnen Sie den Ordner, der die erfassten Daten zu einem bestimmten Imaging-Zeitpunkt enthält, indem Sie > Browser auf Menü Datei > auf Wählen Sie den Ordner aus (Abbildung 2A , Schritt 1).
- Festlegen der Skalierung.
- Unterscheidung eines gültigen Biolumineszenzsignals (über 600 Zählungen gemäß Gerätehandbuch) basierend auf der nicht infizierten Kontrolle. Doppelklicken Sie dazu auf das Bild der nicht infizierten Mäuse. Wählen Sie dann in der oberen linken Ecke des neuen Fensters die Option Anzahl im Feld Einheiten aus. Passen Sie dann die Farbskala auf den Mindestwert von 600 an. Das resultierende Bild ist die Grundlinie zum Festlegen der minimalen Skala der Strahlung.
- Wählen Sie bei aktivem Sequenzfenster die Option Radiance im Feld Einheiten . Passen Sie die Farbskala und die Farbtabelle in der Werkzeugpalette an. Deaktivieren Sie dazu das Kontrollkästchen Individuell im Bereich Farbskalengrenzen .
- Markieren Sie die Kästchen Logarithmische Skala und Manuell (Abbildung 2A - Schritt 4). Legen Sie die minimalen Skalennummern entsprechend der nicht infizierten Kontrolle (wie in Schritt 6.8 beobachtet) und den Bereich mit dem höchsten Signal als Maximum fest (wie in Abbildung 2A durch die Pfeile dargestellt).
HINWEIS: Bei der In-vivo-2D-Lichtmessung handelt es sich um eine relative Quantifizierung. Aufgrund von Unterschieden in der Version und Kalibrierung der einzelnen Geräte können unterschiedliche Skalenwerte gefunden werden. Daher konnten die in den repräsentativen Ergebnissen gezeigten Werte nicht mit anderen Experimenten übereinstimmen, die an anderen Geräten durchgeführt wurden, und dennoch gemäß den internen Kontrollen (nicht infiziert und infiziert nicht behandelt) gleichermaßen valide sein. - Nachdem Sie den gleichen Maßstab für alle Bilder eingestellt haben, doppelklicken Sie auf jedes Bild, maximieren Sie das Fenster und exportieren Sie die Bildansicht in einem Bildformat (.jpg, .tiff usw.), indem Sie auf die Schaltfläche Grafiken exportieren klicken und die Dateien nach treatment_miceID_time Punkt benennen. (Abbildung 2A - Schritt 5). Führen Sie dieses Verfahren für alle Bilder aus.
- Führen Sie Messungen durch.
- Wählen Sie ein beliebiges Bild aus der Sequenz aus und doppelklicken Sie darauf. Klicken Sie im Fenster Werkzeugpalette > Abschnitt ROI-Werkzeuge auf die Schaltfläche Quadrat (Abbildung 2B - Schritt 1) und zeichnen Sie ein Rechteck, das sich über die gesamte Maus erstreckt.
- Klicken Sie auf den Rand des erstellten ROI und kopieren Sie den gleichen ROI für jede Maus und fügen Sie ihn ein (was zu drei ROIs im Bild führt). Speichern Sie die ROIs, indem Sie im Abschnitt ROI-Tools auf Speichern klicken. Wenden Sie die gespeicherten ROIs auf alle Bilder an, indem Sie das Kontrollkästchen Auf Sequenz anwenden aktivieren und dann auf Laden klicken. Die gespeicherten ROIs werden für alle Mäuse im gesamten Experiment verwendet.
- Passen Sie die ROI-Position in jeder Maus an, damit das Tier besser in den Messbereich passt. Wenn alle Mäuse beschriftet sind, klicken Sie auf die Schaltfläche ROIs messen (Abbildung 2B – Schritt 2). Die Tabelle mit den ROI-Messungen wird angezeigt. Wählen Sie Messarten aus: Strahldichte; Bildattribute: alle möglichen Werte; ROI Abmessungen: cm. Klicken Sie dann auf die Schaltfläche Alle auswählen , gefolgt von der Schaltfläche Kopieren .
- Fügen Sie die Daten direkt in eine Tabellenanalysesoftware (Tabellenkalkulation) ein. Alternativ können Sie eine Datei in .csv oder .txt Format exportieren.
- Arbeiten Sie an den Daten.
- Organisieren Sie in der Tabellenanalysesoftware die Daten nach Gruppen (Behandlung, Kontrolle, nicht infiziert, nicht behandelt usw.).
- Die Parasitenlast wird als Ganzkörper-Biolumineszenz dargestellt. Ordnen Sie daher die Daten so an, dass sie mit den ventralen und dorsalen Gesamtflusswerten derselben Mäuse übereinstimmen, und summieren Sie sie.
- Berechnen Sie den Mittelwert und die Standardabweichung der summierten Werte unter Berücksichtigung jeder Gruppe (z. B.: Ergänzende Tabelle 1). Plotten Sie die Daten in Grafik- und Statistiksoftware.
- Bereiten Sie eine Podiumsdiskussion mit biolumineszierenden Bildern in einer Bild- oder Folienpräsentationssoftware vor. Platzieren Sie jede Maus in einer Spalte und jeden Zeitpunkt in der Zeile, um eine Wirksamkeitsmatrix für Medikamente zu erstellen, die die Visualisierung und Interpretation der Daten erleichtert.
HINWEIS: Es gibt eine Option, um die Bilder direkt in die Imaging-Software zu erstellen, ohne Schritt 6.2.4 (View > Image Layout Window) auszuführen. Die Softwareschnittstelle und die Tools schränken jedoch die Datenorganisation ein.
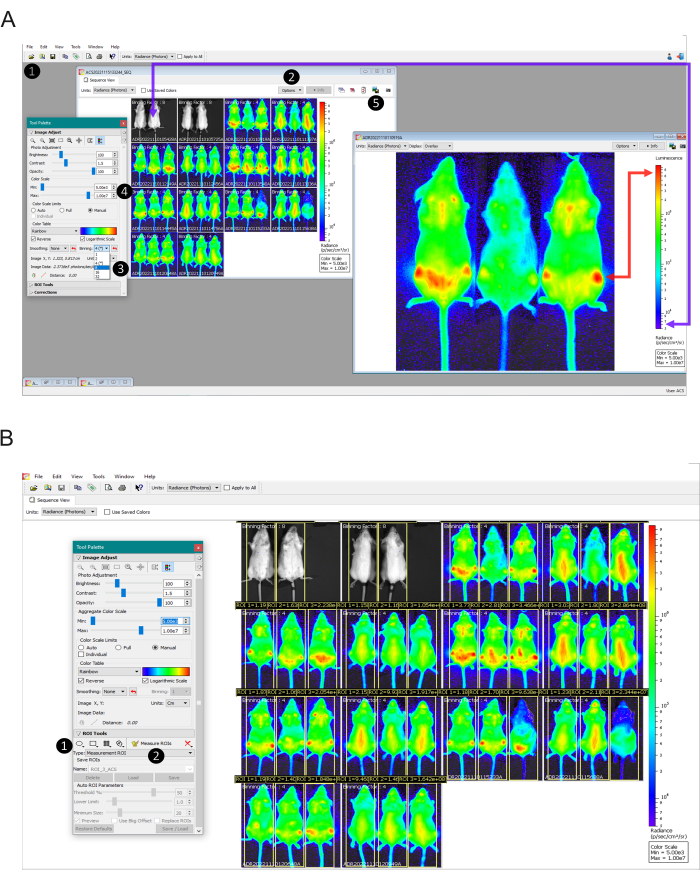
Abbildung 2: Datenanalyseschritte von der Einstellung der Bildskalen bis zur Quantifizierung der Lumineszenz. (A) Living Image Software-Ansicht für die Bilddatenverarbeitung. Schritt 1: Laden Sie die erfassten Daten als Sequenz mit dem Browser-Tool hoch. Schritt 2: Identifizieren Sie das Binning, das für jede Aufnahme verwendet wird (wird über den einzelnen Bildern angezeigt). Schritt 3: Setzen Sie alle Bilder von infizierten Mäusen auf denselben Binning-Faktor und wenden Sie den Binning-Faktor 16 auf die nicht infizierten Mäuse an. Schritt 4: Stellen Sie die Farbskala manuell ein, basierend auf nicht infizierten Mäusen (violetter Pfeil), die auf dem Bildschirm als nicht biolumineszierend zu sehen sein sollten, und infizierten und unbehandelten Mäusen auf den höchsten biolumineszierenden Brennpunkten (roter Pfeil), die als rot zu sehen sein sollten. Schritt 5: Um ein Bild ohne schriftliche Informationen zu erhalten, doppelklicken Sie auf jedes Bild und exportieren Sie das Bild mit der Schaltfläche Grafiken exportieren . (b) Ansicht der ROI-Tools (Regions of Interest). Schritt 1: Zeichnen Sie einen ROI, der eine Maus vollständig abdeckt, und kopieren Sie den gleichen ROI für jedes Tier und fügen Sie ihn ein. Speichern Sie die angepassten ROIs, und wenden Sie sie auf alle Bilder im Test an. Schritt 2: Klicken Sie auf die Schaltfläche ROIs messen , um die Tabelle zu erstellen, die als .csv oder .txt exportiert werden soll. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
7. Ex-vivo-Verfahren
- Injizieren Sie 150 mg/kg D-Luciferin i.p. in die Maus (eine pro ex vivo-Runde ) und warten Sie 3 Minuten. Betäuben Sie die Mäuse mit 100 mg/kg Ketamin und 10 mg/kg Xylazin i.p.
- In einer biologischen Sicherheitswerkbank schneidet man, wenn die Maus nicht auf das Einklemmen der Pfoten reagiert, die Haut der Maus, um das Bauchfell (ohne die Bauchhöhle zu öffnen) und das Gewebe der linken Achselhöhle freizulegen. Fahren Sie mit der Blutung fort, indem Sie die Arteria axillaris und das Gefäß durchtrennen.
- Entnehmen Sie das Blut mit einer Einweg-Pasteurpipette. Dann perfundieren Sie 10 ml 0,3 mg/ml D-Luciferin in DPBS-Lösung durch den linken Ventrikel des Herzens.
- Legen Sie die ausgewählten Organe an vorher festgelegten Stellen auf einer Petrischale aus und weichen Sie sie in 0,3 mg/ml d-Luciferin-Lösung ein. Dieser Vorgang muss innerhalb von maximal 30 Minuten durchgeführt werden.
- Erfassen Sie das Lumineszenzbild der exzidierten Organe (Herz, Lunge, Thymus, Leber, Quadrizepsmuskel, Mesenterium, Milz, Niere, Nebenniere, viszerales Fett, Speiseröhre, Magen, Dünndarm, Blinddarm, Dickdarm, Gehirn, Unterhautfett, Gebärmutter, Gonadenfett, Blase und Peritoneummembran) mit einer Belichtungszeit von 5 Minuten und Binning 16, abhängig von der Signalintensität (gesättigte Bilder sind nicht akzeptabel)22.
HINWEIS: Das gleiche Verfahren muss bei einer nicht infizierten Maus vor den infizierten Mäusen durchgeführt werden, um den Schwellenwert festzulegen.
Ergebnisse
Unter Verwendung eines adäquaten Mausmodells, das auf transgenen Parasiten basiert, die konstitutiv Luziferase exprimieren, ist es möglich, wichtige Merkmale der menschlichen T . cruzi-Infektion zu reproduzieren, die dem Wirt nur minimalen Schaden zufügen, was eine Echtzeit-Verfolgung der Parasiten durch Ganzkörper-BLI des Wirts in einer longitudinalen (lebenslangen) Weise für bis zu mehrere Monate ermöglicht12.
Abbildung 3 zeigt ein Pilotexperiment, das den Zeitverlauf der CL Brener Luc::Neon-Infektion vom Tag 1 nach der Infektion bis 150 dpi bei BALB/c-Mäusen zeigt. In den ersten 20 dpi nimmt die Biolumineszenz-abgeleitete Parasitenlast zu, typisch für den Parasitämie-Peak, gefolgt von einem starken Rückgang der Parasitenlast aufgrund der Immunkontrolle der Mäuse. Somit gilt die akute Phase der Infektion als die ersten 50 dpi. Die chronische Phase ist definiert, wenn die Infektion eine konstante Biolumineszenzrate von 100-150 dpi erreicht.
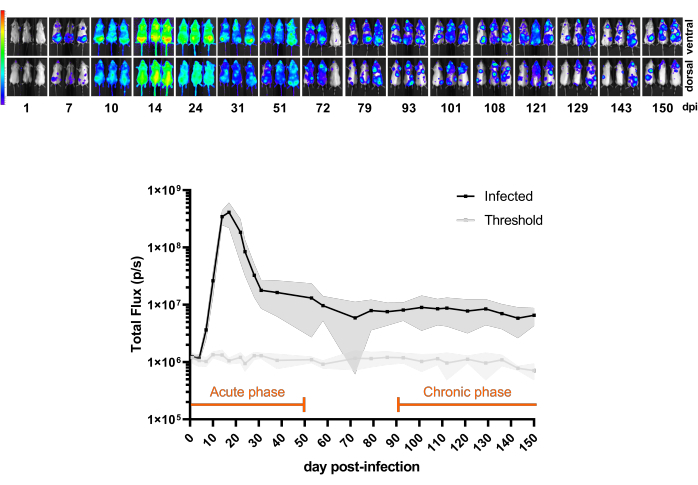
Abbildung 3: Verstehen des Modells. Kinetik der Trypanosoma cruzi CL Brener Luc::Neoninfektion bei BALB/c-Mäusen (n = 11). Oberes Bild: ventrale und dorsale Biolumineszenzbilder zu verschiedenen Zeitpunkten für 150 Tage nach der Infektion (dpi) mit 1 x 10³ Blutbahn-Trypomastigoten durch intraperitoneale Injektion. Heatmap-Skala (in Log10) des Biolumineszenzsignals in der Strahldichte (p/s/cm2/sr). Farbcode: Lila = 5 x 103; rot = 1 x 107. Unteres Bild: Quantifizierung des biolumineszierenden Signals im Gesamtfluss (p/s) von Ganzkörpermäusen. Die Daten werden als Mittelwerte (Linien) und Standardabweichungen (schattierte Bereiche) ausgedrückt. Zeiträume, die in diesem Mausmodell für akute und chronische Phasen der Infektion definiert sind, sind orange hervorgehoben. Die Lumineszenzmittelwerte von nicht infizierten Mäusen (n = 3) sind als Schwellenwert dargestellt (hellgraue Linie). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Auch die therapeutischen Ergebnisse können vorhergesagt werden, da die Hauptphasen der Infektion in einem Mausmodell gut nachgebildet werden. Daher wird BLI nun in der translationalen Wissenschaft durch Proof-of-Concept-Studien angewendet, die die Entscheidungsfindung über das Wirksamkeitspotenzial und den Fortschritt von Wirkstoffen in der Entwicklungspipeline unterstützen10,27. Im akuten Mausmodell sollte die orale Behandlung beginnen, wenn die Infektion den Parasitämie-Höhepunkt (ca. 14-21 dpi) erreicht, der durch eine hohe Anzahl von Trypomastigoten im Blutkreislauf (ca. 1 x 105 Trypomastigoten/ml - Daten nicht gezeigt) und eine systemische Infektion gekennzeichnet ist. In der chronischen Phase beginnt die Behandlung bei Mäusen bei 100 dpi, wenn die Parasitenlast vergleichsweise viel geringer ist, mit stabiler suboffener Parasitämie.
Um die Anwendung des oben beschriebenen Protokolls bei der Bewertung von Antiparasitika zu demonstrieren, verglichen wir die Behandlungswirksamkeit von Benznidazol (BZ), dem Standardmedikament zur Behandlung der Chagas-Krankheit, und Posaconazol (Posa), einem Sterol-14α-Demethylase (CYP51)-Hemmer, der in klinischen Studien zur Chagas-Krankheit versagt hat und der sich auch als Antiparasitikum gegen T. cruzi in vitro und in vivo als unwirksam erwiesen hat, einschließlich des in diesem Protokoll beschriebenen BLI-Modells 13,18,28,29,30.
Für das akute Mausmodell wurden Kohorten von 6 Mäusen pro Gruppe 20 Tage lang oral mit einer Sonde31 behandelt, wobei Posa in einer Dosis von 20 mg/kg oder BZ in einer Dosis von 100 mg/kg einmal täglich verabreicht wurde. Mäuse wurden auch 5 Tage lang mit BZ in einer Dosis von 100 mg/kg einmal täglich behandelt, um die Wirkung kurzer Behandlungen zu bewerten. Nach der Eliminierung der Verbindung (10 Tage nach Beendigung der Behandlung) wurden die BLI-negativen Mäuse immunsupprimiert, ein Zustand, der einen Infektionsrückfall begünstigt, wenn keine parasitologische Heilung erreicht wird (Abbildung 4A). Die Posa-Behandlung führte am Ende der Behandlung zu einer Verringerung der Biolumineszenz-abgeleiteten Parasitenlast um 99,49 % ± 0,27 % (mittlere ± Standardabweichung) und blieb während der Eliminationsphase der Wirkstoffbestandteile auf einem ähnlichen Niveau wie bei nicht infizierten Mäusen (mit Ausnahme von Maus #3 mit einem transienten Signal bei 40 dpi und Maus #2, die bei 44 dpi einen schwachen BLI-Fleck aufwies). Im Vergleich zur unbehandelten Gruppe reduzierte die BZ-Behandlung für 20 Tage die Biolumineszenz-abgeleitete Parasitenlast am Ende der Behandlung um 100 % ± 0,01 %. Im Gegensatz dazu führte die kurze Behandlung mit BZ über 5 Tage bei 19 dpi zu einer Reduktion von 99,98 % ± 0,03 % (ähnlich dem Schwellenwert). In diesem Fall war die BLI-Reduktion jedoch vorübergehend und bei den nachfolgenden Akquisitionen zeigten alle Mäuse eine Infektionsreaktivierung (Abbildung 4B).
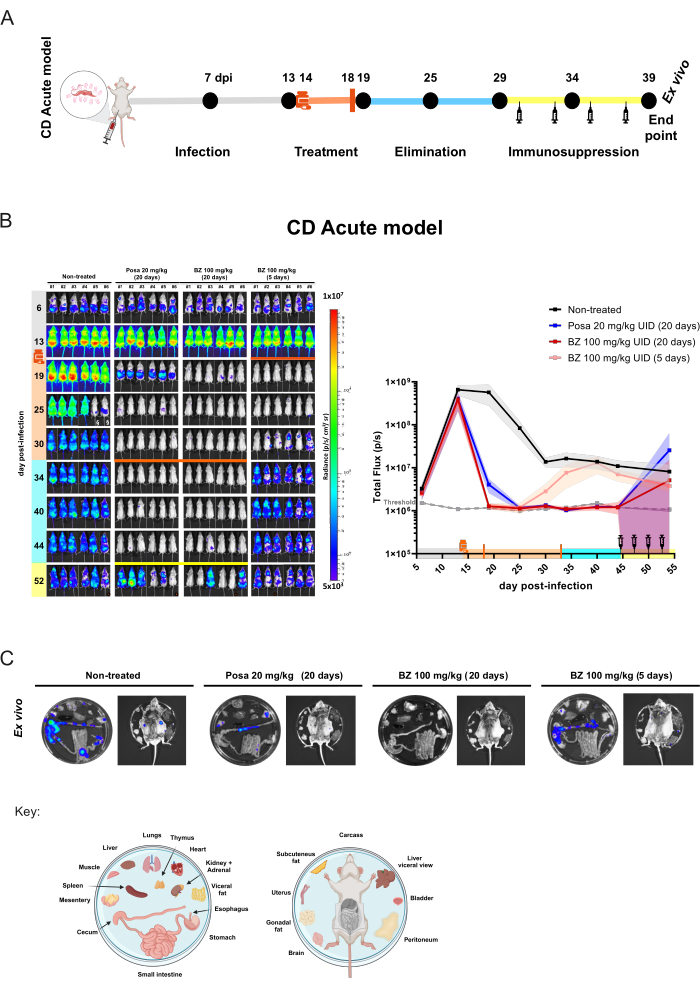
Abbildung 4: Proof-of-Concept-Versuchsdesign und Ergebnisse mit Biolumineszenz-Bildgebung im Akutmodell der Chagas-Krankheit. (A) Schematische Darstellung des Zeitverlaufs im akuten Mausmodell der Chagas-Krankheit für präklinische Studien zur Bewertung der Wirksamkeit der Wirkstoffe. Schwarze Punkte: Zeitpunkte der Bildgebung. Medizinflasche und orangefarbener Balken: Beginn bzw. Ende der Behandlung. Spritzensymbol: Cyclophosphamid-Injektionen. DPI: Tag nach der Infektion. Farbcode: grau = unbehandelte Infektion; orange = Behandlungsdauer; blau = Eliminationsphase der Verbindung; gelb = Immunsuppressionsperiode. (B) Zeitverlauf der Behandlung von Trypanosoma cruzi. Links: ventrale Biolumineszenzbilder von BALB/c-Mäusen (i) unbehandelt oder 20 Tage lang behandelt mit (ii) Posaconazol (Posa) in einer Menge von 20 mg/kg, (iii) Benznidazol (BZ) mit 100 mg/kg, die 20 Tage lang behandelt wurden, und (iv) BZ mit 100 mg/kg, die 5 Tage lang mit (n = 6/Gruppe) behandelt wurden. Alle Behandlungen wurden oral durch Sonde (10 ml/kg) einmal täglich verabreicht. Die Heatmap derLog-10-Skala zeigt die Intensität des Biolumineszenzsignals von niedrig (blau) bis hoch (rot) an. Rechte Grafik: Ganzkörper-Quantifizierung von Biolumineszenz-Bildgebungsdaten. Die Daten werden als Mittelwerte (Linien) und Standardabweichungen (schattierte Bereiche) ausgedrückt. Schlüssel: Medizinflasche: Beginn der Behandlung (14 dpi); orangefarbener Balken: Ende der Behandlung (18 dpi/33 dpi); Cyclophosphamid-Injektionen mit Spritzensymbol (ab Tag 44-53); orangefarbener Punkt: Maus, die im Ex-vivo-Verfahren analysiert wurde; § Daten aufgrund eines D-Luciferin-Austritts im Urin ausgeschlossen. (C) Ex-vivo-Verfahren zum Nachweis von T. cruzi-Herden in Organen und Geweben. Der Plattenverteilungsschlüssel wird am unteren Rand der Abbildung dargestellt (erstellt mit BioRender.com: ZY26LG8AOF). Gleiche Strahldichteskala wie im vivo-Panel gezeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
In diesem Modell kann eine antiparasitäre Behandlung die Parasitenlast unter die BLI-Nachweisgrenze von 1000 Parasiten senken. Mäuse erscheinen also als BLI minus10. Um sicherzustellen, dass eine parasitologische Heilung erreicht wurde, ist es notwendig, die Immunsuppression von Mäusen durch eine Cyclophosphamid-Behandlung zu fördern29,32. Mäuse, die nach medikamentöser Behandlung immer noch eine nicht nachweisbare Parasitenlast aufweisen, werden nach Immunsuppression BLI-positiv. Dieser Effekt zeigt sich in größerem Umfang bei der Posa-Behandlung im akuten Modell, die einen Parasitenrückfall begünstigt. In diesem Experiment wurde das ex vivo-Verfahren an Mäusen mit dem geringsten Biolumineszenzsignal durchgeführt, um den Tropismus des Parasitengewebes zu bewerten (Abbildung 4C). Unbehandelte Mäuse zeigen starke biolumineszierende Signale, insbesondere im Gastrointestinaltrakt (TGI) und in verwandten Geweben wie viszeralem Fett und Mesenterium. Darüber hinaus war die Haut eine Stelle, die mit der Persistenz von Parasiten in Verbindung gebracht wurde. Mäuse, die mit Posa behandelt wurden, wiesen biolumineszierende Flecken mit geringerer Intensität auf, die stärker auf den Dickdarm, das Mesenterium und das viszerale Fett beschränkt waren. Andererseits wird bei Mäusen, die mit einem kurativen Behandlungsschema wie BZ 100 mg/kg für 20 Tage behandelt wurden, auch unter Immunsuppression kein biolumineszierendes Signal nachgewiesen. Daher wird unter Berücksichtigung der Tatsache, dass nach der Förderung der Bedingungen für das biolumineszierende Signal, das über den Schwellenwert von 1000 Parasiten10 ansteigt, und der Erhöhung der Empfindlichkeit durch Freilegung der viszeralen Organe davon ausgegangen, dass BZ 100 mg/kg für 20 Tage eine sterile Heilung bietet. Die Beurteilung der sterilen Heilung wurde zuvor durch verschiedene Techniken validiert 10,13,17,33,34.
Ein ähnliches Studiendesign wurde auf das chronische Modell (Abbildung 5A) angewendet, in dem die Behandlung von Mäusen (n = 6/Gruppe) am Tag 100 nach der Infektion begann. Zu diesem Zeitpunkt wurden Posa 20 mg/kg, BZ in einer Dosierung von 100 mg/kg oder 10 mg/kg einmal täglich 20 Tage lang oral verabreicht. Nach der Eliminationsphase des Medikaments wurden die BLI-negativen Mäuse immunsupprimiert. Um die sterile Heilung zu beurteilen, wurden Mäuse, die am Ende der Immunsuppressionsphase noch BLI-negativ waren, einer Ex-vivo-Analyse unterzogen.
Bei chronischen Infektionen führte die Behandlung mit Posa in einer Dosierung von 20 mg/kg zu einer Abnahme der Biolumineszenz-abgeleiteten Parasitenlast um 95,03 % ± 6,18 % am Ende der Behandlung und blieb während der Eliminationsphase des Arzneimittels auf einem ähnlichen Niveau wie bei nicht infizierten Mäusen. Nach der Immunsuppression zeigte die Mehrzahl der Mäuse ein variables Niveau des BLI-Signals und der Verteilung (Abbildung 5B). Das Ex-vivo-Verfahren zeigte, dass eine BLI-negative Ganzkörper-Maus, die mit Posa behandelt wurde, einen biolumineszierenden Fleck im Dickdarm aufwies, der durch eine Ex-vivo-Untersuchung nachweisbar war (Abbildung 5C).
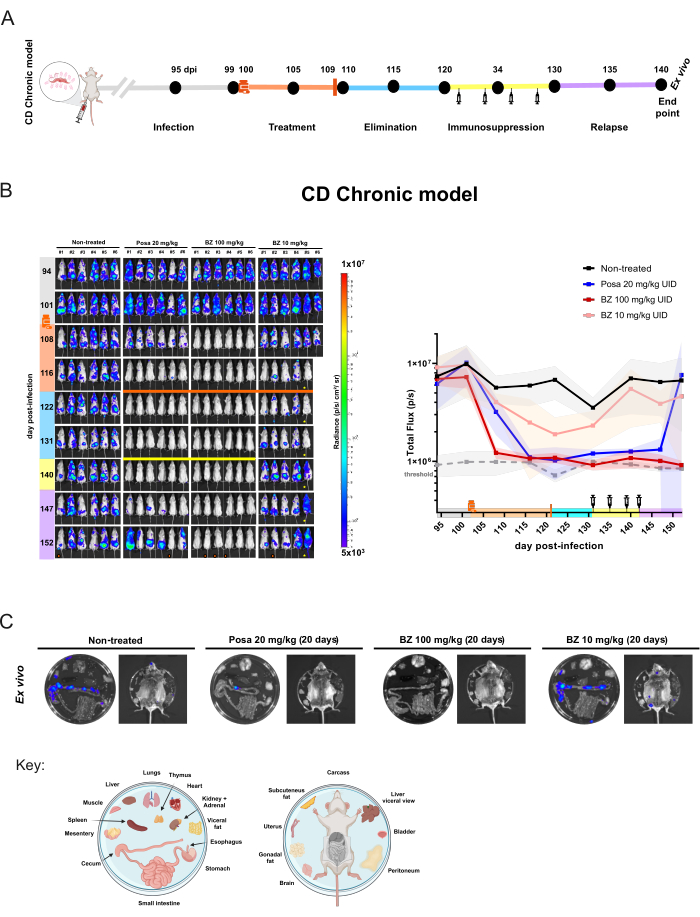
Abbildung 5: Versuchsdesign und Ergebnisse der Arzneimittelbewertung im chronischen Modell der Trypanosoma cruzi-Infektion durch Biolumineszenz-Bildgebung. (A) Schematische Darstellung des Versuchsdesigns eines Mausmodells für die chronische Chagas-Krankheit. Schwarze Punkte: Zeitpunkte der Bildgebung. Medizinflasche und orangefarbener Balken: Beginn bzw. Ende der Behandlung. Spritzensymbol: Cyclophosphamid-Injektionen. Dpi: Tag nach der Infektion. Farbcode: Grau = unbehandelte Infektion; orange = Behandlungsdauer; blau = Eliminationsphase der Verbindung; gelb = Immunsuppression; lila = Rückfall. (B) Längsschnittbewertung der Behandlungswirksamkeit im chronischen Modell der Chagas-Krankheit. Linkes Bild: ventrale BLI von BALB/c-Mäusen (i) unbehandelt oder 20 Tage lang mit (ii) Posaconazol (Posa) in einer Dosis von 20 mg/kg behandelt; iii) Benznidazol (BZ) in einer Dosis von 100 mg/kg und (iv) BZ in einer Dosis von 10 mg/kg (n = 6/Gruppe). Alle Behandlungen wurden einmal täglich oral per Sonde verabreicht. Rechtes Diagramm: Summe der Rohdaten des ventralen und dorsalen Gesamtflusses. Schlüssel: Medizinflasche: Beginn der Behandlung (102 dpi); orangefarbener Balken: Ende der Behandlung (121 dpi); Gelber Balken und Spritzensymbol: Cyclophosphamid-Injektionen (ab Tag 131-142). Orangefarbener Punkt: Maus, die im Ex-vivo-Verfahren analysiert wurde. ! Die Maus starb während der Narkose.  Die Maus zeigt abdominale Anomalien. Die Heatmap-Skala (Log10) zeigt die Biolumineszenzintensität in der Strahlungseinheit von niedrig (3 × 105 als blau) bis hoch (1 × 107 als rot) an. (C) Ex-vivo-Analyse des T . cruzi-Tropismus im Gewebe. Biolumineszenznachweis von exzidierten Organen von immunsupprimierten in vivo BLI-negativen Mäusen nach Behandlung mit Posa und BZ bei 100 mg/kg oder Mäusen mit dem niedrigsten Signal in unbehandelten und BZ bei 10 mg/kg-Gruppen. Der Plattenverteilungsschlüssel ist am unteren Rand der Abbildung dargestellt (erstellt mit BioRender.com: ZY26LG8AOF). Die Ausstrahlungsskala entspricht der des In-vivo-Panels . Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Die Maus zeigt abdominale Anomalien. Die Heatmap-Skala (Log10) zeigt die Biolumineszenzintensität in der Strahlungseinheit von niedrig (3 × 105 als blau) bis hoch (1 × 107 als rot) an. (C) Ex-vivo-Analyse des T . cruzi-Tropismus im Gewebe. Biolumineszenznachweis von exzidierten Organen von immunsupprimierten in vivo BLI-negativen Mäusen nach Behandlung mit Posa und BZ bei 100 mg/kg oder Mäusen mit dem niedrigsten Signal in unbehandelten und BZ bei 10 mg/kg-Gruppen. Der Plattenverteilungsschlüssel ist am unteren Rand der Abbildung dargestellt (erstellt mit BioRender.com: ZY26LG8AOF). Die Ausstrahlungsskala entspricht der des In-vivo-Panels . Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Die Behandlung mit BZ bei 100 mg/kg reduzierte die Biolumineszenz auf Schwellenwerte (93,87 % ± 2,14 %) bei 122 dpi und bis zum Ende des Experiments. Unter Berücksichtigung der ex vivo-Analyse erreichte BZ eine Heilungsrate von 100% (6/6 Mäuse), da keine der Mäuse eine Rückkehr des biolumineszierenden Signals zeigte, selbst wenn immunsupprimierte und innere Organe untersucht wurden. Das bedeutet, dass es keinen Rückfall gibt. Nichtsdestotrotz führte das BZ-Behandlungsschema mit einer niedrigeren Konzentration zu einer leichten Verringerung der Biolumineszenz (85,95 % ± 18,43 %), aber zu keiner Heilung, da die Mäuse zu allen nachfolgenden Zeitpunkten weiterhin nachweisbare biolumineszierende Signalherde zeigten. Dieses Modell ermöglicht somit eine quantitative Unterscheidung zwischen unwirksamen Behandlungen (Posaconazol und suboptimale Behandlung mit Benznidazol) und wirksamen Behandlungen (optimale Dosierung und Behandlungsdauer mit Benznidazol).
Ergänzende Abbildung 1: Präinfektionsanalyse der Expression von Luciferase in der T. cruzi-Population durch Messung des Reportergens mNeonGreen Fluoreszenz. Durchflusszytometrie des fluoreszierenden mNeonGreen-Proteins, das konstitutiv vom CL Brener Luc::Neon-Parasiten exprimiert wird. Normalisiertes Histogramm der Parasitenzahl (Y-Achse) durch mNeonGreen-Fluoreszenzintensität (X-Achse). Die interne Legende zeigt den analysierten Stamm und die analysierte Form, den Fluoreszenzmedian und den Prozentsatz der Fluoreszenzpopulation. Gate-Linien werden durch den CL-Brener-Wildtyp-Stamm (WT) als nicht-fluoreszierende Kontrolle definiert. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Tabelle 1: Beispiel für eine Analysetabelle in der BLI-Messung. Rohdaten aus der Quantifizierung der Biolumineszenzbildgebung am Tag 19 nach der Infektion im Akutmodell, das in den repräsentativen Ergebnissen in Abbildung 4B verwendet wird. Beschreibung der Gruppe: Kontrolle als nicht infizierte Mäuse (n = 3/Gruppe); als unbehandelte infizierte Mäuse; Posaconazol (Posa) in einer Dosis von 20 mg/kg für 20 Tage; Benznidazol (BZ) in einer Dosis von 100 mg/kg für 20 Tage; BZ bei 100 mg/kg 5 Tage lang behandelt (n = 6/Gruppe). Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Die Biolumineszenz-Bildgebung ist eine bahnbrechende Methode, die den Nachweis eines Berichtsgens anhand eines sichtbaren und infraroten Spektrums elektromagnetischer Strahlung ermöglicht. Daher sind keine radioaktiv markierten Marker erforderlich, um Ihre Probezu verfolgen 35. BLI eignet sich für Nagetiermodelle und andere kleine Arten. Es ist sehr nützlich für präklinische Studien, da es sicherer ist und mehrere Bildrunden ermöglicht, was zu minimalen Beschwerden bei den Tieren führt. Außerdem ist die In-vivo-Bildgebung sehr flexibel, da Biolumineszenz, Fluoreszenz und andere Techniken wie die Positronen-Emissions-Tomographie kombiniert werdenkönnen 36.
Die optische Bildgebung wird von optischen physikalischen Eigenschaften wie Absorption und Streuung bestimmt. Alle Gewebe absorbieren und streuen Licht unterschiedlicher Wellenlängen37. Ein kritischer Schritt ist die Auswahl eines Reportergens, ohne die emittierte Wellenlänge des durch die chemische Reaktion erzeugten Lichts zu berücksichtigen. Während die Expression eines Reportergens in vitro in Biolumineszenz-Assays hoch sein kann, können die gleichen Expressionsniveaus möglicherweise nicht erreicht werden, wenn zur In-vivo-Einstellung übergegangen wird. In diesem Protokoll verwendeten wir eine rotverschobene Photinus pyralis Luciferase (PpyRE9H)38-Codon-optimierte Version für Trypanosomatide9, die Licht bei 617 nm emittiert, eine der am besten geeigneten für in vivo-Studien 39. Wellenlängen länger als 600 nm werden von körpereigenen Chromophoren, insbesondere Hämoglobin und Melanin, weniger absorbiert und gestreut. Auf diese Weise kann rotes Licht durch mehrere Zentimeter Gewebe hindurch geleitet werden, so dass die Photonen die CCD-Kamera auch aus dem viszeralen Gewebe erreichenkönnen 39,40.
Ein Problembereich bei bildgebenden Verfahren ist das Fehlen eines umfassenden Verständnisses ihrer Funktion und Wirkungen. Binning, eine Vorverarbeitungstechnik, kombiniert die von zusammenhängenden Detektoren erfassten Informationen zu einem größeren Pixel. Dieser Prozess verbessert das Signal-Rausch-Verhältnis, reduziert Hintergrundgeräusche und verbessert die Empfindlichkeit. Es verringert jedoch die Genauigkeit der räumlichen Auflösung, was zu einem pixeligen Bild führt41,42. Dieser Kompromiss ist ein wichtiger Aspekt in Ihrer Bildgebungsstrategie.
Basierend auf dem Target Product Profile und dem Target Candidate Profile for Chagasdisease 34 konzentriert sich die Proof-of-Concept-Studie auf die Sensitivität zum Nachweis von T. cruzi und hilft bei der Feststellung, ob ein neuer Wirkstoffkandidat eine sterile Heilung erreichen kann (dargestellt durch das Fehlen eines Rezidivs nach mehreren Immunsuppressionsrunden). Daher führen wir die BLI mit dem höchsten Binning-Faktor aus, ohne das Bild zu übersättigen. Wenn das Bild übersättigt ist, wird eine Neuaufnahme mit einem niedrigeren Binning-Faktor durchgeführt. Während der Analyse wird eine mathematische Korrektur auf die Bilder angewendet, die ein anderes Binning erforderten. Auf diese Weise sollten die endgültigen Daten mit dem gleichen Binning dargestellt werden. Tabelle 1 zeigt die unterschiedlichen Werte, die erhalten wurden, wenn unterschiedliche Binning-Faktoren im selben Bild und in denselben ROIs angewendet wurden.
Tabelle 1: Einfluss der Binning-Einstellungen auf die BLI-Quantifizierung. Quantifizierung von drei ROIs auf dem Bild des akuten Modells (d13) und des chronischen Modells (d118), analysiert in verschiedenen Binning-Faktoren. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Aufgrund des aktuellen Szenarios der Chagas-Krankheit in der Klinik zielen die Bemühungen zur Wirkstoffforschung darauf ab, Parasiten vollständig zu eliminieren (parasitologische Heilung)27,34. Daher enthält das präklinische In-vivo-Protokoll Ansätze, die die Grenzen der technischen Sensibilität von BLI überwinden. Einer der Ansätze besteht darin, die Mäuse mit Cyclophosphamid zu behandeln, um die Immunantwort zu verringern, die die Parasitenlast steuert. Eine andere Strategie besteht darin, die Gewebetiefe zu verringern und Schichten von Muskeln, Haut und Fell zu entfernen, die den Lichtweg zur Kamera behindern. Durch das ex vivo-Verfahren können kleine biolumineszierende Flecken nachgewiesen werden, die Parasitenherde unterhalb der in vivo BLI-Schwelle aufdecken, wie in Abbildung 5C im ex vivo-Ergebnis einer mit Posa behandelten Maus gezeigt.
Die Konzeption eines Pilotexperiments zur Evaluierung des Modells selbst und der Infektionsdynamik ist entscheidend für die Etablierung eines genauen Experiments zur Bewertung der Wirksamkeit von Antiparasitika. Auf diese Weise wird der Forscher in der Lage sein, die richtigen BLI-Einstellungen und den Verlauf des Infektionszeitpunkts im Voraus zu definieren. In einem explorativen Experiment ist die "Autoexposure" ein Werkzeug, das hilfreich sein kann, um die Aufnahmeeinstellungen zu definieren. Mit diesem Werkzeug legt der Forscher die Priorität von drei Einstellungen (Belichtungszeit, Binning und Blende) fest, um das bestmögliche Bild zu erhalten. Insbesondere sollte der Forscher darauf achten, dass die Bilder innerhalb des Dynamikbereichs der CCD-Kamera aufgenommen werden, ohne Übersättigung oder Unterbelichtung, was durch die minimalen und maximalen Grenzen der Skala und der Autoexposure-Funktion überprüft werden kann (Menü Bearbeiten > Einstellungen > Tab Aufnahme > Tab Autoexposure). In diesem Protokoll wurde die Kamerablende auf den Maximalwert (F/Stop: 1) eingestellt und unterschiedliche Belichtungszeiten und Binning-Faktoren für akute und chronische Modelle definiert. Diese Einstellungen ermöglichen eine zeitliche Vorhersagbarkeit, um verschiedene Bildrunden gleichzeitig durchzuführen. Da die Reportermethode auf einer enzymatischen Reaktion basiert, beeinflussen sowohl die Bioverteilung des Substrats in der Maus als auch die Luciferase-Kinetik das Biolumineszenzsignal und damit die Quantifizierung der Infektion (Abbildung 1B). Folglich führt die Aufnahme von Bildern zu verschiedenen Zeitpunkten der enzymatischen Kinetik zu einer Datenvariabilität, die nicht berücksichtigt oder korrigiert werden kann und sich auf die Berechnung des Gesamtflusses (Photonen/Sekunde) oder der Strahldichte (Photonen/Sekunde/cm2/Steradiant) auswirkt. Außerdem zeigt die T. cruzi-Infektion bei Mäusen eine dynamische räumliche Positionierung (verschiedene Bereiche und Gewebe, Tiefe und Parasitenlast). Daher könnte die Festlegung eines Wertes für die zu erfassende Anzahl schwächere Signalquellen (geringe Anzahl von Parasiten an einer bestimmten Stelle tiefer im Gewebe) übersehen, wenn die Quelle eines anderen stärkeren Signals die definierten Auto-Expositionskriterien erfüllt.
Eine knifflige Funktion der Living Image-Software ist die Anzeige des aufgenommenen Bildes in einer automatischen Farbskala. Es gibt keine Möglichkeit, die Skala so voreinzustellen, dass automatisch ein brandneu aufgenommenes Bild entsprechend den ausgewählten Skalenwerten angezeigt wird (siehe Protokollschritt 6.2). Diese Situation zwingt den Forscher, die Bilder manuell nacheinander auf die gewählten Maximal- und Minimalwerte zu ändern. Dies hat zur Folge, dass die unerfahrenen und nicht gut geschulten Benutzer während der Erfassungssitzung nicht über die richtige Anzeige verfügen und die Daten in die Irre führen oder zu diesem Zeitpunkt wichtige Informationen verlieren könnten. Dafür ist der Pilotversuch von Vorteil.
Eine der häufigsten Fragen zum Proof-of-Concept-Versuchsdesign ist die Wahl der Behandlungsdauer und -dosis. Bei neuen chemischen Wirkstoffen werden diese Parameter in der Regel durch die Wirksamkeit und Selektivität der Verbindung in vitro definiert, in Kombination mit Daten aus dem Arzneimittelmetabolismus und der Pharmakokinetik (DMPK) und Verträglichkeitsstudien, die vor der Prüfung der Wirksamkeit in vivo durchgeführt wurden. Zusammenfassend lässt sich sagen, dass nach der Identifizierung von Verbindungen, die in der Lage sind, den Parasiten in Zellen selektiv abzutöten, die ersten ADME-Experimente (Absorption, Verteilung, Metabolismus und Ausscheidung) in vitro durchgeführt werden, um unter anderem die wässrige Löslichkeit, die Zellpermeabilität und die metabolische Stabilität der Verbindungen abzuschätzen. Wenn die Verbindungen ein gutes Gleichgewicht der In-vitro-Eigenschaften aufweisen (die in der Regel in den Profilen der Zielkandidaten definiert sind), werden diese Kandidaten in vivo pharmakokinetischen (PK) Studien an gesunden Mäusen unterzogen, die die Exposition der Verbindung im Blut (und möglicherweise auch im Gewebe) beschreiben und eine allgemeine Vorstellung von der Verträglichkeit bei verschiedenen Dosierungen geben17. 34,43. Im Idealfall besteht das Ziel der PK-Bewertung bei den meisten Infektionskrankheiten darin, die Machbarkeit zu bestimmen, freie Plasmakonzentrationen (korrigiert um die Plasmaproteinbindung) zu erreichen, die über den EC50/EC90-Konzentrationen 44 liegen - der wirksamen Konzentration, die das Wachstum von 50 % bzw. 90 % der Parasiten abtötet oder zumindest hemmt - für einen ausreichend langen Zeitraum. Wenn bei einer bestimmten Dosis eine ausreichende Exposition erreicht wird, kann dieses Schema während der Wirksamkeitsstudien unter Verwendung des Chagas BLI-Modells angewendet werden. Für Studien zur Repositionierung von Arzneimitteln sollten In-vitro- und In-vivo-PK-Daten verfügbar sein. Ein guter Anfang für das Reprofiling von Medikamenten sind chemische Datenbanken wie PubChem45, die anerkannte Daten liefern, die mit Hilfe der allometrischen Skalierung46 auf Mäuse übertragen werden können, um sichere und nicht-toxische Behandlungsschemata abzuschätzen, die getestet werden sollen. Das ist jedoch nicht immer der Fall. PK-Studien sind in der akademischen Wissenschaft immer noch ein übersehenes Feld, und nur wenige Pharmaunternehmen veröffentlichen ihre PK-Ergebnisse. Die Fachwelt der Wirkstoffforschung empfiehlt, die In-vivo-PK-Bewertung zusammen mit Arzneimittelwirksamkeitstests (Pharmakodynamik) einzubeziehen47. Daher ist die präklinische Bildgebung mit gleichzeitigen Verbindungsmessungen kompatibel, und dieser damit verbundene Ansatz erhöht die Robustheit der Daten.
Darüber hinaus werden die Handhabung, das Gewicht und der Gesundheitszustand der Mäuse während des gesamten Experiments überwacht. Anzeichen von Toxizität und Nebenwirkungen wie Krümmen, Zittern, Gleichgewichtsverlust, Unwilligkeit, Fütterungs- oder Getränkeunlust, Erschöpfung oder andere Anomalien, die in der Gruppe oder bei einzelnen Mausbedingungen auftreten, sollten in präklinischen Studien registriert und berichtet werden. Eines der Ziele der optischen Bildgebung ist es, das Wohlbefinden der Tiere zu gewährleisten. Daher sollten humane Endpunkte bei Mäusen mit Schmerzsymptomen angewendet werden, die in der 'Grimace-Skala48 beschrieben sind. Außerdem wurden die Mäuse wöchentlich während der BLI-Akquisition und häufiger während der Medikamentendosierung und der CTX-Behandlung gewogen. Gemäß den Tierschutzbestimmungen müssen Mäuse, die mehr als 20 % ihres Körpergewichts verlieren, sofort auf humane Weise eingeschläfert werden.
Das Biolumineszenzmodell von T. cruzi ist nun das hochmoderne experimentelle Modell für die Entdeckung und Entwicklung neuer Therapien für die Chagas-Krankheit. Ein Modell, das Schlüsselmerkmale der T. cruzi-Infektion und der Chagas-Krankheitrepliziert 49 und eine Echtzeitüberwachung von Parasitämie und die Differenzierung von Verbindungen mit unterschiedlichen Wirksamkeitsprofilen in Verbindung mit bekannten Wirkmechanismen ermöglicht. BLI ist eine Technik, die das Durchsetzungsvermögen bei der Identifizierung von infiziertem Gewebe verbessert. Es ermöglicht die präzise Selektion infizierter Gewebe, die in einem breiten Spektrum von Ansätzen eingesetzt werden können, einschließlich aller klassischen Methoden, die bereits in der T. cruzi-Forschung angewendet werden50,51. Darüber hinaus ermöglicht es Forschern, Spitzentechnologien zu erforschen und neue zu entwickeln33. Darüber hinaus sorgt BLI für eine Verbesserung des Wohlbefindens der Tiere und eine rationellere Verwendung gemäß den 3R-Prinzipien10,35, alles auf einmal.
Mehrere Forschungsgruppen, die sich mit vernachlässigten Tropenkrankheiten befassen, befinden sich in Ländern, in denen in vivo bildgebende Geräte nicht verfügbar sind. Um das derzeitige Szenario zu überwinden, fördern neue internationale Netzwerke wie Global BioImaging und die mit ihnen verbundenen Konsortien Maßnahmen, um einen offenen Zugang zu den Kerneinrichtungen der Bildgebung zu ermöglichen und die Ausbildung von Mitarbeitern und Bildgebungswissenschaftlern zu verbessern52,53. Diese Initiativen, zusammen mit benutzerfreundlichen Protokollen wie diesem, können Bedingungen schaffen, die High-End-Technologien für alle Forscher demokratisieren. Die Implementierung dieser Methode in der präklinischen Wirkstoffforschung bot eine solide Wirksamkeitsmessung und einen prädiktiven Wert des klinischen Ergebnisses, was die Wirkstoffforschung für die Chagas-Krankheit erleichtert.
Offenlegungen
Die Autoren haben keine Interessenkonflikte anzugeben.
Danksagungen
Die Autoren danken Amanda Franscisco, John Kelly und Fanny Escudié für die Bereitstellung von BLI-Schulungen und Unterstützung bei Wirksamkeitstests für Medikamente, John Kelly und Simone Calderano für die Bereitstellung von Parasiten und Gabriel Padilla für die Unterstützung bei Tierversuchen. A.C.S. erhielt ein CAPES PSDE-Stipendium für die Ausbildung an der London School of Hygiene and Tropical Medicine (Vereinigtes Königreich). Die Autoren danken auch der FLUIR-Plattform (Flow Cytometry and Imaging Research) an der Core Facility for Scientific Research - University of Sao Paulo (CEFAP-USP) für die technische Unterstützung bei der Analyse der IVIS-Spektrum-Geräte und dem Labor für Genetik und sanitäre Kontrolle ICB-USP für die Assays nach dem Experiment zur Qualitätskontrolle von Mäusen als spezifisch pathogenfrei. Dieses Projekt wurde vom DNDi gefördert. DNDi ist seinen öffentlichen und privaten Spendern dankbar, die seit seiner Gründung im Jahr 2003 alle DNDi-Aktivitäten finanziert haben. Eine vollständige Liste der Spender von DNDi finden Sie unter https://dndi.org/about/donors/.
Materialien
| Name | Company | Catalog Number | Comments |
| BD LSRFortessa™ X-20 Cell Analyzer | BD Biosciences | ||
| Weighing Balance (animal facility) | Available from several suppliers | ||
| IVIS Spectrum In Vivo Imaging System | Revvity (former PerkinElmer) | ||
| FlowJ Software v10.7.1 | BD Biosciences | ||
| Living Image Software for Spectrum v4.7.1 | Revvity (former PerkinElmer) | License Free Analysis Software called 'Aura Imaging' could be used for the most basic features provided by Spectral Instruments Imaging (Bruker company) (https://spectralinvivo.com/software/) | |
| Microsoft Office software | Microsoft | ||
| GraphPad Prism v8.4.0 | GraphPad Software Inc. | ||
| DMEM Low Glucose | Vitrocell | D0025 | |
| Sodium bicarbonate | Sigma-Aldrich | S5761-500G | |
| Foetal Bovine Serum (FBS) | Gibco | 16000-044 | |
| Penicillin-Streptomycin | Gibco | 15140-122 | |
| Trypsin 0.5% EDTA | Gibco | 25300-062 | |
| LIT medium | In house | ||
| Hygromycin B (50 mg/mL) | Gibco | 10687010 | |
| Grace′s Insect Medium | Sigma-Aldrich | G9771 | |
| HEPES | Sigma-Aldrich | 54457 | |
| IVISBrite d-luciferin potassium salt | Revvity (former PerkinElmer) | 122799 | Also could be used: VivoGlo Luciferin, in vivo grade (Promega/P1043); D-Luciferin, Monopotassium Salt (Thermo Scientific/88293) or PierceD-Luciferin, Monosodium* Salt (Thermo Scientific/88291); D-Luciferin, Potassium Salt (GoldBio/LUCK or eLUCK); D-Luciferin, Sodium* Salt (GoldBio/LUCNA or eLUCNA) *Sodium or potassium salt differences relies minimal chances on solubility, however do not affect in vivo performance. |
| DPBS | Gibco | 21600-044 | |
| Cyclophosphamide (CTX) | Sigma-Aldrich | C0768-5g | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D5879 | |
| (Hydroxypropyl)methyl cellulose (HPMC) | Sigma-Aldrich | 09963-25G | |
| Benzyl alcohol | Sigma-Aldrich | 402834 | |
| Tween 80 | Sigma-Aldrich | P1754-1L | |
| Benznidazole | ELEA | ||
| Posaconazole (Noxafil commercial formulation) | Schering-Phough | ||
| Giemsa | Available from several suppliers | ||
| gavage needle (stainless-steel straight) - 22GA | Aton | CA2003 | |
| 1 mL Syringe and 31G needle | Available from several suppliers | ||
| 1 mL Syringe and removable 26G needle | Available from several suppliers | ||
| 1 mL Syringe and removable 24G X¾ needle | Available from several suppliers | ||
| Sterile Syringe Filter 0.2 µm | Available from several suppliers | ||
| A4 Matte Black paper 120gr or thicker | Paper Color/ Canson (Available from several suppliers) | ||
| aluminum foil | Available from several suppliers | ||
| Neubauer chamber | Available from several suppliers |
Referenzen
- WHO fact sheet. Chagas disease (also known as American trypanosomiasis). WHO, World Health Organization. , Available from: https://www.who.int/news-room/fact-sheets/detail/chagas-disease-(american-trypanosomiasis) (2023).
- Lee, B. Y., Bacon, K. M., Bottazzi, M. E., Hotez, P. J. Global economic burden of Chagas disease: a computational simulation model. Lancet Infect Dis. 13 (4), 342-348 (2013).
- Bern, C. Chagas' disease. N Engl J Med. 373 (5), 456-466 (2015).
- Shikanai-Yasuda, M. A., Carvalho, N. B. Oral transmission of Chagas disease. Clin Infect Dis. 54 (6), 845-852 (2012).
- Lidani, K. C. F., et al. Chagas disease: From discovery to a worldwide health problem. Front Public Health. 7, 166(2019).
- Perez-Molina, J. A., Molina, I. Chagas disease. Lancet. 391 (10115), 82-94 (2018).
- Field, M. C., et al. Anti-trypanosomatid drug discovery: An ongoing challenge and a continuing need. Nat Rev Microbiol. 15 (7), 447(2017).
- Kratz, J. M. Drug discovery for chagas disease: A viewpoint. Acta Trop. 198, 105107(2019).
- McLatchie, A. P., et al. Highly sensitive in vivo imaging of Trypanosoma brucei expressing 'red-shifted' luciferase. PLoS Negl Trop Dis. 7 (11), e2571(2013).
- Lewis, M. D., Francisco, A. F., Taylor, M. C., Kelly, J. M. A new experimental model for assessing drug efficacy against Trypanosoma cruzi infection based on highly sensitive in vivo imaging. J Biomol Screen. 20 (1), 36-43 (2015).
- Costa, F. C., et al. Expanding the toolbox for Trypanosoma cruzi: A parasite line incorporating a bioluminescence-fluorescence dual reporter and streamlined CRISPR/Cas9 functionality for rapid in vivo localisation and phenotyping. PLoS Negl Trop Dis. 12 (4), e0006388(2018).
- Lewis, M. D., et al. Bioluminescence imaging of chronic Trypanosoma cruzi infections reveals tissue-specific parasite dynamics and heart disease in the absence of locally persistent infection. Cell Microbiol. 16 (9), 1285-1300 (2014).
- Francisco, A. F., et al. Limited ability of posaconazole to cure both acute and chronic Trypanosoma cruzi infections revealed by highly sensitive in vivo imaging. Antimicrob Agents Chemother. 59 (8), 4653-4661 (2015).
- du Sert, N. P., et al. The arrive guidelines 2.0: Updated guidelines for reporting animal research. PLoS Biol. 18 (7), e3000410(2020).
- Turner, P. V., Brabb, T., Pekow, C., Vasbinder, M. A. Administration of substances to laboratory animals: routes of administration and factors to consider. J Am Assoc Lab Anim Sci. 50 (5), 600-613 (2011).
- Turner, P. V., Pekow, C., Vasbinder, M. A., Brabb, T. Administration of substances to laboratory animals: equipment considerations, vehicle selection, and solute preparation. J Am Assoc Lab Anim Sci. 50 (5), 614-627 (2011).
- Francisco, A. F., et al. Nitroheterocyclic drugs cure experimental Trypanosoma cruzi infections more effectively in the chronic stage than in the acute stage. Sci Rep. 6, 35351(2016).
- Moraes, C. B., et al. Nitroheterocyclic compounds are more efficacious than CYP51 inhibitors against Trypanosoma cruzi: implications for Chagas disease drug discovery and development. Sci Rep. 4, 4703(2014).
- Shaner, N. C., et al. A bright monomeric green fluorescent protein derived from Branchiostoma lanceolatum. Nat Methods. 10 (5), 407-409 (2013).
- de Araújo-Jorge, T. C., de Castro, S. L. Chagas Disease: Manual for Animal Experimentation. , FIOCRUZ Publisher. Rio de Janeiro. (2000).
- JoVE. JoVE Science Education Database. Anesthesia Induction and Maintenance. JoVE. , (2023).
- Taylor, M. C., et al. Exploiting genetically modified dual-reporter strains to monitor experimental Trypanosoma cruzi infections and host-parasite interactions. Methods Mol Biol. 1955, 147-163 (2019).
- Keyaerts, M., et al. Inhibition of firefly luciferase by general anesthetics: effect on in vitro and in vivo bioluminescence imaging. PLoS One. 7 (1), e30061(2012).
- Jiron, J. M., et al. Comparison of isoflurane, ketamine-dexmedetomidine, and ketamine-xylazine for general anesthesia during oral Procedures in rice rats (Oryzomys palustris). J Am Assoc Lab Anim Sci. 58 (1), 40-49 (2019).
- GoldBio. GoldBio Luciferin In Vivo Handbook - a detailed method for Luciferin preparation and administration for model animals. GoldBio Protocol. , Available from: https://goldbio.com/documents/1068/Luciferin%20in%20vivo%20handbook.pdf (2013).
- Revity. Preparation of IVISbriteTM D-Luciferin for in vitro and in vivo bioluminescent assays. Revvity Standard Operate Procedure (Tech Notes). , Available from: https://resources.perkinelmer.com/lab-solutions/resources/docs/SOP_LuciferinPrep_InVitroInVivo_BLI-Assays.pdf (2023).
- Chatelain, E., Scandale, I. Animal models of Chagas disease and their translational value to drug development). Expert Opin Drug Discov. 15 (12), 1381-1402 (2020).
- Khare, S., et al. Antitrypanosomal treatment with benznidazole is superior to posaconazole regimens in mouse models of Chagas disease. Antimicrob Agents Chemother. 59 (10), 6385-6394 (2015).
- Bustamante, J. M., Craft, J. M., Crowe, B. D., Ketchie, S. A., Tarleton, R. L. New, combined, and reduced dosing treatment protocols cure Trypanosoma cruzi infection in mice. J Infect Dis. 209 (1), 150-162 (2014).
- Molina, I., et al. Randomized trial of posaconazole and benznidazole for chronic Chagas' disease. N Engl J Med. 370 (20), 1899-1908 (2014).
- JoVE. Science Education Database. Compound Administration II. JoVE. , (2023).
- Pukhalsky, A. L., Toptygina, A. P., Viktorov, V. V. Immunosuppressive action of cyclophosphamide in mice: Contribution of some factors to determination of strain differences. Int J Immunopharmacol. 15 (4), 509-514 (1993).
- Francisco, A. F., et al. Comparing in vivo bioluminescence imaging and the Multi-Cruzi immunoassay platform to develop improved Chagas disease diagnostic procedures and biomarkers for monitoring parasitological cure. PLoS Negl Trop Dis. 16 (10), e0010827(2022).
- Kratz, J. M., et al. The translational challenge in Chagas disease drug development. Mem Inst Oswaldo Cruz. 117, e200501(2022).
- Youn, H., Hong, K. -J. In vivo noninvasive small animal molecular imaging. Osong Public Health Res Perspect. 3 (1), 48-59 (2012).
- Refaat, A., et al. In vivo fluorescence imaging: success in preclinical imaging paves the way for clinical applications. J Nanobiotechnology. 20 (1), 450(2022).
- Pirovano, G., Roberts, S., Kossatz, S., Reiner, T. Optical imaging modalities: Principles and applications in preclinical research and clinical settings. J Nucl Med. 61 (10), 1419-1427 (2020).
- Branchini, B. R., Southworth, T. L., Khattak, N. F., Michelini, E., Roda, A. Red- and green-emitting firefly luciferase mutants for bioluminescent reporter applications. Anal Biochem. 345 (1), 140-148 (2005).
- Zhao, H., et al. Emission spectra of bioluminescent reporters and interaction with mammalian tissue determine the sensitivity of detection in vivo. J Biomed Opt. 10 (4), 041210(2005).
- O'Neill, K., Lyons, S. K., Gallagher, W. M., Curran, K. M., Byrne, A. T. Bioluminescent imaging: a critical tool in pre-clinical oncology research. J Pathol. 220 (3), 317-327 (2010).
- Mennel, L., et al. A photosensor employing data-driven binning for ultrafast image recognition. Sci Rep. 12 (1), 14441(2022).
- Yoo, Y., Im, J., Paik, J. Low-light image enhancement using adaptive digital pixel binning. Sensors. 15 (7), 14917-14931 (2015).
- Moraes, C. B., et al. Accelerating drug discovery efforts for trypanosomatidic infections using an integrated transnational academic drug discovery platform. SLAS Discov. 24 (3), 346-361 (2019).
- Sebaugh, J. L. Guidelines for accurate EC50/IC50 estimation. Pharm Stat. 10 (2), 128-134 (2011).
- Kim, S., et al. PubChem 2023 update. Nucleic Acids Res. 51, D1 D1373-D1380 (2023).
- Sharma, V., McNeill, J. H. To scale or not to scale: the principles of dose extrapolation. Br J Pharmacol. 157 (6), 907-921 (2009).
- Barrow, J. C., Lindsley, C. W. The importance of PK-PD. J Med Chem. 66 (7), 4273-4274 (2023).
- Langford, D. J., et al. Coding of facial expressions of pain in the laboratory mouse. Nat Methods. 7 (6), 447-449 (2010).
- Lewis, M. D., Kelly, J. M. Putting infection dynamics at the heart of Chagas disease. Trends Parasitol. 32 (11), 899-911 (2016).
- Brener, Z. Therapeutic activity and criterion of cure on mice experimentally infected with Trypanosoma cruzi. Rev Inst Med Trop Sao Paulo. 4, 389-396 (1962).
- Cummings, K. L., Tarleton, R. L. Rapid quantitation of Trypanosoma cruzi in host tissue by real-time PCR. Mol Biochem Parasitol. 129 (1), 53-59 (2003).
- Keppler, A., Grebnev, G., Reis, Y. Global BioImaging. , . (2024).
- Pfander, C., et al. Euro-BioImaging - Interdisciplinary research infrastructure bringing together communities and imaging facilities to support excellent research. iScience. 25 (2), 103800(2022).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten