Method Article
약물 효능 연구를 위한 샤가스병 마우스 모델의 In Vivo Bioluminescence 이미징 Demystifying In Vivo Bioluminescence Coaching
요약
여기에 제공된 프로토콜은 데이터 수집, 분석 및 해석에 중점을 두고 트리파노소마 크루지 감염의 생물 발광 모델에서 약물 효능 연구를 수행하기 위한 자세한 단계를 설명합니다. 기술적 문제를 최소화하기 위한 문제 해결 및 품질 관리 절차도 제공됩니다.
초록
샤가스병, 리슈마니아증, 인간 아프리카 트리파노소마증과 같은 인간 원생동물 질병이 공중 보건에 미치는 영향을 통제하고 줄이기 위해서는 신약 및 백신 개발을 가속화해야 합니다. 그러나 이 과정은 매우 복잡한 기생충 생물학 및 질병 발병 기전과 같은 어려움으로 가득 차 있으며, 소외된 열대성 질병의 전형적인 경우와 같이 연구 개발을 위한 자금이 상대적으로 제한적입니다. 따라서 감염 및 질병의 주요 특징을 충분히 재현할 수 있는 동시에 자원을 합리적으로 사용할 수 있는 in vitro 및 in vivo 연구 모델은 이러한 질환에 대한 연구를 진행하는 데 필수적입니다. 한 가지 예는 샤가스병에 대한 생체 내 생물발광 이미징(BLI) 마우스 모델로, 루시페라아제를 발현하는 트리파노소마 크루지 기생충에 의해 생성된 장파장의 빛을 매우 민감하게 감지합니다. 이 기술이 생체 내 약물 효능에 대한 표준 접근 방식이 되었음에도 불구하고, 연구 그룹은 적절한 BLI 장비를 쉽게 구할 수 있는 경우에도 장비 취급 및 품질 관리 절차의 적용에 대한 적절한 실습 교육이 부족하기 때문에 여전히 이를 구현하는 데 어려움을 겪을 수 있습니다. 이 시나리오를 고려할 때, 이 프로토콜은 샤가스병 또는 기타 전염병 마우스 모델에 대한 BLI에 대한 경험이 거의 또는 전혀 없는 연구 그룹에서 프로토콜의 구현을 용이하게 하는 세부 정보와 함께 실험 계획에서 데이터 수집 및 분석에 이르기까지 안내하는 것을 목표로 합니다.
서문
샤가스병은 라틴 아메리카의 풍토병으로 전 세계적으로 약 700만 명이 감염되고 있습니다1. 매년 50,000명 이상의 사망자와 약 70억 달러의 경제적 손실이 이 질병의 무력화로 인해 발생합니다2. 샤가스병은 원생동물인 트리파노소마 크루지(Trypanosoma cruzi)에 의해 발생하며, 이 기생충은 미주 지역의 포유류(야생 및 가축)와 삼중아토 매개체(Hemiptera, Reduviidae)3를 감염시킬 수 있는 기생동물입니다. 다른 중요한 감염 경로로는 수혈, 장기 이식, 경구(감염된 트리아토민에 오염된 음식 섭취)4 및 선천적 전염이 있습니다. 비벡터적 전염 경로는 샤가스병이 비풍토병 지역으로 확산되는 데 기여했다 3,5.
샤가스병은 두 가지 임상 단계로 나타납니다. 급성기는 대부분의 경우 무증상입니다. 증상 감염은 일반적으로 발열, 피로, 근육통, 림프절 병증, 비장 종대증 및 간비대와 같은 비특이적 징후와 관련이 있습니다. 급성기는 또한 종종 특허 기생충 혈증 및 기생충의 전신 순환과 관련이 있습니다. 진단된 사례의 최대 10%에서 사망이 발생할 수 있으며, 특히 구강 감염으로 인한 경우 사망이 발생할 수 있다6. 만성 단계는 종종 증상이 장기간 없는 것이 특징입니다. 시간이 지남에 따라 수십 년 전에 감염된 환자의 약 1/3이 심장 증상을 보이며, 일반적으로 섬유증 및 심근 염증 및/또는 주로 거대식도 및/또는 거대결장 증후군의 발병과 관련된 위장 장애를 동반합니다 3,5,6.
샤가스병의 병인학적 치료는 벤즈니다졸(benznidazole)과 니푸르티목스(nifurtimox) 두 가지 약물로 구성되어 있습니다. 이러한 항기생충제는 50년 이상 사용되어 왔으며 상당한 독성과 제한된 효능을 가지고있습니다 5,7,8. 따라서 샤가스병 환자를 위한 새롭고 안전하며 효과적인 치료법을 개발해야 할 필요성이 시급합니다.
보다 정교하고 정확한 기술을 통해 샤가스병에 대한 새로운 치료법을 찾는 데 진전을 이룰 수 있는 오래된 질문에 대한 답을 얻을 수 있습니다. 이러한 의미에서 과학계는 감염 과정에 대한 생체 내 연구 및 약물 효능 평가 9,10,11,12를 위해 유전자 변형 기생충으로부터 큰 이익을 얻습니다. 생물발광 이미징(BLI) 시스템을 기반으로 한 종단 분석은 치료 요법 중 및 치료 요법 후에 효능을 평가할 수 있도록 하여 트리파노시스 활성을 가진 화합물을 식별할 수 있습니다10,13. BLI 방법은 적색 편이 반딧불이 루시페라아제12를 구성하는 유전자 변형 T. cruzi CL Brener Luc::Neon 계통11에 의해 생성된 빛의 정량을 통해 순환 또는 조직 및 장기의 기생충 부하를 직접 측정합니다.
그럼에도 불구하고 샤가스병 BLI 동물모델 및 약물 효능 연구가 확립된 지 거의 10년이 지났지만 소수의 연구 그룹만이 이 기술을 지배하고 있습니다. 이러한 사실은 적절한 이미징 장비에 대한 접근성이 떨어질 뿐만 아니라 구조화되고 상세한 프로토콜에 대한 교육 및 가용성이 부족하기 때문입니다. 이 방법은 현미경, 혈청학 또는 qPCR에 의한 기생충 DNA 검출을 통한 기생충혈증 평가에 의존하는 다른 접근법에 비해 몇 가지 이점을 제시하는데, 이는 생체 내에서 보다 강력하고 통합된 데이터를 생성할 수 있는 가능성을 통해 생쥐의 웰빙을 개선하고 동물 사용을 줄일 수 있기 때문입니다. 더욱이, 이 방법은 약물 치료 후 내장 장기의 기생충 병소를 즉시 감지할 수 있기 때문에 틀림없이 더 민감합니다10,12. 따라서 이 프로토콜은 기생충학 및 기타 전염병에 대한 연구 그룹이 기술 절차를 자세히 설명하여 실험실에서 이 방법론을 확립하도록 안내하는 것을 목표로 합니다. 여기에서는 DNDi(Drugs for Neglected Diseases initiative)가 주관하는 약물 발견 노력의 일환으로 라틴 아메리카 최초로 브라질에서 샤가스병 BLI 모델을 구현하여 얻은 경험을 공유합니다.
프로토콜
이 프로토콜에 설명된 모든 절차는 Universidade de São Paulo의 Instituto de Ciências Biomédicas의 동물 윤리 위원회가 사전 승인한 지침14 (프로토콜 CEUA ICB/USP no 5787250522)에 따라 제출, 승인 및 수행되었습니다.
1. 솔루션
참고: 10mL/kg(마우스 20g 무게의 경우 200μL)15,16의 사전 조절된 관리 용량을 고려하십시오. 예를 들어, 150mg/kg의 동물 투여량에 도달하기 위해 15mg/mL의 작업 용액을 준비합니다.
- 하이드록시프로필메틸셀룰로오스 현탁액 차량(HPMC-SV)
참고: 필요한 시약은 0.5%(w/v) 하이드록시프로필메틸셀룰로오스(HPMC), 0.4%(v/v) 트윈 80 및 0.5%(v/v) 벤질 알코올입니다.- 200mL의 차량 용액의 경우 HPMC 1g의 무게를 측정하고 64mL의 뜨거운 초순수에 녹입니다. 2분 동안 저어줍니다.
- 얼음처럼 차가운 초순수 120mL를 넣고 1시간 동안 저어줍니다. 벤질 알코올 1mL를 추가합니다.
- 그런 다음 역 피펫팅 기법을 사용하여 Tween 80 0.8mL를 추가하고 용액이 투명해질 때까지 계속 저어줍니다.
- 최종 부피 200mL에 맞게 용액을 조정합니다. HPMC-SV를 최대 4개월 동안 냉장(4°C)하여 보관합니다.
- 벤즈니다졸
- 다음과 같이 필요한 복합 용액의 양을 계산하십시오.
복합 용액의 부피 = (각 일의 투여 횟수 x 일수 x 치료할 마우스 수 x 각 마우스의 투여 용량) + 30% 추가. - 원하는 복용량을 고려하여 필요한 양의 벤즈니다졸(BZ)을 계량합니다. 근치적 치료의 경우, 10일 동안 1일 1회 100mg/kg을 경구 투여하면 CD 만성 모델17에서 100% 완치를 달성할 수 있습니다.
- 원하는 최종 부피를 고려하여 5%(v/v) DMSO의 농도에 도달하기 위한 적절한 양을 계산하고 BZ를 깔끔한 DMSO에 완전히 용해시킵니다.
- 95%(v/v) HPMC-SV 농도에 도달하기 위해 유리관에 적절한 부피의 차량을 추가합니다. DMSO에 용해된 BZ를 HPMC-SV가 포함된 유리관으로 옮깁니다. 현탁액을 강력하게 균질화하고 4 °C에서 보관하십시오.
예: BZ 제형의 최종 부피 = 10mL(단계 1.2.1)
BZ의 양 = 100 mg (단계 1.2.2)
5% DMSO = 0.5mL(단계 1.2.3) 및 95% HPMC-SV = 9.5mL(단계 1.2.4) - 각 약물 투여 전에 제형을 37°C에서 5분 동안 초음파 수조에 넣고 동물 투여 전에 강력하게 균질화합니다.
- 다음과 같이 필요한 복합 용액의 양을 계산하십시오.
- 사이클로포스파마이드(Cyclophosphamide)
- 필요한 양의 사이클로포스파마이드를 초순수에 용해시켜 12.5mg/mL 용액을 얻습니다.
- 여과로 용액을 멸균하고 4°C에서 보관합니다.
- Giemsa 얼룩
- 메탄올 50mL에 Giemsa 분말 시약 0.6mg을 녹입니다. 글리세롤 25mL를 넣고 섞는다. 여과지와 깔때기를 사용하여 침전물을 제거합니다. 원액을 빛으로부터 보호된 실온(RT)에서 보관하십시오.
- Mix-Phosphate Buffer 90 mL (pH 7.2에서 20.5 M Na2HPO4, 65.4 M KH2PO4 )에 10 mL의 Giemsa 용액을 희석하여 작업 용액을 준비합니다.
2. 트리파노소마 크루지 문화
- 생물 안전 작업대(BSC)에서 작업하여 LIT 배지(68.44mM NaCl, 5.36mM KCl, 112.7mM Na2HPO4, 5g/L 트립톤, 5g/L 간 주입 육수, 0.03M 헤민, 4.16mM 포도당)에서 10%(v/v) 소 태아 혈청(FBS)이 보충된 T. cruzi CL Brener Luc::Neon11의 4 x 106 epimastigotes/mL를 배양합니다. 100 μg/mL 페니실린, 100 U/mL 스트렙토마이신 및 150 μg/mL 히그로마이신은 28°C에서 선택적 약물입니다. 기생충은 일반적으로 3-4일 내에 정지 단계에 도달합니다.
- 7-10일 동안 28°C에서 15mL 원뿔형 튜브에 10%(v/v) FBS와 함께 10mL의 Grace's Insect 배지에 3 x 108 epimastigotes를 배양하여 감염성 기생충을 얻기 위한 metacyclogenesis를 유도합니다.
- Giemsa-staining 도말에 의한 분화율을 평가합니다. 이를 위해 분화된 기생충 20μL를 유리 슬라이드에 펴 바르고 10분 동안 건조시킵니다.
- 흄 후드에서 유리 슬라이드를 깔끔한 메탄올로 덮어 샘플 고정을 진행하고 완전히 건조시킵니다(1-2분). 유리 슬라이드를 Giemsa 작업 용액으로 20분 동안 덮습니다.
- 유리 슬라이드를 증류수로 부드럽게 씻으십시오. 현미경으로 metacyclic trypomastigotes의 백분율을 계산합니다. 최소 10%의 차별화율이 달성되면 다음 단계로 진행합니다.
- 기생충을 원심분리하고(10분 동안 120 x g ) 10mL의 DPBS로 펠릿을 재현탁시킵니다. 원심분리를 한 번 더 하고 FBS 10%(v/v), 페니실린 100μg/mL 및 스트렙토마이신 100U/mL가 보충된 DMEM 5mL에 기생충을 재현탁시킵니다.
- 25cm2 배양 플라스크에서 1.66 x 105 LLC-MK2 세포( Macaca mulatta의 신장 상피 세포)를 37°C에서 5%CO2 의 가습 인큐베이터(18)에서 감염을 수행합니다.
- 조직 배양 트리포마스티고테스(TCT)는 8-9일 후에 배지에서 방출됩니다. 1:40의 MOI(Multiplicity of Infection)에서 새로운 LLC-MK2 세포 단층을 TCT로 감염시킵니다.
3. 유세포분석기에 의한 Trypanosoma cruzi 집단 균질성 분석
- CL Brener Luc::Neon 및 CL Brener 야생형 균주의 TCT를 수집하고 120 x g 에서 10분 동안 원심분리한 후 DPBS에서 TCT를 재현탁합니다. 기생충 밀도를 조정하여 1 x 106/mL를 달성합니다.
- mNeonGreen 형광(예: 506/em. 517 nm)19을 기반으로 하는 유세포분석기로 집단 분석을 진행하여 각 샘플에 대해 최소 20,000개의 이벤트를 획득합니다.
참고: 형광 개체군 비율은 야생형과 형질주입된 기생충을 비교하여 얻은 것입니다. 생쥐 감염을 진행하려면 CL Brener Luc::Neon 계통의 형광 기생충 개체군의 최소 95%를 달성해야 합니다(보충 그림 1).
4. 생쥐 실험 감염
참고: 기생충의 양을 늘리기 위해, 혈류 트리포마스티고테스(BT)는 면역 결핍 마우스에서 자주 얻어진다10,13. 여기에서 BALB/C 마우스의 화학적 면역억제를 사용하여 BT를 얻습니다. 이를 위해 96시간 간격으로 62.5mg/kg의 사이클로포스파마이드(CTX)를 복강내 주사로 4회 투여하여 경미한 면역억제를 달성하며, 이는 T. cruzi 감염과 동시에 수행됩니다.
- T. cruzi 감염 1일 전에 복강 내 주사(i.p.)로 멸균 사이클로포스파마이드 62.5mg/kg을 투여합니다.
- 복강 내 경로를 통해 0.2mL의 DPBS에 1 x 104 TCT로 각 마우스를 감염시킵니다. 병원체와 바늘을 다룰 때 사고의 높은 위험에주의하십시오. 전체 절차 동안 장갑과 안면 보호대를 착용하고 BSC에서 감염을 수행합니다.
- 혈액 내 BT를 직접 관찰하여 매일 기생충혈증을 모니터링합니다(Pizzi-Brener 방법)20. 감염 후 약 13-17일(dpi)이 기생충혈증이 최고조에 달할 때 혈액 채취를 실시합니다. 이를 위해 100mg/kg 케타민과 10mg/kg 자일라진으로 마우스를 마취합니다.
- 마우스가 완전히 마취되면21, 3.8%(w/v) 구연산나트륨 50μL가 포함된 24G X3/4 바늘에 부착된 1mL 주사기를 사용하여 심장 천자를 진행합니다. 바늘의 플러그를 뽑고 혈액을 원심 분리기 튜브에 부드럽게 넣으십시오.
- BSC에서 암모늄-염화물-칼륨(ACK) 용해 완충액에서 혈액 부분 표본을 희석하고 Neubauer 챔버의 기생충을 계산합니다. 작은 혈전이 기생충 계산에 영향을 미치므로 이 과정을 최소 두 번 반복하십시오.
알림: 계수 오류를 방지하려면 Neubauer 챔버에서 30 미만 및 300 트리포마스티고트 보다 높은 계수를 피하기 위해 희석 계수를 조정하십시오. - DPBS에 필요한 양의 순수한 혈액을 혼합하여 기생충 밀도를 5 x 103 BT/mL로 조정합니다.
- 26G 바늘을 사용하여 복강 내 경로로 마우스당 0.2mL의 DPBS(5 x 103 BT/mL)에 1 x 103 BT로 면역이 억제되지 않은 BALB/c 마우스를 감염시킵니다(바늘이 좁을수록 기생충 용해가 발생함)22. 복강내 볼륨을 주입한 후 역류를 방지하기 위해 바늘을 마우스 내부에 5초 동안 유지합니다.
- 감염된 쥐를 종이 타월이 있는 상자에 임시로 넣어 누출 또는 출혈 가능성을 확인한 다음 쥐를 우리로 되돌려 보냅니다.
5. 생체 내 이미징
참고: 여기에 사용된 용어의 용어집은 다음과 같습니다.
이미징 세션: 주어진 날짜에 특정 실험의 모든 그룹에서 수행된 생물 발광 획득. 그림 1A 는 절차의 개요를 보여줍니다.
이미징 라운드: D-루시페린 주입에서 마취 회복에 이르기까지 3마리의 마우스로 구성된 하위 그룹에서 수행된 절차. 각 실험 그룹에는 6마리의 마우스가 포함되는 것이 권장되는데, 이는 마우스의 기생충 부하에 대한 내재적 변동성 및 아래에 설명된 BLI 정량화에 영향을 미치는 기타 요인 때문입니다.
이미징 획득: 생물 발광을 정량화하기 위해 이미징 장비에 의해 수행되는 사진 촬영으로, 그 결과 사진의 이미지 오버레이와 정량화된 생물 발광이 유사 색상 척도로 표시됩니다.
이미징 절차: 프로토콜의 이 세션에서 논의된 모든 단계.
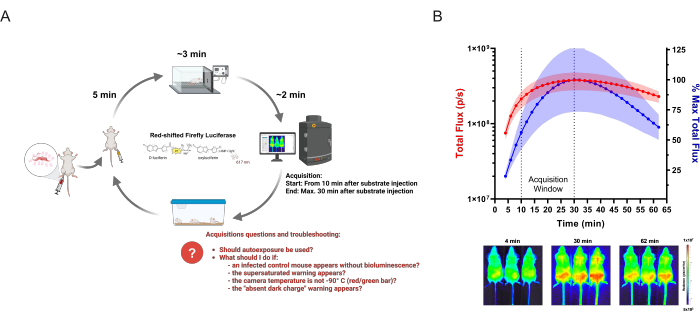
그림 1: BLI 데이터 획득. (A) 감염성 질환 연구에 적용된 획득 워크플로우 다이어그램, 샤가스병 생물 발광 마우스 모델을 예로 들었습니다. 유전자 변형 T. cruzi 에 감염된 마우스는 설정된 시점에서 생체 내 이미징으로 분석됩니다. 각 이미징 라운드에서 최대 3개의 마우스 그룹에 150mg/kg의 효소 기질(D-루시페린)을 주입합니다. 5분 후 산소 중 2.5%(v/v) 이소플루란으로 마취를 실시합니다. 완전히 움직이지 않으면 마우스를 이미징 시스템에 배치하고 정의된 설정에 따라 수집을 시작합니다. 이미징 후 마우스는 마취에서 회복되어 케이지로 돌아갑니다. 연구자가 습득 중에 가질 수 있고 직면할 수 있는 빈번한 질문과 문제는 빨간색으로 강조 표시됩니다. 이 체계는 Lewis et al. (2014) 12 (BioRender.com : UD26KWEVS2로 생성)에서 수정되었습니다. (B) D-루시페린/적색편이 반딧불이 루시페라아제(PpyRE9h)의 생체 내 동역학. T. cruzi parasitemia 피크(n=3)에 있는 마우스를 마취하고 150mg/kg D-루시페린을 주사하였다. 이미지는 1시간(노출 시간: 2분, 비닝: 4) 동안 획득했습니다. 상단: 복부 총 플럭스(p/s) 정량화(왼쪽 Y축, 빨간색) 및 가장 높은 평균 측정의 백분율(오른쪽 Y축, 파란색). 데이터는 평균(곡선) 및 표준 편차(음영 영역)로 표시됩니다. 하단: 첫 번째(4분), 가장 높은 BLI 신호(30분) 및 마지막(62분) 시점의 획득 이미지. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- Acquisition 창의 녹색 막대를 확인하여 CCD(Charge-Coupled Device) 카메라가 차가운지(-90°C) 확인합니다. 막대(녹색 또는 빨간색)를 클릭하여 온도를 시각화합니다.
알림: 이미징 장비 설명서에 따르면 이미징 장비와 소프트웨어는 CCD를 차갑게 유지하기 위해 항상 켜져 있어야 합니다. - 자동 배경 조정이 수행되었는지 확인합니다. 이렇게 하려면 Acquisition > Background > View available Dark Charge를 클릭하십시오. 여러 설정 조합이 있는 목록이 나타납니다.
참고: 이 절차는 발광 노이즈를 줄입니다. 선택한 구성의 결과가 1000보다 큰 값이면 "노출 시간 x (binning²)" 공식에 따라 암흑 충전을 무시해서는 안 됩니다. 소프트웨어 구성에 따라 범주화는 숫자(범주화 계수) 또는 'small'에서 'large'까지의 범위로 표시될 수 있습니다. 범위와 비닝 계수 간의 일치는 장치 설명서에서 찾을 수 있습니다. - Activity Window(활동 창)(소프트웨어 하단의 흰색 영역)가 표시되지 않으면 Activity Window(활동 창) > Menu View(메뉴 보기)에서 활성화합니다.
- Acquisition Window > Field of View를 클릭하여 이미징 영역을 설정합니다. 옵션 C(13.2cm)는 3마리의 마우스를 획득하고 옵션 D(22cm)는 5개의 마우스를 획득합니다.
- Acquisition > Auto-Save를 클릭하여 자동 저장 옵션을 선택하고 각 시점에 대해 새 폴더를 선택하거나 생성합니다.
- 이미징 영역에 무광택 검정 용지를 놓고 칸막이 슬라이드를 입구 사이에 수직으로 놓습니다. 제조업체에서 슬라이드를 제공하지 않은 경우 무광택 검정 용지 조각(3cm x 15cm)을 사용합니다.
- 이미징 챔버의 내부 영역을 조정하여 유리 코콘을 마취 입구에 수용합니다. 작은 검은색 전기 테이프를 사용하여 마취 시스템을 플랫폼(이미지 영역 외부)에 부착합니다.
참고: 일부 버전의 이미징 장치에서는 레이저가 이미징 영역을 정의합니다. 이 도구를 사용할 수 없는 경우 소프트웨어를 통해 이미지를 획득하여 이미징 영역 내의 파티션 슬라이드를 확인하십시오. - 이미징 및 유도 챔버를 위해 이소플루란 기화기를 산소의 2.5%(v/v)로 설정합니다. 가스가 시스템21을 통해 흐르고 있는지 압력 게이지로 확인하십시오.
참고: 이미징 장치에 흡입 마취 시스템이 부착되어 있지 않은 경우 주사 가능한 자일라진 및 케타민23과 같은 다른 마취 옵션이 가능합니다. 이 경우 생쥐의 회복이 느리고 사망 위험이 높습니다24. - 주사기(31G 바늘)에 D-루시페린(D-루시페린을 제조하기 위한 포괄적인 프로토콜은 여러 공급업체에서 제공함)25,26을 채우고, 직사광선으로부터 보호하고, 내부를 종이 타월로 덮어 몇 개의 플라스틱 용기나 추가 케이지를 준비합니다.
- 시간을 쉽게 추적할 수 있도록 시계/시계를 가까이에 두고, 시술 중 마우스 그룹, 루시페린 주입 시간 및 기타 정보를 등록할 수 있는 실험실 노트북을 두십시오.
- 모든 쥐의 무게를 측정하고 체중을 등록합니다. 꼬리에 펜 마커 또는 문신으로 각 마우스를 표시하십시오. 전체 실험 동안 쥐 식별을 잘 표시하십시오. 이 단계는 인수 전날에도 수행할 수 있습니다.
알림: 잉크가 생물 발광 신호를 방해할 수 있으므로 마크가 큰 신체 영역을 차지해서는 안 됩니다. 다른 색상의 영구 마커도 그룹을 구별하는 데 도움이 될 수 있습니다. - 이미징 세션을 시작하려면 배경 발광 이미지를 등록합니다(설정: 노출 시간: 5분; 비닝: 'large' 또는 '16', f/stop: 1) 마우스가 없는 이미징 챔버. 이 절차는 자동 발광 광원 또는 장비에서 원치 않는 문제를 식별하는 데 도움이 됩니다.
참고: BLI는 효소 반응을 기반으로 하기 때문에 시간은 실험의 필수 기능입니다. 동물 취급을 시작하기 전에 위에 나열된 모든 항목과 장비 설정을 확인하십시오. - 처음 3마리의 쥐에 D-루시페린 150mg/kg(i.p.)을 주입하고 내부 장기에 도달하지 않도록 합니다. 마우스를 용기 상자에 넣어 D-루시페린이 누출되는지 여부를 평가합니다(밝은 노란색 용액). 이런 일이 발생하면 메모하고 마우스 그룹과 D-루시페린 주입 시간을 등록하십시오.
- 5분 동안 기다린 다음 마우스를 마취 유도 챔버로 옮깁니다. 시스템을 켭니다. 쥐가 완전히 마취되는 데 약 3분이 걸립니다(다리, 꼬리 흔들림 등과 같은 반응 없음). 21.
- 이미징 장치의 도어를 열고 이미징 챔버로의 마취 흐름을 켤 동시에 유도 챔버를 끕니다.
- 각 마우스를 노즈 콘 위치(마우스 1-3, 왼쪽에서 오른쪽으로)에 놓습니다. 레이저로 표시된 이미징 영역 내부에 복부 쪽이 위로 오도록 마우스를 부드럽게 수용합니다. 적응하는 동안 쥐의 ID와 위치를 확인하십시오. 코뿔에 부분적으로 마취된 쥐의 입구를 강제로 넣지 마십시오.
- 파티션 슬라이드를 마우스 사이에 놓고 이미징 장비의 도어를 닫습니다.
- 소프트웨어 획득 창에서 다음과 같이 획득 설정을 조정합니다.
- 감염되지 않은 마우스의 경우 노출 시간 = 5분 / 비닝 = 'large' 또는 '16'
(임계값을 설정하기 위해 수학적으로 가장 민감한 구성 집합). - 급성 모델에서 감염된 마우스의 경우: 노출 시간 = 2분/ 비닝 = '중간' 또는 '4'.
- 만성 모델에서 감염된 마우스의 경우: 노출 시간 = 5분/ 비닝 = 'large' 또는 '16'.
- 감염되지 않은 마우스의 경우 노출 시간 = 5분 / 비닝 = 'large' 또는 '16'
- D-루시페린 주입 시간이 획득을 시작하기 최소 10분 전에 수행되었는지 확인합니다. 그렇지 않은 경우 루시페라아제 신호의 피크 동안 이미지를 얻는 데 필요한 기간을 기다립니다(그림 1B). 그렇지 않으면 Acquire 를 클릭하여 이미징 수집을 시작합니다.
- 이미징이 시작된 후 이미지 레이블 창이 나타납니다. 루시페린 주입 시간, 실험, 마우스 식별, 시점 및 기록 유지에 도움이 될 수 있는 기타 원하는 정보를 포함하여 각 그룹에 대한 적절한 정보로 상자를 채웁니다. 이 정보는 측정 테이블 파일에 포함됩니다.
- 이미징 획득이 끝날 때 경고 기호 Saturated Image(포화 이미지 )가 표시되는지 확인합니다. 채도가 높은 이미지는 허용되지 않습니다. 이 경우 범주화를 줄이고 새 이미지를 가져옵니다. 분석에서 고려해야 할 메모를 작성하십시오.
- 이미지가 획득되면 이미징 기계 도어를 열고 마우스를 등쪽 보기(뒷면이 위로)로 돌립니다. 획득을 다시 수행하고 적절하게 레이블을 지정합니다.
- 이 영상 촬영이 끝나면 마취 흐름을 끕니다. 이미징 챔버에서 마우스를 조심스럽게 제거하고 용기에 넣습니다.
- 마취 회복을 관찰하면서 쥐의 체중을 기록합니다. 시술 중에 발견된 비정상적인 행동이나 신체 이상을 기록하십시오. 쥐가 다시 움직이기 시작하면 새장에 넣으십시오.
참고: 획득한 각 이미지의 BLI 강도를 확인합니다. 획득이 종료된 후 기록된 생물 발광 이미지와 사진은 고려해서는 안 되는 자동 스케일과 함께 소프트웨어에 표시됩니다. 도구 팔레트 창에서 데이터 분석(아래 설명 참조)에 정의된 배율을 설정합니다.
6. 데이터 분석
참고: 위의 프로토콜은 상용 생체 내 이미징 소프트웨어를 기반으로 합니다. 그러나 소프트웨어 라이센스가 없는 버전은 가장 기본적인 분석을 수행할 수 있습니다. 소프트웨어에 대한 자세한 내용은 재료 표에서 확인할 수 있습니다.
- 파일을 엽니다.
- >Menu File > Browser(브라우저)를 선택하여 특정 이미징 시점에서 획득한 데이터가 포함된 폴더를 엽니다(그림 2A - 1단계).
알림: 선택한 파일에 수집된 모든 데이터가 저장된 테이블 형식으로 새 창이 열립니다. 소프트웨어에서 자동으로 제공하는 이미지 ID(데이터 및 시간 번호)인 클릭 번호 기호, 획득 중 이미지 레이블 창에서 연구원이 제공한 정보 및 획득 설정이 표시됩니다. 이러한 모든 데이터는 포화 이미지를 사용해서는 안 된다는 점을 감안할 때 분석에 사용할 수 있는 이미지를 정렬하는 데 도움이 됩니다. - 감염되지 않은 컨트롤을 포함하여 선택한 이미지와 관련된 여러 행을 선택합니다. 이미징 세션 중에 등록된 정보와 함께 실험실 노트북에 이미지 ID를 기록합니다.
- Load as Group(그룹으로 로드)을 클릭하여 선택한 이미지를 조합합니다. 이 절차에서는 새 시퀀스 이미지를 만듭니다. 따라서 모든 이미지의 기능을 동시에 조정할 수 있습니다. 필요한 경우 원시 데이터를 쉽게 재분석할 수 있도록 6.1단계에서 사용한 것과 다른 새 폴더에 새 시퀀스 이미지를 저장합니다.
- 시퀀스 이미지에서 옵션 > 디스플레이 > 선택 비닝 계수 (Binning Factor )를 클릭하여 각 이미지에 사용되는 비닝을 식별합니다(그림 2A - 2단계). 획득된 비닝 계수는 시퀀스의 각 이미지 상단에 표시됩니다.
- 모든 범주화 요인을 동일한 숫자로 수정합니다. 이렇게 하려면 조정할 이미지를 두 번 클릭합니다. Tool Palette 창 > Image Adjust 섹션에서 적절한 비닝 계수를 선택합니다(그림 2A - 3단계). 비닝 계수 선택은 5.18단계 참조. 모든 발산 이미지에서 이 절차를 수행합니다.
참고: 이 절차는 BLI 정량화(표 1)에 직접적인 영향을 미치며 토론 섹션에서 자세히 설명합니다.
- >Menu File > Browser(브라우저)를 선택하여 특정 이미징 시점에서 획득한 데이터가 포함된 폴더를 엽니다(그림 2A - 1단계).
- 배율을 설정합니다.
- 감염되지 않은 대조군을 기반으로 유효한 생물 발광 신호(장치 설명서에 따라 600 카운트 이상)를 구별합니다. 이를 위해 감염되지 않은 마우스의 이미지를 두 번 클릭하십시오. 그런 다음 새 창의 왼쪽 상단 모서리에서 단위 필드의 개수 옵션을 선택합니다. 그런 다음 색상 눈금을 최소값 600으로 조정합니다. 결과 이미지는 래디언스의 최소 스케일을 설정하는 기준선이 됩니다.
- 시퀀스 창이 활성화된 상태에서 Units 필드에서 Radiance 옵션을 선택합니다. Tool Palette에서 Color Scale(색상 스케일)과 Color Table(색상 테이블)을 조정합니다. 이를 위해 Color Scale Limits 영역에서 Individual 상자를 비활성화합니다.
- Logarithmic Scale 및 Manual 상자를 표시합니다(그림 2A - 4단계). 감염되지 않은 대조군(6.8단계에서 관찰된 대로)에 따라 최소 스케일 번호를 설정하고 신호가 가장 높은 영역을 최대로 설정합니다(그림 2A에서 화살표 참조).
참고: In vivo 2D light mesurament는 상대적 정량화입니다. 각 장치의 버전 및 보정의 차이로 인해 다른 눈금 값을 찾을 수 있습니다. 따라서 대표 결과에서 나타난 값은 다른 기기에서 수행된 다른 실험과 맞지 않으면서도 내부 통제(비감염 및 감염되지 않은 치료)에 따라 동일하게 유효할 수 있습니다. - 모든 이미지에 대해 동일한 배율을 설정한 후 각 이미지를 두 번 클릭하고 창을 최대화한 다음 그래픽 내보내기 버튼을 사용하여 이미지 보기를 이미지 형식(.jpg, .tiff 등)으로 내보내고 treatment_miceID_time점으로 파일 이름을 지정합니다. (그림 2A - 5단계). 모든 이미지에 대해 이 절차를 수행합니다.
- 측정을 수행합니다.
- 시퀀스에서 이미지를 선택하고 두 번 클릭합니다. 도구 팔레트 창> ROI 도구 섹션에서 사각형 버튼(그림 2B-1단계)을 클릭하고 전체 마우스를 덮는 사각형을 그립니다.
- 생성된 ROI의 테두리를 클릭하고 각 마우스에 대해 동일한 ROI를 복사하여 붙여넣습니다(이미지에 3개의 ROI가 생성됨). ROI Tools 섹션에서 저장을 클릭하여 ROI를 저장합니다. Apply to Sequence(시퀀스에 적용) 상자를 선택하여 모든 이미지에 대해 저장된 ROI를 적용한 다음 Load(로드)를 클릭합니다. 저장된 ROI는 전체 실험의 모든 마우스에 사용됩니다.
- 동물이 측정 영역에 더 잘 맞도록 각 마우스의 ROI 위치를 조정합니다. 모든 마우스에 레이블이 지정되면 ROI 측정 버튼을 클릭합니다(그림 2B- 2단계). ROI 측정 표 가 나타납니다. 측정 유형 선택: Radiance; 이미지 속성: 가능한 모든 값; ROI 치수: cm. 그런 다음 모두 선택 버튼을 클릭 한 다음 복사 버튼을 클릭하십시오.
- 데이터를 테이블 분석 소프트웨어(스프레드시트)에 직접 붙여넣습니다. 또는 .csv 또는 .txt 형식으로 파일을 내보냅니다.
- 데이터에 대해 작업합니다.
- 표 분석 소프트웨어에서는 데이터를 그룹별로 정리합니다(치료, 대조군, 비감염, 비처리 등).
- 기생충 부하는 전신 생물 발광으로 표시됩니다. 따라서 동일한 마우스의 ventral 및 dorsal Total Flux 값과 일치하도록 데이터를 정렬하고 합산합니다.
- 각 그룹을 고려하여 합산된 값의 평균과 표준 편차를 계산합니다(예: 보충 표 1). 데이터를 그래프 작성 및 통계 소프트웨어에 플로팅합니다.
- 이미지 또는 슬라이드 프리젠테이션 소프트웨어에서 생물 발광 이미지가 있는 패널을 준비합니다. 각 마우스를 열에 배치하고 각 시점을 행에 배치하여 데이터의 시각화 및 해석을 용이하게 하는 약물 효능 매트릭스를 구축합니다.
참고: 6.2.4단계(이미지 레이아웃 창 보기)를 수행하지 않고 이미지를 이미징 소프트웨어에 직접 빌드> 수 있는 옵션이 있습니다. 그러나 소프트웨어 인터페이스와 도구는 데이터 구성을 제한합니다.
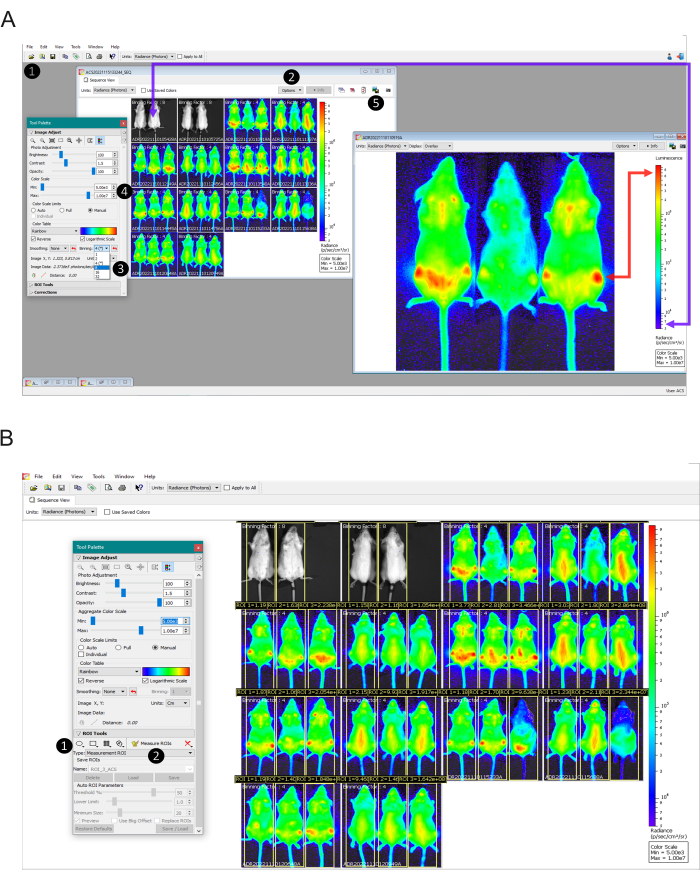
그림 2: 이미지 스케일 설정부터 발광 정량화까지 데이터 분석 단계. (A) 이미지 데이터 처리를 위한 Living Image Software 보기. 1단계: 브라우저 도구를 사용하여 수집된 데이터를 시퀀스로 업로드합니다. 2단계: 각 획득에 사용된 비닝을 식별합니다(개별 이미지 위에 표시됨). 3단계: 감염된 마우스의 모든 이미지를 동일한 비닝 팩터로 설정하고 감염되지 않은 마우스에 대해 비닝 팩터 16을 적용합니다. 4단계: 화면에 비생물 발광으로 보여야 하는 감염되지 않은 마우스(보라색 화살표)와 빨간색으로 보여야 하는 가장 높은 생물 발광 초점(빨간색 화살표)에서 감염되고 치료되지 않은 마우스를 기준으로 색상 스케일을 수동으로 설정합니다. الخطوة 5 : 작성된 정보가 없는 이미지를 얻으려면 각 이미지를 두 번 클릭하고 그래픽 내보내기 버튼을 사용하여 이미지를 내보냅니다. (B) 관심 영역(ROI) 도구 보기. 1단계: 마우스 전체를 포괄하는 ROI를 그리고 각 동물에 대해 동일한 ROI를 복사하여 붙여넣습니다. 조정된 ROI를 저장하고 실험의 모든 이미지에 적용합니다. الخطوة 2 : ROI 측정 버튼을 클릭하여 .csv 또는 .txt로 내보낼 테이블을 생성합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
7. 생체 외 절차
- 마우스에 150mg/kg D-luciferin i.p.를 주입하고( 생체 외 라운드당 1회) 3분 동안 기다립니다. 100mg/kg 케타민과 10mg/kg 자일라진 ip를 사용하여 마우스를 마취합니다.
- 생물 안전 작업대에서 쥐가 발을 꼬집어도 전혀 반응하지 않는 경우 쥐 피부를 절단하여 복막강(복막강을 열지 않고)과 왼쪽 겨드랑이 조직을 노출시킵니다. 겨드랑이 동맥과 혈관을 절단하여 출혈을 진행합니다.
- 일회용 파스퇴르 피펫을 사용하여 혈액을 수집합니다. 그런 다음 심장의 좌심실을 통해 DPBS 용액에 D-루시페린 0.3mg/mL 10mL를 관류합니다.
- 페트리 접시의 미리 설정된 지점에 선택한 장기를 배치하고 0.3mg/mL d-루시페린 용액에 담그십시오. 이 절차는 최대 30분 이내에 수행해야 합니다.
- 절제된 장기(심장, 폐, 흉선, 간, 대퇴사두근, 장간막, 비장, 신장, 부신, 내장 지방, 식도, 위, 소장, 맹장, 결장, 뇌, 피하 지방, 자궁, 생식선 지방, 방광 및 복막)의 발광 이미지를 획득합니다(신호 강도에 따라 비닝 16).
참고: 임계값을 설정하려면 감염된 마우스보다 감염되지 않은 마우스에 대해 동일한 절차를 수행해야 합니다.
결과
루시페라아제(luciferase)를 구성하는 형질전환 기생충에 기초한 적절한 마우스 모델을 사용하면, 숙주에 대한 해를 최소화하는 주요 인간 T. cruzi 감염 특징을 재현할 수 있으며, 숙주의 전신 BLI를 통해 최대 수개월 동안 종적(평생) 방식으로 기생충을 실시간으로 추적할 수 있다12.
그림 3 은 BALB/c 마우스에서 감염 후 1일째부터 150dpi까지의 CL Brener Luc::Neon 감염 시간 경과를 보여주는 파일럿 실험을 보여줍니다. 처음 20dpi에서는 생물 발광 추론 기생충 부담이 증가하며, 이는 기생충 혈증 피크의 전형적인 증상이며, 그 후 생쥐의 면역 조절로 인해 기생충 부하가 급격히 감소합니다. 따라서 감염의 급성 단계는 처음 50dpi로 간주됩니다. 만성 단계는 감염이 100-150dpi의 일정한 생물 발광 속도에 도달할 때 정의됩니다.
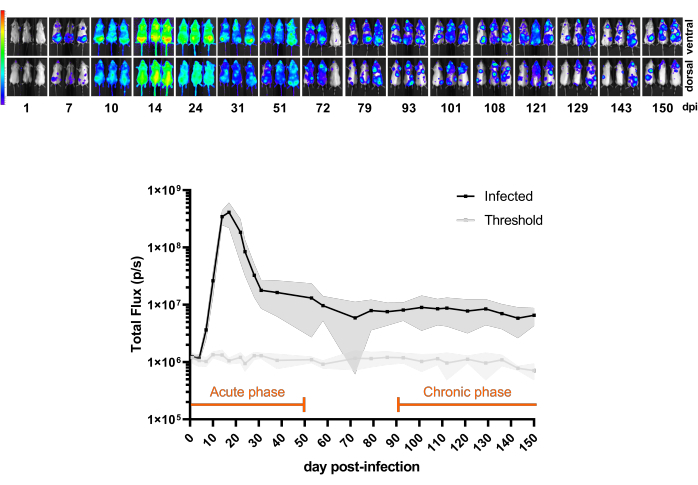
그림 3: 모델 이해. BALB/c 마우스에서 Trypanosoma cruzi CL Brener Luc::Neon 감염의 동역학(n = 11). 상단 패널: 복강 내 주입에 의한 1 x 10³ 혈류 트리포유스트고테를 사용한 감염 후 150일(dpi) 동안 서로 다른 시점의 복부 및 등쪽 생물 발광 이미지. 방사(p/s/cm2/sr)의 생물 발광 신호의 히트맵 스케일(로그10). 색상 코드: 보라색 = 5 x 103; 빨간색 = 1 x 107. 하단 패널: 전신 마우스의 Total Flux(p/s)에서 생물 발광 신호 정량화. 데이터는 평균(선)과 표준 편차(음영 영역)로 표현됩니다. 이 마우스 모델에서 급성 및 만성 감염 단계에 대해 정의된 기간은 주황색으로 강조 표시됩니다. 감염되지 않은 마우스의 발광 평균 값(n = 3)은 임계값(연한 회색 선)으로 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
감염의 주요 단계가 마우스 모델에서 잘 재현되기 때문에 치료 결과도 예측할 수 있습니다. 따라서, BLI는 이제 화합물 효능 잠재력과 개발 파이프라인(10,27)에서의 진행에 대한 의사결정을 지원하는 개념 증명 연구를 통해 중개 과학에 적용되고 있다. 급성 마우스 모델에서 경구 치료는 감염이 혈류에 많은 수의 트리포마스티고테(약 1 x 105 trypomastigotes/mL - 데이터 표시되지 않음) 및 전신 감염을 특징으로 하는 기생충혈증 피크(약 14-21dpi)에 도달할 때 시작해야 합니다. 만성 단계에서 마우스 처리는 기생충 부하가 비교적 훨씬 낮을 때 100dpi에서 시작되며 안정적인 하위 특허 기생충이 있습니다.
항기생충제 평가에서 상술한 프로토콜의 적용을 입증하기 위해, 샤가스병 치료에 사용되는 표준약물인 벤즈니다졸(BZ)과 샤가스병 치료제에 대한 임상시험에서 실패하고 T. cruzi에 대한 항기생충제로서도 효과가 없는 것으로 밝혀진 포사코나졸(Posa)의 치료 효능을 비교했다 , 이 프로토콜 13,18,28,29,30에 설명된 BLI 모델을 포함합니다.
급성 마우스 모델의 경우, 그룹당 6마리의 마우스로 구성된 코호트는 1일 1회 Posa(20mg/kg) 또는 BZ를 100mg/kg으로 20일 동안 gavage31 에 의해 경구 투여했습니다. 마우스는 또한 짧은 치료의 효과를 평가하기 위해 하루에 한 번 100mg/kg으로 5일 동안 BZ로 치료했습니다. 화합물 제거 후(치료 종료 후 10일), BLI 음성 마우스는 기생충학적 치료가 달성되지 않을 때 감염 재발을 촉진하는 상태인 면역을 억제했습니다(그림 4A). Posa 처리는 치료 종료 시 생물발광 추론 기생충 부담이 99.49% ± 0.27%(평균 ± 표준 편차) 감소했으며 약물 화합물 제거 기간 동안 감염되지 않은 마우스와 유사한 수준으로 유지되었습니다(40dpi에서 과도 신호를 가진 마우스 #3 및 44dpi에서 약한 BLI 반점을 보인 마우스 #2 제외). 치료하지 않은 그룹에 비해 20일 동안의 BZ 치료는 치료 종료 시 생물발광 추론 기생충 부담을 100% ± 0.01% 감소시켰습니다. 이에 반해, BZ를 5일간 짧게 처리한 결과, 19dpi에서 99.98% ± 0.03% 감소(역치 수준과 유사)가 나타났다. 그러나 이 경우 BLI 감소는 일시적이었고 후속 획득에서 모든 마우스가 감염 재활성화를 나타냈습니다(그림 4B).
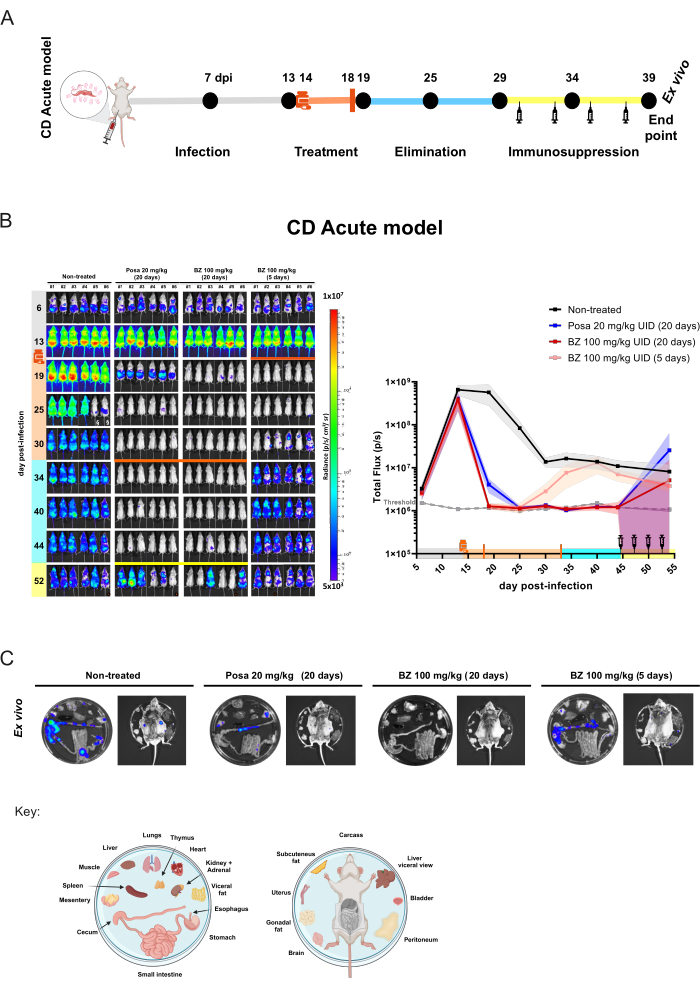
그림 4: 샤가스병 급성 모델에서 생물발광 이미징으로 얻은 개념 증명 실험 설계 및 결과. (A) 화합물 효능 평가를 위한 전임상 연구를 위한 급성 샤가스병 마우스 모델의 타임라인 프로세스 개략도. 검은 점: 이미징 시점. 약 플라스크와 오렌지 바: 각각 치료 시작과 끝. 주사기 아이콘: cyclophosphamide injections. DPI: 감염 후 일. 색상 코드: 회색 = 치료되지 않은 감염; 주황색 = 치료 기간; 파란색 = 화합물 제거 단계; 노란색 = 면역 억제 기간. (B) 트리파노소마 크루지(Trypanosoma cruzi)의 치료 경과. 왼쪽 패널: (i) (ii) 포사코나졸(Posa)을 20mg/kg, (iii) 벤즈니다졸(BZ)을 100mg/kg으로 20일 동안 처리한 후 (iv) 100mg/kg으로 5일 동안 처리한 BZ(n = 6/그룹)로 처리하지 않거나 20일 동안 처리한 BALB/c 마우스의 복부 생물 발광 이미지. 모든 치료는 하루에 한 번 gavage(10mL/kg)로 경구 투여했습니다. 로그10 스케일 히트맵은 낮은 수준(파란색)에서 높은 수준(빨간색)까지의 생물 발광 신호 강도를 나타냅니다. 오른쪽 그래프: 생물 발광 이미징 데이터의 전신 정량화. 데이터는 평균(선)과 표준 편차(음영 영역)로 표현됩니다. 키 : 약 플라스크 : 치료 시작 (14dpi); 주황색 막대: 처리 끝(18dpi/33dpi); 주사기 아이콘 사이클로포스파마이드 주사(44-53일째부터); 주황색 점: 생체 외 절차로 분석된 마우스; § 소변에서 D-루시페린 누출로 인해 제외된 데이터. (C) 장기 및 조직에서 T. cruzi 병소 검출을 위한 생체 외 절차. 플레이트 분포 키는 그림 하단에 표시됩니다(BioRender.com: ZY26LG8AOF로 생성됨). 생체 내 패널에 표시된 것과 동일한 광도 스케일. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
이 모델에서 항기생충 처리는 기생충 부하를 1000개의 기생충의 BLI 검출 한계 이하로 줄일 수 있습니다. 따라서 마우스는 BLI 음성10으로 나타납니다. 기생충학적 치료가 달성되었음을 보장하기 위해서는, 사이클로포스파마이드 처리를 사용하여 마우스의 면역억제를 촉진하는 것이 필요하다29,32. 약물 처리 후에도 여전히 검출할 수 없는 기생충 부하가 있는 마우스는 면역 억제 후 BLI 양성이 됩니다. 이 효과는 기생충 재발을 촉진하는 급성 모델에서 Posa 치료에 의해 더 광범위하게 나타납니다. 이 실험에서는 기생충 조직 영양성을 평가하기 위해 생체 발광 신호가 가장 낮은 마우스에서 ex vivo 절차를 수행했습니다(그림 4C). 처리하지 않은 마우스는 특히 위장관(TGI) 및 내장 지방 및 장간막과 같은 관련 조직에서 강력한 생체 발광 신호를 보여줍니다. 또한, 피부는 기생충 지속성과 관련된 부위였습니다. Posa로 처리한 마우스는 결장, 장간막 및 내장 지방에 더 국한된 저강도 생물 발광 반점을 나타냈습니다. 반면에, 20일 동안 BZ 100mg/kg과 같은 치료 치료 요법으로 치료된 마우스에서는 면역 억제 상태에서도 생체 발광 신호가 감지되지 않았습니다. 따라서, 생체 발광 신호가 1000 기생충10의 임계 수준 이상으로 상승하는 조건을 촉진하고, 내장 기관을 노출시킴으로써 민감도를 높인 후, BZ 100 mg/kg을 20일간 투여하는 것이 무균 치료를 제공하는 것으로 생각된다. 멸균 경화의 평가는 이전에 다양한 기술 10,13,17,33,34에 의해 검증되었습니다.
유사한 연구 설계가 만성 모델(그림 5A)에 적용되었으며, 감염 후 100일째에 마우스(n = 6/그룹)가 치료를 시작했습니다. 이 시점에서 Posa 20mg/kg, BZ 100mg/kg 또는 10mg/kg을 1일 1회 20일 동안 경구 투여했습니다. 약물 제거 기간이 지난 후, BLI 음성 마우스는 면역 억제되었습니다. 또한, 멸균 치료를 평가하기 위해, 면역억제 단계가 끝날 때 여전히 BLI 음성인 마우스를 생체 외 분석을 실시했습니다.
만성 감염에서 20mg/kg의 Posa를 투여한 결과, 치료 종료 시 생물발광 추정 기생충 부담이 95.03% ± 6.18% 감소하였으며, 약물 제거 기간 동안 감염되지 않은 마우스와 비슷한 수준으로 유지되었다. 면역억제 후, 대다수의 마우스는 다양한 수준의 BLI 신호 및 분포를 보여주었습니다(그림 5B). Ex vivo 절차에서 Posa로 처리한 한 전신 BLI 음성 마우스는 ex vivo 검사를 통해 검출할 수 있는 결장에 생체 발광 반점이 있음이 밝혀졌습니다(그림 5C).
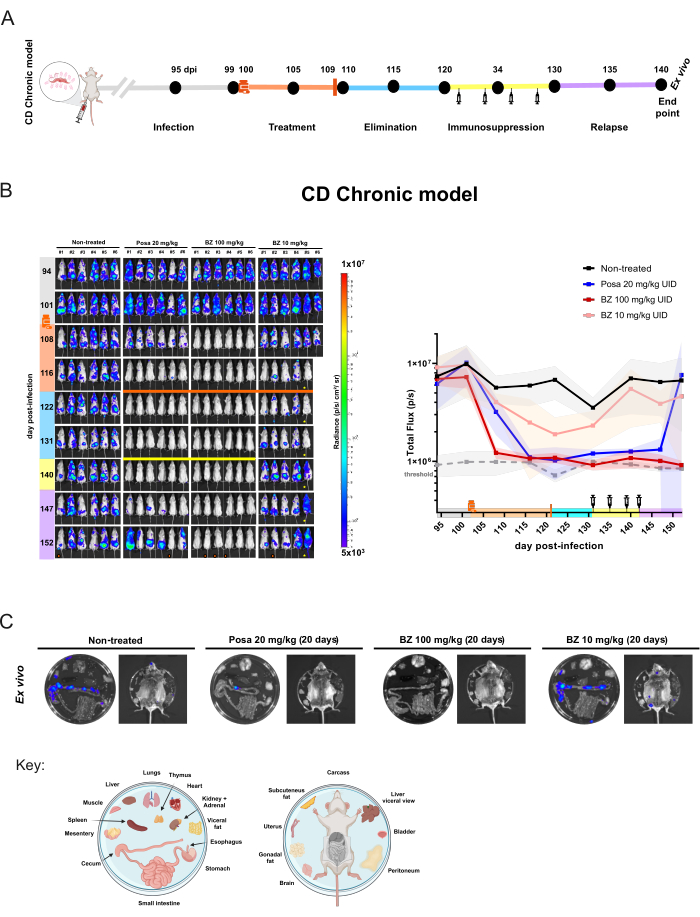
그림 5: 생물발광 이미징에 의한 트리파노소마 크루지 감염의 만성 모델에서 달성된 약물 평가 실험 설계 및 결과. (A) 만성 샤가스병 마우스 모델의 실험 설계 개략도. 검은 점: 이미징 시점. 약 플라스크와 오렌지 바: 각각 치료 시작과 끝. 주사기 아이콘: cyclophosphamide injections. Dpi: 감염 후 일. 색상 코드: 회색 = 치료되지 않은 감염; 주황색 = 치료 기간; 파란색 = 화합물 제거 단계; 노란색 = 면역 억제; 라일락 = 재발. (B) 샤가스병 만성 모델에서 치료 효능의 종단 평가. 왼쪽 패널: BALB/c 마우스의 복부 BLI (i) 20mg/kg에서 (ii) 포사코나졸(Posa)로 20일 동안 치료하지 않거나 처리함; (iii) 100mg/kg의 벤즈니다졸(BZ) 및 (iv) 10mg/kg의 BZ(n = 6/그룹). 모든 치료는 하루에 한 번 gavage로 경구 투여되었습니다. 오른쪽 그래프: ventral and dorsal total flux raw data의 합계. 키 : 약 플라스크 : 치료 시작 (102dpi); 주황색 막대: 처리 끝(121dpi); 노란색 막대 및 주사기 아이콘: 사이클로포스파마이드 주사(131-142일). 주황색 점: 생체 외 절차로 분석된 마우스. ! 마우스는 마취 중에 사망했습니다.  쥐는 복부 이상을 표시합니다. 히트맵 스케일(로그10)은 낮은 수준(3 × 10,5, 파란색)에서 높음(1 × 10,7, 빨간색)까지 광도 단위의 생물 발광 강도를 나타냅니다. (C) 조직 내 T. cruzi tropism의 생체 외 분석. 100mg/kg에서 Posa 및 BZ로 처리한 후 면역억제된 in vivo BLI 음성 마우스 또는 10mg/kg 그룹에서 비처리 및 BZ에서 가장 낮은 신호를 가진 마우스에서 절제된 장기의 생물 발광 검출. 플레이트 분포 키는 그림 하단에 표시됩니다(BioRender.com: ZY26LG8AOF로 생성). 래디언스 스케일은 in vivo 패널과 동일합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
쥐는 복부 이상을 표시합니다. 히트맵 스케일(로그10)은 낮은 수준(3 × 10,5, 파란색)에서 높음(1 × 10,7, 빨간색)까지 광도 단위의 생물 발광 강도를 나타냅니다. (C) 조직 내 T. cruzi tropism의 생체 외 분석. 100mg/kg에서 Posa 및 BZ로 처리한 후 면역억제된 in vivo BLI 음성 마우스 또는 10mg/kg 그룹에서 비처리 및 BZ에서 가장 낮은 신호를 가진 마우스에서 절제된 장기의 생물 발광 검출. 플레이트 분포 키는 그림 하단에 표시됩니다(BioRender.com: ZY26LG8AOF로 생성). 래디언스 스케일은 in vivo 패널과 동일합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
100mg/kg에서 BZ로 처리하면 생물 발광이 122dpi에서 임계값 수준(93.87% ± 2.14%)으로 감소하고 실험이 끝날 때까지 계속되었습니다. 체외 분석을 고려할 때, BZ는 면역 억제 및 내부 장기를 검사한 후에도 생체 발광 신호가 반환되지 않았기 때문에 100%(6/6 마우스)의 치료율을 달성했습니다. 그것은 재발이 없다는 것을 의미합니다. 그럼에도 불구하고, 더 낮은 농도의 BZ 처리 요법은 생물 발광의 약간의 감소(85.95% ± 18.43%)를 가져왔지만, 마우스가 모든 후속 시점에서 감지 가능한 생물 발광 신호 병소를 계속 보였기 때문에 치료법은 없었습니다. 따라서, 이 모델은 비효율적인 치료(포사코나졸 및 벤즈니다졸을 사용한 차선의 치료)와 효과적인 치료(벤즈니다졸을 사용한 최적의 투여 및 치료 기간) 간의 정량적 구별을 허용합니다.
보충 그림 1: 리포터 유전자 mNeonGreen 형광 측정에 의한 루시페라아제의 T. cruzi 집단 발현의 감염 전 분석. CL Brener Luc::Neon 기생충에 의해 구성적으로 발현되는 mNeonGreen 형광 단백질의 유세포 분석. mNeonGreen 형광 강도(X축)에 의한 기생충 수(Y축)의 정규화된 히스토그램. 내부 범례는 분석된 균주 및 형태, 형광 중앙값 및 형광 집단의 백분율을 보여줍니다. 게이트 라인은 CL Brener 야생형(WT) 변형에 의해 비형광 제어로 정의됩니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 표 1: BLI 측정에서 분석 표의 예. 그림 4B에 표시된 대표 결과에 사용된 급성 모델에서 감염 후 19일째의 생물발광 이미징 정량화에서 얻은 원시 데이터. 그룹 설명: 감염되지 않은 마우스로 대조군(n = 3/그룹); 치료되지 않은 감염된 마우스로서의 차량; 20일 동안 20mg/kg에서 포사코나졸(Posa); 20 일 동안 100 mg / kg에서 벤즈니다졸 (BZ); 100일 동안 치료된 5mg/kg의 BZ(n = 6/그룹). 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
생물 발광 이미징은 전자기 방사선의 가시광선 및 적외선 스펙트럼을 사용하여 보고서 유전자를 검출할 수 있는 획기적인 방법입니다. 따라서 표본35을 추적하기 위해 방사성 표지 마커가 필요하지 않습니다. BLI는 설치류 모델 및 기타 작은 종에 적합합니다. 전임상 연구에 매우 유용한데, 이는 더 안전하고 여러 번의 이미지 라운드를 허용하여 동물의 불편함을 최소화하기 때문입니다. 게다가, 생체 내 이미징은 생물 발광, 형광 및 양전자 방출 단층 촬영(36)과 같은 기타 기술을 결합할 수 있기 때문에 매우 유연합니다.
광학 이미징은 흡수 및 산란과 같은 광학적 물리적 특성에 의해 지배됩니다. 모든 조직은 독특한 파장의 빛을 다르게 흡수하고 산란시킨다37. 한 가지 중요한 단계는 화학 반응에 의해 생성된 빛의 방출 파장을 고려하지 않고 리포터 유전자를 선택하는 것입니다. 리포터 유전자 발현 수준은 생물 발광 분석에서 in vitro에서 높을 수 있지만, in vivo 설정으로 진행할 때 동일한 수준의 발현을 달성하지 못할 수 있습니다. 이 프로토콜에서는 617nm에서 빛을 방출하는 트리파노소마티드9에 대해 적색편이 Photinus pyralis luciferase (PpyRE9H)38 코돈 최적화 버전을 사용했으며, 이는 in vivo studies39에 가장 적합한 것 중 하나입니다. 600nm보다 긴 파장은 신체 내인성 발색단, 특히 헤모글로빈과 멜라닌에 의해 덜 흡수되고 산란됩니다. 따라서, 적색광은 수 센티미터의 조직을 통해 투과될 수 있어, 광자가 내장 조직(39,40) 내부에서도 CCD 카메라에 도달할 수 있게 한다.
이미징 설정에서 우려되는 한 가지 영역은 기능과 효과에 대한 포괄적인 이해가 부족하다는 것입니다. 전처리 기술인 비닝(Binning)은 인접한 검출기에서 획득한 정보를 더 큰 픽셀로 결합합니다. 이 프로세스는 신호 대 잡음 비율을 향상시켜 배경 소음을 줄이고 감도를 향상시킵니다. 그러나, 이는 공간 해상도 정확도를 감소시켜, 픽셀화된 이미지(41,42)를 생성한다. 이러한 절충은 이미징 전략에서 중요한 고려 사항입니다.
Chagas disease34에 대한 Target Product Profile 및 Target Candidate Profile을 기반으로 하는 개념 증명 연구는 T. cruzi 를 검출하기 위한 민감도에 중점을 두고 있으며 신약 후보가 멸균 치료(여러 번의 면역 억제 라운드 후 재발 부족으로 나타남)를 달성할 수 있는지 확인하는 데 도움이 됩니다. 따라서 이미지를 과포화하지 않고 가장 높은 비닝 팩터를 사용하여 BLI를 실행합니다. 이미지가 과포화되면 더 낮은 비닝 팩터를 사용하여 새로운 획득이 수행됩니다. 해석 중에는 다른 비닝이 필요한 이미지에 수학적 보정이 적용됩니다. 이렇게 하면 최종 데이터가 동일한 범주화를 사용하여 표시되어야 합니다. 표 1 은 동일한 이미지와 ROI에 고유한 비닝 팩터를 적용했을 때 얻은 다양한 값을 보여줍니다.
표 1: 비닝 설정이 BLI 정량화에 미치는 영향. 급성 모델(d13) 및 만성 모델(d118)의 이미지에 대한 세 가지 ROI의 정량화, 서로 다른 비닝 요인에서 분석됨. 이 표를 다운로드하려면 여기를 클릭하십시오.
현재 임상에서 샤가스병의 시나리오로 인해 약물 발견 노력은 기생충(기생충학적 치료)을 완전히 제거하는 것을 목표로 합니다27,34. 따라서 in vivo 전임상 프로토콜은 BLI 기술적 감수성의 한계를 극복하는 접근법을 포함하고 있습니다. 접근법 중 하나는 기생충 부하를 조절하는 면역 반응을 줄이기 위해 생쥐를 사이클로포스파마이드로 치료하는 것입니다. 또 다른 전략은 조직의 깊이를 줄이고 카메라로 가는 빛의 경로를 방해하는 근육, 피부 및 털 층을 제거하는 것입니다. ex vivo 절차를 통해 작은 생물 발광 반점을 감지하여 Posa로 처리한 마우스의 생체 외 결과인 그림 5C와 같이 생체 내 BLI 임계값 미만의 기생충 병소를 드러낼 수 있습니다.
모델 자체와 감염 역학을 평가하기 위한 파일럿 실험을 설계하는 것은 항기생충 약물 효능 평가를 위한 정확한 실험을 수립하는 데 중요합니다. 따라서 연구자는 적절한 BLI 설정과 감염 시간 경과를 미리 정의할 수 있습니다. 탐색적 실험에서 획득 설정을 정의하는 데 도움이 될 수 있는 도구 중 하나는 '자동 노출'입니다. 이 도구를 사용하여 연구원은 가능한 최상의 이미지를 얻기 위해 세 가지 설정(노출 시간, 비닝 및 F/스톱)의 우선 순위를 설정합니다. 특히, 연구자는 CCD 카메라의 다이내믹 레인지 내에서 이미지가 과포화나 노출 부족 없이 획득되도록 해야 하며, 이는 스케일의 최소 및 최대 제한과 자동 노출 기능(메뉴 편집 > 기본 설정 > 탭 획득 > 탭 자동 노출)을 통해 확인할 수 있습니다.). 이 프로토콜에서는 카메라 조리개를 최대값(F/Stop: 1)으로 설정하고 급성 및 만성 모델에 대해 서로 다른 노출 시간과 비닝 계수를 정의했습니다. 이러한 설정은 서로 다른 이미지 라운드를 동시에 수행할 수 있는 시간 예측 가능성을 제공합니다. 리포터 분석법이 효소 반응을 기반으로 한다는 점을 고려할 때, 마우스로의 기질의 생체 분포와 루시페라아제 역학은 모두 생물 발광 신호에 영향을 미치므로 감염 정량화에 영향을 미칩니다(그림 1B). 결과적으로, 효소 역학의 다양한 순간에 이미지를 획득하면 설명하거나 수정할 수 없는 데이터 변동성이 발생하고 총 플럭스(광자/초) 또는 광도(광자/초/cm2/스테라디안) 계산에 영향을 미칩니다. 게다가, T. cruzi 감염은 마우스에서 동적 공간 위치 지정(다양한 영역과 조직, 깊이, 기생충 부하)을 표시합니다. 따라서 획득할 counts 값을 설정하면 다른 강력한 신호 소스가 정의된 자동 노출 기준을 충족하는 경우 더 약한 신호 소스(조직의 더 깊은 특정 지점에 있는 적은 수의 기생충)를 놓칠 수 있습니다.
Living Image 소프트웨어의 까다로운 기능 중 하나는 획득한 이미지를 자동 컬러 스케일로 표시하는 것입니다. 선택한 스케일 값에 따라 새로 획득한 이미지를 자동으로 표시하도록 스케일을 사전 설정하는 옵션은 없습니다(프로토콜 단계 6.2 참조). 이러한 상황으로 인해 연구자는 이미지를 선택한 최대 및 최소 값으로 하나씩 수동으로 변경해야 합니다. 결과적으로, 경험이 없고 잘 훈련되지 않은 사용자는 획득 세션 중에 적절한 판독값을 얻지 못하며, 데이터를 오도하거나 해당 시점에서 중요한 정보를 잃을 수 있습니다. 이를 위해서는 파일럿 실험이 유익합니다.
개념 증명 실험 설계에 대한 가장 일반적인 질문 중 하나는 처리 기간과 용량을 선택하는 방법입니다. 새로운 화학 물질의 경우, 이러한 매개변수는 일반적으로 약물 대사 및 약동학(DMPK)에 의해 생성된 데이터 및 효능에 대한 생체 내 테스트 전에 수행된 내약성 연구와 함께 체외에서 화합물 효능 및 선택성에 의해 정의됩니다. 요약하면, 세포 내 기생충을 선택적으로 죽일 수 있는 화합물을 식별한 후 첫 번째 ADME 실험(흡수, 분포, 대사 및 배설)을 체외에서 수행하여 화합물의 수용성, 세포 투과성 및 대사 안정성을 추정합니다. 화합물이 in vitro 특성(일반적으로 표적 후보 프로필에 정의됨)의 양호한 균형을 보이는 경우, 이러한 후보 물질은 건강한 마우스를 대상으로 한 생체 내 약동학(PK) 연구로 진행되며, 이 연구는 혈액 내에서(그리고 아마도 조직에서도) 화합물 노출을 개략적으로 설명하고 다양한 용량 수준에서의 내약성에 대한 일반적인 아이디어를 제공합니다17, 34,43. 이상적으로, 대부분의 전염병에서 PK 평가의 목표는 충분히 오랜 기간 동안 EC50/EC90 농도(각각 기생충의 50% 또는 90%의 성장을 억제하거나 최소한 억제하는 유효 농도)보다 높은 유리 혈장 농도(혈장 단백질 결합에 대해 보정됨)에 도달할 수 있는 타당성을 결정하는 것입니다. 특정 용량 수준에서 충분한 노출이 이루어지면 이 요법은 Chagas BLI 모델을 사용하여 효능 연구 중에 사용할 수 있습니다. 약물 재배치 연구의 경우 in vitro 및 in vivo PK 데이터를 사용할 수 있어야 합니다. 약물 재현을 위한 좋은 시작은 PubChem45와 같은 화학 데이터베이스이며, 이는 allometric scaling46을 사용하여 마우스로 변환하여 테스트할 안전하고 무독성 치료 요법을 추정할 수 있는 인식된 데이터를 제공합니다. 그러나 항상 그런 것은 아닙니다. PK 연구는 여전히 학계에서 간과되는 분야이며 PK 결과를 발표하는 제약 회사는 거의 없습니다. 약물 발견 과학계는 약물 효능 분석(약력학)과 함께 in vivo PK 평가를 포함할 것을 권장합니다47. 따라서 전임상 이미징은 화합물 측정과 동시에 호환되며, 이러한 관련 접근 방식은 데이터 견고성을 향상시킵니다.
또한 쥐의 취급, 체중 및 건강 상태는 전체 실험 전반에 걸쳐 모니터링됩니다. 구부정, 떨림, 균형 상실, 움직이기를 꺼리는 태도, 먹이거나 마시는 것을 꺼리는 태도, 엎드리는 태도 또는 그룹 또는 개별 마우스 상태에 존재하는 기타 이상과 같은 독성 및 부작용의 징후는 전임상 연구에 등록하고 보고해야 합니다. 광학 이미징의 목표 중 하나는 동물의 복지를 보장하는 것입니다. 따라서, 인도적인 종점은 'Grimace scale48'에 기술된 통증 징후가 있는 마우스에 적용되어야 합니다. 또한, BLI 획득 중에는 마우스의 무게를 매주 측정했으며, 약물 투여 및 CTX 치료 중에는 더 자주 체중을 측정했습니다. 동물 복지 규정에 따라 체중이 20% 이상 감소한 쥐는 즉시 인도적으로 안락사시켜야 합니다.
T. cruzi 생물 발광 모델은 현재 샤가스병에 대한 새로운 치료법의 발견 및 개발을 위한 최첨단 실험 모델입니다. T. cruzi 감염 및 샤가스병49의 주요 특징을 복제하는 모델로, 기생충혈증을 실시간으로 모니터링하고 알려진 작용 방식과 관련된 다양한 효능 프로필을 가진 화합물을 구별할 수 있습니다. BLI는 감염된 조직을 식별하는 데 있어 적극성을 향상시키는 기술입니다. 이를 통해 감염된 조직의 정확한 선택이 T. cruzi 연구50,51에서 이미 적용된 모든 고전적인 방법을 포함하여 광범위한 접근법에서 사용될 수 있습니다. 또한 연구원들은 최첨단 기술을 탐색하고 새로운 기술을 개발할 수 있습니다33. 또한 BLI는 3R 원칙10,35에 따라 동물의 복지 향상과 보다 합리적인 사용을 동시에 제공합니다.
소외된 열대성 질병에 초점을 맞춘 여러 연구 그룹은 생체 내 이미징 장치를 사용할 수 없는 국가에 배치되어 있습니다. 현재의 상황을 극복하기 위해 글로벌 바이오이미징(Global BioImaging) 및 관련 컨소시엄과 같은 새로운 국제 네트워크는 이미징 핵심 시설에 대한 개방적인 접근을 제공하고 직원 및 이미징 과학자의 교육을 개선하기 위한 조치를 촉진합니다52,53. 이와 같은 친근한 사용자 프로토콜과 함께 이러한 이니셔티브는 모든 연구자에게 고급 기술을 민주화할 수 있는 조건을 제공할 수 있습니다. 전임상 약물 발견에서 이 방법을 구현하면 임상 결과의 확실한 효능 판독 및 예측 가치를 제공하여 샤가스병에 대한 약물 발견을 촉진할 수 있습니다.
공개
저자는 선언할 이해 상충이 없습니다.
감사의 말
저자는 약물 효능 분석에 대한 BLI 교육 및 지원을 제공한 Amanda Franscisco, John Kelly 및 Fanny Escudié, 기생충을 제공한 John Kelly와 Simone Calderano, 동물 연구를 지원한 Gabriel Padilla에게 감사를 표합니다. A.C.S는 London School of Hygiene and Tropical Medicine(영국)에서 교육을 받기 위해 CAPES PSDE 장학금을 받았습니다. 저자들은 또한 IVIS Spectrum 장비 분석에 대한 기술 지원을 제공한 상파울루 대학교(University of Sao Paulo)의 핵심 과학 연구 시설(CEFAP-USP)의 유세포 분석 및 이미징 연구(FLUIR) 플랫폼과 특정 병원체가 없는 마우스의 품질 관리를 위한 실험 후 분석을 위해 유전학 및 위생 제어 ICB-USP 연구소에 감사를 표했습니다. 이 프로젝트는 DNDi의 자금 지원을 받았습니다. DNDi는 2003년 창립 이래 모든 DNDi 활동에 자금을 제공해 준 공공 및 민간 기부자들에게 감사의 뜻을 전합니다. DNDi의 전체 기부자 목록은 https://dndi.org/about/donors/ 에서 확인할 수 있습니다.
자료
| Name | Company | Catalog Number | Comments |
| BD LSRFortessa™ X-20 Cell Analyzer | BD Biosciences | ||
| Weighing Balance (animal facility) | Available from several suppliers | ||
| IVIS Spectrum In Vivo Imaging System | Revvity (former PerkinElmer) | ||
| FlowJ Software v10.7.1 | BD Biosciences | ||
| Living Image Software for Spectrum v4.7.1 | Revvity (former PerkinElmer) | License Free Analysis Software called 'Aura Imaging' could be used for the most basic features provided by Spectral Instruments Imaging (Bruker company) (https://spectralinvivo.com/software/) | |
| Microsoft Office software | Microsoft | ||
| GraphPad Prism v8.4.0 | GraphPad Software Inc. | ||
| DMEM Low Glucose | Vitrocell | D0025 | |
| Sodium bicarbonate | Sigma-Aldrich | S5761-500G | |
| Foetal Bovine Serum (FBS) | Gibco | 16000-044 | |
| Penicillin-Streptomycin | Gibco | 15140-122 | |
| Trypsin 0.5% EDTA | Gibco | 25300-062 | |
| LIT medium | In house | ||
| Hygromycin B (50 mg/mL) | Gibco | 10687010 | |
| Grace′s Insect Medium | Sigma-Aldrich | G9771 | |
| HEPES | Sigma-Aldrich | 54457 | |
| IVISBrite d-luciferin potassium salt | Revvity (former PerkinElmer) | 122799 | Also could be used: VivoGlo Luciferin, in vivo grade (Promega/P1043); D-Luciferin, Monopotassium Salt (Thermo Scientific/88293) or PierceD-Luciferin, Monosodium* Salt (Thermo Scientific/88291); D-Luciferin, Potassium Salt (GoldBio/LUCK or eLUCK); D-Luciferin, Sodium* Salt (GoldBio/LUCNA or eLUCNA) *Sodium or potassium salt differences relies minimal chances on solubility, however do not affect in vivo performance. |
| DPBS | Gibco | 21600-044 | |
| Cyclophosphamide (CTX) | Sigma-Aldrich | C0768-5g | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D5879 | |
| (Hydroxypropyl)methyl cellulose (HPMC) | Sigma-Aldrich | 09963-25G | |
| Benzyl alcohol | Sigma-Aldrich | 402834 | |
| Tween 80 | Sigma-Aldrich | P1754-1L | |
| Benznidazole | ELEA | ||
| Posaconazole (Noxafil commercial formulation) | Schering-Phough | ||
| Giemsa | Available from several suppliers | ||
| gavage needle (stainless-steel straight) - 22GA | Aton | CA2003 | |
| 1 mL Syringe and 31G needle | Available from several suppliers | ||
| 1 mL Syringe and removable 26G needle | Available from several suppliers | ||
| 1 mL Syringe and removable 24G X¾ needle | Available from several suppliers | ||
| Sterile Syringe Filter 0.2 µm | Available from several suppliers | ||
| A4 Matte Black paper 120gr or thicker | Paper Color/ Canson (Available from several suppliers) | ||
| aluminum foil | Available from several suppliers | ||
| Neubauer chamber | Available from several suppliers |
참고문헌
- WHO fact sheet. Chagas disease (also known as American trypanosomiasis). WHO, World Health Organization. , Available from: https://www.who.int/news-room/fact-sheets/detail/chagas-disease-(american-trypanosomiasis) (2023).
- Lee, B. Y., Bacon, K. M., Bottazzi, M. E., Hotez, P. J. Global economic burden of Chagas disease: a computational simulation model. Lancet Infect Dis. 13 (4), 342-348 (2013).
- Bern, C. Chagas' disease. N Engl J Med. 373 (5), 456-466 (2015).
- Shikanai-Yasuda, M. A., Carvalho, N. B. Oral transmission of Chagas disease. Clin Infect Dis. 54 (6), 845-852 (2012).
- Lidani, K. C. F., et al. Chagas disease: From discovery to a worldwide health problem. Front Public Health. 7, 166(2019).
- Perez-Molina, J. A., Molina, I. Chagas disease. Lancet. 391 (10115), 82-94 (2018).
- Field, M. C., et al. Anti-trypanosomatid drug discovery: An ongoing challenge and a continuing need. Nat Rev Microbiol. 15 (7), 447(2017).
- Kratz, J. M. Drug discovery for chagas disease: A viewpoint. Acta Trop. 198, 105107(2019).
- McLatchie, A. P., et al. Highly sensitive in vivo imaging of Trypanosoma brucei expressing 'red-shifted' luciferase. PLoS Negl Trop Dis. 7 (11), e2571(2013).
- Lewis, M. D., Francisco, A. F., Taylor, M. C., Kelly, J. M. A new experimental model for assessing drug efficacy against Trypanosoma cruzi infection based on highly sensitive in vivo imaging. J Biomol Screen. 20 (1), 36-43 (2015).
- Costa, F. C., et al. Expanding the toolbox for Trypanosoma cruzi: A parasite line incorporating a bioluminescence-fluorescence dual reporter and streamlined CRISPR/Cas9 functionality for rapid in vivo localisation and phenotyping. PLoS Negl Trop Dis. 12 (4), e0006388(2018).
- Lewis, M. D., et al. Bioluminescence imaging of chronic Trypanosoma cruzi infections reveals tissue-specific parasite dynamics and heart disease in the absence of locally persistent infection. Cell Microbiol. 16 (9), 1285-1300 (2014).
- Francisco, A. F., et al. Limited ability of posaconazole to cure both acute and chronic Trypanosoma cruzi infections revealed by highly sensitive in vivo imaging. Antimicrob Agents Chemother. 59 (8), 4653-4661 (2015).
- du Sert, N. P., et al. The arrive guidelines 2.0: Updated guidelines for reporting animal research. PLoS Biol. 18 (7), e3000410(2020).
- Turner, P. V., Brabb, T., Pekow, C., Vasbinder, M. A. Administration of substances to laboratory animals: routes of administration and factors to consider. J Am Assoc Lab Anim Sci. 50 (5), 600-613 (2011).
- Turner, P. V., Pekow, C., Vasbinder, M. A., Brabb, T. Administration of substances to laboratory animals: equipment considerations, vehicle selection, and solute preparation. J Am Assoc Lab Anim Sci. 50 (5), 614-627 (2011).
- Francisco, A. F., et al. Nitroheterocyclic drugs cure experimental Trypanosoma cruzi infections more effectively in the chronic stage than in the acute stage. Sci Rep. 6, 35351(2016).
- Moraes, C. B., et al. Nitroheterocyclic compounds are more efficacious than CYP51 inhibitors against Trypanosoma cruzi: implications for Chagas disease drug discovery and development. Sci Rep. 4, 4703(2014).
- Shaner, N. C., et al. A bright monomeric green fluorescent protein derived from Branchiostoma lanceolatum. Nat Methods. 10 (5), 407-409 (2013).
- de Araújo-Jorge, T. C., de Castro, S. L. Chagas Disease: Manual for Animal Experimentation. , FIOCRUZ Publisher. Rio de Janeiro. (2000).
- JoVE. JoVE Science Education Database. Anesthesia Induction and Maintenance. JoVE. , (2023).
- Taylor, M. C., et al. Exploiting genetically modified dual-reporter strains to monitor experimental Trypanosoma cruzi infections and host-parasite interactions. Methods Mol Biol. 1955, 147-163 (2019).
- Keyaerts, M., et al. Inhibition of firefly luciferase by general anesthetics: effect on in vitro and in vivo bioluminescence imaging. PLoS One. 7 (1), e30061(2012).
- Jiron, J. M., et al. Comparison of isoflurane, ketamine-dexmedetomidine, and ketamine-xylazine for general anesthesia during oral Procedures in rice rats (Oryzomys palustris). J Am Assoc Lab Anim Sci. 58 (1), 40-49 (2019).
- GoldBio. GoldBio Luciferin In Vivo Handbook - a detailed method for Luciferin preparation and administration for model animals. GoldBio Protocol. , Available from: https://goldbio.com/documents/1068/Luciferin%20in%20vivo%20handbook.pdf (2013).
- Revity. Preparation of IVISbriteTM D-Luciferin for in vitro and in vivo bioluminescent assays. Revvity Standard Operate Procedure (Tech Notes). , Available from: https://resources.perkinelmer.com/lab-solutions/resources/docs/SOP_LuciferinPrep_InVitroInVivo_BLI-Assays.pdf (2023).
- Chatelain, E., Scandale, I. Animal models of Chagas disease and their translational value to drug development). Expert Opin Drug Discov. 15 (12), 1381-1402 (2020).
- Khare, S., et al. Antitrypanosomal treatment with benznidazole is superior to posaconazole regimens in mouse models of Chagas disease. Antimicrob Agents Chemother. 59 (10), 6385-6394 (2015).
- Bustamante, J. M., Craft, J. M., Crowe, B. D., Ketchie, S. A., Tarleton, R. L. New, combined, and reduced dosing treatment protocols cure Trypanosoma cruzi infection in mice. J Infect Dis. 209 (1), 150-162 (2014).
- Molina, I., et al. Randomized trial of posaconazole and benznidazole for chronic Chagas' disease. N Engl J Med. 370 (20), 1899-1908 (2014).
- JoVE. Science Education Database. Compound Administration II. JoVE. , (2023).
- Pukhalsky, A. L., Toptygina, A. P., Viktorov, V. V. Immunosuppressive action of cyclophosphamide in mice: Contribution of some factors to determination of strain differences. Int J Immunopharmacol. 15 (4), 509-514 (1993).
- Francisco, A. F., et al. Comparing in vivo bioluminescence imaging and the Multi-Cruzi immunoassay platform to develop improved Chagas disease diagnostic procedures and biomarkers for monitoring parasitological cure. PLoS Negl Trop Dis. 16 (10), e0010827(2022).
- Kratz, J. M., et al. The translational challenge in Chagas disease drug development. Mem Inst Oswaldo Cruz. 117, e200501(2022).
- Youn, H., Hong, K. -J. In vivo noninvasive small animal molecular imaging. Osong Public Health Res Perspect. 3 (1), 48-59 (2012).
- Refaat, A., et al. In vivo fluorescence imaging: success in preclinical imaging paves the way for clinical applications. J Nanobiotechnology. 20 (1), 450(2022).
- Pirovano, G., Roberts, S., Kossatz, S., Reiner, T. Optical imaging modalities: Principles and applications in preclinical research and clinical settings. J Nucl Med. 61 (10), 1419-1427 (2020).
- Branchini, B. R., Southworth, T. L., Khattak, N. F., Michelini, E., Roda, A. Red- and green-emitting firefly luciferase mutants for bioluminescent reporter applications. Anal Biochem. 345 (1), 140-148 (2005).
- Zhao, H., et al. Emission spectra of bioluminescent reporters and interaction with mammalian tissue determine the sensitivity of detection in vivo. J Biomed Opt. 10 (4), 041210(2005).
- O'Neill, K., Lyons, S. K., Gallagher, W. M., Curran, K. M., Byrne, A. T. Bioluminescent imaging: a critical tool in pre-clinical oncology research. J Pathol. 220 (3), 317-327 (2010).
- Mennel, L., et al. A photosensor employing data-driven binning for ultrafast image recognition. Sci Rep. 12 (1), 14441(2022).
- Yoo, Y., Im, J., Paik, J. Low-light image enhancement using adaptive digital pixel binning. Sensors. 15 (7), 14917-14931 (2015).
- Moraes, C. B., et al. Accelerating drug discovery efforts for trypanosomatidic infections using an integrated transnational academic drug discovery platform. SLAS Discov. 24 (3), 346-361 (2019).
- Sebaugh, J. L. Guidelines for accurate EC50/IC50 estimation. Pharm Stat. 10 (2), 128-134 (2011).
- Kim, S., et al. PubChem 2023 update. Nucleic Acids Res. 51, D1 D1373-D1380 (2023).
- Sharma, V., McNeill, J. H. To scale or not to scale: the principles of dose extrapolation. Br J Pharmacol. 157 (6), 907-921 (2009).
- Barrow, J. C., Lindsley, C. W. The importance of PK-PD. J Med Chem. 66 (7), 4273-4274 (2023).
- Langford, D. J., et al. Coding of facial expressions of pain in the laboratory mouse. Nat Methods. 7 (6), 447-449 (2010).
- Lewis, M. D., Kelly, J. M. Putting infection dynamics at the heart of Chagas disease. Trends Parasitol. 32 (11), 899-911 (2016).
- Brener, Z. Therapeutic activity and criterion of cure on mice experimentally infected with Trypanosoma cruzi. Rev Inst Med Trop Sao Paulo. 4, 389-396 (1962).
- Cummings, K. L., Tarleton, R. L. Rapid quantitation of Trypanosoma cruzi in host tissue by real-time PCR. Mol Biochem Parasitol. 129 (1), 53-59 (2003).
- Keppler, A., Grebnev, G., Reis, Y. Global BioImaging. , . (2024).
- Pfander, C., et al. Euro-BioImaging - Interdisciplinary research infrastructure bringing together communities and imaging facilities to support excellent research. iScience. 25 (2), 103800(2022).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유