Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Nörogelişimsel Bozuklukla İlişkili Deubikitile Edici Enzimlerin İn Vitro Ubikitin Zincir Bölünme Testi ile Enzimatik Aktivitesinin Ölçülmesi
Bu Makalede
Özet
Bu protokol, rekombinant protein saflaştırmasını ubikitin zincir bölünme deneyleri ile birleştirerek nörogelişimsel bozukluklarla ilişkili genetik varyasyonun deubikitile edici enzim aktivitesi üzerindeki etkisinin nasıl ölçüleceğini açıklar.
Özet
Nörogelişimsel bozukluklar (NDD'ler) sinir sistemi fonksiyonundaki bozukluklarla ilişkilidir, ancak genellikle moleküler düzeyde tam olarak anlaşılamamıştır. Tek genlerin neden olduğu ayrık bozukluklar, atipik nörogelişimi yönlendiren mekanizmaları araştırmak için modeller sağlar. Deubikitile edici enzim (DUB) ailesi proteinlerini kodlayan genlerin varyantları birkaç NDD ile ilişkilidir, ancak bu gen varyantları tarafından yönlendirilen bozuklukların patojenik mekanizmalarının belirlenmesine ihtiyaç vardır. Gen varyantlarının DUB aktivitesi üzerindeki etkisi, substrattan bağımsız bir in vitro ubikitin bölünme testi kullanılarak deneysel olarak belirlenebilir. Bu tahlil, katalitik aktiviteyi doğrudan ölçmek için aşağı akış substratları hakkında bilgi gerektirmez. Burada, gen varyantlarının enzimatik aktivite üzerindeki etkisini belirleme protokolü, X'e bağlı zihinsel engellilik 105'te (XLID105) mutasyona uğrayan DUB Ubiquitin Spesifik Proteaz 27, X'e bağlı (USP27X) kullanılarak modellenmiştir. Bu deneysel boru hattı, DUB genlerindeki varyantlar tarafından yönlendirilen nörogelişimsel bozuklukların altında yatan mekanizmaları açıklığa kavuşturmak için kullanılabilir.
Giriş
Nörogelişimsel bozukluklar (NDD'ler), atipik sinir sistemi gelişimini yönlendiren çevresel veya genetik belirleyicileri olan çeşitli etiyolojilerden kaynaklanır1. Yeni nesil dizileme genetik testleri, ubikitin sistemi ile ilgili genlerde artan sayıda varyantı genetik NDD'lerle ilişkilendirmiştir2. Ubikuitin sistemi, lokalizasyon, stabilite, protein-protein etkileşimleri veya aktivite3 dahil olmak üzere hücresel davranıştaki değişiklikleri yönlendirmek için küçük protein değiştirici ubikuitinin protein substratlarındaki lizin kalıntılarına bağlanmasını katalize eder. Ubikitilasyona E1 aktive edici, E2 konjugasyon ve E3 ligaz enzimleri4 aracılık eder ve ubikitin'in protein substratlarından5 bölünmesini ve uzaklaştırılmasını katalize eden deubikitilasyon enzimlerinin (DUB'ler) aktivitesi ile geri dönüşümlüdür. Ubikuitin, yedi lizin kalıntısından (K6, K11, K27, K29, K33, K48, K63) herhangi biri veya ubikuitinin M1 kalıntısı üzerinde oluşan bir monomer (monoubikitilasyon) veya polimerik zincirler (poliubikitilasyon) olarak substrata bağlanabilir. Bu farklı ubikitin zincir topolojileri ve bunların kombinasyonları, sinyal iletimi6 için anahtar olan bir hücresel kod oluşturur.
USP27X, USP7, USP9X, USP48, STAMBP, OTUD4, OTUD6B ve OTUD5 gibi DUB'lar NDD 2,7,8,9,10,11 ile ilişkilendirilmiştir. Çoğu NDD için, patogenezi yönlendiren moleküler mekanizmalar deneysel olarak tanımlanmamıştır. Son zamanlarda tanımlanan bozuklukları yönlendiren DUB'ların bazıları tam olarak anlaşılamamıştır ve genetik varyasyonun protein fonksiyonu üzerindeki etkisini değerlendirmek için kullanılabilecek bilinen hücresel okumalardan yoksundur. İn vitro, ubikitin zincir bölünme deneyleri, gen varyantlarının enzimatik aktivite12 üzerindeki etkisini ölçebilen substrattan bağımsız DUB aktivite okumaları olarak bu sınırlamanın üstesinden gelir.
İn vitro ubikitin bölünme testleri 1980'lerden beri kullanılmaktadır. Radyoaktif işaretli substratların kullanıldığı bu tahliller, Histon H2A13'ü deubikitilleme kapasitesi ile tanımlanan izopeptidaz ve ubikitini çeşitli kimyasal konjugatlardan hidrolize etme kabiliyeti ile tanımlanan ubikitin karboksil-terminal hidrolaz (UCH) dahil olmak üzere ilk DUB'ların keşfine izin verdi 14,15,16. Ayrıca, eritrositlerden ve iskelet kasından izopeptidaz T ve birkaç UCH'yi ve ubikitine özgü proteazları (UBP'ler) tanımlamak için radyoaktif işaretli poliubikitile edilmiş tam uzunlukta proteinler veya peptitler kullanıldı, 17,18,19,20. Tanımlanmış bir uzunluk ve bağlantı tipine (K48'e bağlı tetra-ubikitin) ubikitin zincirleri ilk olarak İzopeptidaz T21'in DUB aktivitesini ölçmek için kullanıldı. O zamandan beri, bu test mutasyon analizlerinde DUB aktivitesini ölçmek için altın standart haline geldi22,23. Bu testin rafine edilmesi şu anda elektroforez ve Coomassie mavisi, SYPRO turuncu, yakut ve gümüş leke gibi geleneksel jel lekeleri veya floresan veya immünoblotlama bazlı tespit12,24 yoluyla ubikitin bölünmesinin görselleştirilmesine izin vermektedir. Minimum zincir uzunluğu ve bağlantı özgüllüğü 25,26,27,28 gibi DUB aktivitesinin moleküler yönleri, fonksiyonel deneylerde farklı uzunluklarda ubikuitin zincirleri (örneğin, di-, tri-, tetra-ubikitin) ve bağlar (K6, K11, K27, K29, K33, K48, K63, doğrusal) kullanılarak açıklığa kavuşturulabilir. NDD ile ilişkili varyantlar, ubikitin zincir bağlantı tipine özgü11 olan DUB aktivite kusurlarına neden olabilir.
Saflaştırılmış rekombinant DUB proteinlerini kullanan bir di-ubikitin bölünme testi, NDD varyantlarının DUB aktivitesi üzerindeki etkisini doğrudan ölçebilir. NDD X'e bağlı zihinsel engellilik bozukluğunda mutasyona uğrayan USP27X 105 (XLID105)7,28 burada sunulan süreci modeller. Bu yaklaşım, mevcut ve bilinmeyen DUB ile ilişkili NDD'lerdeki gen varyantları tarafından DUB aktivitesinin nasıl bozulduğunun belirlenmesine izin verir.
Access restricted. Please log in or start a trial to view this content.
Protokol
Aşağıdaki protokol, yetkin hücrelerin farklı suşlarında eksprese edilen çeşitli afinite etiketleri kullanılarak rekombinant proteinler için uyarlanabilir. İfade edilen proteine bağlı olarak, kültürleme ve gece ekspresyon koşulları, OD600'ün ekspresyon indüksiyonu, ekspresyon süresi, ekspresyon sıcaklığı ve IPTG konsantrasyonunda optimizasyonunu gerektirebilir. Protokole genel bir bakış Şekil 1'de gösterilmiştir. Bu çalışmada kullanılan reaktiflerin ve ekipmanların detayları Malzeme Tablosunda listelenmiştir.
1. Yetkili Rosetta 2 E. coli hücrelerinin rekombinant GST-USP27X ekspresyon plazmidi ile dönüşümü
NOT: Bakteri kültürünün sterilitesini korumak için, ortam kaplarının bir Bunsen brülör alevi altında açık olduğu adımları gerçekleştirin. Optimum oksijen transferine izin vermek için, 19 mm ila 50 mm yörüngeye ve 200 rpm29 hıza sahip tezgah üstü sıcaklık kontrollü bir çalkalayıcıda bakteri kültürü çalkalaması gerçekleştirin.
- Kullanmadan hemen önce 20 μL kimyasal olarak yetkin Rosetta 2 E. coli hücrelerini buz üzerinde çözdürün. 1-10 ng pGEX6P1-USP27X ekspresyon plazmidi ekleyin (N-terminal Glutatyon-S-transferaz (GST)30 etiketli USP27X için kodlayan ve Ampisilin direnci içeren) ve buz üzerinde 5 dakika inkübe edin.
- Kuru bir banyoda 42 ° C'de 30 saniye boyunca ısı şoku. 2 dakika buz üzerinde inkübe edin.
- 80 μL oda sıcaklığında (RT) SOC ortamı ekleyin. 19 mm yörüngeli tezgah üstü sıcaklık kontrollü çalkalayıcıda 200 rpm dönüş ile 37 °C'de 60 dakika inkübe edin.
- 25 μg/L Kloramfenikol ve 50 μg/L Ampisilin ile desteklenmiş bir LB agar plakası üzerinde 50 μL kültür plakası. Sıcaklık kontrollü bir inkübatörde kapağı aşağı bakacak şekilde 37 °C'de 20 saat inkübe edin.
2. Ekspresyon plazmidinden rekombinant proteinin gece boyunca bakteri ekspresyonu
NOTLAR: Bakteri kültürünün sterilitesini korumak için, ortam kaplarının bir Bunsen brülör alevi altında açık olduğu adımları gerçekleştirin. Optimum oksijen transferine izin vermek için, 19 mm ila 50 mm yörüngeye ve 200 rpm29 hıza sahip tezgah üstü sıcaklık kontrollü bir çalkalayıcıda bakteri kültürü çalkalaması gerçekleştirin. Bir spektrofotometre kullanarak OD600 kültürünü ölçün.
- 2 L'lik şaşkın kültür şişesinde %0,4 gliserol içeren 1 L ultra saf suya 47,6 g TB Tozu ekleyerek 1 L Müthiş Et Suyu (TB) ortamı hazırlayın. Orta kısmı 30 dakika otoklavlayın ve RT'ye soğutun.
- Tek bir dönüştürülmüş bakteri kolonisi seçin ve 25 μg / L Kloramfenikol ve 50 μg / L Ampisilin ile desteklenmiş 10 mL steril LB ortamına ekleyin. 19 mm yörüngeli tezgah üstü sıcaklık kontrollü çalkalayıcıda 200 rpm dönüş ile 37 °C'de 20 saat inkübe edin.
- 25 μg/L Kloramfenikol ve 50 μg/L Ampisilin (başlangıç kültürünün ekspresyon kültürüne oranı 1:100) ile takviye edilmiş 1 L TB ortamına 10 mL gece boyunca kültür ekleyin. Kültür OD 600 0,5-0,6 arasında olana kadar 19 mm yörüngeli tezgah üstü sıcaklık kontrollü çalkalayıcıda200 rpm dönüşle 37 °C'de inkübe edin.
- Ekspresyon indüklemek için kültüre 50 μM IPTG ekleyin, 16 ° C'ye soğutun ve 200 rpm dönüşle 16 ° C'de 20 saat inkübe edin.
- ≥3.000 x g ve 4 ° C'de 20 dakika santrifüjleme yoluyla ekspresyon kültüründen pelet hücreleri. Peleti -80 °C'de en az 1 saat saklayın.
NOT: Bu noktada, deneme duraklatılabilir ve daha sonra (tercihen aynı hafta) yeniden başlatılabilir. Pelet -80 °C'de uzun süre saklanabilir.
3. Yerçekimi-akış afinite sütunu ile protein saflaştırması
NOT: Her saflaştırma için uygun reçine, bağlama, yıkama, elüsyon ve depolama tamponları, saflaştırılan rekombinant proteine bağlı olacaktır. SDS-PAGE tamponundaki hücre peleti, süpernatant, akış, yıkama fraksiyonları ve elüsyon fraksiyonlarından numuneler toplayın. Saflaştırmanın başarısını değerlendirmek için numuneler için SDS-PAGE ve Coomassie boyama yapın. 4 °C'de saflaştırma yapın ve fraksiyonları buz üzerinde tutun. Protein etiketlerinin bölünmesi, ilgili proteaza özgü bölünme bölgesini hedeflemek için uygun proteaz kullanılarak kolon üzerinde veya dışında gerçekleştirilebilir.
- Boş yerçekimi akış sütununu imbik standına sabitleyin ve glutatyon agaroz reçinesi ile doldurun. 1 L ekspresyon kültüründen toplanan bir hücre peletini saflaştırmak için 2-3 mL reçine kullanın.
- Sütunu bir reçine yatağı hacmi% 20 etanol ile yıkayın. Bir reçine yatağı hacmi MS500 tamponu (20 mM Tris pH 7.5, 500 mM NaCl, 0.5 mM TCEP) ile sütunu 3 kez yıkayın. Hücre peletini hazırlarken kurumayı önlemek için reçinenin tamponla kaplı kalması için sütunu durdurun.
- Hücre peletini 4 °C'de çözdürün. Çözülmüş pelete 30 mL MS500 tamponu (20 mM Tris pH 7.5, 500 mM NaCl, 0.5 mM TCEP, 60 mg lizozim ve bir proteaz inhibitör tableti) ekleyin. Nazik uçtan uca döndürme ile 4 ° C'de 30 dakika boyunca kireçlenin.
- Parçalanmış hücreleri, 50 mL'lik bir santrifüj tüpünde veya bir pipet ucundan dağıtıldığında lizat serbestçe akana kadar buz üzerinde metal bir beherde sonikleştirin. Süpernatanı temizlemek için 4 °C'de 30 dakika ve ≥20.000 x g'da santrifüjleyin.
NOT: Sonikatör ayarlarını ampirik olarak belirleyin. Sonikatörü, viskoz lizatı serbest akışlı ve şeffaf bir sıvıya indirgemek için toplam 120 s yeterli olacak şekilde ayarlayın. - Süpernatanı bir behere boşaltın ve temizlenmiş lizatı kolona yükleyin. Akışı toplarken yerçekimi akışıyla kolondan lizat geçirin. Toplanan akışın bulunduğu sütunu yükleyin ve sütundan geçirin.
- Kolonu en az iki reçine yatağı hacmi MS500 yıkama tamponu (20 mM Tris pH 7.5, 500 mM NaCl, 0.5 mM TCEP) ile 5 kez yıkayın. Yıkama akışını 5 mL'lik fraksiyonlar halinde toplayın. Protein varlığını görsel olarak kontrol etmek için her fraksiyondan 1 μL'yi 100 μL Bradford reaktifine ekleyin. Son yıkamada bağlanmamış protein artık mevcut olmayana kadar yıkayın ve gerekirse ek yıkama adımları ekleyin.
- MS500 elüsyon tamponunu (10 mM glutatyon ve 10 mM NaOH ile desteklenmiş MS500 tamponu) kolon boyunca çalıştırarak ve 5 mL elüsyon fraksiyonları toplayarak proteini geri kazanın. 100 μL Bradford reaktifine 1 μL elüat ekleyerek protein varlığını kontrol edin. Bradford reaktifi artık proteinlerin mevcut olduğunu göstermediğinde fraksiyonları toplamayı bırakın.
- Çökeltme ve santrifüjleme ile tampon değişimi gerçekleştirin. Elüata 2 hacim 4 M amonyum sülfat ekleyerek, bulanıklaşana kadar hafifçe ters çevirerek ve ardından 4 ° C'de 30 dakika ve ≥ 20.000 x g ve tekrar 5 dakika daha santrifüjleyerek proteini çökeltin. Her santrifüjlemeden sonra protein peletini bozmadan süpernatanı çıkarın.
- % 25 gliserol ile desteklenmiş proteini MS500'de yeniden çözün ve saklayın. Protein peletlerini veya proteini -80 °C'de depolama tamponunda saklayın.
4. İn vitro ubikitin zincir bölünme testi
NOT: Önceki raporlarda31 açıklanan veya ampirik olarak belirlenen DUB özgüllüğüne dayalı olarak ubikitin zincir uzunluğunu ve bağlantı tiplerini seçin. Gerekirse, bu protokol, tanımlanmış uzunluk ve bağlantı tipine sahip ticari olarak temin edilebilen ubikitin zincirlerinden oluşan bir panel üzerinde ilgilenilen vahşi tip DUB'un aktivitesini test etmek için kullanılabilir. Test27 için başlangıç noktaları olarak 375-750 ng'lik bir di-ubikitin zincir miktarı ve 1-2 μM'lik bir DUB konsantrasyonu kullanılabilir.
- 10x DUB aktivasyon tamponu hazırlayın (500 mM Tris-HCl pH 7.5, 500 mM NaCl ve 100 mM TCEP).
- Her DUB için her zaman noktası için, 1x DUB aktivasyon tamponunda (DUB karışımı) 10 μL toplam 2 μM saflaştırılmış GST-USP27X hazırlayın. Ana karışımları hazırlayın ve bunları zaman noktalarına bölün.
- DUB karışımını RT'de 10 dakika inkübe edin.
- Deubikitilasyon reaksiyonunun başlamasını önlemek için ubikitin zincirleri eklemeden önce 0 zamanına kadar 7 μL SDS-PAGE yükleme tamponu ekleyin.
- Her DUB için her bir zaman noktasına, 10 μL 1x DUB aktivasyon tamponunda seyreltilmiş 375 ng K-63 di-ubikitin zinciri ekleyin. Toplam hacim reaksiyon başına 20 μL'dir.
- Tüpleri 30 °C'de inkübe edin ve her zaman noktasını 7 μL SDS-PAGE yükleme tamponu ile durdurun.
- Seçilen zaman noktalarında mono-ubikuitin varlığındaki değişikliği analiz etmek için ubikuitin ve USP27X için% 4 -% 12 gradyan jel ve immünoblot 7,32 ile SDS-PAGE gerçekleştirin.
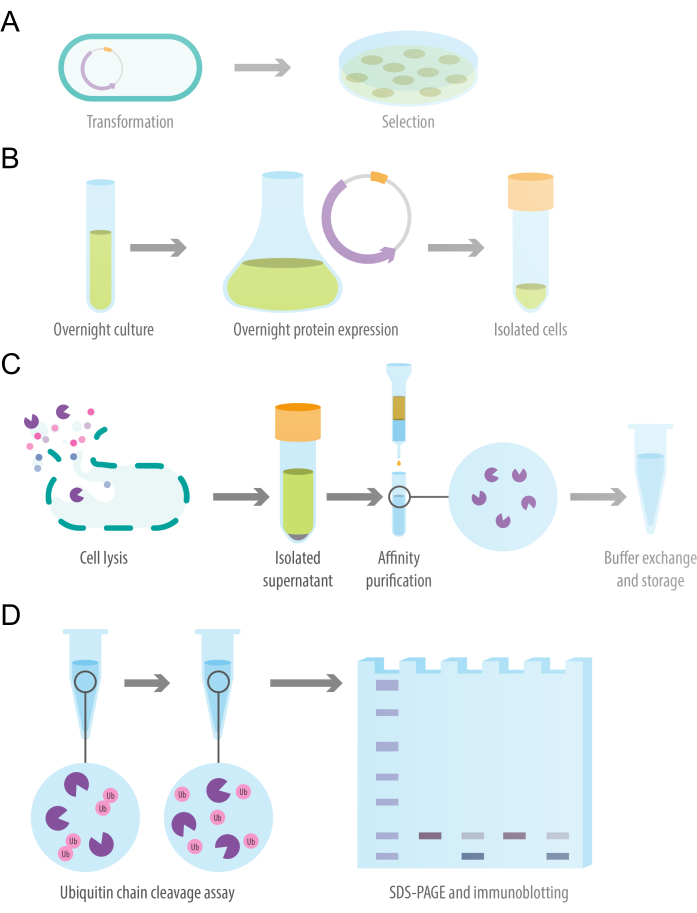
Şekil 1: Çalışma tasarımının şeması. (A) Yetkin E. coli hücrelerinin rekombinant protein ekspresyonu plazmidi ile dönüşümü. (B) Rekombinant deubikitilaz proteininin gece boyunca bakteriyel ekspresyonu. (C) Bir yerçekimi akış afinite sütunu kullanılarak rekombinant deubikitlazın protein saflaştırılması. (D) Deubikitile edici aktiviteyi değerlendirmek için in vitro ubikitin zincir bölünme testi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
XLID105 ile ilişkili varyantların USP27X katalitik aktivitesi üzerindeki etkisini belirlemek için, GST etiketli vahşi tip USP27X ve XLID105 ilişkili varyant F313V, Y381H ve S404N USP27X proteinleri bakterilerden saflaştırıldı. Bu varyantlar, USP27X'in USP katalitik alanı içinde bulunur (Şekil 2A). USP27X'in daha önce K63 ubikitin zincirlerini31 parçaladığı bildirildiğinden, vahşi tip USP27X ve XLID105 ilişkili var...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Bu makale, rekombinant USP27X DUB'ların ekspresyonu ve saflaştırılması için bir protokol ve vahşi tip USP27X ve NDD ile ilişkili varyant proteinlerin deubikitile edici aktivitesini karşılaştırmak için bir in vitro ubikitin zincir bölünme testi sunar. Bu tahlil, XLID105 ilişkili varyantların USP27X katalitik aktivitesinibozduğunu belirledi 7. Bu mekanik içgörü, XLID105 USP27X fonksiyonel bozulma bozukluğu olarak tanımlamamıza yardı...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarlar herhangi bir çıkar çatışması beyan etmemektedir.
Teşekkürler
Bu çalışma, Sanford Research başlangıç fonları tarafından FB'ye ve NIH hibe R01CA233700 MJS'ye finanse edildi. Sanat eseri Felipe G. Serrano (www.illustrative-science.com) tarafından yapılmıştır. GST-USP27X plazmidi için Dr. Greg Findlay'e (Dundee Üniversitesi) teşekkür ederiz.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Amersham Protran 0.45 NC 200 mm × 200 mm 25/PK | Cytiva | 10600041 | |
| Ammonium sulfate | Fisher Scientific | AC205872500 | |
| Ampicillin | Fisher Scientific | BP1760 25 | |
| Anti- Ubiquitin (Mouse monoclonal) | Biolegend | Cat# 646302, RRID:AB_1659269 | (WB: 1:1000) |
| Anti-GST (Sheep polyclonal) | MRC-PPU Reagents and Services | Cat# S902A Third bleed | (WB: 1:1000) https://mrcppureagents.dundee.ac.uk/ |
| Baffled Culture Flasks 2 L | Fisher Scientific | 10-042-5N | |
| Bradford Reagent | Millipore Sigma | B6916-500ML | |
| Chloramphenicol | Gold Biotechnology | C-105-25 | |
| Complete, Protease Inhibitor tablets | Millipore Sigma | 5056489001 | |
| Econo-Column 1.5 × 5 cm | Bio-Rad | 7371507 | |
| Eppendorf ThermoMixer F1.5 | Eppendorf | 5384000020 | |
| Excel | Microsoft | https://www.microsoft.com/en-us/microsoft-365/excel | |
| Glycerol | Genesee Scientific | 18-205 | |
| Illustrator | Adobe | https://www.adobe.com/products/illustrator.html | |
| Image Studio | LI-COR Biosciences | https://www.licor.com/bio/image-studio/ | |
| Inkscape | Inkscape | https://inkscape.org/ | |
| Invitrogen 4-12% NuPAGE 1mm 12 well gel | Thermo Fisher Scientific | NP0322BOX | |
| IPTG (Isopropyl-b-D-Thiogalactopyranoside) | Genesee Scientific | 20-109 | |
| IRDye 800CW Donkey anti-Goat IgG Secondary Antibody | LI-COR Biosciences | Cat# 926-32214 | (WB: 1:10000) |
| IRDye 800CW Donkey anti-Mouse IgG Secondary Antibody | LI-COR Biosciences | Cat# 926-32212 | (WB: 1:10000) |
| Isotemp Digital Dry Bath | Fisher Scientific | 88860022 | |
| K63 Di-Ubiquitin | South Bay Bio LLC | SBB-UP0072 | |
| LB Agar | Genesee Scientific | 11-119 | |
| LB Broth | Genesee Scientific | 11-118 | |
| Lysozyme | Gold Biotechnology | L-040-100 | |
| MaxQ 4000 Benchtop Orbital Shaker | Thermo Fisher Scientific | SHKE4000-7 | |
| MES-SDS Running Buffer | Boston Bioproducts Inc | BP-177 | |
| Mini Tube Rotator | Fisher Scientific | 88-861-051 | |
| NuPage LDS Sample buffer 4x | Thermo Fisher Scientific | NP0007 | |
| Odyssey Fc Imager | LI-COR Biosciences | 43214 | |
| PageRuler Plus Ladder | Thermo Fisher Scientific | 26620 | |
| pGEX6P1 human USP27X | MRC-PPU Reagents and Services | DU21193 | https://mrcppureagents.dundee.ac.uk/ |
| pGEX6P1 human USP27X F313V | Addgene | 225715 | Koch et at 2024 (PMID: 38182161) |
| pGEX6P1 human USP27X S404N | Addgene | 225717 | Koch et at 2024 (PMID: 38182161) |
| pGEX6P1 human USP27X Y381H | Addgene | 225716 | Koch et at 2024 (PMID: 38182161) |
| Pierce Glutathione Agarose | Thermo Fisher Scientific | 16100 | |
| PMSF (Phenylmethylsulfonyl fluoride) | Gold Biotechnology | P-470-10 | |
| Polysorbate 20 (Tween 20) | Fisher Scientific | AC233360010 | |
| Rosetta 2 Competent Cells | Millipore Sigma | 71402-M | |
| SimplyBlue SafeStain | Thermo Fisher Scientific | LC6060 | |
| SmartSpec 3000 | Bio-Rad | 170-2501 | |
| SOC medium | Thermo Fisher Scientific | 15544034 | |
| Sodium chloride | Genesee Scientific | 18-216 | |
| Sonifier 250 | Branson | 100-132-135 | |
| Sorvall RC 6 Plus Centrifuge | Thermo Fisher Scientific | 46910 | |
| TCEP (Tris-(carboxyethyl) phosphine hydrochloride) | Gold Biotechnology | TCEP10 | |
| Terrific Broth Powder | Genesee Scientific | 18-225 | |
| Tris Base | Genesee Scientific | 18-146 | |
| XCell SureLock Mini-Cell and XCell II Blot Module | Thermo Fisher Scientific | EI0002 |
Referanslar
- Morris-Rosendahl, D. J., Crocq, M. -A. Neurodevelopmental disorders: the history and future of a diagnostic concept. Dialogues Clin Neurosci. 22 (1), 65-72 (2020).
- Ebstein, F., Küry, S., Papendorf, J. J., Krüger, E. Neurodevelopmental disorders (NDD) caused by genomic alterations of the ubiquitin-proteasome system (UPS): the possible contribution of immune dysregulation to disease pathogenesis. Front Mol Neurosci. 14, 733012(2021).
- Hershko, A., Ciechanover, A. The ubiquitin system. Annu Rev Biochem. 67 (10), 425-479 (1998).
- Pickart, C. M. Mechanisms underlying ubiquitination. Annu Rev Biochem. 70 (1), 503-533 (2001).
- Komander, D., Clague, M. J., Urbé, S. Breaking the chains: structure and function of the deubiquitinases. Nat Rev Mol Cell Biol. 10 (8), 550-563 (2009).
- Yau, R., Rape, M. The increasing complexity of the ubiquitin code. Nat Cell Biol. 18 (6), 579-586 (2016).
- Koch, I., et al. USP27X variants underlying X-linked intellectual disability disrupt protein function via distinct mechanisms. Life Sci Alliance. 7 (3), e202302258(2024).
- Hao, Y. -H., et al. USP7 acts as a molecular rheostat to promote WASH-dependent endosomal protein recycling and is mutated in a human neurodevelopmental disorder. Mol Cell. 59 (6), 956-969 (2015).
- Fountain, M. D., et al. Pathogenic variants in USP7 cause a neurodevelopmental disorder with speech delays, altered behavior, and neurologic anomalies. Genet Med. 21 (8), 1797-1807 (2019).
- Santiago-Sim, T., et al. Biallelic variants in OTUD6B cause an intellectual disability syndrome associated with seizures and dysmorphic features. Am J Hum Genet. 100 (4), 676-688 (2017).
- Beck, D. B., et al. Linkage-specific deubiquitylation by OTUD5 defines an embryonic pathway intolerant to genomic variation. Sci Adv. 7 (4), eabe2116(2021).
- Cho, J., Park, J., Kim, E. E., Song, E. J. Assay systems for profiling deubiquitinating activity. Int J Mol Sci. 21 (16), 1-16 (2020).
- Matsui, S., Sandberg, A. A., Negoro, S., Seon, B. K., Goldstein, G. Isopeptidase: A novel eukaryotic enzyme that cleaves isopeptide bonds. Proc Natl Acad Sci USA. 79 (5), 1535-1539 (1982).
- Rose, I. A., Warms, J. V. B. An enzyme with ubiquitin carboxy-terminal esterase activity from reticulocytes. Biochemistry. 22 (18), 4234-4237 (1983).
- Wilkinson, K. D., Cox, M. J., Mayer, A. N., Frey, T. Synthesis and characterization of ubiquitin ethyl ester, a new substrate for ubiquitin carboxyl-terminal hydrolase. Biochemistry. 25 (21), 6644-6649 (1986).
- Pickart, C. M., Rose, I. A. Ubiquitin carboxyl-terminal hydrolase acts on ubiquitin carboxyl-terminal amides. J Biol Chem. 260 (13), 7903-7910 (1985).
- Hadari, T., Warms, J. V. B., Rose, I. A., Hershko, A. A ubiquitin C-terminal isopeptidase that acts on polyubiquitin chains: Role in protein degradation. J Biol Chem. 267 (2), 719-727 (1992).
- Woo, S. K., et al. Multiple ubiquitin C-terminal hydrolases from chick skeletal muscle. J Biol Chem. 270 (32), 18766-18773 (1995).
- Woo, S. K., et al. Purification and characterization of a new ubiquitin C-terminal hydrolase (UCH-1) with isopeptidase activity from chick skeletal muscle. J Biochem. 121 (4), 684-689 (1997).
- Baek, S. H., et al. Molecular cloning of a novel ubiquitin-specific protease, UBP41, with isopeptidase activity in chick skeletal muscle. J Biol Chem. 272 (41), 25560-25565 (1997).
- Wilkinson, K. D., et al. Metabolism of the polyubiquitin degradation signal: Structure, mechanism, and role of isopeptidase T. Biochemistry. 34 (44), 14535-14546 (1995).
- Hu, M., et al. Crystal structure of a UBP-family deubiquitinating enzyme in isolation and in complex with ubiquitin aldehyde. Cell. 111 (7), 1041-1054 (2002).
- Hu, M., et al. Structure and mechanisms of the proteasome-associated deubiquitinating enzyme USP14. EMBO J. 24 (21), 3747-3756 (2005).
- Gorka, M., Magnussen, H. M., Kulathu, Y. Chemical biology tools to study deubiquitinases and UBL proteases. Semin Cell Dev Biol. 132, 86-96 (2022).
- Faesen, A. C., et al. The differential modulation of USP activity by internal regulatory domains, interactors, and eight ubiquitin chain types. Chem Biol. 18 (12), 1550-1561 (2011).
- Mevissen, T. E. T., et al. OTU deubiquitinases reveal mechanisms of linkage specificity and enable ubiquitin chain restriction analysis. Cell. 154 (1), 169-184 (2013).
- Kwasna, D., et al. Discovery and characterization of ZUFSP/ZUP1, a distinct deubiquitinase class important for genome stability. Mol Cell. 70 (1), 150-164.e6 (2018).
- Hu, H., et al. X-exome sequencing of 405 unresolved families identifies seven novel intellectual disability genes. Mol Psychiatry. 21 (1), 133-148 (2016).
- Hartmann, I. Shaker Orbit - Revolving in Space Around the Samples? Eppendorf Lab Academy. Eppendorf Lab Academy. , at https://www.eppendorf.com/us-en/lab-academy/lab-solutions/others/shaker-orbit-revolving-in-space-around-the-samples (2020).
- Smith, D. B., Johnson, K. S. Single-step purification of polypeptides expressed in Escherichia coli as fusions with glutathione S-transferase. Gene. 67 (1), 31-40 (1988).
- Ritorto, M. S., et al. Screening of DUB activity and specificity by MALDI-TOF mass spectrometry. Nat Commun. 5, 4763(2014).
- Bustos, F., Bustos, F. Immunoblotting using precast gels. , protocols.io (2024).
- Wingfield, P. T. Overview of the purification of recombinant proteins. Curr Protoc Protein Sci. 80, 6.1.1-6.1.35 (2015).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır