Citometria de Fluxo e Separação de Células Ativadas por Fluorescência (FACS): Isolamento de Linfócitos B Esplênicos
Fonte: Perchet Thibaut1,2,3, Meunier Sylvain1,2,3, Sophie Novault4, Rachel Golub1,2,3
1 Unidade de Linfopose, Departamento de Imunologia, Instituto Pasteur, Paris, França
2 INSERM U1223, Paris, França
3 Université Paris Diderot, Sorbonne Paris Cité, Cellule Pasteur, Paris, França
4 Flow Cytometry Platfrom, Cytometry and Biomarkers UtechS, Center for Translational Science, Pasteur Institute, Paris, França
A função geral do sistema imunológico é defender o corpo contra organismos infecciosos e outros invasores. Os glóbulos brancos, ou leucócitos, são os principais atores do sistema imunológico. Após a infecção, eles são ativados e iniciam uma resposta imune. Leucócitos podem ser divididos em várias submíopes (por exemplo, células mielóides, linfócitos, células dendríticas) com base em diferentes parâmetros que podem ser biológicos, físicos e/ou funcionais (por exemplo, tamanho, granularidade e secreção). Uma maneira de caracterizar leucócitos é através de suas proteínas superficiais, que são principalmente receptores. Cada população de leucócitos expressa uma combinação específica de receptores (por exemplo, citotóxicos, ativadores, receptores migratórios) que podem definir subconjuntos entre populações. Como o sistema imunológico abrange uma ampla gama de populações celulares, é essencial caracterizá-las para decifrar sua participação na resposta imune.
A citometria de fluxo (FC ou FCM) é um método amplamente utilizado para analisar a expressão da superfície celular e moléculas intracelulares, caracterizando e definindo diferentes tipos de células em uma mistura celular heterogrógena. Os citómetros de fluxo são compostos por três subsetores principais: fluidos, ópticos e eletrônicos. O sistema fluido transporta as células em um córrego de tal forma que elas passam na frente de um laser um por um. O sistema óptico consiste em fontes de luz (lasers) para iluminar as partículas, filtros ópticos para direcionar a luz resultante e sinais fluorescentes para detectores apropriados. Finalmente, o sistema eletrônico converte os sinais de luz detectados em sinais eletrônicos que podem ser processados pelo computador. À medida que uma célula individual passa na frente do raio laser, ela espalha luz. Um detector na frente do feixe mede a dispersão dianteira (FS) e vários detectores para a dispersão lateral da medida lateral (SC). O FS se correlaciona com o tamanho da célula e a SC é proporcional à granularidade das células. Dessa forma, as populações celulares podem muitas vezes ser distinguidas com base em diferenças em seu tamanho e granularidade apenas.
Além de analisar o tamanho, a forma e a complexidade de uma célula, a citometria de fluxo é amplamente utilizada para detectar a expressão dos receptores de superfície celular (1). Isso é feito usando anticorpos monoclonais com rótulo fluorocromático que se ligam a receptores específicos de células conhecidos. Após a excitação, esses fluorochromes ligados emitem uma luz de comprimento de onda específico, chamada comprimento de onda de emissão, que pode ser detectado e pontuado. As medidas de fluorescência fornecem dados quantitativos e qualitativos sobre receptores de superfície celular fluorocromático. Os hematologistas foram os primeiros a utilizar FC para o acompanhamento terapêutico das populações de células imunes (2). Agora, é usado para uma ampla gama de aplicações como imunofenofoteping, viabilidade celular, expressão genética, contagem de células e análise de GFP.
FACS (Fluorescente Activated Cell Sorter) é um tipo especializado de citometria de fluxo, que classifica uma população de células em subpopulação usando rotulagem fluorescente. Assim como a citometria de fluxo convencional, os primeiros dados FS, SC e fluorescentes são coletados. Em seguida, a máquina aplica uma carga (negativa ou positiva) e um sistema de deflexão eletrostática (eletroímãs) facilita a coleta de gotículas carregadas contendo células em tubos apropriados.
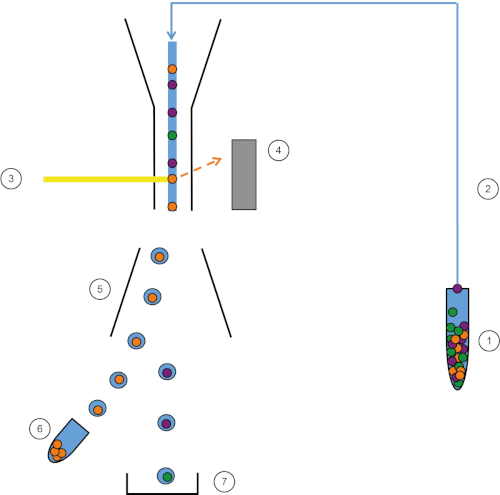
Figura 1: Representação esquemática de FACS. A amostra (1) é aspirada no FACS (2) e passada na frente do laser (3). A fluorescência celular é sentida por detectores de fluorescência (4). Finalmente, as células são incorporadas em gotículas e as células de interesse são desviadas por placas de deflexão (5) e coletadas em um tubo de coleta (6). As demais células vão para o lixo (7). Clique aqui para ver uma versão maior desta figura.
O aspecto de classificação do FACS apresenta muitas vantagens. Muitos testes podem ajudar a entender o papel de células específicas no sistema imunológico, como análises da expressão genética como RT-qPCR, ciclo celular ou secreção de citocinas. No entanto, as células devem ser purificadas rio acima para obter resultados claros e específicos. Aqui, o FACS vem em útil e as células desejadas podem ser classificadas com grande pureza, produzindo resultados altamente confiáveis e reprodutíveis. Facs também pode ser usado para classificar células com base em colorações nucleares ou outras manchas intracelulares e de acordo com a presença, ausência e densidade de receptores superficiais. FACS é agora uma técnica padrão para a purificação de subpopulações de células e tem a capacidade de classificar até quatro populações simultaneamente.
Este exercício de laboratório demonstra como isolar leucócitos esplênicos e, em seguida, como classificar especificamente células linfoides B da mistura de células leucócitos esplênicas usando FACS.
1. Preparação
- Antes de começar, coloque luvas de laboratório e as roupas de proteção apropriadas.
- Esterilize todas as ferramentas de dissecção, primeiro com um detergente e depois com 70% de etanol e depois seque bem.
- Prepare 50mL da solução de sal balanceada da Hank (HBSS) contendo 2% de soro fetal de bezerro (FCS).
2. Dissecção
- Usando um sistema de entrega de dióxido de carbono, eutanize o rato por hipóxia. Fixar
Neste protocolo, purificamos linfócitos B esplênicos usando a tecnologia FACS. Primeiro isolamos leucócitos do baço e os manchamos. Usando uma combinação de marcadores de superfície de célula B, criamos uma estratégia de gating para classificá-los (Figura 2, painel superior). No final do experimento, verificamos se as células do tubo de coleta eram células B através de um "teste de pureza". Mantivemos a mesma estratégia de gating e observamos que mais de 98% das células era...
A citometria de fluxo é uma técnica em primeira mão para caracterizar e classificar populações de células imunes com alto grau de pureza. É ferramenta primordial no campo da pesquisa, pois permite o enriquecimento de populações celulares específicas e decifrar a resposta imune aos patógenos. Com o aumento do número de fluorochromes disponíveis e citómetros, o número de parâmetros detectáveis é altamente aumentado. Como resultado, a análise bioinformática dos dados FACS começou a surgir e abriu novos ...
- Lanier, L. L. Just the FACS. The Journal of Immunology, 193 (5), 2043-2044 (2014).
- Walker, J. M. Epiblast Stem Cells IN Series Editor.
- Tung, J. W., Heydari, K., Tirouvanziam, R., Sahaf, B., Parks. D. R., Herzenberg, L. A., and Herzenberg. L. A. Modern Flow Cytometry: A Practical Approach. Clinics in Laboratory Medicine. 27 (3), 453-468 (2007).
- Walker, J. M. Tumor Angiogenesis Assays IN Series Editor.
Pular para...
Vídeos desta coleção:

Now Playing
Citometria de Fluxo e Separação de Células Ativadas por Fluorescência (FACS): Isolamento de Linfócitos B Esplênicos
Immunology
92.5K Visualizações

Seleção de Células Ativadas por Magnetismo (MACS): Isolamento de Linfócitos T Tímicos
Immunology
22.7K Visualizações

Ensaios ELISA: Indireto, Sanduíche e Competitivo
Immunology
236.7K Visualizações

Ensaio ELISPOT: Detecção de Esplenócitos Secretores de IFN-γ
Immunology
28.3K Visualizações

Imunohistoquímica e imunocitoquímica: imageamento de tecidos via microscopia de luz
Immunology
78.4K Visualizações

Geração de anticorpos: produzindo anticorpos monoclonais usando hibridomas
Immunology
43.3K Visualizações

Microscopia de imunofluorescência: Coloração por imunofluorescência de secções de tecido embebidos em parafina
Immunology
53.5K Visualizações

Microscopia confocal de fluorescência: uma técnica para determinar a localização de proteínas em fibroblastos de camundongos
Immunology
42.9K Visualizações

Técnicas Baseadas em Imunoprecipitação: Purificação de Proteínas Endógenas Usando Esferas de Agarose
Immunology
87.3K Visualizações

Análise do Ciclo Celular: Avaliação da Proliferação de Células T CD4 e CD8 Após Estimulação Usando Coloração CFSE e Citometria de Fluxo
Immunology
24.1K Visualizações

Transferência de células adotivas: introduzindo esplenócitos de camundongos doadores para um camundongo hospedeiro e avaliando o sucesso via FACS
Immunology
22.1K Visualizações

Ensaio para Morte Celular: Ensaio de Liberação de Cromo para Avaliar a Capacidade Citotóxica
Immunology
151.3K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados