A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تنقية م. magneticum سلالة AMB - 1 بروتين المرتبطين Magnetosome MamAΔ41
In This Article
Summary
ماما هي فريدة من نوعها Magnetosome البروتينات المرتبطة بها والتي كانت معروضة على المشاركة في تنشيط magnetosome. هنا نقدم بروتوكول تنقية ماما الحذف متحولة (MamAΔ41) من م. magneticum AMB - 1.
Abstract
البكتيريا Magnetotactic تضم مجموعة متنوعة من الكائنات المجهرية المائية التي تكون قادرة على توجيه نفسها على امتداد الحقول المغنطيسية. ويعتقد أن هذا السلوك للمساعدة في بحثهم عن بيئات مناسبة
Protocol
1. الاستنساخ والتعبير عن الجينات ماما في E. القولونية
وقد تتضخم متحولة mamAΔ41 الجينات باستخدام تفاعل البلمرة المتسلسل (PCR) من الحمض النووي الجينومي للmagneticum Magnetospirillum AMB - 1 ، مع الاشعال : 5' - GCATTACGCATATGGACGACATCCGCCAGGTG - 3 "و 5' - GCGCGGCAGCCATA - 3 - TGGCATACG. شظايا من الحمض النووي في تضخيمها ، تم استحداث لموقع NcoI في ATG كودون بدء واستعيض عن رامزة إنهاء مع موقع ScoI. وهضمها شظايا مع NcoI وSACI والمستنسخة في مواقع كل من pET52b (+) ، مما أدى إلى AMB1 - pET52bMamAΔ41. في هذا البناء ، وتنصهر فيها الجين mamAΔ41 في الإطار مع صاحب العلامة 10 ، في محطة سي. وكان electroporated البلازميد الى سلالة كولاي BL21. كولاي سلالة كانت تزرع BL21 بايواء pET52bMamAΔ41 في الحث الذاتي (15) التي تحتوي على أمبيسلين المتوسطة (50 ملغ / مل) 310 · K لمدة 3 ساعات. انتقلت بعد ذلك زراعة درجة الحرارة من 310 درجة إلى K · 300 وحافظ ل48 ساعة إضافية في · 300 ك. وكان حصاد الخلايا بواسطة الطرد المركزي في 5465g لمدة 10 دقيقة على 277 · ك. 8 لترات تنتج ثقافة 60 غراما من بيليه الخلية الرطب.
2. الحسابات المعلوماتية الحيوية
حسابات الوزن الجزيئي (MW) ، وفقا لتسلسل الأحماض الأمينية والاستيعاب المتوقع لل1mg/1ml للبروتين في 280nm ، وذلك باستخدام ملقم ProtParam (http://www.expasy.ch/tools/protparam.html). ل10His - تاج MamAΔ41 22529 ميغاواط هو دا (240 الأحماض الأمينية) وMamAΔ41 (9 الأحماض الأمينية مع اليسار بعد إزالة صاحب العلامة تلو ثرومبين) ميغاواط و20596.5Da (187 الأحماض الأمينية). الاستيعاب المتوقع لل1mg/1ml للبروتين في ل10His - 280nm تاج MamAΔ41 هو 0،595 و 0،579 لMamAΔ41 هو. بالإضافة إلى ذلك ، تسلسل الأحماض الأمينية لا تحتوي على أية بقايا السيستين. ولذلك ، لا يطلب من وكلاء خفض خلال عملية التنقية.
3. تنقية MamAΔ41
- الحل لإعداد الأوراق المالية ، وإعداد الموازنة من (200 مل لكل منهما) في تركيزات التالية : إيميدازول (MW ز / مول 228.2) 4M الحل ، كلوريد الصوديوم (MW ز / مول 58.44) 5M الحل ، تريس ، حمض الهيدروكلوريك (121.3 ميغاواط ز / مول ) حل 1M ، وضبط درجة الحموضة = 8. إضافة الماء المقطر مزدوجة (أحواض دبي الجافة العالمية) ، وباستخدام مزيج دوامة حتى حل واضح. فلتر تصفية 0.22μm حلول مع والحفاظ على درجة حرارة الغرفة.
- إعداد وتصفية 6 مخازن جديدة من الحلول الأسهم (Table1).
- تمييع ووقف الخلايا في وحدة تخزين في المخزن المؤقت نسبة 01:02 ، غرام من الخلايا لالعازلة (مل).
- إضافة 10μl لكل من البكتيريا 10gr الأول الدناز (1 ملغ / مل) من أجل كسر شظايا من الحمض النووي في العينة. إضافة 1ml 20gr لكل من البكتيريا من البروتياز EDTA مجانا كوكتيل المانع. احتضان لمدة 20 دقيقة على الجليد.
- تعطل الخلايا دورتين من الصحافة الفرنسية على 25000 رطل. خلافا صوتنة ، يستهدف الصحافة الفرنسية في ارتفاع حجم (> 10ML) قذف الخلية عن طريق إجبار الخلايا تحت ضغط عال من خلال فوهة رقيقة. ينبغي تبريد المكبس على الجليد لمدة عشر دقائق قبل استخدامه والتجمع بسبب تراكم الحرارة.
- نقل الخلايا في أنابيب lysed 25ml نابذة فائقة السرعة والتوازن منهم على وجه التحديد (50mg) مع العازلة وحتى العينة يصل خط أنبوب ليالي الرقبة.
- خلية منفصلة الحطام بواسطة الطرد المركزي في الترا 270000 ز لمدة 1 ساعة على 277 · ك.
- تعد محلية الصنع العمود خطورة NTA ني (2.5cm قطر) وذلك بإضافة 4 مل من ني NTA الراتنج ، والتي تحافظ في الايثانول 20 ٪ ، على العمود. السماح للانخفاض السوائل تماما ، ثم تغسل مع 40 مل من أحواض دبي الجافة العالمية ، والسماح للهبوط السائل تماما. قبل معايرتها الراتنج في العمود مع 40 مل من ألف العازلة
- تطبيق جزء من ذوبان فائقة أنابيب الطرد المركزي في العمود خطورة NTA ني. السماح للانخفاض السوائل ، وجمع من خلال تدفق (بروتينات غير منضم) والحفاظ على 277K.
- بيليه جمع عينة من الأنابيب فائقة الطرد المركزي التي تستخدم تلميح صغير لالغاء بيليه. مزيج قمة في 50μl 5 ٪ β - 2X المركابتويثانول في SDS - PAGE العازلة العينة.
- غسل العمود مع 100 مل ب العازلة واسمحوا انخفاض السوائل ، والتدفق من خلال جمع والحفاظ على 277K.
- إعداد 15 علامة إيبندورف أنابيب (1.5ml).
- شطف -- إغلاق صمام عمود ثم تحميل 1ml جيم العازلة على العمود ؛ احتضان لمدة 3 دقائق تليها فتح صمام وجمع من خلال تدفق. كرر هذه الخطوة ثلاث مرات.
- أزل بقية تعليق في 1 مل عازلة زيادات C وإغلاق صمام.
- قياس OD في 280nm من الكسور وتقييم موقع ذروة البروتين ، وإذا كان لا يزال OD> 0.3 ، وهناك حاجة إلى عينات إضافية.
- SDS - PAGE تحليل الكسور التي تم جمعها. يجب أن يتم تنفيذ مثل هذا التحليل أيضا مع العينات التالية ، والبروتينات من خلال تدفق غير منضم ، ويغسل وتدفق من خلال شltra - الطرد المركزي بيليه العينة. مزيج من كل عينة 10μl مع 10μl 5 ٪ β - 2X المركابتويثانول في SDS - PAGE العازلة العينة. تحميل العينات على 15 ٪ SDS - PAGE وتشغيل لمدة 45 دقيقة في 180 فولت.
- وصمة عار في هلام 15 مل من محلول InstantBlue ، يهز لمدة 1 ساعة. تأكد من أن تتناول مربع من البلاستيك ومحمية من الضوء.
- تقييم هلام ، وإذا كان التعبير عن بروتين عالية ومحددة وفقا لنطاقات إرشادية ، دمج الكسور eluted المحدد.
- من أجل إزالة - 10 - صاحب العلامة ، إضافة البقري ثرومبين (10 وحدة / ميكرولتر) ، 10μl ثرومبين البروتين لكل 1 ملغ ، وفقا لتوصية الشركة الصانعة للعينة مجتمعة.
- يستخدم الغسيل لإزالة الزائدة وإيميدازول لخفض تركيزات كلوريد الصوديوم عن المستويات المطلوبة خلال ملزم التبادل الأيوني. لغسيل الكلى ، وخفض الطول المطلوب من الوزن الجزيئي 7 دينار قطع (MWCO) أنابيب غسيل الكلى. يغسل مع أحواض دبي الجافة العالمية ، وجعل عقدة في نهاية واحدة (أو الختم مع مقاطع). نقل اندمجت حل البروتين على الكيس مع ترك بعض المساحة في أعلى وحتى المشبك.
- غمر أنابيب غسيل الكلى في 4 لترات عازلة مبردة غسيل الكلى (الاحتياطي D). تحريك حل ببطء على مدى ليلة في 277 · ك.
- تتخذ من أنابيب غسيل الكلى من الدورق ، وجعل قطع صغيرة ونقلها إلى البروتين 50ml الانبوب.
- التبادل الأيوني اللوني : تجميع معبأة مسبقا MonoQ العمود PE 4.6/100 سريع على الأداء اللوني السائل (FPLC). غسل العمود مع أحجام العمود 5 (CV) التابعة ل الماء المصفى. معايرتها العمود مع السيرة الذاتية ل5 دال العازلة
- يغسل الحلقة الحقن مع أحواض دبي الجافة العالمية (أحجام حلقة اثنين) وكرر مع د. العازلة تحميل البروتين في حلقة الحقن.
- حقن عينة البروتين (معدل التدفق من 1 مل / دقيقة) ، والبدء في جمع الكسور لSDS - PAGE الكشف عن البروتينات غير محدود.
- إذا كان حجم البروتين الأولية (الخطوة 3.23) أكبر من حلقة الحقن ، وكرر الخطوات 3،25-3،26 ، دون غسل الحلقة ، حتى يتم تحميل العينة كاملة على العمود.
- غسل العمود مع السيرة الذاتية ل3 C عازلة من أجل إزالة البروتينات غير محدود.
- أزل البروتين مع التدرج الخطي 60 دقيقة من 40 2000mM كلوريد الصوديوم بين مخازن D & E (عند 100 ٪ E العازلة هي نهاية التدرج) ، معدل التدفق 1 دقيقة مل / (رغم أنه يمكن استخدام معدلات التدفق العالي في تكلفة كميات أكبر ، ولكن أقل تركيزا قمم البروتين). جمع البروتينات القمم لأنها تظهر في chromatogram 280nm.
- نظيفة معبأة مسبقا وفقا لتصنيع العمود التوصية.
- SDS - PAGE تحليل الكسور التي تم جمعها. يجب أن يتم تنفيذ مثل هذا التحليل مع عينات التالية ، والبروتينات من خلال تدفق غير محدود والبروتين من خلال تدفق القمم. تشغيل SDS - PAGE وصمة عار كما ذكر في الخطوات 3،17-3،18.
- جل تقييم لوجود البروتين في نطاقات ميغاواط توقع وفقا لعلامة قبل الملطخة البروتين. دمج الكسور شطف المختارة التي تحتوي على البروتين ذات الصلة.
- Dialyze العينات المدمجة ، من أجل تخفيض تركيزات كلوريد الصوديوم اللازمة لاستبعاد حجم اللوني. إجراء غسيل الكلى كما هو مذكور في الخطوات 3،21-3،23 ضد F. العازلة
- تركيز البروتين باستخدام عينة Vivaspin - 15 10000 MWCO إلى 8 ملغ / مل في جهاز للطرد المركزي الجدول ، 4000 دورة في الدقيقة. التحقق من صحة قياس تركيز رغبة في التطوير التنظيمي في 280nm كفيت الكوارتز. إذا يتركز أيضا على البروتين تمييع مع F العازلة وقياس مرة أخرى.
- تجميع حجم الاستبعاد قبل معبأة العمود ، HiLoad 26/60 Superdex 200 ، على FPLC ؛ غسل العمود مع 3 السيرة الذاتية لأحواض دبي الجافة العالمية للمياه التي تمت تصفيتها. معايرتها مع العمود 3 السيرة الذاتية لF. العازلة
- غسل حلقة الحقن مع أحواض دبي الجافة العالمية 5ml (أحجام حلقة اثنين) تليها نفس الحجم مع واو العازلة تحميل أي أكثر من 4 مل من العينة البروتين في حلقة الحقن.
- حقن عينة بروتين (معدل تدفق 3.5 مل / دقيقة) ، والبدء في جمع الكسور ذروة البروتينات كما تظهر عليه chromatogram 280nm. السماح لتدفق العازلة حتى يصل حجم العمود.
- إذا كان حجم البروتين الأولية (الخطوة 3.23) أكبر من حلقة الحقن ، وكرر الخطوات 3،25-3،26 ، دون غسل الحلقة ، حتى يتم تحميل العينة كاملة على العمود.
- نظيفة معبأة مسبقا العمود وفقا لتوصية التصنيع.
- SDS - PAGE تحليل الكسور التي تم جمعها. يجب أن يتم تنفيذ مثل هذا التحليل مع البروتين قمم العينات. تشغيل SDS - PAGE وصمة عار كما ذكر في الخطوات 3،17-3،18.
- تقييم جل : إذا قمم البروتين محددة ، في ميغاواط توقع الصحيح وفقا للعلامة قبل الملطخة البروتين وفرقة واحدة فقط مرئيا دمج مختارة الكسور eluted من البروتين ذات الصلة.
- تركيز البروتين باستخدام عينة - 15 Vivaspin 10000 MWCO إلى 20> ملغ / مل في جهاز للطرد المركزي الجدول دورة في الدقيقة 4000. التحقق من تركيز الرغبة في التطوير التنظيمي من خلال قياس 280nm. وتركزت ثم MamAΔ41 المنقى إلى 26.5 ملغ / مل التبلور. <لى> تأكيد نقاء العينة وتحديد البروتين باستخدام مصفوفة بمساعدة الليزر الامتزاز / التأين (MALDI - TOF).
- إذا كان البروتين النقي وفقا لمطياف الكتلة وSDS PAGE ، تقسيم MamAΔ41 مركزة لأنابيب إيبندورف قبل بعلامات ؛ 25 50μl البروتين في كل منهما.
- فلاش مجمدة في النيتروجين السائل وتخزينه في 193 · ك.
4. ممثل النتائج
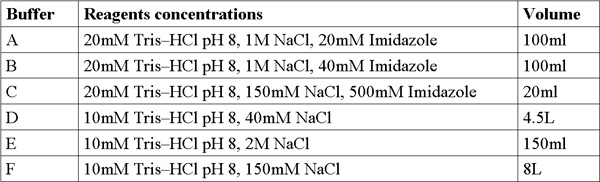
عندما يتم هذا البروتوكول بشكل صحيح وينبغي للمرء الحصول عالي النقاء ، وعينات حجم البروتين متجانسة ومركزة. هذه عينات من البروتين ثم يتم بلورة جاهزة للمحاكمات وكذلك الدراسات البيوكيميائية مثل حركية الأنزيمات ، تقارب ملزمة وأكثر من ذلك. الموصوفة هنا النتائج ممثل خطوات رئيسية في البروتوكول تنقية. ينبغي SDS - PAGE تحليل الشخصية شطف العمود تقارب ني NTA تكشف عالية من البروتين وأعربت في أكثر من الكسر للذوبان في ميغاواط المناسبة ~ 22kDa (الشكل 1). ينبغي لهذا التحليل SDS - PAGE تكشف أيضا عن الحد الأدنى من البروتين وجدت في البروتينات غير محدود من خلال التدفق ، ويغسل وتدفق من خلال عينة فائقة الطرد المركزي بيليه. إذا نطاقات كبيرة من البروتين المناسبة لا تظهر في هذه العينات وينبغي للمرء أن ينظر خاطئ إعداد العازلة ، ومشاكل في تمزيق الخلايا أو مشاكل في ظروف لصناعة السيارات في ثقافة التحريض والنمو.
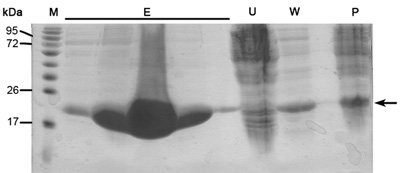
غير متشكلة التبادل الأيوني اللوني من أجل الفصل بين البروتين لدينا مرغوب فيه للبروتينات القولونية الأخرى التي كانت منضمة إلى الراتنج النيكل (بسبب التفاعلات الكهربائي أو الحامض الاميني / السلبية الأحماض الأمينية حلقات الغنية بالبروتين) ، وتقطيعه ، صاحب الكلمات الدلالية البروتين مرغوب فيه. هذا العمود يفصل البروتينات الخاصة بهم وفقا لتقارب ملزمة للراتنج المشحونة إيجابيا في إطار زيادة تركيزات كلوريد الصوديوم. وبروتين عالية سالبة الشحنة أزل في تركيزات أعلى كلوريد الصوديوم appose الى معتدلة منها شحنة سالبة. مزايا هذا العمود وارتفاع معدل تدفق والقدرة على الربط. وchromatogram التبادل الأيوني (الشكل 2) يكشف عن فصل البروتينات الجيدة بين السكان 3 في زيادة تركيز كلوريد الصوديوم. وهناك حاجة SDS - PAGE تحليلها من أجل تحديد ميغاواط لكل السكان ، وعزل واحد مرغوب فيه وتقييم ما إذا كانت هناك حاجة إلى مزيد من الخطوات لتنقية. السكان الأول هو MamAΔ41 (~ 20 كيلو دالتون) في حين أن الثاني هو MamAΔ41 السكان + صاحب العلامة (~ 22kDa) التي لم يكن من قبل المشقوق ثرومبين البقري والسكان الثالث هو غير قابل للكشف في SDS - PAGE بسبب تركيز منخفض. إذا لم يتم فصل البروتينات قمم بوضوح ينبغي للمرء أن ينظر في الخطأ أو تغيير إعداد العازلة المنحدر من الانحدار كلوريد الصوديوم.
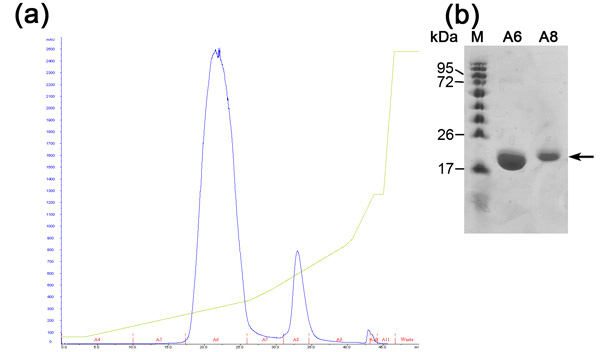
غير متشكلة حجم الاستبعاد اللوني من أجل الفصل بين البروتين لدينا المرغوب فيه بروتينات الخلية القولونية الأخرى التي كانت منضمة إلى الراتنج ني NTA وكانوا لا يفصلون خلال التبادل الأيوني اللوني. هذا العمود يفصل البروتينات وفقا لحجمها. والبروتينات الكبيرة في أحجام أصغر أزل شطف مقابل تلك الصغيرة التي سيتم eluted بأحجام أكبر. وchromatogram العمود (الشكل 3) يكشف عن الفصل جيدة من البروتين المرغوب فيه واحدة السكانية الرئيسية. ويبدو أن السكان أزل في الحجم المناسب مع مونومر ميغاواط من 20 كيلو دالتون ~. تم الكشف عن وجود الفرقة 80 كيلو دالتون ~ (القولونية البروتين النموذجية التي تربط ني NTA الراتنج) في SDS - PAGE قبل التحميل العمود ويختفي خلال هذا السباق. حيث أن تركيز هذا البروتين 80 كيلو دالتون ~ منخفضة لتبدأ ، وسكانها لا تظهر في chromatogram بسبب تخفيف وهناك حاجة SDS - PAGE تحليل لتحديد كفاءة التنقية. نوصي تحميل عينة المخففة ومركزة من ذروة الرئيسي لSDS - PAGE بحيث يمكن لأحد أن يحدد بالتأكيد وجود البروتين النقي في ميغاواط المناسبة. في هذه المرحلة هو تنقية البروتين وينبغي تقييمها من خلال التجانس - TOF MALDI. وكشف هذا التحليل بروتين في 20347 ميجاوات من دا وآخر في ميغاواط من دا 10176 (الشكل 4). في 10 كيلو دالتون ~ البروتين وتضاعف كلف ~ البروتين 20 كيلو دالتون. كان من المتوقع ميجاوات MamAΔ41 مع الأحماض الأمينية 9 غادر بعد إزالة صاحب تاج 20596.5 دا. بمقارنة فإنه إلى ميغاواط - TOF MALDI الحصول جدنا أنهم 248 دا إربا. وهذا يمكن أن تنتج عن الاختلاف أخطاء القياس TOF MALDI ، و / أو بسبب تدهور المشتركة للميثيونين الأول وجليكاين الثانية. على أن تبرم ، هو تنقية للغاية من البروتين ويمكن استخدامها لاجراء تجارب اخرى.
الجدول 1. الصياغات العازلة.
الشكل 1. ممثل SDS - PAGE تحليل تنقية العمود ني NTA من اليمين إلى اليسار ؛ ف فائقة الطرد المركزي بيليه (3.11 خطوة بروتوكول) ، W - يغسل (3.12 خطوة بروتوكول) ، U - غير محدود من البروتينات (3.10 خطوة بروتوكول) ، E - خمسة مسارات للعصيدة شطفليه (3.14 خطوة بروتوكول) ، M -- علامة البروتين (تشير الأرقام ميغاواط). يشير السهم MamAΔ41.
الشكل 2. تحليل الخطوة ايون اللوني الصرف (أ) التبادل الأيوني (MonoQ عمود) chromatogram ؛ الأزرق -- 280nm الاستيعاب ، ويمثل تركيز البروتين ، وكلوريد الصوديوم تركيز الأخضر ، الأحمر -- بيان الكسور التي تم جمعها. (ب) الممثل SDS - PAGE تحليل ايون خطوة تنقية الصرف. من اليسار إلى اليمين ؛ M -- علامة البروتين (تشير الأرقام ميغاواط) ، A6 -- أولا كسر الذروة ، A8 الثانية وكسر الذروة.

الشكل 3. تحليل حجم الاستبعاد اللوني (أ) استبعاد الحجم (Superdex 200 عمود) chromatogram ؛ الأزرق -- 280nm الاستيعاب ، ويمثل تركيز البروتين ، إشارة حمراء من الكسور التي تم جمعها. (ب) الممثل SDS - PAGE تحليل الاستبعاد حجم خطوة التنقية. من اليسار إلى اليمين ؛ M - البروتين علامة (تشير الأرقام ميغاواط) ، عينة PreI ما قبل حقن ، A4 - 6 جزء مجتمعة التي تم جمعها من الذروة الأولى ، A4 - 6D - المخففة التي تم جمعها من الكسر الذروة.
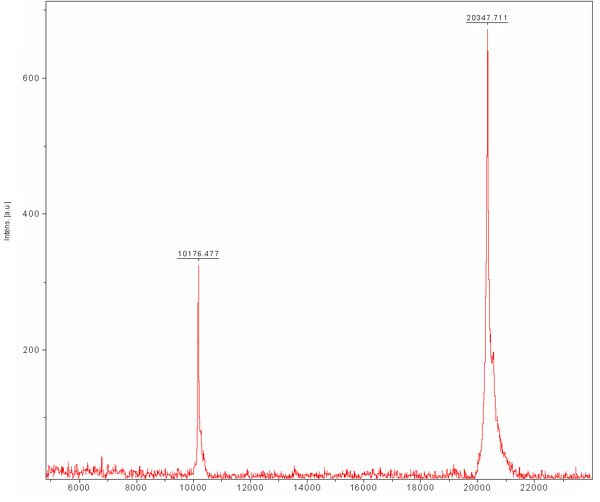
الشكل 4. مصفوفة بمساعدة الليزر الامتزاز / التأين (MALDI - TOF) طيف كتلة تنقية MamAΔ41. المصفوفة هو حمض Sinapic (SA). MamAΔ41 معروضة في دا 20347 ، كما يظهر أيضا هو تضاعف الأنواع المكلف في MamAΔ41 10176 دا.
Discussion
تنقية البروتين هو خطوة رئيسية في أي البروتينات الحيوية أو الدراسات البنيوية. لأن كل من البروتين هي فريدة من نوعها مع سلوكها ، ويحتاج المرء لتحديد خصائصه وتعديلها وفقا لذلك تنقية. وينبغي تحليل البروتين الهدف كخطوة أولى نحو تنقية استخدام أدوات المعلوماتية الحيوية. يت?...
Acknowledgements
نعترف الدكتور أمير أهاروني لدعمه وجينو دافيدوف ، Grimberg نعوم وتشن غوتمان للحصول على المشورة وتعليقاتهم.
Materials
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Name | Company | Catalog Number | Comments | |
| French Press | Equipment | Thermo scientific | FA-078A | |
| Pressure cell | Equipment | Thermo scientific | FA-032 | |
| Ultra-centrifuge | Equipment | Sorvall | Discovery 90SE | |
| Rottor | Equipment | Beckman | Ti60 | |
| Ultra-centrifuge tubes; PC-Bottle+Cap Assay 26.3ml | Equipment | Beckman | BC-355618 | |
| 2.5cm diameter, Glass Econo-Column Chromatography Columns | Equipment | BioRad | 737-2521 | |
| Ni-NTA His Bind resin | Equipment | Novagen | M0063428 | |
| Spectrophotometer | Equipment | Amersham Biosiences | Ultraspec 2100 pro | |
| Quartz cuvette | Equipment | Hellma | 104-QS | |
| Fast Performance Liquid Chromatography- AKTA purifier 10 | Equipment | GE Healthcare Biosciences | 28-4062-64 | |
| Ion exchange column – MonoQ 4.6/100 PE | Equipment | GE Healthcare Biosciences | 10025543 | |
| Size exclusion pre-packed column-HiLoad 26/60 Superdex 200 | Equipment | GE Healthcare Biosciences | 17-1071-01 | |
| Centricon - Vivaspin15 – 10,000 MWCO | Equipment | Sartorius Stedim Biotech GmbH | VS1501 | |
| Table centrifuge | Equipment | Thermo scientific | IEC CL30R | |
| MALDI-TOF | Equipment | Bruker Daltonics | Reflex IV | |
| Tris-HCl (hydrotymethyl) aminomethane | Reagent | BioLab | 20092391 | |
| Sodium Chloride | Reagent | FRUTROM | 235553470 | |
| Imidazole | Reagent | Alfa Aesar | 288-32-4 | |
| EDTA free protease inhibitors cocktail | Reagent | Sigma | P-8849 | |
| Dnase I (Deoxyribonuclease I) | Reagent | Sigma | DN-25 | |
| Bovine Thrombin | Reagent | Fisher BioReagents | BP25432 | |
| Glycine | Reagent | BioLab | 07132391 | |
| Soudim Dodecyl Sulfate (SDS) | Reagent | BioLab | 19822391 | |
| Beta-mercaptoethanol | Reagent | Sigma | M-3148 | |
| InstantBlue | Reagent | Expedeon | 1SB01L | |
| PageRuler Prestained Protein Ladder | Reagent | Fermentas | SM0671 |
References
- Faivre, D., Schuler, D. Magnetotactic Bacteria and Magnetosomes. Chem Rev. 108, 4875-4898 (2008).
- D'Andrea, L. D., Regan, L. TPR proteins: the versatile helix. Trends Biochem Sci. 28, 655-662 (2003).
- Young, J. C., Barral, J. M., Hartl, U. l. r. i. c. h., F, . More than folding: localized functions of cytosolic chaperones. Trends Biochem Sci. 28, 541-547 (2003).
- Brocard, C., Hartig, A. Peroxisome targeting signal 1: is it really a simple tripeptide?. Biochim Biophys Acta. 1763, 1565-1573 (2006).
- Fransen, M., Amery, L., Hartig, A., Brees, C., Rabijns, A., Mannaerts, G. P., Van Veldhoven, P. P. Comparison of the PTS1- and Rab8b-binding properties of Pex5p and Pex5Rp/TRIP8b. Biochim Biophys Acta. 1783, 864-873 (2008).
- Baker, M. J., Frazier, A. E., Gulbis, J. M., Ryan, M. T. Mitochondrial protein-import machinery: correlating structure with function. Trends Cell Biol. 17, 456-464 (2007).
- Mirus, O., Bionda, T., von Haeseler, A., Schleiff, E. Evolutionarily evolved discriminators in the 3-TPR domain of the Toc64 family involved in protein translocation at the outer membrane of chloroplasts and mitochondria. J Mol Model. 15, 971-982 (2009).
- Gatsos, X., Perry, A. J., Anwari, K., Dolezal, P., Wolynec, P. P., Likic, V. A., Purcell, A. W., Buchanan, S. K., Lithgow, T. Protein secretion and outer membrane assembly in Alphaproteobacteria. FEMS Microbiol Rev. 32, 995-1009 (2008).
- Tiwari, D., Singh, R. K., Goswami, K., Verma, S. K., Prakash, B., Nandicoori, V. K. Key residues in Mycobacterium tuberculosis protein kinase G play a role in regulating kinase activity and survival in the host. J Biol Chem. 284, 27467-27479 (2009).
- Edqvist, P. J., Broms, J. E., Betts, H. J., Forsberg, A., Pallen, M. J., Francis, M. S. Tetratricopeptide repeats in the type III secretion chaperone, LcrH: their role in substrate binding and secretion. Mol Microbiol. 59, 31-44 (2006).
- Grunberg, K., Muller, E. C., Otto, A., Reszka, R., Linder, D., Kube, M., Reinhardt, R., Schuler, D. Biochemical and proteomic analysis of the magnetosome membrane in Magnetospirillum gryphiswaldense. Appl Environ Microbiol. 70, 1040-1050 (2004).
- Komeili, A., Vali, H., Beveridge, T. J., Newman, D. K. Magnetosome vesicles are present before magnetite formation, and MamA is required for their activation. Proc Natl Acad Sci USA. 101, 3839-3843 (2004).
- Okuda, Y., Fukumori, Y. Expression and characterization of a magnetosome-associated protein, TPR-containing MAM22, in Escherichia coli. FEBS Lett. 491, 169-173 (2001).
- Taoka, A., Asada, R., Sasaki, H., Anzawa, K., Wu, L. F., Fukumori, Y. Spatial localizations of Mam22 and Mam12 in the magnetosomes of Magnetospirillum magnetotacticum. J Bacteriol. 188, 3805-3812 (2006).
- Studier, F. W. Protein production by auto-induction in high density shaking cultures. Protein Expression and Purification. 41, 207-234 (2005).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved