Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Очистка М. magneticum Штамм AMB-1 Magnetosome белка, связанного MamAΔ41
Резюме
Мама уникальный Magnetosome связанные белок, который был показан на участие в magnetosome активации. Здесь мы представляем очистки протокол Мама удаления мутант (MamAΔ41) от М. magneticum AMB-1.
Аннотация
Чувствительный к магнитному полю бактерии составляют разнообразную группу водных микроорганизмов, которые способны ориентироваться вдоль геомагнитного поля. Такое поведение, как полагают, чтобы помочь их поиск подходящих сред
протокол
1. Клонирование и экспрессия гена мама в E. палочки
Мутантный ген mamAΔ41 амплифицировали с использованием полимеразной цепной реакции (ПЦР) из геномной ДНК Magnetospirillum magneticum AMB-1, с праймеров: 5'-GCATTACGCATATGGACGACATCCGCCAGGTG-3 'и 5'-GCGCGGCAGCCATA-TGGCATACG-3'. В амплифицированных фрагментов ДНК, сайт NcoI был представлен на инициирующего кодона ATG и терминирующий кодон был заменен на сайте ScoI. Фрагменты переваривают NcoI и SacI и клонировали в соответствующих участках pET52b (+), что приводит к pET52bMamAΔ41-AMB1. В этой конструкции, ген mamAΔ41 были слиты в рамке с 10-его тег в C-конца. Плазмиду электропорации в кишечной палочки штамма BL21. Кишечной палочки штамма BL21 укрывательство pET52bMamAΔ41 был выращен в авто-индукции (15) среде, содержащей ампициллин (50 мг / мл) 310 ° К в течение 3 часов. Культивирования температуру сместился от 310 ° до 300 ° К и поддерживается в течение еще 48 ч при 300 ° К. Клетки собирали центрифугированием при 5465g в течение 10 минут при температуре 277 ° К. 8 литров культуры производства 60 граммов мокрого осадок клеток.
2. Биоинформатика Расчеты
Расчет молекулярного веса (МВт), в соответствии с аминокислотной последовательности кислот и предсказал поглощения 1mg/1ml белка в 280 нм, используя сервер ProtParam (http://www.expasy.ch/tools/protparam.html). Для 10His-Tag-MamAΔ41 МВт 22529 Da (240 аминокислот) и для MamAΔ41 (с 9 аминокислот, оставшегося после его-теги удаление тромбина) МВт 20596.5Da (187 аминокислот). Предсказано поглощение 1mg/1ml белка в 280 нм для 10His-Tag-MamAΔ41 является 0,595 и 0,579 MamAΔ41 является. Кроме того, последовательность аминокислот не содержат остатков цистеина. Таким образом, восстановителей не требуется во время процесса очистки.
3. Очистка MamAΔ41
- Для подготовки массы решение, взвесить и подготовить (200 мл) в следующих концентрациях: имидазола (МВт 228,2 г / моль) 4М решение, NaCl (М 58,44 г / моль) 5M решение, Трис-HCl (Mw 121,3 г / моль ) 1М раствора, отрегулировать рН = 8. Добавить бидистиллированной воды (DDW) и смешать использованием вихрь, пока раствор не станет прозрачным. Фильтры решения с 0.22μm фильтр и хранить при комнатной температуре.
- Подготовка и фильтр 6 свежих буферов со склада решений (табл.1).
- Развести и приостановить клеток в буфер в соотношении 1:2, грамм клеток в буфер объем (мл).
- Добавить 10 мкл для каждого 10гр бактерий ДНКазы I (1 мг / мл), чтобы сломать фрагментов ДНК в образце. Добавить 1 мл для каждого 20гр бактерий ЭДТА свободной коктейль ингибиторов протеазы. Инкубируйте в течение 20 мин на льду.
- Разрушенных клеток двумя циклами французской прессе в 25000 фунтов на квадратный дюйм. В отличие от ультразвука, французская пресса направлен на высокой громкости (> 10 мл) ячейки экструзии, заставляя клетки под высоким давлением через тонкие отверстия. Поршня должна быть охлаждена на льду в течение десяти минут до его использования и сборки в зависимости от температуры наращивание.
- Передача лизированных клеток в 25 мл труб ультрацентрифуге и баланс их именно (50 мг) с буфером, пока образец достигает линии шеи трубки с.
- Отдельные обломки ячейки Ультра центрифугированием при 270 000 г в течение 1 часа при температуре 277 ° К.
- Подготовка домашнего тяжести Ni НТА колонке (2,5 см в диаметре) путем добавления 4 мл Ni НТА смолы, которые сохраняются у 20% этанола, на колонку. Пусть жидкость капля полностью, затем промыть 40 мл DDW и пусть капля жидкости полностью. Предварительно уравновешенной смолы в колонку с 40 мл буфера А.
- Применить растворимой фракции от ультра-центрифугирования труб от тяжести колонки Ni НТА. Пусть жидкость капли, собирать проточные (несвязанных белков) и сохранить на 277K.
- Сбор образцов гранул из ультра-центрифугирования трубы с использованием небольшая заметка на металлолом гранул. Смешайте чаевые в 50 мкл 5% β-меркаптоэтанола в 2X SDS-PAGE образца буфера.
- Промыть колонку с 100 мл буфера В. Пусть жидкость капли, собирать проточные и сохранить на 277K.
- Подготовка Эппендорф отмечен 15 труб (1,5 мл).
- Элюирование - закрыть клапан колонке, а затем загрузить 1 мл буфера С на колонке; инкубировать в течение 3 мин, а затем, открыв клапан и проточный коллекции. Повторите это действие три раза.
- Элюировать остальные подвески в 1 мл буфера C шагом и закрыть клапан.
- Мера ОП при 280 нм фракций и оценить расположение белков пик, если OD до сих пор> 0,3, дополнительных образцов не требуется.
- SDS-PAGE анализа собранных фракций. Такой анализ должен быть выполнен также со следующими образцами, несвязанных белков проточный, промойте проточной, а иLTRA-центрифугирования гранулы образца. Смешать 10 мкл из каждого образца с 10 мкл 5% β-меркаптоэтанола в 2X SDS-PAGE образца буфера. Нагрузка образцов на 15% SDS-PAGE и запустить в течение 45 минут в 180 вольт.
- Пятно гель в 15 мл раствора InstantBlue, встряхивать в течение 1 часа. Убедитесь, что пластиковая коробка покрыта и защищена от воздействия света.
- Оценка гель, если экспрессии белка является высоким и конкретными в соответствии с ориентировочной полосы, слить выбранные элюировали фракций.
- Для того чтобы снять 10-His-теги, добавлять бычьего тромбина (10 ед / мкл), 10 мкл тромбина на 1 мг белка, в соответствии с рекомендациями производителя, чтобы комбинированной выборки.
- Диализ используется для удаления избыточного имидазола и снижения концентрации NaCl для уровней, необходимых во время привязки ионного обмена. Для диализа, вырезать нужную длину от 7 кДа молекулярной массой отрезать (MWCO) диализных трубок. Промыть DDW и сделать узел на одном конце (или печать с изображением клипов). Передача объединены белкового раствора на сумку, оставляя некоторое пространство сверху и складывать в кучу.
- Погрузите диализа труб в 4 литра охлажденной буфера диализа (буфер D). Перемешать раствор медленно в течение ночи при 277 ° К.
- Возьмите из диализных трубок стакан, сделайте небольшой надрез и передачи белка 50 мл трубки.
- Ионообменная хроматография: собрать расфасованных MonoQ 4.6/100 PE колонке Быстрая жидкостная хроматография (ПСОК). Промыть колонку с 5 столбцов объемов (CV) в DDW фильтрованной воды. Уравновешенной колонки с 5 CV буфера D.
- Вымойте инъекции петли с DDW (два тома цикла) и повторите с буфером Д. нагрузки белка в инъекции цикла.
- Inject белка образца (скорости потока 1 мл / мин) и начать собирать дробей для SDS-PAGE обнаружения неограниченных белков.
- Если первоначальный объем белка (шаг 3,23) больше, чем инъекции цикл, повторите шаги 3.25-3.26, без стиральной цикл, пока весь образец погружен на колонке.
- Вымойте колонки с 3 CV буфера C, чтобы удалить неограниченной белков.
- Элюции белка с 60 мин линейным градиентом 40 2000мм NaCl между буферами D & E (при 100% буфера Е конца градиента), скорость потока 1 мл / мин (хотя и более высокие скорости потока могут быть использованы в стоимость большие объемы, но менее концентрированный, пики белка). Сбор белки пиков как они представлены в 280 нм хроматограмме.
- Чистая расфасованных колонки по производству рекомендации.
- SDS-PAGE анализа собранных фракций. Такой анализ следует проводить со следующими образцами, неограниченные белков проточные и белковых пиков проточные. Выполнить SDS-PAGE и пятна, как упоминание в шагах 3.17-3.18.
- Оценка гель для существования белка полосы предсказал МВт в соответствии с белком предварительно окрашенный маркером. Слияние выбранных элюирования фракций, которые содержат соответствующие белки.
- Диализировать объединены образцов, с целью снижения концентрации NaCl необходимую для размера хроматографии. Выполните диализа как указано в 3.21-3.23 шаги против буфера F.
- Концентрат белка примера с использованием Vivaspin-15 10000 MWCO до 8 мг / мл в таблице центрифуги, 4000 оборотов в минуту. Проверка желание концентрации путем измерения ОП при 280 нм в кварцевой кювете. Если белок является слишком сосредоточены развести его с буфером F и измерить снова.
- Соберите гель расфасованных колонки, HiLoad 26/60 Superdex 200, на FPLC; мыть колонки с 3 биография DDW фильтрованной воды. Уравновешенной колонки с 3 CV буфера F.
- Вымойте инъекции цикл с 5 мл DDW (два тома цикла), а затем тот же объем буфера Ф. нагрузки не более 4 мл белка в образце инъекции цикла.
- Inject белка образца (скорость потока 3,5 мл / мин) и начать сбор фракций белков пик, как они появляются его 280 нм хроматограмме. Пусть буфер потока, пока не достигнет объем колонки.
- Если первоначальный объем белка (шаг 3,23) больше, чем инъекции цикл, повторите шаги 3.25-3.26, без стиральной цикл, пока весь образец погружен на колонке.
- Чистая расфасованных колонки по производству рекомендации.
- SDS-PAGE анализа собранных фракций. Такой анализ должен быть выполнен с белком пиков образцов. Выполнить SDS-PAGE и пятна, как упоминание в шагах 3.17-3.18.
- Оценка геля: если белок пики конкретного, в правильном предсказал МВт в соответствии с белком предварительно окрашенный маркером, и только одна полоса видна слить выбранные элюировали доли соответствующего белка.
- Концентрат белка примера с использованием Vivaspin-15 10000 MWCO до> 20 мг / мл в таблице центрифуги, 4000 оборотов в минуту. Проверка желание концентрации путем измерения ОП при 280 нм. Очищенной MamAΔ41 затем концентрировали до 26,5 мг / мл для кристаллизации.
- Подтвердить чистоты образца и идентификации белков использованием Matrix-активированная лазерная десорбция / ионизация (MALDI-TOF).
- Если белок очищается в соответствии с масс-спектрометром и SDS-PAGE, разделить сосредоточены MamAΔ41 предварительно помечены Эппендорф труб; 25-50 мкл белка в каждой.
- Флэш замораживали в жидком азоте и хранить при 193 ° К.
4. Представитель Результаты
Когда этот протокол будет сделано правильно, человек должен получать высокой степени очистки, размер однородной и концентрированные образцы белка. Эти белковые образцы готов к кристаллизации испытаний, а также биохимические исследования, такие как фермент кинетики, сродство и многое другое. Описанные здесь представитель результаты основных этапов очистки протокола. SDS-PAGE анализа профиль элюирования Ni-NTA колонке близость должна выявить высоко над выразил белка в растворимой фракции на соответствующих МВт ~ 22kDa (рис. 1). Это SDS-PAGE анализ должен также выявить минимум, если какой-либо белка в неограниченном белков проточный, промойте проточной и ультра-центрифугирования гранулы образца. Если большие полосы соответствующего белка появляются в этих образцах следует учитывать неправильно подготовки буфера, проблемы в разрушение клеток или проблемы в культуре авто-индукции условий и роста.
Ионообменная хроматография предварительно того, чтобы отделить между нашими желательно белка других белков E.coli, которые были связаны с никелем смолы (из-за электростатического взаимодействия или гистидина / отрицательных аминокислот богатой петли белка) и режиссерский His-меткой желательно белка. Эта колонка отделяет белки в соответствии с их сродством к положительно заряженной смолы при увеличении концентрации NaCl. Высоко отрицательно заряженных белка вымывается в высших NaCl концентрации сопоставлять до умеренного отрицательно заряженными. Преимущества этой колонке высокой скорости потока и связывающей способности. Хроматограммы ионного обмена (рис. 2) показывает хорошее разделение между 3 белков населения в увеличении концентрации NaCl. SDS-PAGE анализ необходим для того, чтобы определить МВт каждая популяция, изолируя желательно один и оценка ли дальнейшие шаги очистка не требуется. Первый населения MamAΔ41 (~ 20 кДа), а второе населения MamAΔ41 + Его Tag (~ 22kDa), который был не расщепляется бычьего тромбина и третий населения не обнаруживается в SDS-PAGE из-за низкой концентрации. Если белки пиков не разделены четко следует считать неправильным подготовки буфера или изменение наклона градиента NaCl.
Размер хроматографии исключения предварительно того, чтобы отделить между нашими желательно белка другой клетки E.coli белки, которые были связаны с Ni-NTA смолы и не были отделены в процессе ионообменной хроматографии. Эта колонка отделяет белки в зависимости от их размера. Большие белки будут элюируются в меньших объемах элюирования отличие от маленьких, которые будут элюировали в больших объемах. Колонке хроматограмме (рис. 3) показывает хорошее разделение желательно белка как одна главная населения. Население кажется элюируются в соответствующий размер мономера с МВт ~ 20 кДа. Наличие ~ 80 кДа зоны (E.coli типичные белка, который связывается Ni-NTA смола) обнаруживается в SDS-ПААГ до колонки загрузки и исчезает во время этого запуска. Так как концентрация этого ~ 80 кДа белок низкой для начала, ее население не появляется в хроматограмме из-за его разбавления и SDS-PAGE анализа необходимо, чтобы определить эффективность очистки. Мы рекомендуем загрузки разбавленной и концентрированной выборки основной пик на SDS-PAGE, поэтому можно уверенно определить наличие чистого белка в соответствующем МВт. На этом этапе белок очищается и его однородность должны быть оценены MALDI-TOF. Этот анализ показал, белка в 20347 МВт, да и еще в 10176 МВт Da (рис. 4). ~ 10 кДа белок ~ 20 кДа белок удвоился взимается. Предсказал МВт MamAΔ41 с 9 аминокислот, оставшегося после его-Tag удаление было 20596,5 Да. Сравнивая его с получен MALDI-TOF МВт мы обнаружили, что они 248 Da друг от друга. Это различие может быть результатом MALDI-TOF ошибок измерения и / или из-за общей деградации первый метионин и второй глицина. В заключение, белок высокой степени очистки и может быть использована для дальнейших экспериментов.
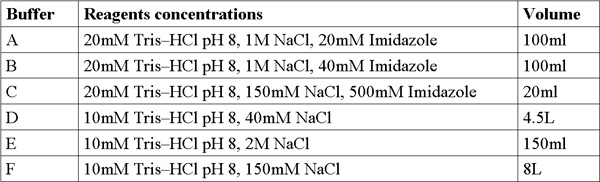
Таблица 1. Буфер формулировок.
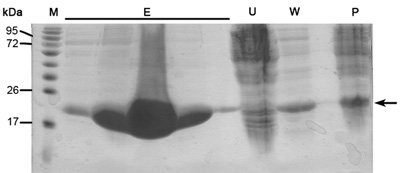
Рисунок 1. Представитель SDS-PAGE анализа Ni-NTA колонке очистки Справа налево;. Р-ультра-центрифуги гранул (3,11 протокол шаг), W-мыть (3,12 протокол шаг), U-неограниченная белков (3,10 протокол шаг), E- пять полос элюирования SAMPле (3,14 протокол шаг), М - белка маркера (номера указывают МВт). Стрелка указывает MamAΔ41.
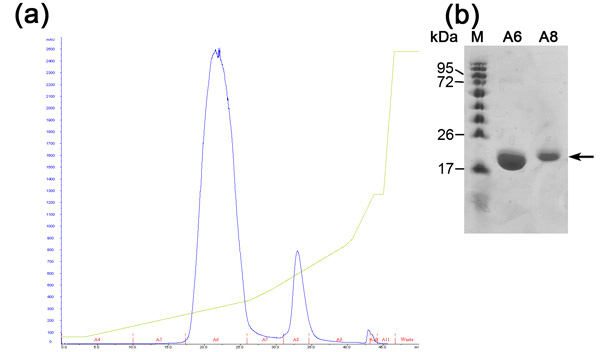
Рисунок 2. Анализ ионообменной хроматографии стадии (а) ионный обмен (MonoQ колонка) хроматограммы; Blue - поглощения 280 нм, представляет собой концентрацию белка, Green-NaCl концентрации, красный - указание фракций собираются. (Б) представитель SDS-PAGE анализа этап очистки ионного обмена. Слева направо; М - белка маркера (номера указывают МВт), A6 - первая фракция пик, А8-второй пик фракции.

Рисунок 3. Размер хроматографии анализ () Размер исключения (Superdex 200 столбцов) хроматограммы; Blue - поглощения 280 нм, представляет собой концентрацию белка, Красный указанием фракций собираются. (Б) представитель SDS-PAGE анализа шага очистки исключения. Слева направо; М-белка маркера (номера указывают МВт), PreI-предварительно вводили образца, А4-6 комбинированных доля собранных из первого пика, A4-6D-Разводненная доля собранных из пике.
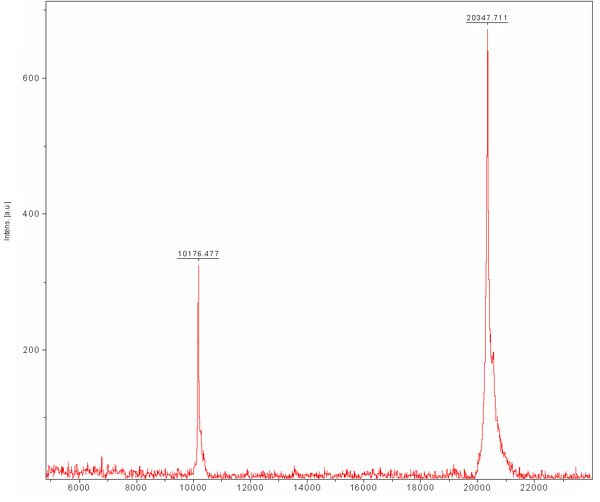
Рисунок 4. Matrix-активированная лазерная десорбция / ионизация (MALDI-TOF) масс-спектр очищенного MamAΔ41. Матрицы Sinapic кислота (SA). MamAΔ41 показан на 20347 Да, также показана удвоилось взимается видов MamAΔ41 на 10176 Да.
Обсуждение
Белки очистки является основным шагом в любом белков биохимические или структурные исследования. С каждого белка уникальна своим собственным поведением, нужно определить его свойства и изменить его очистки соответственно. Белка-мишени должны быть проанализированы как первый шаг на ?...
Благодарности
Мы признаем, д-р Амир Ахарони за поддержку и Геула Давыдов, Ноам Гримберг и Чэнь Гутман за их советы и комментарии.
Материалы
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Name | Company | Catalog Number | Comments | |
| French Press | Equipment | Thermo scientific | FA-078A | |
| Pressure cell | Equipment | Thermo scientific | FA-032 | |
| Ultra-centrifuge | Equipment | Sorvall | Discovery 90SE | |
| Rottor | Equipment | Beckman | Ti60 | |
| Ultra-centrifuge tubes; PC-Bottle+Cap Assay 26.3ml | Equipment | Beckman | BC-355618 | |
| 2.5cm diameter, Glass Econo-Column Chromatography Columns | Equipment | BioRad | 737-2521 | |
| Ni-NTA His Bind resin | Equipment | Novagen | M0063428 | |
| Spectrophotometer | Equipment | Amersham Biosiences | Ultraspec 2100 pro | |
| Quartz cuvette | Equipment | Hellma | 104-QS | |
| Fast Performance Liquid Chromatography- AKTA purifier 10 | Equipment | GE Healthcare Biosciences | 28-4062-64 | |
| Ion exchange column – MonoQ 4.6/100 PE | Equipment | GE Healthcare Biosciences | 10025543 | |
| Size exclusion pre-packed column-HiLoad 26/60 Superdex 200 | Equipment | GE Healthcare Biosciences | 17-1071-01 | |
| Centricon - Vivaspin15 – 10,000 MWCO | Equipment | Sartorius Stedim Biotech GmbH | VS1501 | |
| Table centrifuge | Equipment | Thermo scientific | IEC CL30R | |
| MALDI-TOF | Equipment | Bruker Daltonics | Reflex IV | |
| Tris-HCl (hydrotymethyl) aminomethane | Reagent | BioLab | 20092391 | |
| Sodium Chloride | Reagent | FRUTROM | 235553470 | |
| Imidazole | Reagent | Alfa Aesar | 288-32-4 | |
| EDTA free protease inhibitors cocktail | Reagent | Sigma | P-8849 | |
| Dnase I (Deoxyribonuclease I) | Reagent | Sigma | DN-25 | |
| Bovine Thrombin | Reagent | Fisher BioReagents | BP25432 | |
| Glycine | Reagent | BioLab | 07132391 | |
| Soudim Dodecyl Sulfate (SDS) | Reagent | BioLab | 19822391 | |
| Beta-mercaptoethanol | Reagent | Sigma | M-3148 | |
| InstantBlue | Reagent | Expedeon | 1SB01L | |
| PageRuler Prestained Protein Ladder | Reagent | Fermentas | SM0671 |
Ссылки
- Faivre, D., Schuler, D. Magnetotactic Bacteria and Magnetosomes. Chem Rev. 108, 4875-4898 (2008).
- D'Andrea, L. D., Regan, L. TPR proteins: the versatile helix. Trends Biochem Sci. 28, 655-662 (2003).
- Young, J. C., Barral, J. M., Hartl, U. l. r. i. c. h., F, . More than folding: localized functions of cytosolic chaperones. Trends Biochem Sci. 28, 541-547 (2003).
- Brocard, C., Hartig, A. Peroxisome targeting signal 1: is it really a simple tripeptide?. Biochim Biophys Acta. 1763, 1565-1573 (2006).
- Fransen, M., Amery, L., Hartig, A., Brees, C., Rabijns, A., Mannaerts, G. P., Van Veldhoven, P. P. Comparison of the PTS1- and Rab8b-binding properties of Pex5p and Pex5Rp/TRIP8b. Biochim Biophys Acta. 1783, 864-873 (2008).
- Baker, M. J., Frazier, A. E., Gulbis, J. M., Ryan, M. T. Mitochondrial protein-import machinery: correlating structure with function. Trends Cell Biol. 17, 456-464 (2007).
- Mirus, O., Bionda, T., von Haeseler, A., Schleiff, E. Evolutionarily evolved discriminators in the 3-TPR domain of the Toc64 family involved in protein translocation at the outer membrane of chloroplasts and mitochondria. J Mol Model. 15, 971-982 (2009).
- Gatsos, X., Perry, A. J., Anwari, K., Dolezal, P., Wolynec, P. P., Likic, V. A., Purcell, A. W., Buchanan, S. K., Lithgow, T. Protein secretion and outer membrane assembly in Alphaproteobacteria. FEMS Microbiol Rev. 32, 995-1009 (2008).
- Tiwari, D., Singh, R. K., Goswami, K., Verma, S. K., Prakash, B., Nandicoori, V. K. Key residues in Mycobacterium tuberculosis protein kinase G play a role in regulating kinase activity and survival in the host. J Biol Chem. 284, 27467-27479 (2009).
- Edqvist, P. J., Broms, J. E., Betts, H. J., Forsberg, A., Pallen, M. J., Francis, M. S. Tetratricopeptide repeats in the type III secretion chaperone, LcrH: their role in substrate binding and secretion. Mol Microbiol. 59, 31-44 (2006).
- Grunberg, K., Muller, E. C., Otto, A., Reszka, R., Linder, D., Kube, M., Reinhardt, R., Schuler, D. Biochemical and proteomic analysis of the magnetosome membrane in Magnetospirillum gryphiswaldense. Appl Environ Microbiol. 70, 1040-1050 (2004).
- Komeili, A., Vali, H., Beveridge, T. J., Newman, D. K. Magnetosome vesicles are present before magnetite formation, and MamA is required for their activation. Proc Natl Acad Sci USA. 101, 3839-3843 (2004).
- Okuda, Y., Fukumori, Y. Expression and characterization of a magnetosome-associated protein, TPR-containing MAM22, in Escherichia coli. FEBS Lett. 491, 169-173 (2001).
- Taoka, A., Asada, R., Sasaki, H., Anzawa, K., Wu, L. F., Fukumori, Y. Spatial localizations of Mam22 and Mam12 in the magnetosomes of Magnetospirillum magnetotacticum. J Bacteriol. 188, 3805-3812 (2006).
- Studier, F. W. Protein production by auto-induction in high density shaking cultures. Protein Expression and Purification. 41, 207-234 (2005).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены