È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Purificazione della M. magneticum Strain AMB-1 proteina Magnetosome Associated MamAΔ41
In questo articolo
Riepilogo
Mama è un unico Magnetosome proteina associata che ha dimostrato di essere coinvolti nella attivazione magnetosome. Qui vi presentiamo il protocollo di purificazione di Mama cancellazione mutante (MamAΔ41) da M. magneticum AMB-1.
Abstract
Batteri magnetotactic comprendono un gruppo eterogeneo di microrganismi acquatici che sono in grado di orientarsi lungo i campi geomagnetici. Questo comportamento è creduto per aiutare la loro ricerca di ambienti adatti
Protocollo
1. Clonazione ed espressione di Mama Gene in E. coli
Il gene mutante mamAΔ41 è stato amplificato utilizzando la reazione a catena della polimerasi (PCR) dal DNA genomico di Magnetospirillum magneticum AMB-1, con primer: 5'-GCATTACGCATATGGACGACATCCGCCAGGTG-3 'e 5'-GCGCGGCAGCCATA-TGGCATACG-3'. Nei frammenti di DNA amplificato, un sito che NcoI è stato introdotto al codone di inizio ATG e il codone di terminazione è stata sostituita con un sito ScoI. I frammenti sono stati digeriti con NcoI e Saci e clonato nei rispettivi siti di pET52b (+), dando luogo a pET52bMamAΔ41-AMB1. In questo costrutto, il gene è stato fuso mamAΔ41 in-frame con il suo tag-10 al C-terminale. Il plasmide è stato elettroporate in ceppo di E. coli BL21. E. coli ceppo BL21 ospitare pET52bMamAΔ41 è stato coltivato in auto-induzione (15) su terreno contenente ampicillina (50 mg / ml) 310 ° K per 3 ore. La temperatura di coltivazione è stato poi spostato da 310 ° a 300 ° K e mantenuti per ulteriori 48 ore a 300 ° K. Le cellule sono state raccolte mediante centrifugazione a 5465g per 10 min a 277 ° K. 8 litri cultura prodotta 60 grammi di pellet umido.
2. Bioinformatica Calcoli
I calcoli di peso molecolare (MW), secondo la sequenza aminoacidi acidi e l'assorbimento previsto di 1mg/1ml di proteine a 280 nm, utilizzando il server ProtParam (http://www.expasy.ch/tools/protparam.html). Per 10His-Tag-MamAΔ41 il MW è 22.529 Da (240 aminoacidi) e per MamAΔ41 (con 9 aminoacidi sinistra dopo la sua rimozione dal tag-trombina) il Mw è 20596.5Da (187 aminoacidi). L'assorbimento del predetto 1mg/1ml di proteine a 280 nm per 10His-Tag-MamAΔ41 è 0,595 e per MamAΔ41 è 0,579. Inoltre, la sequenza di amminoacidi non contiene residui di cisteina. Pertanto, agenti riducenti non sono richiesti durante il processo di purificazione.
3. Purificazione di MamAΔ41
- Per la preparazione delle soluzioni madre, pesare e preparare (200 ml) nelle concentrazioni seguenti: imidazolo (MW 228,2 g / mol) 4M soluzione NaCl (Mw 58,44 g / mol) 5M soluzione, Tris-HCl (Mw 121,3 g / mol soluzione) 1M, aggiustare il pH = 8. Aggiungere acqua bidistillata (DDW) e miscelare con un vortice fino a quando la soluzione è limpida. Soluzioni di filtraggio con filtro 0.22μm e conservare a temperatura ambiente.
- Preparare e filtro 6 tamponi freschi soluzioni di riserva (Tabella 1).
- Diluire e sospendere le cellule in un tampone di A in rapporto 1:2, grammi di cellule per tamponare volume (ml).
- Aggiungere 10μl per ogni 10gr di batteri di DNasi I (1 mg / ml) al fine di rompere frammenti di DNA nel campione. Aggiungere 1ml per ogni 20gr di batteri di cocktail EDTA inibitore della proteasi libero. Incubare per 20 minuti sul ghiaccio.
- Turbativa celle da due cicli di stampa francese a 25.000 psi. A differenza di sonicazione, la stampa francese si rivolge ad alto volume (10 ml>) estrusione in cella forzando le cellule ad alta pressione attraverso un orifizio sottile. Il pistone deve essere raffreddato in ghiaccio per dieci minuti prima del suo utilizzo e il montaggio a causa di accumulo di temperatura.
- Trasferire le cellule lisate in provette da 25 ml ultracentrifuga ed equilibrio con precisione (50mg) con tampone A fino a quando l'esemplare ha raggiunto la linea del collo del tubo s.
- Detriti cellulari Ultra separata per centrifugazione a 270.000 g per 1 ora a 277 ° K.
- Preparare una casa colonna gravità Ni NTA (2,5 cm di diametro) con l'aggiunta di 4 ml di Ni NTA resina, che si conserva in etanolo al 20%, sulla colonna. Lasciar cadere del tutto fluido, quindi lavare con 40 ml di DDW e lasciar cadere del tutto fluido. Pre-equilibrata la resina nella colonna con 40 ml di tampone A.
- Applicare la frazione solubile da ultra-centrifugazione tubi sulla colonna gravità Ni NTA. Lasciar cadere liquido, raccogliere flow-through (non legato) e conservare a 277K.
- Raccogliere campioni di pellet da ultra-centrifugazione tubi utilizzando una piccola mancia per la demolizione del pellet. Mescolare la punta in 50μl del 5% β-mercaptoetanolo in 2X SDS-PAGE tampone del campione.
- Lavare la colonna con 100 ml di tampone B. Lasciate che la goccia fluida, raccogliere flow-through e preservare a 277K.
- Preparare 15 segnato tubi eppendorf (1,5 ml).
- Eluizione - valvola colonna stretta e quindi caricare 1 ml di tampone C nella colonna; incubare per 3 minuti seguito da apertura della valvola e di flusso attraverso la raccolta. Ripetere questa operazione tre volte.
- Resto eluire di sospensione a incrementi di 1 ml di tampone C e chiudere la valvola.
- Misura OD a 280 nm delle frazioni e di valutare la localizzazione del picco proteine, se l'OD è ancora> 0,3, campioni supplementari sono necessari.
- SDS-PAGE analisi delle frazioni raccolte. Tale analisi deve essere eseguita anche con gli esempi seguenti, le proteine non legato flow-through, lavare flow-through e uLTRA-pellet centrifugazione del campione. Mescolare 10μl di ciascun campione con 10μl del 5% β-mercaptoetanolo in 2X SDS-PAGE tampone del campione. Caricare i campioni, il 15% SDS-PAGE e correre per 45 minuti a 180 Volt.
- Macchia il gel in 15 ml di soluzione InstantBlue, agitare per 1 ora. Assicurarsi che la scatola di plastica è coperto e protetto dalla luce.
- Valutare gel, se espressione della proteina è alta e specifiche in base alle fasce indicative, unione selezionato frazioni eluite.
- Al fine di rimuovere 10-His-tag, aggiungere trombina di origine bovina (10 unità / mL), 10μl trombina per 1 mg di proteina, secondo le indicazioni del produttore per il campione combinato.
- La dialisi è utilizzato per eccesso di rimozione imidazolo e diminuire le concentrazioni di NaCl per i livelli necessari durante l'associazione a scambio ionico. Per dialisi, lunghezza desiderata di 7 kD peso molecolare tagliato fuori (MWCO) tubi di dialisi. Lavare con DDW e fare un nodo ad una estremità (o sigillo con clips). Trasferire la soluzione proteina fusa sulla borsa lasciando qualche spazio in alto e morsetto in su.
- Immergere il tubo di dialisi in 4 buffer di dialisi litri refrigerato (Buffer D). Agitare la soluzione lentamente durante la notte a 277 ° K.
- Estrarre il tubo di dialisi del bicchiere, fare un taglio piccolo e trasferire la proteina a tubo 50ml.
- Cromatografia a scambio ionico: assemblare preconfezionati MonoQ 4.6/100 colonna PE sul veloce Performance Liquid Chromatography (FPLC). Lavare la colonna con 5 volumi di colonna (CV) di DDW acqua filtrata. Equilibrata la colonna con 5 CV di tampone D.
- Lavare il ciclo di iniezione con DDW (due volumi loop) e ripetere con il tampone D. carico della proteina nel ciclo di iniezione.
- Iniettare il campione (flusso di 1 ml / min) e iniziare a raccogliere frazioni per SDS-PAGE rilevazione di proteine senza limiti.
- Se il volume delle proteine iniziale (passo 3.23) è più grande ansa di iniezione, ripetere i passaggi 3,25-3,26, senza lavare il ciclo, fino a quando l'intero campione è stato caricato su colonna.
- Lavare la colonna con 3 CV di tampone C al fine di rimuovere le proteine illimitato.
- Eluire la proteina con un gradiente di 60 min lineare di 40 2000mm NaCl tra i respingenti D & E (quando E tampone al 100% è la fine del gradiente), portata 1 ml / min (anche se portate superiori può essere utilizzato nel costo del volumi più grandi, ma meno concentrati, i picchi delle proteine). Raccogliere i picchi proteine come appaiono nel cromatogramma 280nm.
- Pulire preconfezionati colonna in base alla produzione di raccomandazione.
- SDS-PAGE analisi delle frazioni raccolte. Tale analisi deve essere eseguita con i seguenti esempi, le proteine illimitata flow-through e proteine picchi di deflusso. Eseguire la SDS-PAGE e macchia menzione in passi 3,17-3,18.
- Valutare gel per l'esistenza di proteine bande al Mw previsto secondo il marcatore proteico pre-colorato. Unisci frazioni di eluizione selezionate che contengono la proteina in questione.
- Dializzare i campioni fusa, in modo da abbassare le concentrazioni di NaCl necessaria per cromatografia dimensione esclusione. Eseguire la dialisi, come indicato nei passi 3,21-3,23 contro tampone F.
- Concentrare il campione di proteine con un Vivaspin-15 10000 MWCO a 8 mg / ml in una centrifuga da tavolo, 4000 rpm. Convalidare concentrazione desiderio da parte delle DO a 280 nm in cuvette al quarzo. Se la proteina è troppo concentrato diluirla con F tampone e misurare di nuovo.
- Montare l'esclusione dimensioni preconfezionati colonna, HiLoad 26/60 Superdex 200, su FPLC; lavare la colonna con 3 CV di DDW acqua filtrata. Equilibrata la colonna con 3 CV di tampone F.
- Lavare ciclo di iniezione con DDW 5ml (due volumi loop) seguito da stesso volume con il tampone di F. carico non più di 4 ml del campione di proteine nel ciclo di iniezione.
- Iniettare il campione (portata di 3,5 ml / min) e iniziare a raccogliere frazioni di picco proteine come appaiono lo cromatogramma 280nm. Lasciate che il flusso del buffer fino a raggiungere il volume della colonna.
- Se il volume delle proteine iniziale (passo 3.23) è più grande ansa di iniezione, ripetere i passaggi 3,25-3,26, senza lavare il ciclo, fino a quando l'intero campione è stato caricato su colonna.
- Pulire preconfezionati colonna secondo le raccomandazioni fabbricazione.
- SDS-PAGE analisi delle frazioni raccolte. Tale analisi deve essere eseguita con i campioni di proteine picchi. Eseguire la SDS-PAGE e macchia menzione in passi 3,17-3,18.
- Valutare gel: se i picchi sono proteine specifiche, nella corretta Mw previsto secondo il marcatore proteico pre-colorati e una sola banda è visibile unione selezionato frazioni eluizione della proteina in questione.
- Concentrato campione di proteine con un-15 Vivaspin 10.000 MWCO a> 20 mg / ml in una centrifuga da tavolo, 4000 rpm. Convalidare concentrazione desiderio da parte delle DO a 280 nm. Il MamAΔ41 purificato è stato poi concentrato a 26,5 mg / ml per la cristallizzazione.
- Conferma la purezza del campione e l'identificazione delle proteine con Matrix-assisted laser desorbimento / ionizzazione (MALDI-TOF).
- Se la proteina è purificata secondo spettrometro di massa e SDS-PAGE, dividere il MamAΔ41 concentrato di pre-marcato tubi eppendorf; 25-50μl proteina in ciascuno.
- Flash congelati in azoto liquido e conservare a 193 ° K.
4. Rappresentante Risultati
Quando questo protocollo è fatto correttamente si dovrebbe ottenere altamente purificato, campioni di proteine grandezza omogenea e concentrata. Questi campioni di proteine sono pronti per le prove di cristallizzazione e studi biochimici, come la cinetica enzimatica, affinità di legame e di più. Qui descritte sono risultati rappresentativi delle fasi essenziali del protocollo di purificazione. SDS-PAGE L'analisi del profilo di eluizione di Ni-NTA colonna di affinità dovrebbe rivelare molto più di proteina espressa nella frazione solubile in MW appropriati di circa 22kDa (Figura 1). Questa SDS-PAGE analisi dovrebbe anche rivelare minimo eventuali proteine nelle proteine sconfinato flusso continuo, lavare flow-through e ultra-centrifugazione del campione di pellet. Se grandi fasce della proteina appropriati appaiono in questi campioni si dovrebbe considerare la preparazione sbagliata tampone, problemi di rottura delle cellule in coltura o problemi di auto-induzione condizioni e la crescita.
Cromatografia a scambio ionico è preformato per separare tra la nostra proteina auspicabile altre proteine E.coli che erano legati alla resina nichel (a causa di interazioni elettrostatiche o istidina / negativo amino acidi ricchi di proteine loop) e non tagliato His-tag proteina desiderabile. Questa colonna separa le proteine in base alla loro affinità di legame alla resina carica positiva con concentrazioni crescenti di NaCl. Proteina forte carica negativa si eluire in concentrazioni più elevate di NaCl appose a moderata quelli a carica negativa. I vantaggi di questa colonna sono elevata portata e capacità di legame. Il cromatogramma a scambio ionico (Figura 2) rivela una buona separazione tra i 3 popolazioni di proteine per aumentare la concentrazione di NaCl. SDS-PAGE analisi è necessaria al fine di determinare MW di ciascuna popolazione, isolando quella desiderabile e valutare se le fasi di depurazione sono necessarie ulteriori. La popolazione prima è MamAΔ41 (~ 20 kDa) mentre la seconda popolazione è MamAΔ41 + Il suo Tag (~ 22kDa) che non è stata tagliata da trombina bovina e la popolazione terzo è rilevabile in SDS-PAGE a causa di bassa concentrazione. Se i picchi proteine non sono separate in modo chiaro si dovrebbe considerare la preparazione sbagliata tampone o modificare la pendenza del gradiente di NaCl.
Esclusione cromatografia dimensione è preformato per separare tra la nostra proteina auspicabile altre proteine cellulari E.coli che erano legati al Ni-NTA resina e non sono stati separati durante la cromatografia a scambio ionico. Questa colonna separa le proteine in base alle loro dimensioni. Proteine di grandi dimensioni si eluire in volumi di eluizione più piccoli rispetto a quelli più piccoli che verranno eluiti in grandi volumi. Il cromatogramma colonna (figura 3) mostra una buona separazione della proteina desiderabile come una popolazione principale. La popolazione sembra eluire monomero di dimensioni adeguate con un MW di ~ 20 kDa. La presenza di banda ~ 80 kDa (proteina E.coli tipico che si lega al Ni-NTA resina) viene rilevato in SDS-PAGE prima del caricamento della colonna e scompare durante questa corsa. Poiché la concentrazione di questa proteina 80 kDa ~ è basso per cominciare, la sua popolazione non appare nel cromatogramma a causa della sua diluizione e SDS-PAGE analisi è necessaria per determinare l'efficienza di purificazione. Si consiglia di caricare un campione diluito e concentrato del picco principale al SDS-PAGE così si poteva sicuramente determinare la presenza di una proteina pura in MW appropriato. A questo punto la proteina è purificata e la sua omogeneità dovrebbe essere valutata con MALDI-TOF. Questa analisi ha rivelato una proteina in MW di 20347 Da e un altro in Mw di 10.176 Da (Figura 4). I 10 kDa ~ è la proteina 20 kDa ~ raddoppiato carica. La MW previsto di MamAΔ41 con i 9 aminoacidi sinistra dopo la sua rimozione è stata-Tag Da 20596,5. Confrontandolo con il ottenute MALDI-TOF MW abbiamo scoperto che sono 248 Da parte. Questa diversità può derivare da MALDI-TOF errori di misura e / o causa di degrado comune della metionina primo e il secondo glicina. Per concludere, la proteina è altamente purificato e può essere utilizzato per ulteriori esperimenti.
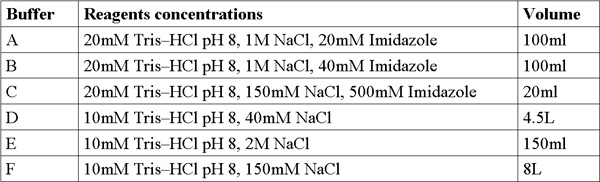
Tabella 1. Formulazioni tampone.
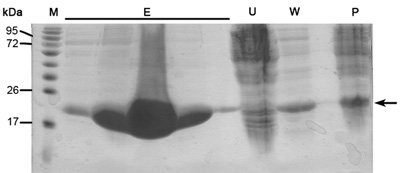
Figura 1. Rappresentante SDS-PAGE analisi di Ni-NTA purificazione colonna Da destra a sinistra;. P-ultra-centrifuga a pellet (3.11 passo protocollo), W-wash (3.12 passo protocollo), U-illimitata proteine (3.10 passo protocollo), E- cinque corsie di eluizione samples (3,14 passo protocollo), M - marker di proteine (i numeri indicano MW). La freccia indica MamAΔ41.
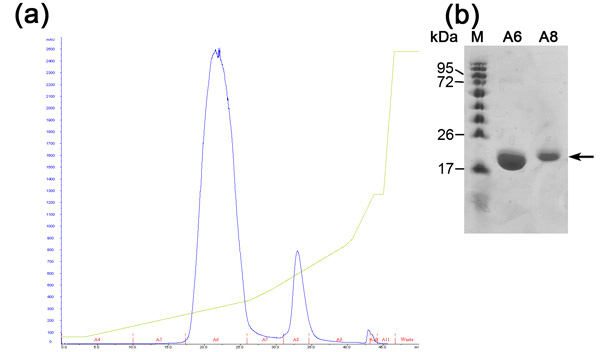
Figura 2. Analisi del passo cromatografia a scambio ionico (a) a scambio ionico (colonna MonoQ) cromatogramma; Blu - 280nm assorbimento, rappresenta la concentrazione di proteine, Green-NaCl concentrazione, Rosso - l'indicazione delle frazioni raccolte. (B) Rappresentante SDS-PAGE analisi della fase di purificazione a scambio ionico. Da sinistra a destra; M - marker di proteine (i numeri indicano Mw), A6 - frazione primo picco, A8-secondo frazione di picco.

Figura 3. Esclusione analisi cromatografia dimensioni (a) esclusione Dimensioni (200 Superdex colonna) cromatogramma; Blu - 280nm assorbimento, rappresenta la concentrazione di proteine, indicazione Rosso delle frazioni raccolte. (B) Rappresentante SDS-PAGE analisi di fase di purificazione esclusione dimensioni. Da sinistra a destra; M-proteina marker (i numeri indicano MW), Prei-pre-iniezione del campione, A4-6 frazione combinato raccolti dal primo picco, A4-6D-diluiti frazione raccolta dalla vetta.
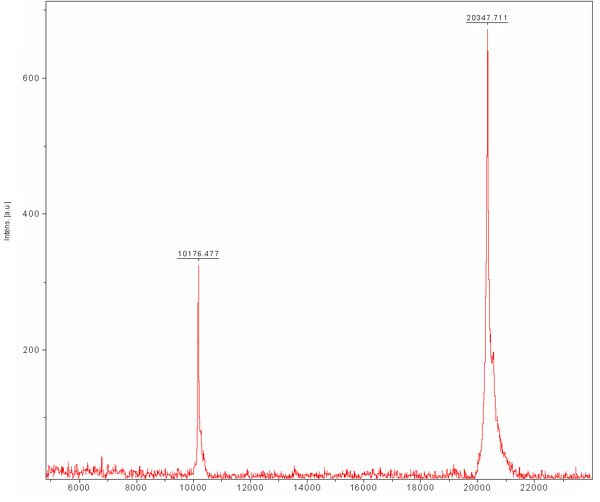
Figura 4. Matrix-assisted laser desorbimento / ionizzazione (MALDI-TOF) spettro di massa di purificato MamAΔ41. La matrice è l'acido Sinapic (SA). MamAΔ41 mostrato a 20347 Da, anche mostrato è la specie raddoppiato carica di MamAΔ41 a 10176 Da.
Discussione
Purificazione di proteine è il passo principale in qualsiasi biochimica delle proteine o studi strutturali. Dato che ogni proteina è unico, con il proprio comportamento, si ha la necessità di definire le sue proprietà e modificare di conseguenza la sua purificazione. Obiettivo di proteine deve essere analizzato come un primo passo verso la purificazione mediante strumenti bioinformatici. Sono utilizzati per calcolare la iso-elettrico punto di destinazione, valutare la sua necessità di ridurre / os...
Riconoscimenti
Noi riconosciamo il dottor Amir Aharoni per il suo sostegno e Gheula Davidov, Noam Grimberg e Chen Guttman per i loro consigli e commenti.
Materiali
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Name | Company | Catalog Number | Comments | |
| French Press | Equipment | Thermo scientific | FA-078A | |
| Pressure cell | Equipment | Thermo scientific | FA-032 | |
| Ultra-centrifuge | Equipment | Sorvall | Discovery 90SE | |
| Rottor | Equipment | Beckman | Ti60 | |
| Ultra-centrifuge tubes; PC-Bottle+Cap Assay 26.3ml | Equipment | Beckman | BC-355618 | |
| 2.5cm diameter, Glass Econo-Column Chromatography Columns | Equipment | BioRad | 737-2521 | |
| Ni-NTA His Bind resin | Equipment | Novagen | M0063428 | |
| Spectrophotometer | Equipment | Amersham Biosiences | Ultraspec 2100 pro | |
| Quartz cuvette | Equipment | Hellma | 104-QS | |
| Fast Performance Liquid Chromatography- AKTA purifier 10 | Equipment | GE Healthcare Biosciences | 28-4062-64 | |
| Ion exchange column – MonoQ 4.6/100 PE | Equipment | GE Healthcare Biosciences | 10025543 | |
| Size exclusion pre-packed column-HiLoad 26/60 Superdex 200 | Equipment | GE Healthcare Biosciences | 17-1071-01 | |
| Centricon - Vivaspin15 – 10,000 MWCO | Equipment | Sartorius Stedim Biotech GmbH | VS1501 | |
| Table centrifuge | Equipment | Thermo scientific | IEC CL30R | |
| MALDI-TOF | Equipment | Bruker Daltonics | Reflex IV | |
| Tris-HCl (hydrotymethyl) aminomethane | Reagent | BioLab | 20092391 | |
| Sodium Chloride | Reagent | FRUTROM | 235553470 | |
| Imidazole | Reagent | Alfa Aesar | 288-32-4 | |
| EDTA free protease inhibitors cocktail | Reagent | Sigma | P-8849 | |
| Dnase I (Deoxyribonuclease I) | Reagent | Sigma | DN-25 | |
| Bovine Thrombin | Reagent | Fisher BioReagents | BP25432 | |
| Glycine | Reagent | BioLab | 07132391 | |
| Soudim Dodecyl Sulfate (SDS) | Reagent | BioLab | 19822391 | |
| Beta-mercaptoethanol | Reagent | Sigma | M-3148 | |
| InstantBlue | Reagent | Expedeon | 1SB01L | |
| PageRuler Prestained Protein Ladder | Reagent | Fermentas | SM0671 |
Riferimenti
- Faivre, D., Schuler, D. Magnetotactic Bacteria and Magnetosomes. Chem Rev. 108, 4875-4898 (2008).
- D'Andrea, L. D., Regan, L. TPR proteins: the versatile helix. Trends Biochem Sci. 28, 655-662 (2003).
- Young, J. C., Barral, J. M., Hartl, U. l. r. i. c. h., F, . More than folding: localized functions of cytosolic chaperones. Trends Biochem Sci. 28, 541-547 (2003).
- Brocard, C., Hartig, A. Peroxisome targeting signal 1: is it really a simple tripeptide?. Biochim Biophys Acta. 1763, 1565-1573 (2006).
- Fransen, M., Amery, L., Hartig, A., Brees, C., Rabijns, A., Mannaerts, G. P., Van Veldhoven, P. P. Comparison of the PTS1- and Rab8b-binding properties of Pex5p and Pex5Rp/TRIP8b. Biochim Biophys Acta. 1783, 864-873 (2008).
- Baker, M. J., Frazier, A. E., Gulbis, J. M., Ryan, M. T. Mitochondrial protein-import machinery: correlating structure with function. Trends Cell Biol. 17, 456-464 (2007).
- Mirus, O., Bionda, T., von Haeseler, A., Schleiff, E. Evolutionarily evolved discriminators in the 3-TPR domain of the Toc64 family involved in protein translocation at the outer membrane of chloroplasts and mitochondria. J Mol Model. 15, 971-982 (2009).
- Gatsos, X., Perry, A. J., Anwari, K., Dolezal, P., Wolynec, P. P., Likic, V. A., Purcell, A. W., Buchanan, S. K., Lithgow, T. Protein secretion and outer membrane assembly in Alphaproteobacteria. FEMS Microbiol Rev. 32, 995-1009 (2008).
- Tiwari, D., Singh, R. K., Goswami, K., Verma, S. K., Prakash, B., Nandicoori, V. K. Key residues in Mycobacterium tuberculosis protein kinase G play a role in regulating kinase activity and survival in the host. J Biol Chem. 284, 27467-27479 (2009).
- Edqvist, P. J., Broms, J. E., Betts, H. J., Forsberg, A., Pallen, M. J., Francis, M. S. Tetratricopeptide repeats in the type III secretion chaperone, LcrH: their role in substrate binding and secretion. Mol Microbiol. 59, 31-44 (2006).
- Grunberg, K., Muller, E. C., Otto, A., Reszka, R., Linder, D., Kube, M., Reinhardt, R., Schuler, D. Biochemical and proteomic analysis of the magnetosome membrane in Magnetospirillum gryphiswaldense. Appl Environ Microbiol. 70, 1040-1050 (2004).
- Komeili, A., Vali, H., Beveridge, T. J., Newman, D. K. Magnetosome vesicles are present before magnetite formation, and MamA is required for their activation. Proc Natl Acad Sci USA. 101, 3839-3843 (2004).
- Okuda, Y., Fukumori, Y. Expression and characterization of a magnetosome-associated protein, TPR-containing MAM22, in Escherichia coli. FEBS Lett. 491, 169-173 (2001).
- Taoka, A., Asada, R., Sasaki, H., Anzawa, K., Wu, L. F., Fukumori, Y. Spatial localizations of Mam22 and Mam12 in the magnetosomes of Magnetospirillum magnetotacticum. J Bacteriol. 188, 3805-3812 (2006).
- Studier, F. W. Protein production by auto-induction in high density shaking cultures. Protein Expression and Purification. 41, 207-234 (2005).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon