Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La purificación de la M. magneticum Tensión AMB-1 magnetosomas proteína asociada MamAΔ41
En este artículo
Resumen
Mamá es una única proteína magnetosomas asociados, que ha demostrado ser involucrados en la activación de magnetosomas. Aquí se presenta el protocolo de purificación de Mama supresión mutante (MamAΔ41) de M. magneticum AMB-1.
Resumen
Las bacterias magnetotácticas comprenden un grupo heterogéneo de microorganismos acuáticos que son capaces de orientarse a lo largo de los campos geomagnéticos. Este comportamiento se cree para ayudar a su búsqueda de ambientes adecuados
Protocolo
1. Clonación y expresión de genes en E. mamá coli
El gen mutante mamAΔ41 se amplificó mediante la reacción en cadena de la polimerasa (PCR) de ADN genómico de Magnetospirillum magneticum AMB-1, con los cebadores: 5'-GCATTACGCATATGGACGACATCCGCCAGGTG-3 'y 5'-GCGCGGCAGCCATA-TGGCATACG-3'. En los fragmentos de ADN amplificados, un sitio NcoI se introdujo en el codón de iniciación ATG y el codón de terminación fue sustituido por un sitio de SCOI. Los fragmentos fueron digeridos con NcoI y SacI y se clonó en los respectivos sitios de pET52b (+), dando lugar a pET52bMamAΔ41-AMB1. En esta construcción, el gen mamAΔ41 se fusionó en marco con el Su 10-etiqueta en el C-terminal. El plásmido se electroporación en la cepa de E. coli BL21. Cepa de E. coli BL21 albergar pET52bMamAΔ41 se cultivó en auto-inducción (15) un medio que contiene ampicilina (50 mg / ml) 310 ° K durante 3 horas. La temperatura de cultivo fue cambiado luego de 310 ° a 300 ° K y mantenido durante 48 horas a 300 ° K. Las células fueron cosechadas por centrifugación a 5465g durante 10 minutos a 277 ° K. 8 litros cultura produce 60 gramos de celda húmeda de pellets.
2. Bioinformática cálculos
Los cálculos de peso molecular (MW), de acuerdo a la secuencia de aminoácidos y la absorción prevista de 1mg/1ml de proteína en 280 nm, utilizando el servidor ProtParam (http://www.expasy.ch/tools/protparam.html). Para 10His-Tag-MamAΔ41 el MW es 22.529 Da (240 aminoácidos) y de MamAΔ41 (con 9 aminoácidos izquierda después de su etiqueta de eliminación de la trombina) es el Mw 20596.5Da (187 aminoácidos). La absorción prevista de 1mg/1ml de proteína en 280 nm para 10His-Tag-MamAΔ41 es 0,595 y 0,579 para MamAΔ41 es. Además, la secuencia de aminoácidos no contiene residuos de cisteína. Por lo tanto, agentes reductores no son necesarios durante el proceso de purificación.
3. La purificación de MamAΔ41
- De preparación de la solución, pesar y preparar (200 ml cada una) en las siguientes concentraciones: imidazol (228,2 MW g / mol) solución de 4M, NaCl (Mw 58,44 g / mol) solución 5 M, Tris-HCl (121,3 Mw g / mol solución) 1 M, ajustar el pH = 8. Agregue el agua doblemente destilada (DDW) y se mezcla con un vórtex hasta que la solución es clara. Soluciones de filtro con filtro de 0.22μm y mantener a temperatura ambiente.
- Preparar y filtro 6 buffers frescos de las soluciones madre (Tabla 1).
- Diluir y suspender las células en un buffer de volumen en relación 1:2, los gramos de células en el búfer (ml).
- Añadir 10μl para cada 10gr de bacterias de DNasa I (1 mg / ml) a fin de romper los fragmentos de ADN en la muestra. Añadir 1 ml por cada 20gr de bacterias de EDTA cóctel de inhibidores de la proteasa libre. Incubar durante 20 min en hielo.
- Interrumpió las células por dos ciclos de la prensa francesa de 25.000 psi. A diferencia de ultrasonidos, la prensa francesa está dirigida a un volumen alto (10 ml>) de extrusión celular al forzar a las células a alta presión a través de un orificio delgado. El pistón debe ser enfriada en hielo durante diez minutos antes de su uso y montaje debido a la acumulación de temperatura.
- Transferencia de las células lisadas en tubos de 25 ml de ultracentrifugación y el equilibrio con precisión (50 mg) con un buffer hasta que la muestra llega a la línea del tubo s cuello.
- Restos de células separadas por ultracentrifugación a 270.000 g durante 1 hora a 277 ° K.
- Prepare una gravedad casera Ni NTA columna (2,5 cm de diámetro) mediante la adición de 4 ml de Ni NTA resina, que se conserva en el 20% de etanol, en la columna. Dejó caer el líquido por completo, lavar con 40 ml de DDW y dejó caer el líquido por completo. Pre-equilibrio de la resina en la columna con 40 ml de tampón A.
- Aplicar la fracción soluble de los tubos de ultracentrifugación de la gravedad Ni columna NTA. Dejó caer el líquido, recoger el flujo a través de (proteínas libre) y preservar a 277K.
- Recoja la muestra de sedimento de los tubos ultra-centrifugación mediante el uso de una pequeña propina para el desguace de la pastilla. Mezclar la punta en 50μl de 5% β-mercaptoetanol en 2X SDS-PAGE muestra de amortiguación.
- Lavar la columna con 100 ml de tampón B. Que la caída de líquidos, recoger el filtrado y conservar a 277K.
- Prepare 15 tubos eppendorf marcados (1,5 ml).
- Elución - válvula de columna cerrar y volver a la carga de 1 ml de solución tampón en la columna C, se incuba durante 3 min seguido de la apertura de la válvula y la recolección de flujo continuo. Repita este paso tres veces.
- Eluir resto de la suspensión en 1 ml de búfer incrementos de C y cerrar la válvula.
- Medida de OD a 280 nm de las fracciones y evaluar la ubicación del pico de proteína, si la densidad óptica es aún> 0,3, las muestras se necesitan.
- Análisis SDS-PAGE de las fracciones recogidas. Dicho análisis debe llevarse a cabo también con los siguientes ejemplos, las proteínas no consolidados a través de flujo, lavado de corriente y de uARLT-centrifugación pellet de la muestra. Mezcla de 10μl de cada muestra con 10μl de 5% β-mercaptoetanol en 2X SDS-PAGE muestra de amortiguación. Cargar las muestras, el 15% SDS-PAGE y una duración de 45 minutos en 180 voltios.
- Tinción del gel en 15 ml de solución de InstantBlue, agitar durante 1 hora. Asegúrese de que la caja de plástico está cubierto y protegido de la luz.
- Evaluar gel, si la expresión de proteínas es alta y específica de acuerdo con las bandas de indicativo, combinación seleccionado fracciones eluidas.
- Con el fin de eliminar de 10 Su-etiqueta, añadir la trombina bovina (10 unidades / l), 10μl de trombina por 1 mg de proteína, de acuerdo con las recomendaciones del fabricante para la muestra combinada.
- La diálisis se utiliza para eliminar el exceso de imidazol y disminuir las concentraciones de NaCl de los niveles necesarios durante el atascamiento del ion del cambio. Para la diálisis, cortar la longitud deseada de 7 kD de peso molecular corte (MWCO) tubos de diálisis. Lavar con DDW y hacer un nudo en un extremo (o un sello con clips). Transferencia de solución de proteína se fusionó en la bolsa, dejando algo de espacio en la parte superior y abrazadera para arriba.
- Sumerja el tubo de diálisis en tampón de diálisis 4 litros refrigerados (Buffer D). Agitar la solución lentamente durante la noche a 277 ° K.
- Saque el tubo de diálisis del vaso, hace una pequeña incisión y la transferencia de la proteína de 50 ml de tubo.
- Cromatografía de intercambio iónico: reunir preenvasados MonoQ 4.6/100 columna PE en cromatografía líquida rápida de rendimiento (FPLC). Lavar la columna con 5 volúmenes de columna (CV) de agua filtrada DDW. Equilibra la columna con 5 VC de buffer D.
- Lave el circuito de inyección con DDW (dos volúmenes de bucle) y repetir con el tampón de carga D. la proteína en el circuito de inyección.
- Inyectar la muestra de proteínas (velocidad de flujo de 1 ml / min) y se empezarán a recoger las fracciones para la detección de SDS-PAGE de las proteínas sin límites.
- Si el volumen inicial de proteína (paso 3,23) es mayor que el circuito de inyección, repita los pasos 3.25-3.26, sin lavar el circuito, hasta que toda la muestra se carga en la columna.
- Lavar la columna con 3 CV de tampón C con el fin de eliminar las proteínas sin límites.
- Eluir la proteína con un gradiente lineal de 60 minutos de 40 2000mm NaCl entre topes D y E (cuando el 100% E buffer es el final de la pendiente), la tasa de flujo de 1 ml / min (a pesar de mayores tasas de flujo se puede utilizar en el costo de volúmenes más grandes, pero menos concentrado, los picos de proteínas). Recoger los picos de proteínas que aparecen en el cromatograma de 280 nm.
- Limpie preenvasados columna de acuerdo para la fabricación de recomendación.
- Análisis SDS-PAGE de las fracciones recogidas. Dicho análisis debe realizarse con los siguientes ejemplos, las proteínas sin límites de flujo continuo y proteínas picos de flujo a través de. Ejecute el SDS-PAGE y tinción como menciona en los pasos 3.17-3.18.
- Evaluar gel de proteínas en la existencia de bandas Mw previsto de acuerdo con la proteína pre-manchada marcador. Combinación seleccionado fracciones de elución que contienen la proteína correspondiente.
- Diálisis de las muestras combinadas, a fin de reducir las concentraciones de NaCl necesaria para cromatografía de exclusión. Realizar la diálisis como se menciona en los pasos 3,21-3,23 frente a tampón F.
- Concentrar la muestra de la proteína usando un Vivaspin-15 10000 MWCO a 8 mg / ml en una centrífuga de mesa, 4.000 rpm. Validar la concentración de deseo mediante la medición de OD a 280 nm en cubetas de cuarzo. Si la proteína está muy concentrada que se diluye con tampón F y vuelva a medir.
- Ensamble de exclusión de tamaño preenvasados columna, HiLoad 26/60 Superdex 200, en el FPLC, lavar la columna con 3 CV de agua filtrada DDW. Equilibra la columna con 3 CV de tampón F.
- Lave bucle de inyección de 5 ml con DDW (dos volúmenes de bucle), seguido por el mismo volumen con el tampón de carga F. no más de 4 ml de la muestra de proteínas en el circuito de inyección.
- Inyectar la muestra de proteínas (velocidad de flujo de 3,5 ml / min) y se empezarán a recoger las fracciones pico de proteínas que aparecen es el cromatograma de 280 nm. Deja que el flujo de buffer hasta que se alcanza un volumen de columna.
- Si el volumen inicial de proteína (paso 3,23) es mayor que el circuito de inyección, repita los pasos 3.25-3.26, sin lavar el circuito, hasta que toda la muestra se carga en la columna.
- Limpie preenvasados columna de acuerdo con la recomendación de la fabricación.
- Análisis SDS-PAGE de las fracciones recogidas. Dicho análisis debe llevarse a cabo con los picos de proteínas de muestras. Ejecute el SDS-PAGE y tinción como menciona en los pasos 3.17-3.18.
- Evaluar gel: si los picos de proteínas específicas, en el Mw correcta previsto de acuerdo con la proteína pre-manchada marcador y sólo es visible una banda de combinación seleccionado fracciones eluidas de la proteína correspondiente.
- Concentrar la muestra de proteínas con un Vivaspin-15 10000 MWCO a> 20 mg / ml en una centrífuga de mesa, 4.000 rpm. Validar la concentración de deseo mediante la medición de OD a 280 nm. El MamAΔ41 purificada se concentró a 26,5 mg / ml para la cristalización.
- Confirmar pureza de la muestra y la identificación de proteínas utilizando Matrix asistida por láser de desorción / ionización (MALDI-TOF).
- Si la proteína es purificada de acuerdo con el espectrómetro de masas y SDS-PAGE, se divide el MamAΔ41 concentrado para pre-marcadas tubos Eppendorf, 25-50μl de proteínas en cada uno.
- Flash congelado en nitrógeno líquido y se almacena a 193 ° K.
4. Resultados representante
Cuando este protocolo se hace correctamente se debe tener muy purificada, el tamaño de las muestras de proteínas homogénea y concentrada. Estas muestras de proteínas están listas para los ensayos de cristalización, así como estudios bioquímicos, tales como la cinética de enzimas, la afinidad de unión y mucho más. Aquí descritos son resultados representativos de los pasos principales en el protocolo de purificación. SDS-PAGE análisis del perfil de elución de Ni-NTA columna de afinidad que revelan muy a las proteínas expresadas en la fracción soluble en MW apropiado de ~ 22kDa (Figura 1). Este análisis SDS-PAGE también debe revelar mínimo si cualquier proteína en las proteínas sin límites a través del flujo, lavar el filtrado y ultra-centrifugación de la muestra de pellets. Si las bandas grandes de la proteína adecuada no aparecen en estas muestras se debe considerar la preparación de búfer incorrecto, los problemas de ruptura celular o problemas en la cultura de inducción auto-condiciones y el crecimiento.
Cromatografía de intercambio iónico está preformada para separar entre nuestra proteína deseable para otras proteínas de E. coli que se unido a la resina de níquel (debido a las interacciones electrostáticas o histidina / negativo lazos de aminoácidos ricos en proteínas) y sin cortes de etiquetado Su proteína deseable. Esta columna separa las proteínas de acuerdo a su afinidad de unión a la resina con carga positiva en las concentraciones crecientes de NaCl. Proteínas de alta carga negativa se eluyen en mayores concentraciones de NaCl aproximar a los moderados de carga negativa. Las ventajas de esta columna son de alto caudal y capacidad de unión. El cromatograma de intercambio iónico (Figura 2) muestra una buena separación entre las tres poblaciones de proteínas en la creciente concentración de NaCl. SDS-PAGE se necesita un análisis para determinar MW de cada población, aislando a la deseable y la evaluación de si otras medidas de purificación son necesarios. La primera población es MamAΔ41 (~ 20 kDa), mientras que la segunda población es MamAΔ41 + Su Tag (~ 22kDa) que no se separó de la trombina bovina y la tercera población es indetectable en SDS-PAGE, debido a la baja concentración. Si los picos de las proteínas no se separan claramente se debe considerar la preparación de búfer incorrecto o el cambio de la pendiente del gradiente de NaCl.
Cromatografía de exclusión está preformada para separar entre nuestra proteína deseable para otras proteínas de las células de E. coli que se unido a la resina Ni-NTA y fueron separados durante cromatografía de intercambio iónico. Esta columna separa las proteínas según su tamaño. Proteínas de gran tamaño se eluyen en el volumen de elución más pequeños frente a los pequeños que se eluye en grandes volúmenes. El cromatograma de la columna (Figura 3) muestra una buena separación de la proteína deseable como una población principal. La población parece eluir en el tamaño adecuado de monómero con un peso molecular de ~ 20 kDa. La presencia de la banda de ~ 80 kDa (proteína de E.coli típicos que se une la resina Ni-NTA) se detecta en SDS-PAGE antes de la carga de columna y desaparece durante esta carrera. Dado que la concentración de esta proteína ~ 80 kDa es baja para empezar, su población no aparece en el cromatograma, debido a su dilución y SDS-PAGE se necesita un análisis para determinar la eficiencia de depuración. Recomendamos cargar una muestra diluida y concentrada de la cumbre principal de la SDS-PAGE para un seguro podría determinar la presencia de una proteína pura en el MW apropiado. En esta etapa de la proteína se purifica y su homogeneidad deben ser evaluadas por MALDI-TOF. Este análisis reveló una proteína en MW de 20.347 Da y otro en Mw de 10.176 Da (Figura 4). El ~ 10 kDa es el ~ 20 kDa duplicado cargos. El MW previstos de MamAΔ41 con los 9 aminoácidos izquierda después de su etiqueta de eliminación fue 20596,5 Da. Al compararla con la obtenida MALDI-TOF MW se encontró que son 248 Da aparte. Esta diferencia puede deberse a errores de medición MALDI-TOF y / o debido a la degradación común de la primera metionina y glicina el segundo. Para concluir, la proteína es altamente purificada y se puede utilizar para otros experimentos.
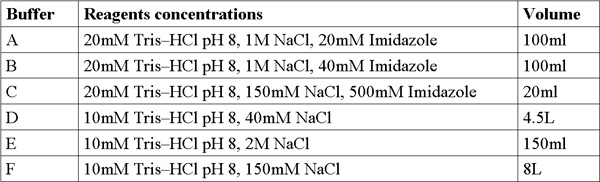
Tabla 1. Formulaciones de búfer.
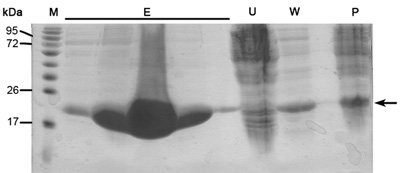
Figura 1. Representante SDS-PAGE análisis de purificación en columna Ni-NTA De derecha a izquierda;. P-ultra-centrífuga de pellets (3,11 paso del protocolo), W-lavado (3,12 paso del protocolo), U-sin límites proteínas (3,10 paso del protocolo), E- cinco carriles de elución samples (3,14 paso del protocolo), M - marcador de la proteína (números indican MW). La flecha indica MamAΔ41.
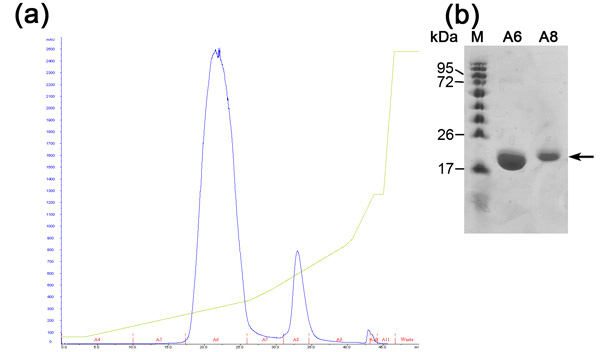
Figura 2. El análisis de cromatografía de intercambio iónico paso (a) El intercambio de iones (columna MonoQ) cromatograma, azul - 280 nm de absorción, representa la concentración de proteínas, Green-NaCl de concentración, Rojo - indicación de las fracciones recogidas. (B) Representante de SDS-PAGE análisis de la etapa de purificación de intercambio iónico. De izquierda a derecha, M - marcador de la proteína (números indican Mw), A6 - fracción primer pico, A8-segunda fracción pico.

Figura 3. El análisis por cromatografía de exclusión por tamaño (a) la exclusión de tamaño (columna Superdex 200) cromatograma, azul - 280 nm de absorción, representa la concentración de proteínas, la indicación de Red de las fracciones recogidas. (B) Representante de SDS-PAGE análisis de la etapa de purificación por exclusión de tamaño. De izquierda a derecha, M-proteína marcadora (los números indican MW), muestra de PREI-pre-inyección, A4-6 fracción combinada recogidos en el primer pico, A4-6D-diluida fracción recogida desde el pico.
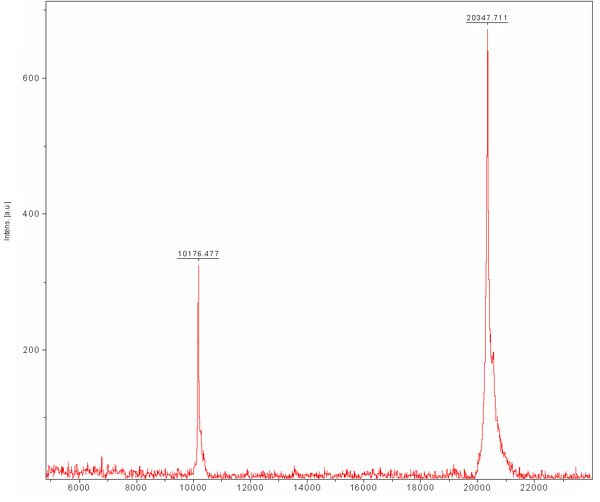
Figura 4. Láser asistida por matriz de desorción / ionización (MALDI-TOF) espectro de masas de agua purificada MamAΔ41. La matriz es el ácido sinápico (SA). MamAΔ41 muestra a 20.347 Da, también se muestra es la especie de doble carga de MamAΔ41 a 10.176 Da.
Discusión
Purificación de proteínas es el paso principal en todas las proteínas bioquímicos o estudios estructurales. Dado que cada proteína es única con su propio comportamiento, es necesario definir sus propiedades y modificar en consecuencia su purificación. Blanco de la proteína debe ser analizado como un primer paso hacia la purificación usando herramientas bioinformáticas. Que se utilizan para calcular el objetivo de punto isoeléctrico, evaluar su necesidad de la reducción / oxidación medio ambiente y su necesi...
Agradecimientos
Reconocemos el Dr. Amir Aharoni por su apoyo y Geula Davidov, Grimberg Noam y Guttman Chen por sus consejos y comentarios.
Materiales
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Name | Company | Catalog Number | Comments | |
| French Press | Equipment | Thermo scientific | FA-078A | |
| Pressure cell | Equipment | Thermo scientific | FA-032 | |
| Ultra-centrifuge | Equipment | Sorvall | Discovery 90SE | |
| Rottor | Equipment | Beckman | Ti60 | |
| Ultra-centrifuge tubes; PC-Bottle+Cap Assay 26.3ml | Equipment | Beckman | BC-355618 | |
| 2.5cm diameter, Glass Econo-Column Chromatography Columns | Equipment | BioRad | 737-2521 | |
| Ni-NTA His Bind resin | Equipment | Novagen | M0063428 | |
| Spectrophotometer | Equipment | Amersham Biosiences | Ultraspec 2100 pro | |
| Quartz cuvette | Equipment | Hellma | 104-QS | |
| Fast Performance Liquid Chromatography- AKTA purifier 10 | Equipment | GE Healthcare Biosciences | 28-4062-64 | |
| Ion exchange column – MonoQ 4.6/100 PE | Equipment | GE Healthcare Biosciences | 10025543 | |
| Size exclusion pre-packed column-HiLoad 26/60 Superdex 200 | Equipment | GE Healthcare Biosciences | 17-1071-01 | |
| Centricon - Vivaspin15 – 10,000 MWCO | Equipment | Sartorius Stedim Biotech GmbH | VS1501 | |
| Table centrifuge | Equipment | Thermo scientific | IEC CL30R | |
| MALDI-TOF | Equipment | Bruker Daltonics | Reflex IV | |
| Tris-HCl (hydrotymethyl) aminomethane | Reagent | BioLab | 20092391 | |
| Sodium Chloride | Reagent | FRUTROM | 235553470 | |
| Imidazole | Reagent | Alfa Aesar | 288-32-4 | |
| EDTA free protease inhibitors cocktail | Reagent | Sigma | P-8849 | |
| Dnase I (Deoxyribonuclease I) | Reagent | Sigma | DN-25 | |
| Bovine Thrombin | Reagent | Fisher BioReagents | BP25432 | |
| Glycine | Reagent | BioLab | 07132391 | |
| Soudim Dodecyl Sulfate (SDS) | Reagent | BioLab | 19822391 | |
| Beta-mercaptoethanol | Reagent | Sigma | M-3148 | |
| InstantBlue | Reagent | Expedeon | 1SB01L | |
| PageRuler Prestained Protein Ladder | Reagent | Fermentas | SM0671 |
Referencias
- Faivre, D., Schuler, D. Magnetotactic Bacteria and Magnetosomes. Chem Rev. 108, 4875-4898 (2008).
- D'Andrea, L. D., Regan, L. TPR proteins: the versatile helix. Trends Biochem Sci. 28, 655-662 (2003).
- Young, J. C., Barral, J. M., Hartl, U. l. r. i. c. h., F, . More than folding: localized functions of cytosolic chaperones. Trends Biochem Sci. 28, 541-547 (2003).
- Brocard, C., Hartig, A. Peroxisome targeting signal 1: is it really a simple tripeptide?. Biochim Biophys Acta. 1763, 1565-1573 (2006).
- Fransen, M., Amery, L., Hartig, A., Brees, C., Rabijns, A., Mannaerts, G. P., Van Veldhoven, P. P. Comparison of the PTS1- and Rab8b-binding properties of Pex5p and Pex5Rp/TRIP8b. Biochim Biophys Acta. 1783, 864-873 (2008).
- Baker, M. J., Frazier, A. E., Gulbis, J. M., Ryan, M. T. Mitochondrial protein-import machinery: correlating structure with function. Trends Cell Biol. 17, 456-464 (2007).
- Mirus, O., Bionda, T., von Haeseler, A., Schleiff, E. Evolutionarily evolved discriminators in the 3-TPR domain of the Toc64 family involved in protein translocation at the outer membrane of chloroplasts and mitochondria. J Mol Model. 15, 971-982 (2009).
- Gatsos, X., Perry, A. J., Anwari, K., Dolezal, P., Wolynec, P. P., Likic, V. A., Purcell, A. W., Buchanan, S. K., Lithgow, T. Protein secretion and outer membrane assembly in Alphaproteobacteria. FEMS Microbiol Rev. 32, 995-1009 (2008).
- Tiwari, D., Singh, R. K., Goswami, K., Verma, S. K., Prakash, B., Nandicoori, V. K. Key residues in Mycobacterium tuberculosis protein kinase G play a role in regulating kinase activity and survival in the host. J Biol Chem. 284, 27467-27479 (2009).
- Edqvist, P. J., Broms, J. E., Betts, H. J., Forsberg, A., Pallen, M. J., Francis, M. S. Tetratricopeptide repeats in the type III secretion chaperone, LcrH: their role in substrate binding and secretion. Mol Microbiol. 59, 31-44 (2006).
- Grunberg, K., Muller, E. C., Otto, A., Reszka, R., Linder, D., Kube, M., Reinhardt, R., Schuler, D. Biochemical and proteomic analysis of the magnetosome membrane in Magnetospirillum gryphiswaldense. Appl Environ Microbiol. 70, 1040-1050 (2004).
- Komeili, A., Vali, H., Beveridge, T. J., Newman, D. K. Magnetosome vesicles are present before magnetite formation, and MamA is required for their activation. Proc Natl Acad Sci USA. 101, 3839-3843 (2004).
- Okuda, Y., Fukumori, Y. Expression and characterization of a magnetosome-associated protein, TPR-containing MAM22, in Escherichia coli. FEBS Lett. 491, 169-173 (2001).
- Taoka, A., Asada, R., Sasaki, H., Anzawa, K., Wu, L. F., Fukumori, Y. Spatial localizations of Mam22 and Mam12 in the magnetosomes of Magnetospirillum magnetotacticum. J Bacteriol. 188, 3805-3812 (2006).
- Studier, F. W. Protein production by auto-induction in high density shaking cultures. Protein Expression and Purification. 41, 207-234 (2005).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados