A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
استخراج الحمض النووي عالية الوزن الجزيئي من ماتس الميكروبية
In This Article
Summary
نحن نقدم بروتوكول محسنة لاستخراج الحمض النووي عالية الوزن الجزيئي من الحصير الجرثومية الشديدة الملوحة. يتم فصل الخلايا الميكروبية من مصفوفة حصيرة قبل استخراج الحمض النووي وتنقيتها. هذا من شأنه أن يعزز تركيز ، والجودة ، وحجم الحمض النووي. ويمكن استخدام بروتوكول الحرارية للعينات أخرى.
Abstract
تحليل ناجحة ودقيقة ، وتفسير البيانات metagenomic يعتمد على استخراج كفاءة عالية الجودة ، وارتفاع الوزن الجزيئي المجتمع الحمض النووي (HMW). ومع ذلك ، والعينات البيئية تشكل حصيرة غالبا ما يواجهون صعوبات في الحصول على تجمعات كبيرة عالية الجودة HMW الحمض النووي. الحصير الجرثومية الشديدة الملوحة تحتوي على كميات عالية من المواد البوليمرية خارج الخلية (EPS) (1) والأملاح التي قد تمنع التطبيقات المصب من الحمض النووي المستخرج. وغالبا ما تستخدم أساليب مباشرة وقاسية في استخراج الحمض النووي من عينات الحرارية. وعادة ما تستخدم هذه الأساليب لأن العائد على السهم في الفرش ، ومصفوفة لاصقة ، تربط الحمض النووي 2،3 أثناء تحلل المباشر. نتيجة لأساليب أشد قسوة الاستخراج ، والحمض النووي أصبحت مجزأة إلى أحجام صغيرة 4،5،6.
الحمض النووي وهكذا يصبح مناسبة لاستنساخ ناقلات كبيرة إدراج. من أجل الالتفاف على هذه القيود ، ونحن التقرير منهجية محسنة لاستخراج الحمض النووي HMW من نوعية جيدة وكمية من الحصير الجرثومية الشديدة الملوحة. استخدمنا أسلوب غير المباشرة التي تنطوي على فصل الخلايا الميكروبية من الخلفية مصفوفة حصيرة من خلال المزج والطرد المركزي المغاير. وكان استخدام مجموعة من الإجراءات الميكانيكية والكيميائية لاستخلاص وتنقية من الحمض النووي للخلايا الجرثومية المستخرجة. بروتوكول لدينا ما يقرب من 2 ميكروغرام الغلة من الحمض النووي HMW (35-50 كيلوبايت) في كل غرام من العينة حصيرة ، مع نسبة 260 / 280 ألف من 1.6. وعلاوة على ذلك ، والتضخيم من جينات الرنا الريباسي 16S 7 تشير إلى أن البروتوكول هو قادر على تقليل أو القضاء على أي آثار المثبطة من الملوثات. نتائجنا توفر منهجية ملائمة لاستخراج الحمض النووي من الحصير HMW الميكروبية للدراسات الفنية وmetagenomic يمكن أن تنطبق على غيرها من العينات البيئية التي استخراج الحمض النووي هو التحدي.
Protocol
1. خلية الميكروبية الاستخراج :
- التجانس الحصير الميكروبية مع مدقة العقيمة طحن عن طريق خلط دقيق. مكان تقريبا كل 30 غراما (وزن رطب) من المادة حصيرة المتجانس في حاوية معقمة من خلاط وارنج ، إضافة حوالي 100 مل من كلوريد الصوديوم M 1 (أو تركيز محدد على العينة في الاستخدام) ، ومزيج ثلاث مرات على سرعة متوسطة لمدة 1 دقيقة مع متقطعة التبريد في الثلاجة -20 درجة مئوية لمدة 1 دقيقة. نقل الطين في زجاجة 250 مل الطرد المركزي وملء ما تبقى فارغة مع حجم كلوريد الصوديوم M 1. يعد حل كلوريد الصوديوم في المياه وتعقيمها DI تصفية تعقيم عليه.
- طرد مزيد من الخلايا الميكروبية من المصفوفة التي تهز (150 دورة في الدقيقة) باستخدام vortexer (دوامة R - الجني 2) في درجة حرارة الغرفة لمدة 30 دقيقة.
- أجهزة الطرد المركزي على سرعة منخفضة (500x غ) لمدة 15 دقيقة على 4 درجات مئوية. نقل بلطف طاف في قارورة مع الحد الأدنى من الاضطرابات الرواسب.
- باستخدام مكعبات الرواسب ، كرر الخطوات ومزج 1.2 و 1.3 أربع مرات إضافية ، مع إضافة جديدة لكلوريد الصوديوم بيليه كل الرواسب في نهاية الخطوة 1.3. يتم نقل كل من طاف استخراج كلوريد الصوديوم في قارورة جديدة.
- الجمع بين supernatants من إخراج السجناء من الزنازين (5) وأجهزة الطرد المركزي في aliquots من 200 مل بسرعة عالية (25،000 XG) لمدة 15 دقيقة على 4 درجات مئوية. تجاهل طاف ، resuspend بيليه كل خلية في 10 مل من فوسفات الصوديوم 2 ٪ ، والجمع بين الكريات ويشكلون وحدة التخزين إلى 200 مل مع فوسفات الصوديوم 2 ٪. غسل الخلايا تهتز (150 دورة في الدقيقة) في درجة حرارة الغرفة لمدة 30 دقيقة. في نهاية هذه الخطوة يجب أن يكون إلا أنبوب واحد من الخلايا للبدء في الخطوة التالية.
- أجهزة الطرد المركزي بسرعة عالية (25،000 XG) لمدة 15 دقيقة على 4 درجات مئوية. تجاهل ، resuspend طاف بيليه الخلية في 200 مل من TE (50 ملي EDTA) ، وغسل الخلايا تهتز (150 دورة في الدقيقة) في درجة حرارة الغرفة لمدة 10 دقيقة.
- أجهزة الطرد المركزي بسرعة عالية (25،000 XG) لمدة 15 دقيقة عند 4 درجة مئوية ، وتجاهل طاف ، resuspend في TE 15 مليلتر (10 ملي EDTA) ، وتخزين 200 ميكرولتر aliquots -80 درجة مئوية في حين الحاجة لإخراج الحمض النووي.
2. استخراج الحمض النووي وتنقية :
- إضافة 5 ميكرولتر 200 M كلوريد الصوديوم ، و 200 ميكرولتر SDS 10 ٪ ، و 100 ميكرولتر M - 14.3 β المركابتويثانول إلى الخلية الميكروبية قسامة 200 ميكرولتر. المزيج بلطف 4-6 مرات عكس.
- يخضع هذا المزيج على 3 جولات من ذوبان للتجمد التي تغمر في النيتروجين السائل لمدة 2 دقيقة تليها ذوبان في الماء 65 درجة مئوية حمام لمدة 5 دقائق. تمديد النهائي لذوبان 10 دقيقة.
- إضافة 200 M 5 ميكرولتر البوتاسيوم خلات (الرقم الهيدروجيني 5.5) ومكان على الجليد لمدة 10 دقيقة. الطرد المركزي في 10000 x ج لمدة 10 دقيقة عند 4 درجة مئوية ، وطاف لنقل أنبوب جديد باستخدام ماصة الحافة واسعة الجوف. إضافة 3 ميكرولتر من ريبونوكلياز ألف واحتضان عند 37 درجة مئوية لمدة 1hr.
- إضافة حجم مساو من كلوروفورم ، يهز لفترة وجيزة قبل انقلاب ، والطرد المركزي في 15000 x ج لمدة 10 دقيقة في درجة حرارة الغرفة.
- نقل بعناية الطبقة العليا من طاف في أنبوب جديد باستخدام ماصة الحافة واسعة الجوف. تجنب pipetting طبقة واجهة بيضاء تقع بين الطبقات العليا والسفلى. كرر الإجراء كلوروفورم الاستخراج.
- إضافة حجم مساو من المبرد (في -20 درجة مئوية) الأيزوبروبانول إلى احتضان وطاف على الجليد لمدة 30 دقيقة إلى الحمض النووي يعجل.
- أجهزة الطرد المركزي بسرعة قصوى (20800 XG) لمدة 10 دقيقة على 4 درجات مئوية لتكوير الحمض النووي.
- تجاهل طاف بيليه وغسل الحمض النووي مع 1 مل من المبرد (في -20 درجة مئوية) الايثانول 70 ٪.
- أجهزة الطرد المركزي بسرعة قصوى (20800 XG) لمدة 10 دقيقة عند 4 درجة مئوية ، وتجاهل طاف ، وتكرار غسل الايثانول 70 ٪ ، والهواء الجاف بيليه الحمض النووي لمدة 10 دقيقة. تكرار غسل 70 ٪ الايثانول.
- Resuspend الحمض النووي في 25 ميكرولتر TE (10 ملي EDTA) ، دافئة عند 65 درجة مئوية لمدة 5 دقائق ، والجمع في أنبوب واحد إذا تم استخدام أنابيب متعددة ، والماكياج الحجم إلى 500 ميكرولتر مع الشركة المصرية للاتصالات.
- إضافة 500 ميكرولتر الجليد الباردة (أو على 4 درجات مئوية) 20 ٪ البولي ايثيلين جلايكول (PEG) (أعد في كلوريد الصوديوم 1.2 متر). المزيج بلطف بواسطة انقلاب ، يحضن على الجليد لمدة 10 دقيقة ، وأجهزة الطرد المركزي في أقصى سرعة لمدة 10 دقيقة عند 4 درجة مئوية إلى الحمض النووي بيليه. إزالة والتخلص من طاف ويغسل DNA مكعبات مع 1 مل من الايثانول 70 ٪ المبردة ، والهواء الجاف لمدة 10 دقيقة ، وresuspend في 30-50 TE ميكرولتر أو الماء الصف الجزيئية. تسهيل إعادة تعليق من الحمض النووي عن الاحترار عند 65 درجة مئوية لمدة 5 دقائق والحمض النووي في مخزن -80 درجة مئوية.
3. الطهارة الحمض النووي ، وتركيز وتحديد الحجم :
- تحديد نوعية الحمض النووي عن طريق قياس 260 / 280 ألف وألف نسب 260/230 باستخدام Nanodrop 1000 معمل أو أي أجهزة أخرى ملائمة.
- تحديد تركيز الحمض النووي باستخدام تكنولوجيا المعلومات كوانت dsDNA طقم الفحص وفقا لتعليمات الشركة الصانعة.
- تحديد حجم الحمض النووي باستخدام الجل الكهربائي نبض الميدان. وشملت تبديل مرة الأولي من 0.35 ثانية ، وقت التبديل النهائي من 7.67 ثانية ، وزاوية 120 درجة عن التدرج من 6.0 V / سم عند وإعداد 1 ٪ agarose هلام مع 0.5X TBE واستخدام المعلمات التالية على نظام معين CHEF XA خطية صamping عامل. وصمة عار مع هلام 1 × أنا SYBR الخضراء لمدة 30 دقيقة. تحميل الحمض النووي بين 700-1000 مجموع نانوغرام على هلام. انظر الشكل. 3 للشكل مكثف للبروتوكول كاملة.
ممثل النتائج :
استخراج الخلايا :
وأظهرت مقتطفات متتابعة الخلية الجرثومية (supernatants) أن تعكر مقتطفات تتناقص مع زيادة عدد عمليات الاستخراج. هذا يشير إلى انخفاض في عدد الخلايا التالية استخراج كل خلية المتعاقبة. المهم أن نلاحظ هنا أنه مع كل خطوة إضافية استخراج الخلايا يتيح الفرصة لإدخال المواد الملوثة ، وينبغي التقليل من عدد من الخلايا بحيث قلع النهائي بيليه الخلية هو ممثل المجتمع الميكروبي بشكل عام. وكانت تسيطر غيرها من مصادر التلوث من خلال اعتماد تقنيات مختبرية كافية العقيمة. على سبيل المثال ، تم إعداد الحلول في مجال المياه وتعقيمها تعقيم DI التصفية. وتعقيم الحاويات مع الكحول ، وتعقيمها ، ومعالجتها تحت ضوء الأشعة فوق البنفسجية والأشعة فوق البنفسجية crosslinker.
تركيز الحمض النووي وتحديد النوعية :
أسفرت بروتوكول حوالي 2 ميكروغرام من الحمض النووي HMW (35-50 كيلوبايت) (الشكل رقم 4) لكل غرام من العينة حصيرة مع نسبة 260 / 280 ألف من 1.6 ، وهناك نسبة 0.7 260/230 (الجدول 1). على الرغم من أن يبدو أن هناك نسبة 260/230 أن تكون منخفضة ، لا تثبيط تطبيق الجزيئية المستندة المصب مثل PCR - 16S التضخيم من جينات الرنا الريباسي وحظ في دراسة منفصلة 7. ومن المهم أن نلاحظ أن الحمض النووي من الحصير الملوحة اثنين من المصادر الرئيسية للتلوث ؛ EPS والأملاح. ولذلك فمن الممكن أن آثار هذه الملوثات قد يكون هناك تأثير على نسب 260/230 على الرغم من الجهود الهائلة للحد من آثارها على تطبيقات تيار باستمرار.
تقرير حجم الحمض النووي :
نبض الحقل الكهربائي للهلام توظف تدفق النابض الحالية مع تبديل الاتجاه متقطعة مما أدى إلى تشويه الحمض النووي كما هو مبين في الشكل 3. أسفرت بروتوكول لدينا الحمض النووي HMW حوالي 35-50 كيلو بايت. في حين أن بعض حجم الحمض النووي قد يكون أصغر من 30 كيلوبايت ، فمن المهم أن يكون جزءا من مسحة فوق 35 كيلو بايت نظرا إلى أن الاستنساخ fosmid يتطلب ~ 40 كيلو بايت إدراج الحمض النووي DNA وشظايا أكبر توفير قدر أكبر من الوصول إلى مسارات السكروز سليمة. في دراستنا ، وقد اقتطعت مسحة الحمض النووي فوق 35 كيلو بايت وتنقيته من أجل استنساخ ناقلات كبيرة تضاف الجزيئية وتطبيقات أخرى.

الرقم الجرثومية الشديدة الملوحة 1. حصيرة موقع أخذ العينات (البركة الكبيرة) الموجود على إلوثيرا ، وجزر البهاما.

الشكل 2. والمقطع العرضي للحصيرة الجرثومية الشديدة الملوحة المستخدمة في هذه الدراسة. تم الحصول على حصيرة الميكروبية من بركة تقع على إلوثيرا الملوحة ، وجزر البهاما.
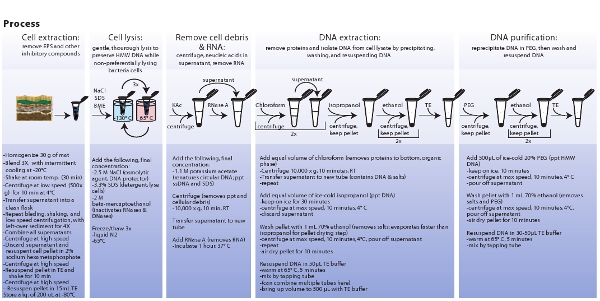
الشكل 3. تمثيل تخطيطي لإجراءات المشاركة في استخراج الخلايا الجرثومية ، وتحلل الخلية ، واستخراج وتنقية الحمض النووي metagenomic. انقر هنا لعرض صورة أكبر.

الشكل 4. الجزيئية توصيف الحمض النووي المستخرج من الوزن باستخدام النبض الكهربائي للهلام الميدان. حارة M هي علامة HMW ، والممرات 1 و 2 من الحمض النووي يتطابق metagenomic المستخرجة من حصيرة الملوحة إلوثيرا باستخدام بروتوكول أعلاه.
| استخراج أسلوب | تركيز نانوغرام / غ | A 260/280 | A 260/230 | |
| PEG | مندوب 1 | 1806.1 | 1.64 | 0.76 |
| مندوب 2 | 2010.8 | 1.61 | 0.75 |
الجدول 1. استخراج قياس تركيز ونوعية الحمض النووي من حصيرة الملوحة الميكروبية.
Access restricted. Please log in or start a trial to view this content.
Discussion
نظرا إلى أن مجموع إزالة الخلية من المعقدة والمتنوعة للغاية العينات الجرثومية حصيرة ليس عمليا ، فإن القلق الأساسي هو مدى الخلايا المستخرجة تمثل حصيرة الميكروبية الشاملة المجتمع. في دراسة سابقة ، أظهرت PCR - DGGE تحليل الجينات الميكروبية 16S الرنا الريباسي أن إزالة الخلاي?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
Acknowledgements
وقد تم تمويل هذا العمل من خلال برنامج المؤسسة الوطنية للعلوم البيئية جينوم (رقم المنحة EF - 0723707).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف | شركة | فهرس العدد | تعليقات |
|---|---|---|---|
| β - المركابتويثانول | سيغما الدريخ | M3148 | |
| البولي ايثيلين جلايكول 8000 | Promega | V3011 | 20 ٪ من كلوريد الصوديوم 1.2 M |
| أسيتات البوتاسيوم | فيشر العلمية | فيشر العلمية | |
| كوانت - IT طقم الفحص dsDNA | Invitrogen | Q33130 | |
| ريبونوكلياز | Epicentre | MRNA092 | |
| كلوريد الصوديوم | BDH كيماويات | BDH8014 | اضرب المناسبة. |
| سلفات الصوديوم دوديسيل | فيشر العلمية | 03-500-509 | 10 ٪ في الماء |
| فوسفات الصوديوم | EMD كيماويات | SX0583 - 3 | 2 ٪ في الماء |
| TBE | فيشر العلمية | BP1333 - 1 | |
| CHEF مخطط نظام XA | راد مختبرات بيولوجية | 170-3670 | |
| معمل NanoDrop 1000 | الحرارية العلمية | ND - 1000 | |
| Vortexer | العلمي للصناعات المحدودة | ||
| الأشعة فوق البنفسجية Crosslinker | UVP | ||
| وارنج خلاط | وارنج المختبر | LB10S |
References
- Decho, A. W. Microbial biofilms in intertidal systems: an overview. Cont. Shelf Res. 20, 1257-1273 (2000).
- Dupraz, C., Visscher, P. T. Microbial lithification in marine stromatolites and hypersaline mats. Trends Microbiol. 13, 429-438 (2005).
- Steffan, R. J., Goksoyr, J., Boj, A. K., Atlas, R. M. Recovery of DNA from soils and sediments. Appl. Environ. Microbiol. 54, 2908-2915 (1988).
- Lee, Y. K., Kim, H. W., Liu, C. L., Lee, H. K. A simple method for DNA extraction from marine bacteria that produce extracellular materials. J. Microbiol. Methods. 52, 245-250 (2003).
- Roose-Amsaleg, C. L., Garnier-Sillam, E., Harry, M. Extraction and Purification of Microbial DNA from Soil and Sediment Samples. Appl. Soil Ecol. 18, 47-60 (2001).
- de Lipthay, J. R., Enzinger, C., Johnsen, K., Aamand, J., Sørensen, S. J. Impact of DNA extraction method on bacterial community composition measured by denaturing gradient gel electrophoresis. Soil Biol. Biochem. 36, 1607-1614 (2004).
- Bey, B. S., Fichot, E. B., Dayama, G., Decho, A. W., Norman, R. S. Extraction of High Molecular Weight DNA from Microbial Mats. Biotechniques. 49, 631-640 (2010).
- Kakirde, S. K., Parsley, L. C., Liles, M. R. Size does matter: Application-driven approaches for soil metagenomics. Soil Biology & Biochemistry. 42, 1911-1923 (2010).
- Rodon, M. R., August, P. R., Bettermann, A. D., Brady, S. F., Grossman, T. H., Liles, M. R., Loiacono, K. A., Lynch, B. A., MacNeil, I. A., Minor, C., Tiong, C. L., Gilman, M., Osburne, M. S., Clardy, J., Handelsman, J., Goodman, R. M. Cloning the Soil Metagenomic: A Strategy for Accessing the Genetic and Functional Diversity of Uncultured Microorganisms. Appl. Environ. Microbiol. 66, 2541-2547 (2000).
- Beja, O., Aravind, L., Koonin, E. V., Suzuki, M. T., Hadd, A., Nguyen, L. P., Jovanovich, S. B., Gates, C. M., Feldman, R. A., Spudich, J. L., Spudich, E. N., DeLong, E. F. Bacterial Rhodopsin: Evidence for a New Type of Phototrophy in the Sea. Science. 289, 1902-1906 (2000).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved