Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Добыча высокомолекулярных ДНК Вес от микробных матах
В этой статье
Резюме
Мы предоставляем улучшенный протокол для извлечения ДНК высокого молекулярного веса от гиперсоленых коврики микроорганизмов. Микробные клетки отделяются от мата матрицы до выделения ДНК и очистки. Это повышает концентрацию, качество и размер ДНК. Протокол может быть использован для других огнеупорных образцов.
Аннотация
Успешные и точный анализ и интерпретация метагеномных данных зависит от эффективной добычи высокого качества, высокой молекулярной массы (HMW) сообщества ДНК. Тем не менее, пробы окружающей среды мат часто создают трудности для получения больших концентраций высокого качества, ДНК HMW. Коврики гиперсоленых микробной содержат большое количество внеклеточных полимерных веществ (EPS) 1 и солей, которые могут препятствовать течению приложений добываемого ДНК. Прямые и жесткие методы часто используются в экстракции ДНК из тугоплавких образцов. Эти методы, как правило, используется, потому что ЭПС в маты, клей матрицы, связывает ДНК 2,3 при прямой лизис. В результате жестких методов добычи, ДНК становится раздроблена на небольшие размеры 4,5,6.
ДНК таким образом, становится не подходит для больших вставить вектор клонирования. Для того чтобы обойти эти ограничения, мы сообщаем усовершенствованной методологии для извлечения ДНК HMW хорошего качества и количества из гиперсоленых коврики микроорганизмов. Мы использовали косвенный метод предусматривающее разделения микробных клеток из матрицы фоне мат через смешивание и дифференциального центрифугирования. Сочетание механических и химических процедур используются для извлечения и очистки ДНК из извлеченных микробных клеток. Наш протокол дает примерно 2 мкг HMW ДНК (35-50 кб) на грамм коврик образца, с 260/280 отношением 1,6. Кроме того, усиление генов 16S рРНК 7 предполагает, что протокол может уменьшить или устранить любые тормозящее действие загрязняющих веществ. Наши результаты дают соответствующую методологию для извлечения ДНК из HMW микробных матах для функциональной метагеномных исследований и могут быть применимы к другим проб окружающей среды, из которой экстракции ДНК является сложной задачей.
протокол
1. Микробная Добыча Cell:
- Однородный микробных матах со стерильной шлифовальные пестиком, смешивая тщательно. Поместите приблизительно все 30 г (сырого веса) гомогенизированных материала мата в стерильную емкость Варинга блендер, добавить около 100 мл 1 М NaCl (или концентрации, характерные для образца используется), и смесь три раза на средней скорости в течение 1 минуты с прерывистого охлаждения в -20 ° C морозильнике в течение 1 мин. Передача суспензии в 250 мл бутылки центрифуги и заполнить оставшиеся пустые объеме с 1 М NaCl. Подготовка раствором хлорида натрия в воде автоклавного DI и фильтр стерилизовать.
- Далее выбить микробных клеток из матрицы путем встряхивания (150 оборотов в минуту) с помощью vortexer (Vortex-Genie R 2) при комнатной температуре в течение 30 мин.
- Центрифуга на низкой скорости (500x г) в течение 15 мин при 4 ° C. Аккуратно передачи супернатант в колбу с минимальным нарушением в осадке.
- Использование гранулированных осадка, повторите шаги смешивания и 1.2 и 1.3 еще четыре раза с добавлением свежей NaCl каждому осадка гранул в конце шага 1.3. Супернатант из каждой экстракции NaCl переносится в свежем колбу.
- Комбинат супернатанты из 5 клеток экстракции и центрифуги в аликвоты 200 мл на высокой скорости (25 000 мкг) в течение 15 мин при 4 ° C. Удалите надосадочную, ресуспендируют каждый осадок клеток в 10 мл 2% натрия гексаметафосфат, объединить окатышей и составляют объем до 200 мл с 2% гексаметафосфат натрия. Вымойте клетки при встряхивании (150 оборотов в минуту) при комнатной температуре в течение 30 мин. В конце этого шага вы должны иметь только одну трубку клеток, чтобы перейти к следующему шагу.
- Центрифуга с высокой скоростью (25 000 мкг) в течение 15 мин при 4 ° C. Удалите надосадочную, ресуспендируют осадок клеток в 200 мл TE (50 мМ ЭДТА), и мыть клетки при встряхивании (150 оборотов в минуту) при комнатной температуре в течение 10 мин.
- Центрифуга с высокой скоростью (25 000 мкг) в течение 15 мин при 4 ° С, отказаться от супернатанта, ресуспендируют в 15 мл TE (10 мМ ЭДТА), и сохранить 200-мкл аликвоты при -80 ° С до необходимой для извлечения ДНК.
2. Добыча и очистка ДНК:
- Добавить 200 мкл 5 М NaCl, 200 мкл 10% SDS и 100 мкл 14,3 M β-меркаптоэтанол к 200-мкл ячейки микробов. Осторожно перемешать путем обращения 4-6 раз.
- Тема смеси до 3 раундов замораживания-оттаивания путем погружения в жидкий азот в течение 2 мин затем оттаивания в 65 ° С на водяной бане 5 мин. Расширение окончательного оттаивания до 10 мин.
- Добавить 200 мкл 5 М ацетата калия (рН 5,5) и место на льду в течение 10 мин. Центрифуга на 10000 мкг в течение 10 мин при 4 ° С и передачи супернатант в новую пробирку с использованием широкого диаметра пипетки. Добавить 3 мкл РНКазы и инкубировать при температуре 37 ° С в течение 1 час.
- Добавить равным объемом хлороформа, встряхните кратко обращением, и центрифуга со скоростью 15000 мкг в течение 10 мин при комнатной температуре.
- Тщательно передачи верхний слой супернатант в новую пробирку с использованием широкого диаметра пипетки. Избегайте пипетки белый слой интерфейс расположен между верхним и нижним слоями. Повторите хлороформ-экстракции.
- Добавить равный объем охлажденного (до температуры -20 ° С) изопропанола, супернатант и инкубировать на льду в течение 30 мин для осаждения ДНК.
- Центрифуга на максимальной скорости (20 800 мкг) в течение 10 мин при 4 ° С для осаждения ДНК.
- Удалите супернатант и мыть ДНК гранул с 1 мл охлажденного (до температуры -20 ° C) 70% этанола.
- Центрифуга на максимальной скорости (20 800 мкг) в течение 10 мин при 4 ° С, отбросить супернатант, повторите 70% этанола мыть, и воздушно-сухих гранул ДНК в течение 10 мин. Повторите 70% этанола стирки.
- Ресуспендируют ДНК в 25 мкл TE (10 мМ ЭДТА), теплые при 65 ° С в течение 5 мин, объединяются в одну трубку, если несколько труб были использованы, и макияж объема до 500 мкл ТЕ.
- Добавить 500 мкл ледяной (или при температуре 4 ° С) 20% полиэтиленгликоля (ПЭГ) (подготовлен в 1,2 М NaCl). Осторожно перемешать обращением, инкубировать на льду в течение 10 мин, и центрифуга с максимальной скоростью в течение 10 мин при 4 ° С для осаждения ДНК. Удаляют супернатант и мыть гранулированный ДНК с 1 мл охлажденной 70% этанола, воздушно-сухой в течение 10 мин, и ресуспендируют в 30-50 мкл ТЕ или молекулярных класса воды. Содействие ресуспендирования ДНК нагреванием при 65 ° С в течение 5 мин и магазин ДНК при температуре -80 ° C.
3. ДНК чистоты, концентрации и определения размеров:
- Определить качество ДНК путем измерения 260/280 и 260/230 отношения использованием Nanodrop 1000 спектрофотометр или любого другого соответствующего инструментария.
- Определение концентрации ДНК использованием Квант-IT дцДНК Пробирной комплект в соответствии с инструкциями производителя.
- Определить размер с помощью ДНК поля импульса гель-электрофореза. Подготовка 1% агарозном геле с 0.5X КЭ и использовать следующие параметры CHEF Mapper XA System; начальный момент времени переключения в 0,35 с, в последний раз выключатель 7,67 с, а 120 ° включены угол градиента 6,0 В / см при г линейныхампинг фактор. Пятно гель с 1 х SYBR Green I в течение 30 мин. Нагрузка между 700-1000 нг тотальной ДНК на геле. См. рис. 3 для сжатой форме полного протокола.
Представитель Результаты:
Сотовые добычи:
Последовательная микробной клетки экстракты (супернатанты) показали, что мутность экстракты уменьшается число увеличению экстракции. Это свидетельствует о сокращении числа клеток после каждого последующего извлечения клеток. Важно отметить здесь, что, поскольку каждый дополнительный шаг добычи клетка дает возможность загрязнения введения, число клеточных экстракции должны быть сведены к минимуму, так что окончательный осадок клеток является представителем общего микробного сообщества. Другие источники загрязнения находятся под контролем лаборатории принятия надлежащих стерильных техник. Например, решения были подготовлены в автоклаве вода DI и фильтр стерилизовать. Контейнеры были стерилизованы с алкоголем, в автоклаве, и лечение под УФ-света и ультрафиолетового сшивателя.
Концентрация ДНК и определения качества:
Протокол дало около 2 мкг HMW ДНК (35-50 кб) (рис. 4) на грамм коврик образца с 260/280 отношением 1,6, а отношение 260/230 0,7 (табл. 1). Хотя соотношение 260/230 оказалась низкой, нет ингибирования вниз по течению молекулярно-приложений, таких как ПЦР-амплификации генов 16S рРНК наблюдалось в отдельном исследовании 7. Важно отметить, что ДНК из гиперсоленых матов состоит из двух основных источников загрязнения; EPS и солей. Поэтому возможно, что следы этих загрязнителей могут быть, влияющих на 260/230 отношения, несмотря на огромные усилия, чтобы уменьшить их влияние на приложения вниз поток.
ДНК размером определения:
Импульсный поле гель-электрофореза использует пульсирующий ток с прерывистым направленного переключатели в результате ДНК мазков, как показано на рисунке 3. Наш протокол дало HMW ДНК примерно 35-50 кб. Хотя некоторые ДНК размер может быть меньше 30 кб, важно иметь часть мазка выше 35 кб, учитывая, что fosmid клонирования необходимо ~ 40 кб ДНК вставок и более крупных фрагментов ДНК, обеспечить более широкий доступ к нетронутым путям биосинтеза. В наших исследованиях ДНК мазка выше 35 кб вырезали и очищенный для крупных вставить вектора клонирования и других молекулярных приложений.

Рисунок 1. Гиперсоленых микробного мата отбора проб (Big Pond), расположенных на Эльютера, Багамские острова.

Рисунок 2. Сечение гиперсоленых коврик микробного, используемые в данном исследовании. Микробного мата была получена из гиперсоленых пруд, расположенный на Эльютера, Багамские острова.
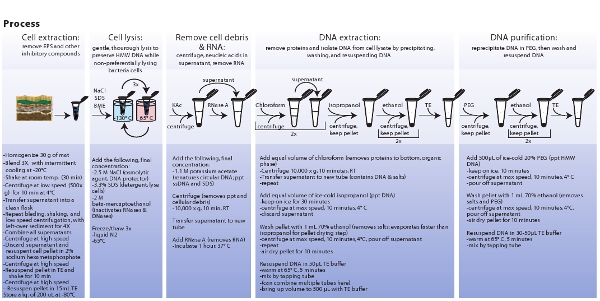
Рисунок 3. Схематическое изображение процедуры, связанные с добычей микробной клетке, лизиса клеток, добычи и очистки метагеномных ДНК. Нажмите здесь, чтобы увидеть увеличенное изображение.

Рисунок 4. Молекулярная характеристика вес добытых ДНК с использованием поля импульса гель-электрофореза. Лейн М HMW маркером, и дорожки 1 и 2 повторов метагеномных ДНК, извлеченной из мата Эльютера гиперсоленых использованием выше протокол.
| Добыча Метод | Концентрация нг / г | 260/280 | 260/230 | |
| PEG | Rep 1 | 1806,1 | 1,64 | 0,76 |
| Rep 2 | 2010,8 | 1,61 | 0,75 |
Таблица 1. Измерение концентрации и качества ДНК, выделенной из микробной гиперсоленых мат.
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Учитывая, что полное удаление ячейки из сложных и весьма разнообразны образцы микробного мата невозможно, главной задачей является, как хорошо извлеченные клетки представляют всего сообщества коврик микроорганизмов. В предыдущем исследовании, ПЦР-анализ DGGE микробных генов 16S рРНК по?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Благодарности
Эта работа финансировалась Национальным научным фондом экологического Genomics программы (грант № EF-0723707).
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | Комментарии |
|---|---|---|---|
| β-меркаптоэтанол | Sigma-Aldrich | M3148 | |
| Полиэтиленгликоль 8000 | Promega | V3011 | 20% в 1,2 М NaCl |
| Калия ацетат | Fisher Scientific | Fisher Scientific | |
| Квант-IT дцДНК Пробирной комплект | Invitrogen | Q33130 | |
| РНКазы | Эпицентр | MRNA092 | |
| Хлористый натрий | Химические вещества BDH | BDH8014 | Соответствующие конц. |
| Додецилсульфата натрия | Fisher Scientific | 03-500-509 | 10% в воде |
| гексаметафосфат натрия | EMD Химические вещества | SX0583-3 | 2% в воде |
| TBE | Fisher Scientific | BP1333-1 | |
| CHEF Mapper XA системы | Bio-Rad Laboratories | 170-3670 | |
| NanoDrop 1000 спектрофотометр | Thermo Scientific | ND-1000 | |
| Vortexer | Научно Industries, Inc | ||
| Ультрафиолетовое Crosslinker | UVP | ||
| Гомогенизатор Уоринга | Варинга лаборатории | LB10S |
Ссылки
- Decho, A. W. Microbial biofilms in intertidal systems: an overview. Cont. Shelf Res. 20, 1257-1273 (2000).
- Dupraz, C., Visscher, P. T. Microbial lithification in marine stromatolites and hypersaline mats. Trends Microbiol. 13, 429-438 (2005).
- Steffan, R. J., Goksoyr, J., Boj, A. K., Atlas, R. M. Recovery of DNA from soils and sediments. Appl. Environ. Microbiol. 54, 2908-2915 (1988).
- Lee, Y. K., Kim, H. W., Liu, C. L., Lee, H. K. A simple method for DNA extraction from marine bacteria that produce extracellular materials. J. Microbiol. Methods. 52, 245-250 (2003).
- Roose-Amsaleg, C. L., Garnier-Sillam, E., Harry, M. Extraction and Purification of Microbial DNA from Soil and Sediment Samples. Appl. Soil Ecol. 18, 47-60 (2001).
- de Lipthay, J. R., Enzinger, C., Johnsen, K., Aamand, J., Sørensen, S. J. Impact of DNA extraction method on bacterial community composition measured by denaturing gradient gel electrophoresis. Soil Biol. Biochem. 36, 1607-1614 (2004).
- Bey, B. S., Fichot, E. B., Dayama, G., Decho, A. W., Norman, R. S. Extraction of High Molecular Weight DNA from Microbial Mats. Biotechniques. 49, 631-640 (2010).
- Kakirde, S. K., Parsley, L. C., Liles, M. R. Size does matter: Application-driven approaches for soil metagenomics. Soil Biology & Biochemistry. 42, 1911-1923 (2010).
- Rodon, M. R., August, P. R., Bettermann, A. D., Brady, S. F., Grossman, T. H., Liles, M. R., Loiacono, K. A., Lynch, B. A., MacNeil, I. A., Minor, C., Tiong, C. L., Gilman, M., Osburne, M. S., Clardy, J., Handelsman, J., Goodman, R. M. Cloning the Soil Metagenomic: A Strategy for Accessing the Genetic and Functional Diversity of Uncultured Microorganisms. Appl. Environ. Microbiol. 66, 2541-2547 (2000).
- Beja, O., Aravind, L., Koonin, E. V., Suzuki, M. T., Hadd, A., Nguyen, L. P., Jovanovich, S. B., Gates, C. M., Feldman, R. A., Spudich, J. L., Spudich, E. N., DeLong, E. F. Bacterial Rhodopsin: Evidence for a New Type of Phototrophy in the Sea. Science. 289, 1902-1906 (2000).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены