A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הפקת DNA גבוהה מולקולרית משקל של מאטס מיקרוביאלית
In This Article
Summary
אנו מספקים פרוטוקול משופר לחילוץ משקל מולקולרי גבוה DNA של חיידקים מחצלות hypersaline. תאים מיקרוביאלית מופרדים המטריצה מחצלת לפני מיצוי DNA וטיהור. זה משפר את הריכוז, איכות, גודל של ה-DNA. הפרוטוקול ניתן להשתמש בדגימות עקשן אחרים.
Abstract
ניתוח מוצלח ומדויק ופרשנות של נתונים metagenomic תלוי מיצוי יעיל של באיכות גבוהה, ה-DNA מולקולרי גבוה (HMW) במשקל הקהילה. עם זאת, דגימות מחצלת סביבתיים מהווים לעיתים קרובות בקשיים להשגת ריכוזים גדולים של ה-DNA באיכות גבוהה HMW,. מחצלות Hypersaline חיידקים מכילים כמויות גדולות של חומרים פולימריים תאיים (EPS) 1 ומלחים שעשויים לעכב יישומים במורד הזרם של ה-DNA חילוץ. שיטות ישיר וקשה משמשים לעיתים קרובות מיצוי דנ"א מדגימות עקשן. שיטות אלה משמשים בדרך כלל משום למניה ב מחצלות, מטריצה דבק, נקשר ה-DNA 2,3 במהלך תמוגה ישיר. כתוצאה שיטות מיצוי קשים, ה-DNA הופך מקוטעת לתוך בגדלים קטנים 4,5,6.
ה-DNA ובכך הופך הולם שיבוט גדול להכניס וקטור. על מנת לעקוף את המגבלות האלה, אנו מדווחים על מתודולוגיה משופרת להפיק דנ"א HMW באיכות וכמות טובה של מחצלות חיידקים hypersaline. אנחנו עובדים בשיטה עקיפה מעורבים הפרדת תאים מיקרוביאליים מהמטריצה רקע מחצלת באמצעות מיזוג צנטריפוגה ההפרש. שילוב של נהלים מכני וכימי שימש כדי לחלץ ולטהר DNA מתאי חיידקים שחולצו. פרוטוקול שלנו התשואות כ -2 מיקרוגרם של HMW DNA (35-50 kb) לגרם מדגם מחצלת, עם יחס של 260/280 1.6. יתר על כן, הגברה של גנים 16S rRNA 7 עולה כי הפרוטוקול יכול להקטין או למנוע תופעות מעכבות של מזהמים. התוצאות שלנו לספק המתודולוגיה המתאימה החילוץ של ה-DNA HMW מ מחצלות חיידקים ללימודי metagenomic פונקציונלי עשויות לחול על דגימות סביבתיות אחרות שמהן מיצוי DNA הוא מאתגר.
Protocol
1. תא מיקרוביאלית Extraction:
- Homogenize מחצלות חיידקים עם העלי שחיקה סטרילי על ידי ערבוב יסודי. כל מקום בערך 30 גרם (משקל רטוב) של חומר הומוגני מחצלת לתוך מיכל סטרילי של וורינג בלנדר, להוסיף כ 100 מ"ל של 1 M NaCl (או ריכוז ספציפיים מדגם בשימוש), ואת תערובת שלוש פעמים במהירות בינונית במשך דקות עם 1 קירור לסירוגין מקפיא ° C -20 דקות 1. מעבירים את התערובת לתוך בקבוק 250 מ"ל צנטריפוגות ולמלא את הריק הנותר עם נפח 1 M NaCl. הכן פתרון NaCl במים DI autoclaved ולסנן לעקר אותה.
- בנוסף לסלק את התאים חיידקים מהמטריצה על ידי רועדת (150 סל"ד) באמצעות vortexer (וורטקס-Genie R 2) בטמפרטורת החדר למשך 30 דקות.
- צנטריפוגה במהירות נמוכה (500x ז) במשך 15 דקות ב 4 ° C. בעדינות להעביר את supernatant לתוך בקבוק עם הפרעה מינימלית במשקעים.
- שימוש משקעים pelleted, חזור מיזוג צעדים 1.2 ו 1.3 ארבע פעמים נוספות עם תוספת של NaCl טריים כל משקעים גלולה בסוף צעד 1.3. Supernatant מתוך מיצוי כל NaCl מועבר לתוך בקבוק טרי.
- מערבבים את supernatants מתוך 5 עקירות התא צנטריפוגות ב aliquots של 200 מ"ל במהירות גבוהה (25,000 XG) במשך 15 דקות ב 4 ° C. בטל supernatant, resuspend כל תא גלולה ב 10 מ"ל של נתרן hexametaphosphate 2%, לשלב כדורי ולעשות את הווליום עד 200 מ"ל עם hexametaphosphate נתרן 2%. שטפו תאים על ידי רועדת (150 סל"ד) בטמפרטורת החדר למשך 30 דקות. בסוף שלב זה אתה צריך רק צינור של תאים כדי להמשיך לשלב הבא.
- צנטריפוגה במהירות גבוהה (25,000 XG) במשך 15 דקות ב 4 ° C. בטל supernatant, resuspend תא גלולה ב 200 מ"ל של TE (50 mM EDTA), ולשטוף תאים על ידי רועדת (150 סל"ד) בטמפרטורת החדר למשך 10 דקות.
- צנטריפוגה במהירות גבוהה (25,000 XG) במשך 15 דקות ב 4 ° C, לבטל את supernatant, resuspend ב 15 מ"ל TE (10 mM EDTA), ולאחסן 200 μL aliquots ב -80 ° C עד הדרוש DNA עקירות.
2. הפקת DNA וטיהור:
- הוספת 200 μL 5 M NaCl, 200 SDS μL 10%, ו 100 μL 14.3 M β-mercaptoethanol את aliquot 200 μL התא של חיידקים. מערבבים בעדינות על ידי 4-6 פעמים היפוך.
- תערובת בכפוף ל 3 סיבובים של הפשרה, הקפאה באמצעות חנקן נוזלי שוקע בתוך 2 דקות ואחריה להפשרה אמבטיה 65 מעלות צלזיוס מים 5 דקות. הרחבת הסופי הפשרה על 10 דקות.
- הוספת 200 אצטט μL 5 M אשלגן (pH 5.5) ומניחים על קרח למשך 10 דקות. צנטריפוגה ב XG 10,000 עבור 10 דקות ב 4 ° C ולהעביר את supernatant לצינור חדש באמצעות טיפ רחב נשא פיפטה. הוסף 3 μL של RNase A ו לדגור על 37 מעלות צלזיוס למשך 1 שעות.
- מוסיפים נפח שווה של כלורופורם, ללחוץ בקצרה על ידי היפוך, ו צנטריפוגות ב XG 15,000 עבור 10 דקות בטמפרטורת החדר.
- להעביר בזהירות את השכבה העליונה של supernatant לתוך צינור חדש באמצעות טיפ רחב נשא פיפטה. הימנע pipetting שכבת ממשק לבן הממוקם בין שכבות העליון והתחתון. חזור על הליך כלורופורם-החילוץ.
- הוסף נפח שווה של צונן (ב -20 ° C) isopropanol את supernatant ו לדגור על קרח למשך 30 דקות כדי לזרז DNA.
- צנטריפוגה על מהירות מרבית (20,800 XG) במשך 10 דקות ב 4 ° C עד גלולה DNA.
- בטל supernatant ולשטוף DNA גלולה עם 1 מ"ל של צונן (ב -20 ° C) 70% אתנול.
- צנטריפוגה על מהירות מרבית (20,800 XG) במשך 10 דקות ב 4 ° C, לבטל את supernatant, חזרו לשטוף אתנול 70%, אוויר יבש DNA גלולה במשך 10 דקות. חזור על לשטוף אתנול 70%.
- ה-DNA Resuspend ב 25 TE μL (10 mM EDTA), חמים 65 מעלות צלזיוס למשך 5 דקות, לשלב לתוך צינור אחד אם צינורות מרובים היו בשימוש, ואיפור נפח μL עם TE 500.
- הוספת 500 μL קר כקרח (או 4 ° C) 20% פוליאתילן גליקול (PEG) (שהוכנו 1.2 M NaCl). מערבבים בעדינות על ידי היפוך, דגירה על קרח במשך 10 דקות, ו צנטריפוגה במהירות המרבית עבור 10 דקות ב 4 ° C עד גלולה DNA. הסר להתעלמות supernatant לשטוף את ה-DNA pelleted עם 1 מ"ל של אתנול 70% צונן, אוויר יבש 10 דקות, ו resuspend ב 30-50 μL TE או מים כיתה מולקולרית. להקל resuspension של ה-DNA על ידי ההתחממות על 65 מעלות צלזיוס למשך 5 דקות ו-DNA חנות ב -80 ° C.
3. טוהר ה-DNA, ריכוז ונחישות גודל:
- קביעת איכות ה-DNA על ידי מדידת 260/280 ו 260/230 יחס באמצעות ספקטרופוטומטר Nanodrop 1000 או כל מכשור מתאים אחר.
- קביעת ריכוז ה-DNA באמצעות קוואנט-IT ערכת dsDNA Assay על פי הוראות היצרן.
- קביעת גודל ה-DNA באמצעות שדה הדופק ג'ל אלקטרופורזה. הכן 1% agarose ג'ל עם TBE 0.5X ולהשתמש הפרמטרים הבאים על Mapper השף XA המערכת; הזמן לעבור הראשונית של 0.35 שניות, זמן לעבור הסופי של 7.67 שניות, ו 120 ° כלול זווית שיפוע של 6.0 V / ס"מ r ליניאריamping גורם. הכתם ג'ל עם 1 x SYBR גרין אני למשך 30 דקות. טען בין 700-1000 מסך ng DNA על ג'ל. ראה איור. עבור 3 בצורה מתומצתת של פרוטוקול מלא.
נציג תוצאות:
תא מיצוי:
Sequential התא של חיידקים תמציות (supernatants) הראו כי עכירות של תמציות פוחתת ככל שמספר להגדיל עקירות. הדבר מצביע על ירידה במספר התאים הבאים מיצוי כל תא רצופים. חשוב לציין כאן כי כל צעד נוסף מיצוי תא מספק הזדמנות הקדמה זיהום, מספר תאים עקירות צריך להיות ממוזער כך שהתא גלולה הסופי הוא נציג של הקהילה חיידקים הכוללת. מקורות אחרים של זיהום נשלטו על ידי אימוץ טכניקות מעבדה מספיק סטרילית. למשל, הפתרונות הוכנו במים DI autoclaved ולסנן מעוקרים. מיכלי עוקרו עם אלכוהול, autoclaved, והתייחסו תחת אור אולטרה סגול UV ו crosslinker.
ה-DNA ריכוז ונחישות איכות:
פרוטוקול הניב כ -2 מיקרוגרם של HMW DNA (35-50 קילו) (איור 4) לגרם מדגם מחצלת עם יחס של 1.6 260/280, 260/230 ו יחס של 0.7 (טבלה 1). למרות יחס 260/230 שנראה נמוך, אין עיכוב יישום מולקולרית מבוסס במורד כגון הגברה-PCR של 16S rRNA גנים נצפתה במחקר נפרד 7. חשוב לציין כי ה-DNA מן hypersaline מחצלות יש שני מקורות עיקריים של זיהום; EPS ומלחים. לפיכך, ייתכן כי עקבות של חומרים מזהמים אלה עשויים להיות השפעה על יחסי 260/230 למרות מאמצים עצומים כדי לצמצם את השפעתם על יישומים זרם למטה.
קביעת גודל ה-DNA:
ג'ל אלקטרופורזה דופק שדה מעסיקה זרימת הנוכחי פועמת עם מתגים כיוונית לסירוגין והתוצאה היא משטח ה-DNA כפי שמוצג באיור 3. פרוטוקול ה-DNA שלנו הניב HMW של כ 35-50 kb. בעוד כמה גודל DNA עשוי להיות קטן יותר מ -30 kb, חשוב להיות חלק למרוח מעל 35 kb בהתחשב בעובדה שיבוט fosmid דורש ~ 40 kb מחדיר דנ"א שברי דנ"א גדולים לספק גישה רחבה יותר מסלולים biosynthetic ללא פגע. במחקרים שלנו, למרוח את ה-DNA מעל 35 קילו היה נכרת וטיהר עבור שיבוט גדול להכניס וקטור ויישומים מולקולריים אחרים.

1. איור חיידקים Hypersaline מחצלת דגימה באתר (בריכה גדולה) הממוקם על אליאותרה, Bahamas.

איור 2. חתך של המזרן חיידקים hypersaline השתמשו במחקר זה. מחצלת חיידקים התקבל בברכה hypersaline ממוקם על אליאותרה, Bahamas.
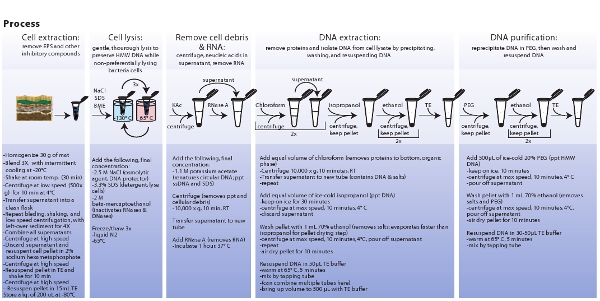
איור 3. ייצוג סכמטי של הליכים מעורבים מיצוי התא של חיידקים, תמוגה התא, חילוץ, טיהור של ה-DNA metagenomic. לחץ כאן כדי להציג תמונה גדולה יותר.

איור 4. אפיון המשקל המולקולרי של הדנ"א מופק באמצעות ג'ל אלקטרופורזה הדופק בתחום. ליין M הוא סמן HMW, ועל נתיבי 1 ו -2 הם משכפל הדנ"א metagenomic שחולצו מן המחצלת אליאותרה hypersaline באמצעות פרוטוקול לעיל.
| שיטת מיצוי | ריכוז ng / g | 260/280 | 260/230 | |
| PEG | הודעות 1 | 1806.1 | 1.64 | 0.76 |
| הודעות 2 | 2010.8 | 1.61 | 0.75 |
טבלה 1. מדידה של ריכוז ואיכות ה-DNA המופק מחצלת hypersaline מיקרוביאלי.
Access restricted. Please log in or start a trial to view this content.
Discussion
בהתחשב בכך הכולל הסרת תאים מדגימות מחצלת מורכב ומגוון מאוד של חיידקים אינה מעשית, הדאגה העיקרית היא באיזו מידה את התאים חילוץ לייצג את הקהילה הכוללת מחצלת מיקרוביאלי. במחקר קודם, ה-PCR-DGGE ניתוח של גנים 16S rRNA הראו כי חיידקים חמש הסרת תא צעדים להשתמש בפרוטוקול זה תמציות ת?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
Acknowledgements
עבודה זו מומנה על ידי תוכנית קרן המדע הלאומית Genomics הסביבה (גרנט לא EF-0723707).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | מספר קטלוגי | תגובות |
|---|---|---|---|
| β-mercaptoethanol | סיגמא אולדריץ | M3148 | |
| פוליאתילן גליקול 8000 | Promega | V3011 | 20% 1.2 M NaCl |
| אשלגן אצטט | פישר סיינטיפיק | פישר סיינטיפיק | |
| קוואנט-IT Assay dsDNA ערכת | Invitrogen | Q33130 | |
| RNase | Epicentre | MRNA092 | |
| נתרן כלוריד | BDH כימיקלים | BDH8014 | מתאים קונצרט כלשהו. |
| Dodecyl סודיום סולפט | פישר סיינטיפיק | 03-500-509 | 10% מים |
| נתרן hexametaphosphate | EMD כימיקלים | SX0583-3 | 2% במים |
| TBE | פישר סיינטיפיק | BP1333-1 | |
| השף Mapper XA מערכת | Bio-Rad Laboratories | 170-3670 | |
| NanoDrop 1000 ספקטרופוטומטר | Thermo Scientific | ND-1000 | |
| Vortexer | מדעי תעשיות בע"מ | ||
| סגול Crosslinker | UVP | ||
| וורינג בלנדר | וארינג מעבדה | LB10S |
References
- Decho, A. W. Microbial biofilms in intertidal systems: an overview. Cont. Shelf Res. 20, 1257-1273 (2000).
- Dupraz, C., Visscher, P. T. Microbial lithification in marine stromatolites and hypersaline mats. Trends Microbiol. 13, 429-438 (2005).
- Steffan, R. J., Goksoyr, J., Boj, A. K., Atlas, R. M. Recovery of DNA from soils and sediments. Appl. Environ. Microbiol. 54, 2908-2915 (1988).
- Lee, Y. K., Kim, H. W., Liu, C. L., Lee, H. K. A simple method for DNA extraction from marine bacteria that produce extracellular materials. J. Microbiol. Methods. 52, 245-250 (2003).
- Roose-Amsaleg, C. L., Garnier-Sillam, E., Harry, M. Extraction and Purification of Microbial DNA from Soil and Sediment Samples. Appl. Soil Ecol. 18, 47-60 (2001).
- de Lipthay, J. R., Enzinger, C., Johnsen, K., Aamand, J., Sørensen, S. J. Impact of DNA extraction method on bacterial community composition measured by denaturing gradient gel electrophoresis. Soil Biol. Biochem. 36, 1607-1614 (2004).
- Bey, B. S., Fichot, E. B., Dayama, G., Decho, A. W., Norman, R. S. Extraction of High Molecular Weight DNA from Microbial Mats. Biotechniques. 49, 631-640 (2010).
- Kakirde, S. K., Parsley, L. C., Liles, M. R. Size does matter: Application-driven approaches for soil metagenomics. Soil Biology & Biochemistry. 42, 1911-1923 (2010).
- Rodon, M. R., August, P. R., Bettermann, A. D., Brady, S. F., Grossman, T. H., Liles, M. R., Loiacono, K. A., Lynch, B. A., MacNeil, I. A., Minor, C., Tiong, C. L., Gilman, M., Osburne, M. S., Clardy, J., Handelsman, J., Goodman, R. M. Cloning the Soil Metagenomic: A Strategy for Accessing the Genetic and Functional Diversity of Uncultured Microorganisms. Appl. Environ. Microbiol. 66, 2541-2547 (2000).
- Beja, O., Aravind, L., Koonin, E. V., Suzuki, M. T., Hadd, A., Nguyen, L. P., Jovanovich, S. B., Gates, C. M., Feldman, R. A., Spudich, J. L., Spudich, E. N., DeLong, E. F. Bacterial Rhodopsin: Evidence for a New Type of Phototrophy in the Sea. Science. 289, 1902-1906 (2000).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved