A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
استخدام اعتراض البصرية لدراسة التفاعلات المرضي المضيف الحيوي للخلية الحية التصوير
In This Article
Summary
ووصف طريقة لتحديد فردي ، والتعامل معها ، ومسببات الأمراض الصورة الحية باستخدام فخ البصرية بالإضافة إلى المجهر القرص الغزل. فخ البصرية يوفر سيطرة المكاني والزماني للكائنات الحية والأماكن المجاورة لها إلى الخلايا المضيفة. مضان المجهري التفاعلات بين الخلايا الحيوية يلتقط مع الحد الأدنى من اضطراب في الخلايا.
Abstract
ديناميكية التصوير الخلية الحية تسمح برؤية مباشرة في الوقت الحقيقي التفاعلات بين خلايا الجهاز المناعي 1 ، 2 ، إلا أن عدم السيطرة المكانية والزمانية بين الخلية البلعمية وميكروب جعلت ركزت الملاحظات في التفاعلات الأولية للاستجابة المضيف لمسببات الأمراض صعبة. تاريخيا ، تم تصوير أحداث الاتصال بين الخلايا مثل البلعمة 3 عن طريق خلط أنواع الخلايا اثنين ، ثم المسح الميداني مستمر من رأي لايجاد اتصالات بين الخلايا الصدفة في المرحلة المناسبة للتفاعل. الطبيعة العشوائية لهذه الأحداث يجعل هذه عملية شاقة ، وأنه من الصعب مراقبة الأحداث في وقت مبكر أو عابرة في الخلية خلية الاتصال عن طريق هذا النهج. هذا الأسلوب يتطلب العثور على أزواج الخلية التي هي على وشك الاتصال ، والمراقبة لهم حتى الاتصال بهم من الطراز الأول ، أو لا. لمعالجة هذه القيود ، ونحن نستخدم محاصرة الضوئية كوسيلة من وسائل ، غير الغازية غير مدمرة ، ولكن سريعة وفعالة لوضع الخلايا في الثقافة.
ويتزايد استخدام المصائد الضوئية ، أو ملاقط بصرية ، في مجال البحوث البيولوجية لالتقاط والتلاعب جسديا الخلايا والجزيئات الأخرى ميكرون الحجم في ثلاثة أبعاد 4. ولوحظ تكثيف الضغط الإشعاع وتطبيقها لنظم منتاش البصرية في عام 1970 5 ، 6 ، وكان أول استخدام للسيطرة على العينات البيولوجية في عام 1987 7. منذ ذلك الحين ، قد نضجت ملاقط بصرية في التكنولوجيا لتحقيق مجموعة متنوعة من الظواهر البيولوجية 8-13.
نحن تصف طريقة السلف ال 14 التي يعيش التصوير من خلال دمج الخلايا الضوئية مع اعتراض الغزل المجهري القرص مبائر مع التحكم في درجة الحرارة والرطوبة لتوفير مجموعة رائعة والسيطرة المكانية والزمانية من الكائنات الممرضة في البيئة الفسيولوجية لتسهيل التفاعل مع الخلايا المضيفة ، على النحو الذي يحدده المشغل. العيش ، وحوصر بصريا الكائنات المسببة للأمراض مثل المبيضات البيض والرشاشية الدخناء ، الذي يمكن أن يسبب يمكن أن تكون مميتة ، والتهابات الغازية في الأفراد المناعة 15 و 16 (مثل الإيدز ، والعلاج الكيميائي ، ومرضى زرع الأعضاء) ، وذلك باستخدام الليزر كثافات غير المدمرة وانتقل بجوار الضامة ، والتي يمكن يبلعم الممرض. وارتفاع القرار ، أحالت الأفلام الخفيفة ومضان القائم على أسس القدرة على مراقبة الأحداث في وقت مبكر من البلعمة في الخلايا الحية. للتدليل على تطبيق واسعة في علم المناعة ، كما حوصر الأولية (خلايا تي) والتلاعب في شكل نقاط الاشتباك العصبي المضادة للCD3 المجهرية المغلفة في الجسم الحي ، وكما تم الحصول على الوقت الفاصل بين التصوير تشكيل المشبك. من خلال توفير وسيلة لبسط السيطرة المكانية غرامة مسببات العيش فيما يتعلق الخلايا المناعية ، ويمكن التقاط التفاعلات الخلوية بواسطة المجهر مضان مع الحد الأدنى من اضطراب الخلايا ويمكن أن تسفر عن بصيرة قوية في وقت مبكر من ردود الحصانة الفطرية والتكيفية.
Protocol
1. شروط الثقافة مسببات الأمراض لمحاصرة البصرية
- تنمو ألف الدخناء (B-5233/RGD12-8) على وسائل الاعلام آغار شبه صلبة تحتوي على SBD (سابورو دكستروز) حتى 30 درجة مئوية لمدة 3 أيام.
- تنمو جيم albicans (SC5314) في YPD (الخميرة ، ببتون سكر العنب) ثقافة السائل تحتوي على 100 ميكروغرام / مل الأمبيسيلين بين عشية وضحاها في حاضنة شاكر في 30 درجة مئوية.
2. إعداد الممرضات لوصفها الفلورسنت
- الحصاد المطلوب كمية مسببات الأمراض ونقلها إلى أنبوب مل تفاعل 1.5.
- إضافة مخزنة 300 ميكرولتر من الفوسفات الملحي (PBS) إلى أنبوب التفاعل.
- يصوتن الخليط لمدة 30 ثانية.
- الطرد المركزي عند 4000 دورة في الدقيقة لمدة 1 دقيقة.
- نضح طاف ، وترك بيليه دون عائق.
- كرر (2.4) و (2.5) مرتين أخريين.
- Resuspend في 500μL من برنامج تلفزيوني.
3. وسم مسببات الأمراض مع صبغة الفلورسنت
- حل 1 ملغ من صبغة من الفائدة (على سبيل المثال اليكسا فلور 488 ، اليكسا فلور 647) في 100 ثنائي ميثيل الفورماميد ميكرولتر (DMF) (تركيز 10 ملغ / مل).
- إضافة 3 ميكرولتر من خليط لصبغ رد فعل أنابيب تحتوي على مسببات الأمراض غسلها.
- تدوير أو تهزه عينة بلغت 37 درجة مئوية لمدة 1 ساعة.
- غسل العينة مع 3X PBS بواسطة الطرد المركزي عند 4000 دورة في الدقيقة لمدة 1 دقيقة.
- Resuspend في 300 ميليلتر من برنامج تلفزيوني.
4. حصاد خلايا تي من الدم الكامل
- الحصول على الدم الكامل (الطازجة).
- الدم الحار ، برنامج تلفزيوني + 2 ٪ الجنين مصل البقر (FBS) ، وhistopaque إلى درجة حرارة الغرفة.
- إضافة CD4 + T RosetteSep الإنسان كوكتيل التخصيب في 50 ميكرولتر خلية / مل من الدم الكامل.
- تدوير العينة واحتضان لمدة 20 دقيقة في درجة حرارة الغرفة.
- تمييع عينة مع حجم مساو من FBS PBS + 2 ٪ ومزيج بلطف.
- طبقة المخفف عينة على رأس histopaque ، والتقليل من الاختلاط
- أجهزة الطرد المركزي لمدة 20 دقيقة في 1200 XG في درجة حرارة الغرفة مع فرامل إيقاف.
- إزالة الخلايا المخصب.
- غسل خلايا المخصب 2X مع + PBS حل FBS 2 ٪.
- ليز خلايا الدم الحمراء لمدة 2 دقيقة مع خلايا الدم الحمراء العازلة lysing
- إضافة 10 مل من FBS PBS 2 ٪ + وأجهزة الطرد المركزي lysed خلايا الدم الحمراء عند 1500 دورة في الدقيقة لمدة 5 دقائق
- نضح طاف ، الحرص على عدم تعكير صفو بيليه
- Resuspend في وسائل الإعلام التي تحتوي على 10 ٪ IMDM مصل بقري جنيني
5. إعداد الضامة 264.7 RAW إلى شرائح الغرفة
- إعداد DMEM (وسط Dulbecco لتعديل النسر) لاحتواء 10 ٪ FBS ، 1 ٪ البنسلين / الستربتوميسين ، و 1 ٪ L - الجلوتامين.
- دافئ وسائل الإعلام ، التربسين ، وبرنامج تلفزيوني في حمام دافئ إلى 37 درجة مئوية.
- غسل لوحة 2X مع برنامج تلفزيوني
- نضح PBS بين كل غسل.
- إضافة 5 مل التربسين إلى لوحة لتغطية السطح (لوحة 10 سم زراعة الأنسجة).
- احتضان لمدة 5 دقائق عند 37 درجة مئوية.
- تدق بلطف الجانب من لوحة لفصل الخلايا من سطح اللوحة. يجب الحرص على عدم رش التربسين خارج اللوحة.
- إضافة 5 مل أو ما يعادل ذلك من وسائل الإعلام إلى التربسين.
- نضح الخليط في أنبوب التفاعل.
- أجهزة الطرد المركزي في 1000 x ج لمدة 3 دقائق.
- نضح وسائل الاعلام ، الحرص على عدم تعكير صفو بيليه.
- Resuspend في 10 مل من وسائل الإعلام.
- إضافة 400 ميكرولتر من وسائل الإعلام إلى كل غرفة من الشريحة الغرفة.
- إضافة 5 ميكرولتر من خلية إلى تعليق كل من المجلسين.
- تنمو بين عشية وضحاها في الحاضنة عند 37 درجة مئوية مع نسبة 5 ٪ CO 2.
6. بالإضافة إلى عينة من الممرضات
- ميكرولتر الماصة 50-10 المسمى مسببات الأمراض ذات الاهتمام (من الخطوات 1-3) في القاعة.
- مزيج دقيق من قبل pipeting صعودا وهبوطا ، والحرص على عدم لمس الجزء السفلي من الغرفة لزعزعة الالتزام الضامة.
7. تحميل العينة على القرص الغزل المجهر مبائر (في شريط فيديو ، من خلال فحص المكونات)
- بدوره على كافة مكونات لصناعة الغزل المجهر مبائر القرص.
- محاذاة مجهر لتصوير مدينة دبي للإنترنت.
- إزالة الشريحة الغرفة من الحاضنة.
- إدراج الشرائح في مرحلة الغرفة المتخصصة.
- إزالة الشريحة الأعلى من الغرفة (التصوير اللازمة لمدينة دبي للإنترنت).
8. استعدادا لمحاصرة الضوئية (في شريط فيديو ، من خلال فحص مكوناتها وكيفية إدماجه في المجهر)
- بدوره على مصراع الكاميرا لفخ البصرية.
- بدوره على ليزر الأشعة تحت الحمراء.
- فتح مصراع الكاميرا (على الليزر) لاعتراض البصرية.
- إغلاق مصراع الكاميرا تأكيد أمام ليزر الأشعة تحت الحمراء عن طريق التحقق مع البطاقة الحمراء.
9. اختيار والتلاعب مع الممرض فخ البصرية
- التركيز على التقيد الضامة على الشريحة.
- العثور على مسببات تذبذب بحرية في حل المتاخمة للالضامة.
- مرحلة الانتقال هذه أن الممرض هو على مقربة من الفخ.
- فتح مصراع والانخراط في الفخ.
- التحرك لجلب عينة الضامة في اتصال مع مصيدة ثابتةPED الممرض.
- صورة مع الغزل القرص مبائر المجهر ، سواء في مدينة دبي للإنترنت ، مضان ، أو مزيج من الاثنين معا. عادة ، يتم محاصرة في مدينة دبي للإنترنت ، ويتم في الوقت الحقيقي مع التصوير مضان.
10. ممثل النتائج :
لممارسة السيطرة الكاملة المكاني والزماني للممرضات والخرز في المجراة في المختبر والبيئة ، وقمنا بتصميم جهاز محاصرة متكاملة مبنية خصيصا على القرص الغزل المجهر مبائر (التخطيطي هو مبين في الشكل 1). بكامل قوتها ، وفرت ليزر 350 ميجاوات من الكهرباء وبعد اقتران الضوء مع العناصر البصرية المختلفة في الجهاز فخ البصرية ، وكانت تستخدم ~ 80 ميجاوات من الكهرباء في TIRF الهدف ، كما يقاس مع السلطة متر ، لتشكل في فخ في الغرفة.
وبغية وضع كائن في غرفة النسبي إلى كائن المحاصرين ، في حين انتقل إلى مرحلة عقد ثابت مع وجوه المحاصرين محاصرة ليزر. وانتقل إلى مرحلة بسرعات بطيئة بما فيه الكفاية ، بحيث قوة السحب على الجسيم المحاصرين لم تتجاوز قوة محاصرة الأقصى.
وصفت مع كل من ثلاثة ألوان (AF488 ، AF568 ، وAF647 الموافق الأخضر والأزرق والأحمر في الشكل ، على التوالي) لتوضيح التصوير مع قنوات متعددة مضان -- السكان منفصلة albicans C. (~ 5 ميكرون الحجم بشكل نموذجي) بينما في نفس الوقت محاصرة بصريا الممرض. وجيم واحد كان محاصرا albicans وانتقلت في نمط مربع من خلال مجموعة من خميرة أخرى ، كما أشارت إلى ذلك السهام الرمادي ، مما يدل على القدرة على التقاط الصور ومعالجتها موقع معين من الممرض واحد يختاره من قبل المشغل حتى في بيئة مزدحمة (الشكل 2A) .
لتوضيح مزيد من المرونة في هذا النظام لاعتراض morphologies شكل مختلف الكائنات المسببة للأمراض التي أظهرتها ، كان منتاش البصرية أيضا قادرا على الاستمرار وضعه حجم سي albicans الجسيمات مع الخيطان الكاذبة. وجيم ونقلت albicans المسمى مع AF647 (الحمراء) على طول مسار كما هو موضح بواسطة السهم الأبيض وضعت بجانب خلايا GFP - LC3 - RAW فلوري (الشكل 2B). جزء من الخميرة C. كان محاصرا albicans كما الخيطان الكاذبة متأخرا على طول.
نحن قادرون أيضا الرشاشية الدخناء المقبل لخلية فأر بلعم الخام من أجل تحليل الإطار الزمني المطلق للالبلعمة مع هذا الخط خلية معينة والممرض (الشكل 3A). بمجرد أن الممرض يجعل الاتصال مع الخلية ، يتم تشغيل في فخ الخروج ، ويتم توظيف الوقت الفاصل بين التصوير لمراقبة الأحداث اللاحقة الخلوية (الشكل 3B). واستخدمت أيضا في فخ الضوئية لالتقاط الأولية (خلايا تي) المعزولة من الدم وإخراج المتاخمة لحبات المغلفة مع الأجسام المضادة لمكافحة CD3 لكي تي خلية لتشكيل المشبك المناعية مع حبة (الشكل 4) ، وتظهر إضافية براعة في فخ مباشرة والتلاعب الخلايا المناعية.
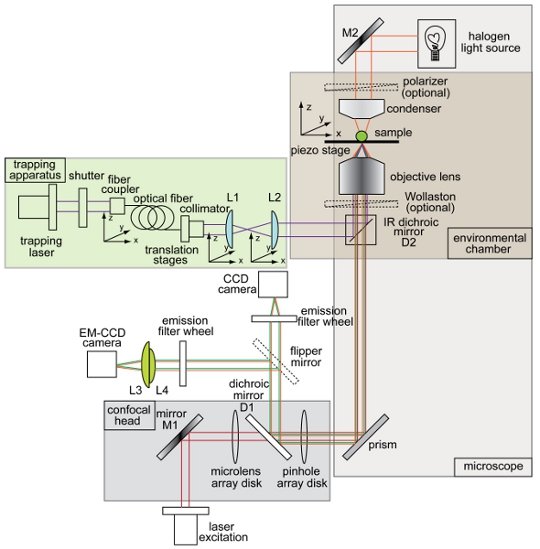
الشكل 1. نظرة عامة والتخطيطي في فخ البصرية مجتمعة والغزل الإعداد القرص مبائر المجهر. تخطيط صك تبين شعاع محاصرة (الأرجواني) ، إنارة الطريق للتصوير brightfield (برتقالي) ، شعاع الإثارة مضان (الحمراء) ، مضان الانبعاثات (الأخضر) ، إلى جانب المسؤول عن جهاز (CCD) الكاميرا ، والإلكترون ضرب الجهاز المسؤول يقترن (EM - CCD) الكاميرا ، المرايا مزدوج اللون (D1 و D2) ، المرايا (M1 و M2) ، وعدسات (L1 ، L2 ، L3 ، L4). وصفت جميع المكونات الأخرى للنظام المجهر فخ مبائر في الشكل.
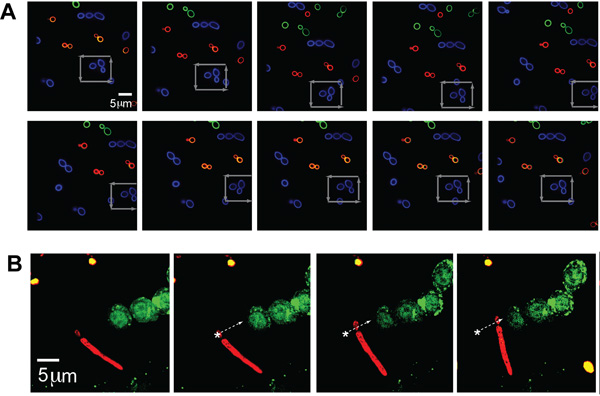
الشكل 2 : (أ) من المحاصرين الإسفار الصور والتلاعب بها C. albicans. والمحاصرين fluorescently المسمى (اليكسا فلور 488 (AF488) ، الزرقاء) الكائن في حقل الأخرى جيم fluorescently المسمى albicans (AF568 والأخضر وAF647 ، الحمراء). يتم نقل هذه المرحلة حول المحاصرين ، CA الجسيمات الزرقاء كما يتبين من الأسهم الرمادية. (ب) المحاصرين الزائفة خوطي شكل C. albicans بجوار GFP - LC3 الخلية RAW. وأعرب شكل psuedohyphal fluorescently المسمى من CA (أحمر ، AF647) المحاصرين بصريا وانتقلت المتاخمة لGFP - LC3 الضامة RAW. تم نقل الكائن CA على طول مسار كما هو موضح بواسطة السهم الأبيض.

الشكل 3. ملائمة وتحديد المواقع أ. الدخناء المقبل لخلية RAW أكلة. (أ) من الصور Brightfield ألف المحاصرين الدخناء ، كما يدل على ذلك السهم الأبيض ، وانتقلت المتمركزة على طول الطريق كما أشار السهم الأحمر. الممرض المحاصرين قليلا من التركيز بسبب اعتراض دفع الكائن أعلى قليلا من المستوى البؤري ألف. يتم نقل الدخناء حتى يتم وضعها بجوار الخلية RAW المطلوب. (باء) انفلونزاorescence التصوير من البلعمة أ. الدخناء بخلية RAW. بعد وضع الممرض المحاصرين المقبل إلى خلية RAW ، يتم تنشيط عملية البلعمة. في 30 ثانية ، وغشاء الخلية RAW يبدأ التغيير وشكل كوب حول الجسيمات. في 60 ثانية ، ويتكون بالكامل الكأس. من 90s الى 150s ، وألف غارق الدخناء ، وبنسبة 180 ثانية ، واستيعابا كاملا للجسيمات

الشكل 4. محاصرة الأولية T - الخلية إلى شكل مشبك مع المضادة للCD3 حبات مغلفة. الصور الأولية لمدينة دبي للإنترنت تي الخلية التي انتقلت في فخ الضوئية لموقف بجوار المغلفة مع حبة مضادة للأجسام المضادة CD3. وتشكل الخلية بعد ذلك المشبك المناعية ، والتي لا يمكن تمييزها بسهولة في الصور.
Access restricted. Please log in or start a trial to view this content.
Discussion
في هذا العمل الذي نقوم استخدام فخ البصرية لالتقاط الجراثيم ذات أبعاد ما بين 3 ميكرون -- 5 ميكرون. على الرغم من مسببات الأمراض التي تهم مختبرنا وعادة ما يكون لهذه الأبعاد ، ونظام منتاش البصرية الموصوفة هنا هي مرنة إلى اعتراض مجموعة واسعة من الأحجام. وقد استخدمت بالفعل ال...
Access restricted. Please log in or start a trial to view this content.
Disclosures
Acknowledgements
وأيد هذا العمل من مستشفى ماساتشوستس الإدارة العامة للصناديق الطب الباطني (JMT ، MKM ، حركة تحرير الكونغو ، JMV) ، المعهد الوطني للتصوير الطبية الحيوية ومنح الهندسة الحيوية T32EB006348 (CEC) ، ومركز مستشفى ماساتشوستس العام للالحاسوبية والتكاملية الأحياء صندوق التنمية وAI062773 ( RJH) ، ومنح AI062773 ، DK83756 وDK 043351 (RJX) ، جبهة الخلاص الوطني 0643745 (MJL) ، NIH R21CA133576 (MJL) ، والمعهد الوطني لأمراض الحساسية والأمراض المعدية التابع لمعاهد الصحة القومية (NIH) AI057999 (JMV ). نشكر نيكولاس جيم يودر لإجراء مناقشات مفيدة ، وتشارلز لباد (RPI ، المؤتمر الوطني العراقي) للحصول على المساعدة التقنية.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف | شركة | فهرس العدد | تعليقات (اختياري) |
|---|---|---|---|
| ألف الدخناء | البينو السلالة ، B-5233/RGD12-8 ، هدية من KJ كوون تشونغ ، المعاهد الوطنية للصحة | ||
| C. albicans | SSY50 - B متحولة ، هدية من Mylonakis الفثيريوس ، MGH ؛ SC5314 السلالة ، هدية من جيرالد فينك ، معهد وايتهيد | ||
| الكسا فلور 488 | Invitrogen | A20000 | |
| الكسا فلور 647 | Invitrogen | A20006 | |
| ثنائي ميثيل الفورماميد | سيغما | D4551 | |
| الدم الطازج | هدية من هيث RJW ، MGH ، سفينتى | ||
| نيكون المجهر المقلوب | نيكون | نموذج TI - E | |
| محاصرة ليزر ، ChromaLase | السماء الزرقاء للبحوث | CLAS - 106 - 02 - STF02 | |
| مضان الإثارة الليزر | متماسك | إنوفا طراز 70C | |
| الألواح لمكونات محاصرة | Thorlabs | MB1224 ، MB1218 | |
| البصري الهواء الجدول | شركة التصنيع التقنية | ||
| مصراع الإلكترونية مع التحكم دواسة | Uniblitz | تم شراؤها من المنتسبين فنسنت ، روتشستر ، نيويورك | |
| Singlemode الألياف البصرية | أوقية بصريات | PMJ - 3S3S - 1064-6 | |
| الألياف ميضعة | Thorlabs | PAF - X - 5 - C | |
| الألياف ميزاء | أوقية بصريات | HPUCO - 23-1064 - P - 25AC | |
| عدسات التلسكوب | Thorlabs | AC254 - 150 - B | البعد البؤري من 150 مم |
| مراحل الترجمة (س ، ص ، ض) | نيوبورت | M - 461 - XYZ | |
| IR مزدوج اللون المرآة | صفاء | ET750 - SP - 2p8 | |
| الهدف عدسة (100X) | نيكون | NA = 1.49 الغمر ، النفط ، والهدف TIRF | |
| رئيس مبائر | يوكوجاوا | CSU الحادي عشر | |
| المستقطب | نيكون | MEN51941 | |
| ولاستون المنشور | نيكون | MBH76190 | |
| EM - CCD كاميرا | هاماماتسو | C9100 - 13 | |
| اتفاقية مكافحة التصحر الكاميرا (ORCA ER) | هاماماتسو | C4742 - 80 - 12AG | |
| مرشح عجلة | Ludl | 99A353 | |
| مرشح عجلة | سوتر | LB10 - نوي | |
| غرف ساترة | Lab-Tek/Nunc | 155409 | |
| Dynabeads | Invitrogen | 111 - 51D | المغلفة مع CD3 مكافحة |
| Dulbecco لتعديل النسر المتوسط (DMEM) | Invitrogen / Gibco | 10313 | |
| البنسلين / الستربتوميسين | Invitrogen / Gibco | 15140-122 | |
| L - الجلوتامين | Invitrogen / Gibco | 25030-081 | |
| الجنين المصل البقري (HyClone) | ThermoScientific | SH30071.03 |
References
- Grakoui, A. The immunological synapse: A molecular machine controlling T cell activation. Science. 285, 221-227 (1999).
- Monks, C. R. Three-dimensional segregation of supramolecular activation clusters in T cells. Nature. 395, 82-86 (1998).
- Stuart, L. M., Ezekowitz, R. A. Phagocytosis and comparative innate immunity: Learning on the fly. Nat Rev Immunol. 8, 131-141 (2008).
- Neuman, K. C., Block, S. M. Optical trapping. Rev Sci Instrum. 75, 2787-2809 (2004).
- Ashkin, A. Optical trapping and manipulation of neutral particles using lasers. Proc Natl Acad Sci USA. 94, 4853-4860 (1997).
- Ashkin, A. Acceleration and trapping of particles by radiation pressure. Phys Rev Lett. 24, 156-159 (1970).
- Ashkin, A., Dziedzic, J. Optical trapping and manipulation of viruses and bacteria Science. Nature. 235, 1517-1520 (1987).
- Khalil, A. S. Single M13 bacteriophage tethering and stretching. Proc Natl Acad Sci USA. 104, 4892-4897 (2007).
- Khalil, A. S. Kinesin's cover-neck bundle folds forward to generate force. Proc Natl Acad Sci USA.. 105, 19247-19252 (2008).
- Li, Z. Membrane tether formation from outer hair cells with optical tweezers. Biophys J. , 1386-1395 (2002).
- Kim, S. The αβ T cell receptor is an anisotropic mechanosensor. J Biol Chem. 284, 31028-31028 (2009).
- Mohanty, S., Mohanty, K., Gupta, P. Dynamics of interaction of RBC with optical tweezers. Opt. Express. 13, 4745-4751 (2005).
- Tam, J. Control and manipulation of pathogens with an optical trap for live cell imaging of intercellular interactions. PLoS One. 5, e15215-e15215 (2010).
- Lin, S. J., Schranz, J., Teutsch, S. M. Aspergillosis case-fatality rate: Systematic review of the literature. Clin Infect Dis.. 32, 358-366 (2001).
- Wey, S. B. Hospital-acquired candidemia - the attributable mortality and excess length of stay. Arch. Intern. Med. 148, 2642-2645 (1988).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved