需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
动态活细胞成像的宿主 - 病原体相互作用的研究使用的光学陷阱
摘要
一种方法是描述单独选择,操作和使用光学陷阱,再加上一个旋转的磁盘显微镜图像活病原体。光陷阱提供了空间和时间的控制生物体和地方他们相邻的宿主细胞。荧光显微镜捕捉动态,以最小的扰动细胞间的相互作用。
摘要
动态活细胞成像允许直接的免疫系统的1,2细胞之间的实时交互的可视化;然而,在空间和时间之间的吞噬细胞和微生物控制的缺乏已呈现集中观察到病原体的宿主反应的初步相互作用困难。从历史上看,如细 胞的吞噬功能3间接触事件已经通过混合两种类型的细胞成像,然后连续扫描场的观点,找到适当的互动阶段偶然间接触。这些事件的随机性,使这个过程繁琐,它是通过这种方法难以观察到在细胞与细胞接触的早期或稍纵即逝的事件。这种方法需要发现细胞对接触的边缘上,并观察他们,直到他们完善他们的联系,或不。为了解决这些限制,我们使用光学诱捕作为一种非侵入性,非破坏性的,但快速和有效的方法定位在培养细胞。
在生物学研究中越来越多地利用光学陷阱,或光镊,捕捉和物理操纵细胞和其他微米大小的颗粒在三个层面 4 。首先观察到的辐射压力和应用光镊系统于1970年5,6,最初是用来控制在1987年7的生物标本。从那时起,光镊技术已经成熟到探头8-13多种生物现象。
我们描述的方法14,进步活细胞成像,通过与纺丝温度和湿度控制的磁盘共聚焦显微镜,提供精致的空间和时间在生理环境中病原微生物的控制,以方便与宿主细胞相互作用,确定由一个集成光学陷阱运营商。活,如白色念珠菌和曲霉 ,这可能会导致免疫功能低下15个人,16( 例如艾滋病,化疗和器官移植患者)的潜在致命性,侵袭性感染,病原微生物光学被困采用非破坏性的激光强度和移动相邻的巨噬细胞,它可以吞噬病原体。高分辨率,传输光,荧光为基础的电影的建立能力,观察活细胞的吞噬功能的早期事件。为了证明在免疫学的广泛适用性,主要的T细胞也被困和操纵与抗CD3 涂层微球在体内形成的突触和突触形成的成像时间推移也获得。通过提供一个方法来施加罚款活病原体与免疫细胞的空间控制,细胞相互作用可以被捕获,以最小的扰动细胞荧光显微镜和先天免疫和适应性免疫的早期反应可以产生强大的洞察力。
研究方案
1。光学诱捕病原体的文化条件
- 生长在一个半固体琼脂的SBD(沙氏葡萄糖)媒体30 ° C 曲霉 (B-5233/RGD12-8)3天。
- 成长C。白色念珠菌 (SC5314)在YPD(酵母蛋白胨葡萄糖)液体培养基在摇床培养箱含有100μg/ mL氨苄青霉素一夜之间30 ° C。
2。病原体为荧光标记的制备
- 收获所需量的病原体,并转移到1.5 ml反应管。
- 反应管中加入300μL磷酸盐缓冲液(PBS)。
- 超声为30秒的混合物。
- 离心1分钟4000转。
- 吸上清液,留下沉淀不受干扰。
- 重复(2.4)和(2.5)两次以上。
- 悬浮在500μL的PBS。
3。用荧光染料标记的病原体
- 溶解1毫克染料(如的Alexa Fluor 488的Alexa Fluor 647)100μL,二甲基甲酰胺(DMF)(浓度为10毫克/毫升)的兴趣。
- 含洗病原体的反应管加入3μL染料混合物。
- 旋转或摇晃样品在37 ° C为1小时。
- 用PBS 3X洗1分钟4000转离心样品。
- 悬浮于300μL的PBS。
4。收获从全血T细胞
- 获得全血(新鲜)。
- 温血,PBS + 2%胎牛血清(FBS)和histopaque室温。
- 在50μL/ ml全血加入RosetteSep人体的CD4 + T细胞富集酒会。
- 旋转样品和20分钟在室温下孵育。
- 稀释样品与等体积PBS + 2%FBS,轻轻混匀。
- 层histopaque顶部稀释样品,最大限度地减少混合
- 离心20分钟,在室温下在1200 XG与制动关闭。
- 删除丰富的细胞。
- 丰富的细胞用PBS + 2%FBS的解决方案2X洗净。
- 红细胞裂解红细胞裂解缓冲2分钟
- 5分钟,加入10 mL PBS + 2%FBS和在1500转离心裂解红细胞中
- 吸上清,注意不要扰乱沉淀
- 悬浮在含10%胎牛血清的IMDM媒体
5。到玻片RAW 264.7巨噬细胞的制备
- 准备贝科改良Eagle培养基)DMEM(含有10%FBS,1%青霉素/链霉素,L -谷氨酰胺和1%。
- 暖媒体,胰蛋白酶,PBS在温水浴至37 ° C。
- 用PBS清洗2倍板
- 吸之间每次洗的PBS。
- 加入5 mL胰酶板盖面(10厘米组织培养板)。
- 5分钟在37 ° C。
- 轻轻敲板块方面,从板面分离的细胞。要小心,不要溅板之外的胰蛋白酶。
- 加入5 mL或同等数额的胰蛋白酶媒体。
- 吸成一个反应管的混合物。
- 在1000 XG离心3分钟。
- 吸媒体,小心不要去打扰颗粒。
- 悬浮在10毫升的媒体。
- 加入400μL的媒体,每个腔室幻灯片。
- 添加5μL的细胞悬液,每个分庭。
- 培养箱中培养过夜增长37 ° C,5%的CO 2 。
6。除了以样本的病原体
- 吸取5-10μL利益标记的病原体(步骤1-3)进入会议厅。
- 调匀pipeting向上和向下,小心不要触摸室底部扰乱坚持的巨噬细胞。
7。样品装载到旋转盘共聚焦显微镜(视频,通过扫描组件)
- 打开所有部件旋转盘共聚焦显微镜。
- DIC的成像显微镜对齐。
- 从孵化器中删除室幻灯片。
- 室幻灯片插入到专业舞台。
- 卸下室幻灯片的顶部(DIC的成像必要)。
8。光学诱捕的准备工作(视频,通过扫描组件和它是如何集成到显微镜)
- 快门打开光陷阱。
- 打开红外激光。
- 打开快门(激光)光学陷阱。
- 确认在前面的红外激光的快门是关闭的检查与IR卡。
9。磁光阱的选择和操纵的病原体
- 注重坚持幻灯片上的巨噬细胞。
- 毗邻巨噬细胞在溶液中的自由波动的病原体。
- 移动阶段,这样的病原体在陷阱附近。
- 打开快门和从事陷阱。
- 移动样品接触到的巨噬细胞与静止陷阱PED的病原体。
- 图像与旋转盘共聚焦显微镜,DIC,荧光,或两者兼而有之。通常情况下,诱捕是在DIC,荧光实时成像。
10。代表性的成果:
为了发挥的空间和时间的控制病原体和珠在体内和体外环境,我们设计一个定制的套色设备集成到一个旋转盘共聚焦显微镜(原理如图1) 。在充分的力量,激光提供350兆瓦电力,〜80兆瓦的电力在TIRF目标,用功率计测量,光耦合与各种光学元件在光学陷阱仪器后,形成的陷阱在会议厅内。
为了室相对被困对象的对象的位置,舞台很感动,而被困的对象与激光捕获静止。舞台是够慢的速度移动,使被困粒子的拖曳力不超过最大阱力。
白色念珠菌单独种群(典型的大小- 〜5微米),标有三种颜色(AF488,AF568,AF647,相应的绿色,蓝色和红色的身影,分别),说明多个荧光通道成像同时光学捕获的病原体。一个单一的C。白色念珠菌是被困在一个正方形图案通过其他酵母集群移动,灰色箭头表示,这表明能够捕获和操纵由运营商即使在拥挤的环境中选择一个单一的病原体的具体位置(图2A) 。
为了进一步说明这一制度陷阱病原微生物表现形态的不同形状的灵活性,光学镊子也能够保持和位于 A C. 白色念珠菌的粒子与一个假菌丝。 c. 在 AF647(红色)标记的白色念珠菌是沿着一个轨迹,所介绍的白色箭头,放在旁边的荧光GFP - LC3 - RAW细胞(图2B )。酵母部分的C.白色念珠菌是被困的假菌丝沿着落后。
我们也定位曲霉下到原始的小鼠巨噬细胞,以分析与这一特定的细胞株和病原体(图3A)吞噬的绝对时限。一旦病原体与细胞接触,陷阱关闭,时间推移成像观察随后的细胞事件(图3B)。光陷阱也被用来捕捉主要的T细胞,从血液中分离出,并指示毗邻珠涂在为T细胞与抗CD3抗体,形成免疫突触与珠(图4),显示其他通用性,以直接捕获和操纵的免疫细胞。
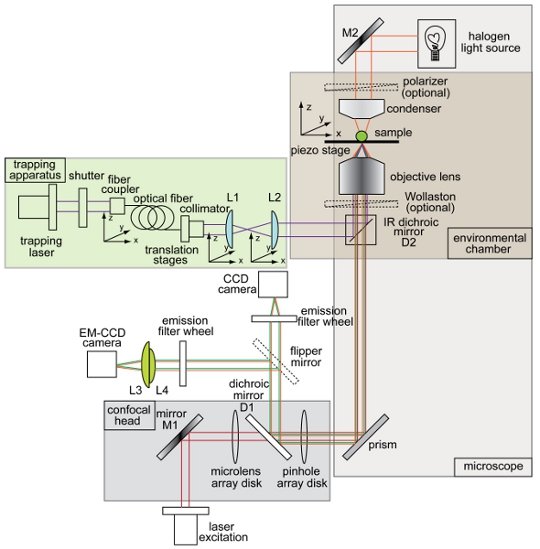
图1概述和原理图相结合的光陷阱和旋转盘共聚焦显微镜设置。仪器布局诱捕束(紫色),明场成像(橙色),荧光激发光(红色),荧光(绿色),电荷耦合器件(CCD)照相机,道路照明电子倍增电荷耦合器件(EM CCD)相机,(D1和D2)分色镜,反射镜(M1和M2),透镜(L1,L2,L3,L4的)。图中的陷阱共聚焦显微镜系统的所有其他组件都标记。
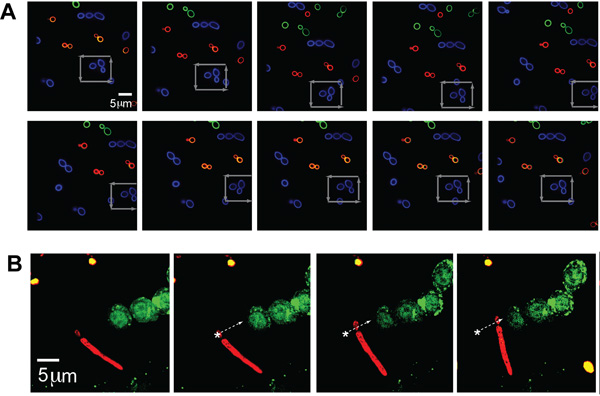
(一)荧光图像捕获和操纵C. 图2。 白色念珠菌 。被困荧光标记(的Alexa Fluor 488(AF488),蓝)生物体在其他C.荧光标记的领域白色念珠菌 (AF568,红,绿色和AF647)。舞台左右移动被困灰色箭头表示的,蓝色的CA粒子。 (二)受困伪菌丝形成的C. GFP - LC3的RAW细胞旁边白色念珠菌 。荧光标记的psuedohyphal形式的CA(红,AF647)光学捕获和移动相邻的GFP - LC3的表达RAW巨噬细胞。 CA的有机体是沿轨迹移动,白色箭头表示。

图3 A 的捕获和定位。 霉菌旁边的一个吞噬的RAW细胞。 (一)明场图像被困答霉菌 ,白色箭头指示,移动和沿红色箭头指示的路径的位置。被困的病原体是稍微重点推动略高于焦平面有机体的陷阱。 霉菌是移动,直到它被放在相邻的RAW细胞所需。 (二)流感A 的吞噬功能成像orescence 霉菌由RAW细胞。后被困的病原体是旁边放置到原始的细胞,吞噬过程中被激活。 30秒,原始细胞的细胞膜开始变化和粒子周围形成一个杯子。在60秒,一杯是完全形成。从90年代到150S,在A.霉菌是吞噬,180秒,粒子是完全内在

图4。捕获的主要T细胞突触形成与抗CD3涂珠。一个主要的T细胞移动到一个位置,旁边与抗CD3抗体的磁珠涂光陷阱DIC图像。细胞然后形成免疫突触,不能在图像很容易看出端倪。
Access restricted. Please log in or start a trial to view this content.
讨论
在这项工作中,我们使用了一个光学陷阱捕捉到3微米之间的尺寸的病原体 - 5微米。虽然我们的实验室感兴趣的病原体通常有这些方面,这里所描述的光镊系统是灵活的陷阱大范围的大小。事实上,光学陷阱被用来捕捉范围从单个原子,细胞直径约10微米的颗粒。此外,这种光学诱捕系统能够捕捉到各种形状:球形的颗粒,椭圆形,而且非常细长的颗粒,这是有用的生物病原体时。
Access restricted. Please log in or start a trial to view this content.
披露声明
致谢
这项工作得到了马萨诸塞州总医院医学内部资金部(JMT,MKM的MLC,JMV),国家生物医学成像和生物工程授予T32EB006348(CEC),美国马萨诸塞州总医院的中心计算和综合生物学的发展基金和AI062773( RJH),补助AI062773,DK83756,和DK 043351(RJX),0643745(MJL)美国国家科学基金会,美国国立卫生研究院R21CA133576(MJL),以及国家过敏和传染病研究所(NIAID的)美国国立卫生研究院(NIH)的AI057999(JMV )。我们感谢尼古拉三尤德,有益的讨论和查尔斯毛毡(RPI的公司)提供技术援助。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | 评论(可选) |
|---|---|---|---|
| 曲霉 | 白化菌株,B-5233/RGD12-8,KJ权涌,美国国立卫生研究院的礼物 | ||
| 白色念珠菌 | SSY50 - B埃莱夫塞里奥Mylonakis,麻省总医院的礼物突变体; SC5314应变,从杰拉尔德芬克的礼物,怀特黑德研究所 | ||
| 的Alexa Fluor 488 | Invitrogen公司 | A20000 | |
| 的Alexa Fluor 647 | Invitrogen公司 | A20006 | |
| 二甲基甲酰胺 | 西格玛 | D4551 | |
| 新鲜血液 | RJW荒地,麻省总医院,HMS的礼物 | ||
| 尼康倒置显微镜 | 尼康 | 钛 - E型 | |
| 补漏激光,ChromaLase | 蓝天研究 | CLAS - 106 - STF02 - 02 | |
| 荧光激发激光 | 连贯 | 模型伊诺70C | |
| 为诱捕组件的面包板 | Thorlabs | MB1224,MB1218 | |
| 光学航空表 | 技术制造公司 | ||
| 踏板控制的电子快门 | Uniblitz | 购买文森特协会,纽约州罗彻斯特 | |
| 单模光纤 | OZ光学 | PMJ - 3S3S - 1064 - 6 | |
| 光纤定位 | Thorlabs | PAF - X - 5 - C | |
| 光纤准直器 | OZ光学 | HPUCO - 23 - 1064 - P - 25AC | |
| 为望远镜镜头 | Thorlabs | AC254 - 150 - B | 焦距为150毫米 |
| 翻译阶段(X,Y,Z) | 纽波特 | M - 461 - XYZ | |
| 红外分色镜 | 浓度 | ET750 - SP - 2p8 | |
| 物镜(100X) | 尼康 | NA = 1.49,浸油,TIRF目标 | |
| 共焦头 | 横河电机 | CSU - 11 | |
| 偏光镜 | 尼康 | MEN51941 | |
| Wollaston棱镜 | 尼康 | MBH76190 | |
| EM - CCD摄像头 | 滨松 | C9100 - 13 | |
| CCD摄像头(ORCA的急诊室) | 滨松 | C4742 - 80 - 12AG | |
| 滤光轮 | Ludl | 99A353 | |
| 滤光轮 | 萨特 | LB10 -西北欧 | |
| 墓室玻璃罩 | Lab-Tek/Nunc | 155409 | |
| 磁珠 | Invitrogen公司 | 111 - 51D | 涂有抗CD3 |
| 贝科改良Eagle培养基(DMEM) | Invitrogen公司/ Gibco公司 | 10313 | |
| 青霉素/链霉素 | Invitrogen公司/ Gibco公司 | 15140-122 | |
| L -谷氨酰胺 | Invitrogen公司/ Gibco公司 | 25030-081 | |
| 胎牛血清(Hyclone公司) | ThermoScientific | SH30071.03 |
参考文献
- Grakoui, A. The immunological synapse: A molecular machine controlling T cell activation. Science. 285, 221-227 (1999).
- Monks, C. R. Three-dimensional segregation of supramolecular activation clusters in T cells. Nature. 395, 82-86 (1998).
- Stuart, L. M., Ezekowitz, R. A. Phagocytosis and comparative innate immunity: Learning on the fly. Nat Rev Immunol. 8, 131-141 (2008).
- Neuman, K. C., Block, S. M. Optical trapping. Rev Sci Instrum. 75, 2787-2809 (2004).
- Ashkin, A. Optical trapping and manipulation of neutral particles using lasers. Proc Natl Acad Sci USA. 94, 4853-4860 (1997).
- Ashkin, A. Acceleration and trapping of particles by radiation pressure. Phys Rev Lett. 24, 156-159 (1970).
- Ashkin, A., Dziedzic, J. Optical trapping and manipulation of viruses and bacteria Science. Nature. 235, 1517-1520 (1987).
- Khalil, A. S. Single M13 bacteriophage tethering and stretching. Proc Natl Acad Sci USA. 104, 4892-4897 (2007).
- Khalil, A. S. Kinesin's cover-neck bundle folds forward to generate force. Proc Natl Acad Sci USA.. 105, 19247-19252 (2008).
- Li, Z. Membrane tether formation from outer hair cells with optical tweezers. Biophys J. , 1386-1395 (2002).
- Kim, S. The αβ T cell receptor is an anisotropic mechanosensor. J Biol Chem. 284, 31028-31028 (2009).
- Mohanty, S., Mohanty, K., Gupta, P. Dynamics of interaction of RBC with optical tweezers. Opt. Express. 13, 4745-4751 (2005).
- Tam, J. Control and manipulation of pathogens with an optical trap for live cell imaging of intercellular interactions. PLoS One. 5, e15215-e15215 (2010).
- Lin, S. J., Schranz, J., Teutsch, S. M. Aspergillosis case-fatality rate: Systematic review of the literature. Clin Infect Dis.. 32, 358-366 (2001).
- Wey, S. B. Hospital-acquired candidemia - the attributable mortality and excess length of stay. Arch. Intern. Med. 148, 2642-2645 (1988).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。