Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Dinamik Canlı Hücre Görüntüleme Konukçu-Patojen Etkileşimleri Çalışma Optik Tuzak
Bu Makalede
Özet
Ayrı ayrı seçmek işlemek için bir yöntem tarif ve görüntü canlı patojenlerin dönen bir diskin mikroskop optik bir tuzak kullanıyor. Optik tuzak mekansal ve zamansal organizmaların kontrolü sağlar ve konak hücrelerine onları komşu yerleştirir. Floresan mikroskopi hücrelere az pertürbasyon dinamik hücrelerarası etkileşimleri yakalar.
Özet
Dinamik canlı hücre görüntüleme, bağışıklık sistemi 1, 2 hücreleri arasında gerçek zamanlı etkileşim doğrudan görselleştirme sağlar; Ancak, fagositik hücre ve mikrop arasındaki mekansal ve zamansal kontrol eksikliği patojenlere karşı konak yanıtının ilk etkileşimler içine gözlemler odaklı hale getirdi zordur. Tarihsel olarak, hücrelerarası kişi olaylarının fagositoz 3 gibi iki hücre tipleri karıştırma imaged ve sonra sürekli etkileşim uygun aşamada serendipitous hücrelerarası kişileri bulmak için tarama alan görünümü. Bu olayların stokastik bu sürecin doğa sıkıcı işler ve bu yaklaşım, erken ya da hücre-hücre teması kısacık olaylar gözlemlemek zordur. Bu yöntemi, temas eşiğinde hücre çiftleri bulma ve onlar erdirmek onların iletişim kadar onları gözlemleyerek gerektirir, ya da yoktur. Bu sınırlamaları aşması için, hücre kültürü yerleştirmek için bir non-invaziv, yıkıcı olmayan, ancak hızlı ve etkili bir yöntem olarak optik yakalama kullanın.
Optik tuzaklar, ya da optik cımbız, giderek, hücre ve diğer mikron boyutlu parçacıklar üç boyutlu 4 yakalama ve fiziksel olarak manipüle biyolojik araştırmalarda kullanılmaktadır. Radyasyon basıncı ilk gözlenen ve 1970 5, 6, optik cımbız sistemleri uygulanan ve ilk kez 1987 7 biyolojik örneklerin kontrol etmek için kullanılmıştır. O zamandan beri, çeşitli biyolojik olgunun 8-13 prob optik cımbız bir teknoloji haline gelmişti.
Biz gelişmeler, optik bir tuzak olarak belirlenen ana hücreleri ile etkileşimleri kolaylaştırmak için fizyolojik bir ortamda patojen organizmaların nefis mekansal ve zamansal kontrol sağlamak için sıcaklık ve nem kontrolü ile disk konfokal mikroskopi iplik ile entegre ederek hücre görüntüleme canlı bir yöntem 14 tarif operatörü. Canlı, immün sistemi baskılanmış bireyler 15, 16 (örneğin AIDS, kemoterapi, ve organ nakli), potansiyel olarak ölümcül, invaziv enfeksiyonlara neden Candida albicans ve Aspergillus, patojen organizmalar gibi optik bitişik tahribatsız lazer yoğunlukları kullanılarak yakalanmış ve taşındı makrofajlar, patojen fagosite. Yüksek çözünürlük, ışık ve floresan tabanlı filmler iletilen canlı hücreler fagositoz erken olayları gözlemleme yeteneği kurulmuştur. Immünoloji geniş uygulanabilirliğini göstermek için, birincil T-hücrelerinin sıkışıp kalmasına ve in vivo anti-CD3 kaplı mikrosferler ile sinaps oluşturmak için manipüle ve sinaps oluşumu zaman atlamalı görüntü de elde edildi. Canlı patojenlerin bağışıklık sistemi hücrelerine göre ince mekansal kontrolü uygulamak için bir yöntem sağlayarak, hücresel etkileşimler hücrelere az pertürbasyon floresan mikroskobu ile yakalanan ve güçlü bir anlayış doğal ve adaptif bağışıklık erken cevaplar verebilmesidir.
Protokol
1. Kültür koşulları optik yakalama patojenlerin
- 3 gün boyunca 30 SBD (Sabouraud dekstroz) içeren yarı-katı agar medya ° C A. fumigatus (B-5233/RGD12-8) büyütün.
- C. büyütün 30 gece bir çalkalayıcı inkübatör 100 mg / ml ampisilin içeren YPD albicans (SC5314) (Maya Peptonlu Dekstroz) sıvı kültür ° C
2. Floresan etiketlenmesi için patojenlerin hazırlanması
- Hasat patojenlerin miktarı istenen ve 1.5 ml reaksiyon tüpüne transfer.
- Fosfat ekle 300 mcL reaksiyon tüpü tamponlu salin (PBS).
- 30 saniye boyunca karışımı sonikasyon.
- 4000 rpm'de 1 dakika boyunca santrifüjleyin.
- Pelet bozulmamış bırakarak süpernatant aspire edin.
- Tekrarlama (2.4) ve (2.5) iki kez daha.
- 500μL PBS içinde süspanse edin.
3. Floresan boya ile patojenler Etiketleme
- 100 mcL dimetilformamid (DMF) (10 mg / ml konsantrasyon) ilgi boya (örneğin Alexa Fluor 488, Alexa Fluor 647) 1 mg çözülür.
- Yıkanmış patojenler içeren reaksiyon tüpleri 3 mcL boya karışımı ekleyin.
- ° C 'de 1 saat süreyle Döndür veya az 37 örnek sallamak.
- 1 dakika 4000 rpm'de santrifüj PBS 3X örneği ile yıkayın.
- PBS 300 mcL süspanse edin.
4. T-hücrelerinin tüm kan Hasat
- Tam kan (taze) edinin.
- Sıcak kan, PBS +% 2 fetal sığır serumu (FBS) ve oda sıcaklığına kadar histopaque.
- 50 mcL / mL tam kan RosetteSep İnsan CD4 + T hücre Zenginleştirme Kokteyl ekleyin.
- Örnek döndürün ve oda sıcaklığında 20 dakika inkübe edin.
- PBS +% 2 FBS eşit hacmi ile örnek seyreltilir ve hafifçe karıştırın.
- Katman karışım en aza indirilmesi, histopaque üst örnek seyreltilmiş
- Fren kapalı olarak oda sıcaklığında 1200 xg'de 20 dakika santrifüjleyin.
- Zenginleştirilmiş hücrelerin çıkarın.
- PBS +% 2 FBS çözüm 2x zenginleştirilmiş hücreleri yıkayın.
- Kırmızı kan hücrelerinin parçalanması tamponu ile 2 dakika boyunca kırmızı kan hücreleri Lyse
- 5 dakika için 10 ml PBS +% 2 FBS ve 1500 rpm'de santrifüj parçalanmış kırmızı kan hücreleri ekle
- Pelet rahatsız etmemek için dikkatli, supernatant aspire
- % 10 fetal sığır serumu içeren IMDM medya içinde süspanse edin
5. Oda slaytlara RAW 264,7 makrofajların hazırlanması
- DMEM (Dulbecco'nun modifiye Eagle orta)% 10 FBS,% 1 penisilin / streptomisin ve% 1 L-glutamin içeren hazırlayın.
- Sıcak ortamı, sıcak banyo 37, tripsin ve PBS ° C
- Plaka 2x PBS ile yıkayın
- Her yıkama arasında PBS aspire.
- 5 ml tripsin yüzeyini kapsayacak şekilde (10 cm doku kültürü plaka için) plaka ekleyin.
- 37 5 dakika boyunca inkübe ° C.
- Plaka yüzey hücreleri ayırmak için hafifçe plaka yana tak. Plaka dışında tripsin sıçrama için dikkatli olun.
- 5 ml tripsin medya eşdeğer miktarda ekleyin.
- Karışımı bir tepki tüp içine aspire edin.
- 3 dakika boyunca 1000 xg'de santrifüjleyin.
- Aspire medya, pelet rahatsız etmemek için dikkatli.
- 10 ml medya süspanse edin.
- Medya odası slayt her odasına 400 mcL ekleyin.
- 5 mcL hücre süspansiyonu, her iki mecliste de ekleyin.
- 37 ° inkübatör geceleme büyütün ° C,% 5 CO 2 ile .
6. Örnek patojenlerin eklenmesi
- Ilgi etiketli patojenlerin pipetleyin 5-10 mcL odasına (adımları 1-3).
- Yapıştırılır makrofajlar rahatsız odasının alt dokunmak için değil, dikkatli ve aşağı yukarı pipeting iyice karıştırın.
7. Disk konfokal mikroskop iplik üzerine numune yükleme (video, bileşenler üzerinden tarama)
- Disk konfokal mikroskop iplik tüm bileşenleri açın.
- DIC görüntüleme için mikroskop hizalayın.
- Inkübatör odasına slayt çıkarın.
- Uzman aşamaya oda slayt takın.
- Oda slayt üst (DIC görüntüleme için gerekli) çıkarın.
8. Optik yakalama Hazırlık (video bileşenleri üzerinden tarama ve nasıl mikroskop içine entegre)
- Optik tuzak için deklanşör açın.
- IR lazer açın.
- Açık optik tuzak çekim hızı (lazer).
- IR lazer önünde deklanşör Onayla KÖ kart ile kontrol ederek kapalı.
9 - Optik tuzak Seçme ve patojen manipülasyonu
- Focus yapıştırılır slayt makrofajlarda.
- Özgürce dalgalanan patojenlerin makrofajlara bitişik bir çözüm bulun.
- Patojen tuzak çevresinde olduğu gibi sahne taşıyın.
- Deklanşör açın ve tuzak meşgul.
- Sabit tuzak ile temas makrofajlar getirmek için örnek Taşıped patojen.
- DIC, floresan, ya da her ikisinin kombinasyonu ya da disk konfokal mikroskop iplik ile görüntü. Tipik olarak, yakalama DIC yapılır ve gerçek zamanlı görüntüleme floresan ile yapılır.
10 Temsilcisi Sonuçlar:
In vivo ve in vitro ortamda, patojenler ve boncuk tam mekansal ve zamansal kontrol uygulamayın, biz dönen bir disk konfokal mikroskop (şematik Şekil 1) üzerine entegre edilmiş bir özel inşa edilmiş yakalama cihazları tasarlanmıştır. Tam güçte lazer, 350 mW güç ve ışık optik tuzak aparatı çeşitli optik bileşenleri ile kaplin sonra, bir güç metre ile ölçülen güç TIRF amacı ~ 80 mW, tuzak oluşturmak için kullanılır Odanın.
Sıkışıp nesne yakalama lazer ile sabit tutarken, kapana kısılmış bir nesneye göre odasında bir nesne konumlandırmak için sahneye taşındı. Sahne tuzağa parçacık sürtünme kuvveti maksimum yakalama gücü geçmemişse, böylece, yavaş yeterli hızlarda taşındı.
C. albicans ayrı popülasyonları (tipik boyutu - ~ 5 mm), çok sayıda floresan kanalları ile görüntüleme göstermek için her üç renk (AF488, AF568, ve AF647,,, yeşil, mavi, ve karşılık gelen bu rakam kırmızı, sırasıyla ) ile etiketlenir. aynı anda optik patojen yakalama. Bir tek C. gri oklarla gösterildiği gibi, kalabalık bir ortamda bile, operatör tarafından seçilen tek bir patojenin belirli bir konuma (Şekil 2A) yakalamak ve manipüle etme yeteneğini gösteren albicans, diğer maya bir küme ile bir kare desen sıkışıp kalmasına ve taşındı .
Patojen organizmalar tarafından sergilenen farklı şekil morfolojileri yakalamak için bu sistem daha fazla esneklik göstermek için, optik cımbız, aynı zamanda bir C tutun ve yerleştirme başardı psödohif ile albicans parçacık. C. AF647 (kırmızı) ile etiketli albicans, beyaz ok tarafından özetlenen ve floresan GFP-LC3 RAW hücreleri (Şekil 2B) yanında yer yörüngesi boyunca taşındı . C maya kısmını psödohif birlikte izledi albicans çakılıp kalmıştım.
Ayrıca bu özel hücre hattı ve patojen (Şekil 3A) fagositoz mutlak bir zaman çerçevesi analiz etmek için RAW fare makrofaj hücre yanında Aspergillus konumlandırılmış. Patojen hücre ile temas edinceye tuzak kapalı, ve zaman atlamalı görüntüleme (Şekil 3B) sonraki hücresel olayları gözlemlemek için kullanılır. Optik tuzak da birincil T-hücrelerinin kandan izole ve boncuk boncuk (Şekil 4) ile bir immünolojik sinaps formu T-hücre için anti-CD3 antikoru ile kaplı bitişik yönettiği yakalamak için kullanılan, ek göstermek çok yönlülük doğrudan tuzak ve bağışıklık hücreleri manipüle.
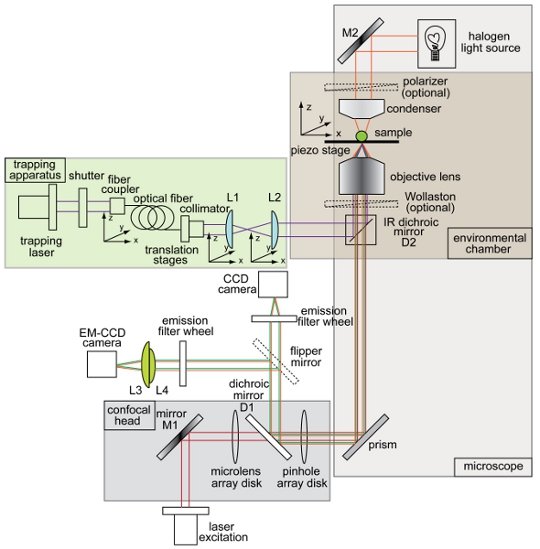
Şekil 1. Genel bilgiler ve şematik kombine optik tuzak ve dönen disk konfokal mikroskop kurulum . Enstrüman düzeni (bindirme kiriş (mor), elektron-çarparak şarj cihazı birleştiğinde aydınlık görüntüleme (turuncu), floresan uyarma ışın (kırmızı), floresans emisyonu (yeşil), şarj çiftli aygıt (CCD) kamerası, aydınlatma yolunu gösteren EM- CCD) kamera (D1 ve D2) dikroik aynalar, aynalar (M1 ve M2) ve objektifler (L1, L2, L3, L4). Tuzak konfokal mikroskop sistemi tüm diğer bileşenler rakam olarak etiketlenir.
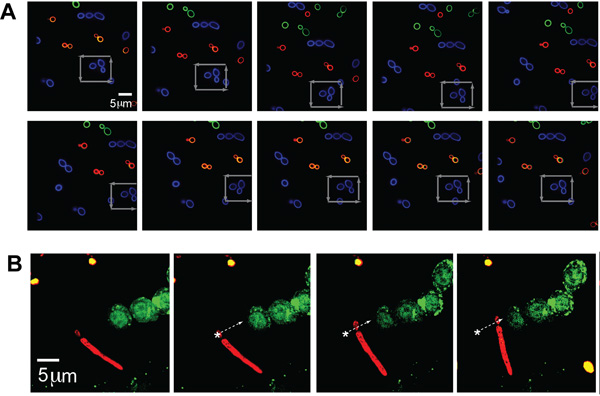
Şekil 2 (A) Floresan görüntüleri sıkışıp kalmasına ve C. manipüle albicans. Diğer C. floresan etiketli bir alanda sıkışıp floresan etiketli (Alexa Fluor 488 (AF488), mavi) organizmanın albicans (AF568, kırmızı, yeşil ve AF647). Sahne gri oklarla gösterildiği gibi tuzak, mavi CA parçacık dolaştı. (B) C Trapped pseudo-hifal formu GFP-LC3 RAW hücre gelecek albicans. CA floresan etiketli psuedohyphal formu (kırmızı, AF647) optik sıkışıp kalmasına ve GFP-LC3 komşu taşındı RAW makrofajlar dile getirdi. CA organizma yörünge boyunca beyaz ok ile gösterildiği gibi taşınır.

Şekil 3. A. Yakalama ve konumlandırma fagositik bir RAW hücre gelecek fumigatus. (A) sıkışıp A. aydınlık görüntüler fumigatus, kırmızı ok ile gösterilen yol boyunca taşınır ve konumlandırılmış, beyaz ok ile gösterilir. Sıkışıp patojen organizma biraz odak düzlemi üzerinde iterek tuzak nedeniyle odak dışı biraz. İstenen RAW hücreye bitişik yerleştirilen kadar fumigatus taşınır. (B) GribiA. fagositoz orescence görüntüleme RAW hücre tarafından fumigatus. Sıkışıp patojen RAW hücreye yerleştirildikten sonra, fagositoz süreç devreye girer. 30 sn, RAW hücre zarı etrafında bir fincan parçacık değiştirmek ve form başlar. 60 s, fincan tam olarak oluşur. 90s 150s, A. fumigatus sardı ve 180 s, parçacık tamamen içselleştirmiş

Şekil 4. Optik tuzak anti-CD3 antikoru ile bir boncuk kaplamalı yanında bir konuma taşındı T-hücre birincil primer T hücre anti-CD3 kaplı boncuklar ile sinaps formu. DIC görüntü bindirme. Hücre, daha sonra görüntüleri kolayca ayırt edilemez bir immünolojik sinaps oluşturur.
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
- 5 mikron Bu çalışmada, 3 mikron arasında boyutları ile patojenler yakalamak için optik bir tuzak. Laboratuara ilgi patojenler genellikle bu boyutları olsa da, burada açıklanan optik cımbız sistemi, boyutları çok geniş bir yelpazede yakalamak için esnek. Aslında optik tuzakları tek atomdan hücreleri çapı yaklaşık 10 mikron arasında değişen partiküller yakalamak için kullanılmıştır. Küresel, eliptik ve biyolojik patojenler ile çalışırken yararlı çok uzamış parçacıklar: Ayrıca, ...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Teşekkürler
Bu çalışma Tıp İç Fonları Massachusetts Genel Hastanesi Bölümü (JMT, MKM, MLC, JMV) Ulusal Biyomedikal Görüntüleme Enstitüsü ve Biyomühendislik hibe T32EB006348 (MSK), Massachusetts Genel Hastanesi Kullanıcı Hesaplamalı ve Bütünleştirici Biyoloji geliştirme fonu için Merkezi ve AI062773 (tarafından desteklenen oldu RJH), hibe AI062773, DK83756 ve DK 043.351 (RJX), NSF 0.643.745 (MJL), NIH R21CA133576 (MJL) ve Ulusal Sağlık Enstitüleri Ulusal Alerji ve Bulaşıcı Hastalıklar Enstitüsü (NIAID) (NIH) AI057999 (JMV .) Nicholas C. Yoder teknik yardım için yararlı tartışmalar için teşekkür eder, ve Charles Keçeler (RPI, Inc.)
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktifin Adı | Şirket | Katalog numarası | Yorumlar (isteğe bağlı) |
|---|---|---|---|
| A. fumigatus | Albino zorlanma, B-5233/RGD12-8, KJ Kwon-Chung, NIH hediye | ||
| C. albicans | SSY50-B mutant, Eleftherios Mylonakis, MGH hediye SC5314 zorlanma, Gerald Fink hediye, Whitehead Enstitüsü'nden | ||
| Alexa Fluor 488 | Invitrogen | A20000 | |
| Alexa Fluor 647 | Invitrogen | A20006 | |
| dimetilformamid | Sigma | D4551 | |
| Taze kan | MGH, HMS RJW Heath, hediyelik | ||
| Nikon inverted mikroskop | Nikon | Model Ti-E | |
| Yakalama lazer, ChromaLase | Blue Sky Araştırma | CLA-106-STF02-02 | |
| Floresan uyarma lazer | Tutarlı | Model Innova 70C | |
| Yakalama bileşenleri için Breadboards | Thorlabs | MB1224, MB1218 | |
| Optik hava tablo | Teknik Manufacturing Corporation | ||
| Pedal kontrolü Elektronik shutter | Uniblitz | Vincent Associates, Rochester, NY satın | |
| Singlemode fiber optik | Oz Optics | PMJ-3S3S-1064-6 | |
| Fiber pozisyoner | Thorlabs | PAF-X-5-C | |
| Fiber kolimatör | Oz Optics | HPUCO-23-1064-P-25AC | |
| Teleskop için objektifler | Thorlabs | AC254-150-B | Odak uzaklığı 150 mm |
| Çeviri aşamaları (x, y, z) | Newport | M-461-XYZ | |
| IR dikroik ayna | Renk parlaklığı | ET750-sp-2p8 | |
| Objektif lens (100X) | Nikon | NA = 1.49, immersiyon yağı, TIRF hedefi | |
| Konfokal kafa | Yokogawa | CSU-XI | |
| Kutuplaştırıcı | Nikon | MEN51941 | |
| Wollaston prizma | Nikon | MBH76190 | |
| EM-CCD kamera | Hamamatsu | C9100-13 | |
| CCD kamera (ORCA ER) | Hamamatsu | C4742-80-12AG | |
| Filtre tekerlek | Ludl | 99A353 | |
| Filtre tekerlek | Sutter | LB10-Nwe | |
| Odacıklı coverglass | Lab-Tek/Nunc | 155409 | |
| Dynabeads | Invitrogen | 111-51D | Anti-CD3 ile kaplı |
| Dulbecco'nun modifiye Eagle orta (DMEM) | Invitrogen / Gibco | 10313 | |
| Penisilin / streptomisin | Invitrogen / Gibco | 15140-122 | |
| L-glutamin | Invitrogen / Gibco | 25030-081 | |
| Fetal Bovine Serum (HyClone) | ThermoScientific | SH30071.03 |
Referanslar
- Grakoui, A. The immunological synapse: A molecular machine controlling T cell activation. Science. 285, 221-227 (1999).
- Monks, C. R. Three-dimensional segregation of supramolecular activation clusters in T cells. Nature. 395, 82-86 (1998).
- Stuart, L. M., Ezekowitz, R. A. Phagocytosis and comparative innate immunity: Learning on the fly. Nat Rev Immunol. 8, 131-141 (2008).
- Neuman, K. C., Block, S. M. Optical trapping. Rev Sci Instrum. 75, 2787-2809 (2004).
- Ashkin, A. Optical trapping and manipulation of neutral particles using lasers. Proc Natl Acad Sci USA. 94, 4853-4860 (1997).
- Ashkin, A. Acceleration and trapping of particles by radiation pressure. Phys Rev Lett. 24, 156-159 (1970).
- Ashkin, A., Dziedzic, J. Optical trapping and manipulation of viruses and bacteria Science. Nature. 235, 1517-1520 (1987).
- Khalil, A. S. Single M13 bacteriophage tethering and stretching. Proc Natl Acad Sci USA. 104, 4892-4897 (2007).
- Khalil, A. S. Kinesin's cover-neck bundle folds forward to generate force. Proc Natl Acad Sci USA.. 105, 19247-19252 (2008).
- Li, Z. Membrane tether formation from outer hair cells with optical tweezers. Biophys J. , 1386-1395 (2002).
- Kim, S. The αβ T cell receptor is an anisotropic mechanosensor. J Biol Chem. 284, 31028-31028 (2009).
- Mohanty, S., Mohanty, K., Gupta, P. Dynamics of interaction of RBC with optical tweezers. Opt. Express. 13, 4745-4751 (2005).
- Tam, J. Control and manipulation of pathogens with an optical trap for live cell imaging of intercellular interactions. PLoS One. 5, e15215-e15215 (2010).
- Lin, S. J., Schranz, J., Teutsch, S. M. Aspergillosis case-fatality rate: Systematic review of the literature. Clin Infect Dis.. 32, 358-366 (2001).
- Wey, S. B. Hospital-acquired candidemia - the attributable mortality and excess length of stay. Arch. Intern. Med. 148, 2642-2645 (1988).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır