Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Использование оптической ловушки для изучения хост-Возбудитель Взаимодействие для динамических изображений Живая сотовый
В этой статье
Резюме
Метод описан в индивидуальном порядке выбирать, манипулировать, и изображение живых патогенов при оптической ловушки связаны с вращающимся диском микроскопом. Оптической ловушки обеспечивает пространственной и временной контроль организмов и помещает их рядом с клетками хозяина. Люминесцентной микроскопии захватывает динамических межклеточных взаимодействий с минимальным возмущением к клеткам.
Аннотация
Dynamic live cell imaging allows direct visualization of real-time interactions between cells of the immune system1, 2; however, the lack of spatial and temporal control between the phagocytic cell and microbe has rendered focused observations into the initial interactions of host response to pathogens difficult. Historically, intercellular contact events such as phagocytosis3 have been imaged by mixing two cell types, and then continuously scanning the field-of-view to find serendipitous intercellular contacts at the appropriate stage of interaction. The stochastic nature of these events renders this process tedious, and it is difficult to observe early or fleeting events in cell-cell contact by this approach. This method requires finding cell pairs that are on the verge of contact, and observing them until they consummate their contact, or do not. To address these limitations, we use optical trapping as a non-invasive, non-destructive, but fast and effective method to position cells in culture.
Optical traps, or optical tweezers, are increasingly utilized in biological research to capture and physically manipulate cells and other micron-sized particles in three dimensions4. Radiation pressure was first observed and applied to optical tweezer systems in 19705, 6, and was first used to control biological specimens in 19877. Since then, optical tweezers have matured into a technology to probe a variety of biological phenomena8-13.
We describe a method14 that advances live cell imaging by integrating an optical trap with spinning disk confocal microscopy with temperature and humidity control to provide exquisite spatial and temporal control of pathogenic organisms in a physiological environment to facilitate interactions with host cells, as determined by the operator. Live, pathogenic organisms like Candida albicans and Aspergillus fumigatus, which can cause potentially lethal, invasive infections in immunocompromised individuals15, 16 (e.g. AIDS, chemotherapy, and organ transplantation patients), were optically trapped using non-destructive laser intensities and moved adjacent to macrophages, which can phagocytose the pathogen. High resolution, transmitted light and fluorescence-based movies established the ability to observe early events of phagocytosis in living cells. To demonstrate the broad applicability in immunology, primary T-cells were also trapped and manipulated to form synapses with anti-CD3 coated microspheres in vivo, and time-lapse imaging of synapse formation was also obtained. By providing a method to exert fine spatial control of live pathogens with respect to immune cells, cellular interactions can be captured by fluorescence microscopy with minimal perturbation to cells and can yield powerful insight into early responses of innate and adaptive immunity.
протокол
1. Условия культивирования патогенных для оптического захвата
- Расти А. fumigatus (B-5233/RGD12-8) на полутвердых сред, содержащих агар SBD (Сабуро декстрозы) при температуре 30 ° С в течение 3 дней.
- Расти C. Albicans (SC5314) в YPD (дрожжи-пептон декстроза) культуральной жидкости, содержащей 100 мкг / мл ампициллина ночь в шейкере инкубаторе при температуре 30 ° C.
2. Подготовка патогенных для флуоресцентной маркировки
- Урожай необходимое количество патогенов и передачи 1,5 трубки реакции мл.
- Добавить 300 мкл фосфатно-солевым буфером (PBS) в реакционную трубку.
- Разрушать ультразвуком смесь в течение 30 секунд.
- Центрифуга при 4000 оборотов в минуту в течение 1 минуты.
- Аспирируйте супернатант, в результате чего гранулы нетронутыми.
- Повтор (2.4) и (2,5) еще два раза.
- Ресуспендируют в 500 мкл ФСБ.
3. Маркировка патогенов с флуоресцентным красителем
- Растворите 1 мг красителей интерес (например, Alexa Fluor 488, Alexa Fluor 647) в 100 мкл диметилформамида (DMF) (концентрация 10 мг / мл).
- Добавить 3 мкл красителя смеси реакции мыть пробирки, содержащие болезнетворные микроорганизмы.
- Поворот не трясите образца при 37 ° С в течение 1 часа.
- Вымойте образца с PBS 3 раза центрифугированием при 4000 оборотов в минуту в течение 1 минуты.
- Ресуспендируют в 300 мкл PBS.
4. Сбор Т-лимфоцитов из цельной крови
- Получить цельной крови (свежий).
- Теплая кровь, PBS + 2% эмбриональной телячьей сыворотки (FBS), а Histopaque до комнатной температуры.
- Добавить RosetteSep правам CD4 + Т-клеток по обогащению Коктейль в 50 мкл / мл цельной крови.
- Поворот образца и инкубировать 20 минут при комнатной температуре.
- Развести образца с равным объемом PBS + 2% ЭТС и аккуратно перемешать.
- Слой разведенного образца на вершине Histopaque, сводя к минимуму перемешивание
- Центрифуга в течение 20 минут при 1200 мкг при комнатной температуре с вынул.
- Удалить обогащенного клеток.
- Вымойте обогащенные клетки 2x с PBS + 2% раствор FBS.
- Lyse красных кровяных клеток в течение 2 минут с красными буфера ячейки лизирующего крови
- Добавьте 10 мл ФСБ + 2% ЭТС и центрифуги лизированных эритроцитов при 1500 оборотов в минуту в течение 5 минут
- Аспирируйте супернатант, стараясь не мешать гранул
- Ресуспендируют в средствах массовой информации IMDM, содержащей 10% эмбриональной телячьей сыворотки
5. Подготовка RAW 264,7 макрофагов в камеру слайдов
- Подготовка DMEM (среда Дульбекко изменение Орла), чтобы содержать 10% FBS, 1% пенициллин / стрептомицин, и 1% L-глутамина.
- Теплый СМИ, трипсин и PBS в теплой ванне до 37 ° C.
- Промыть пластины 2x с PBS
- Аспирируйте PBS между каждой стирки.
- Добавьте 5 мл трипсина к пластине для покрытия поверхности (10 см планшета для культуры ткани).
- Инкубировать в течение 5 мин при 37 ° C.
- Осторожно постучали стороне пластины отделить клетки от поверхности пластины. Будьте осторожны, чтобы не всплеск трипсина вне пластины.
- Добавьте 5 мл или эквивалентную сумму средств массовой информации для трипсина.
- Аспирируйте смесь в реакционную трубку.
- Центрифуга при 1000 мкг в течение 3 минут.
- Аспирируйте СМИ, осторожны, чтобы не мешать гранул.
- Ресуспендируют в 10 мл среды.
- Добавить 400 мкл средств массовой информации для каждой из палат камере слайд.
- Добавьте 5 мкл клеточной суспензии для каждой камеры.
- Вырасти на ночь в инкубаторе при температуре 37 ° C с 5% CO 2.
6. Добавление патогенов к образцу
- Внесите 5-10 мкл меченых патогенных интереса (от шагов 1-3) в камеру.
- Тщательно перемешать по pipeting вверх и вниз, стараясь не прикасаться к нижней части камеры беспокоить придерживался макрофагов.
7. Загрузка образца на вращающийся диск конфокальной микроскопии (в видео, сканирование через компоненты)
- Включите все компоненты вращающийся диск конфокальной микроскопии.
- Совместите микроскоп для DIC изображений.
- Удалить камеру слайд из инкубатора.
- Вставьте камеру скользить в специализированных стадии.
- Удаление верхней части камеры слайд (необходимые для работы с изображениями DIC).
8. Подготовка к оптического захвата (в видео, сканирование через компоненты и как она интегрирована в микроскоп)
- Включите затвора для оптической ловушке.
- Включите ИК-лазера.
- Открытие затвора (на лазер) для оптической ловушке.
- Подтвердите затвор перед ИК лазерного закрыта путем проверки с карты ИК.
9. Выбор и манипуляции с патогеном оптической ловушки
- Сосредоточьтесь на макрофаги на придерживался слайда.
- Найти патогенов свободно колебались в решении смежных с макрофагами.
- Перемещение стадии, что возбудитель находится в близости от ловушки.
- Открытие затвора и заниматься ловушку.
- Перемещение образца принести макрофагов в контакт с стационарных ловушкупед возбудителя.
- Изображение с вращающимся диском конфокальной микроскопии, либо в DIC, флуоресценция, или комбинация обоих. Как правило, захват осуществляется в ДВС, и в реальном времени изображений осуществляется с помощью флуоресценции.
10. Представитель Результаты:
Для того чтобы приложить полный пространственный и временной контроль патогенов и бусин в естественных условиях и в пробирке среды, мы разработали на заказ ловчего аппарата интегрирован на вращающийся диск конфокальной микроскопии (схема приведена на рис. 1). В полную силу, при условии, лазерная 350 мВт и после связи света с различными оптическими компонентами оптической аппаратуры ловушку, ~ 80 мВт на цель TIRF, и измеряется с помощью измерителя мощности, была использована для формирования ловушку в камере.
Для того, чтобы положение объекта в камере относительно захваченного объекта, этап был перенесен, удерживая захваченный объект стационарной с захватом лазера. Этап был перенесен на медленной скорости достаточно, так что сила сопротивления на захваченных частиц не превышает максимальную силу захвата.
Отдельные популяции C. Albicans (типичный размер - ~ 5 мкм) были помечены каждого из трех цветов (AF488, AF568, AF647 и, соответствующий зеленый, синий и красный на рисунке, соответственно) для демонстрации изображения с нескольких каналов флуоресценции одновременно оптически захвата возбудителя. С одной Albicans был пойман в ловушку и переехал в квадратный узор через скопление других дрожжей, о чем свидетельствует серые стрелки, демонстрируя возможность захвата и манипулирования определенном месте одного патогена выбранного оператора даже в условиях перегруженности (рис. 2) .
Для иллюстрации дальнейших гибкости этой системы для улавливания различных морфологических форм выставлены патогенными организмами, оптический пинцет также был в состоянии держать и расположить C. Albicans частицы с pseudohyphae. C. Albicans помечены AF647 (красный) был перемещен по траектории, как это изложено белая стрелка и поместили рядом с люминесцентными GFP-LC3-RAW клетки (рис. 2, б). Дрожжей части С. Albicans был пойман в ловушку, как pseudohyphae волочились.
Мы также расположены Aspergillus fumigatus рядом с RAW ячейки макрофагов мыши с целью анализа абсолютных сроки фагоцитоза к данной линии клеток и патогенных (рис. 3А). Как только возбудитель вступает в контакт с клеткой, ловушкой выключен, и покадровой визуализации используется для наблюдения за последующие клеточных событий (рис. 3В). Оптическую ловушку был также использован для захвата первичных Т-клеток, выделенных из крови и направлены, прилегающих к бисером покрыты анти-CD3 антитела для того, чтобы Т-клеток с образованием иммунологических синапсов с борта (рис. 4), показывают, дополнительные Универсальность непосредственно ловушку и манипулировать иммунных клеток.
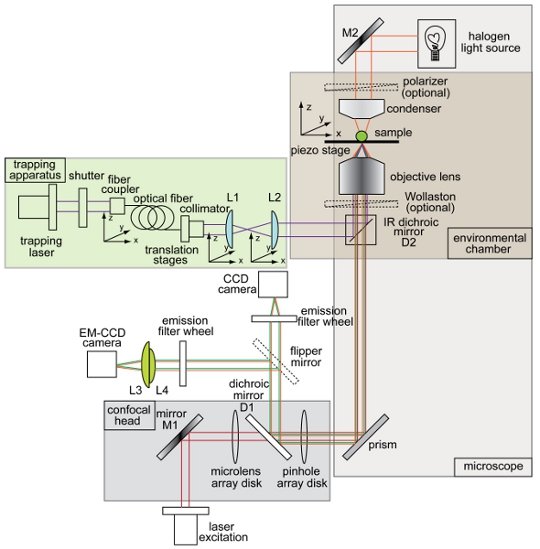
Рисунок 1. Обзор и схема комбинированной оптической ловушки и вращающийся диск установки конфокальной микроскопии. Инструмент макета, показывающий захвата пучка (фиолетовый), освещения пути для светлого изображения (оранжевый), флуоресценция луч возбуждения (красный), флуоресценция выбросов (зеленый), прибор с зарядовой связью (ПЗС) камеры, электронно-умножения Прибор с зарядовой связью (EM- ПЗС) камеры, дихроичных зеркал (D1 и D2), зеркала (М1 и М2), и линзы (L1, L2, L3, L4). Все остальные компоненты ловушки-конфокальной микроскопии системы помечены на рисунке.
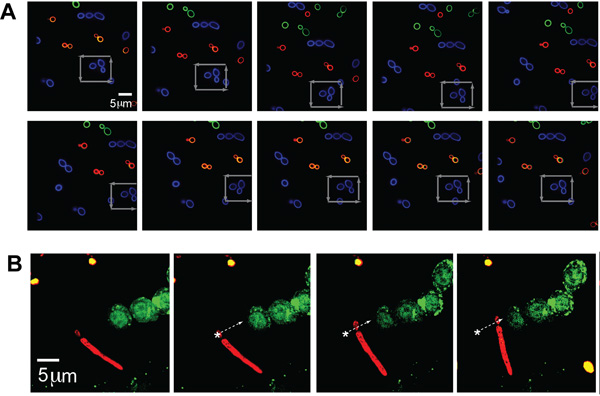
Рисунок 2. () Флуоресцентные изображения уловленных и манипулировать C. Albicans. Ловушке флуоресцентно меченных (Alexa Fluor 488 (AF488), синий) организма в поле других флуоресцентно меченных C. Albicans (AF568, AF647 и зеленый, красный). Этап двигался в ловушке, синий частица CA как показывает серые стрелки. (B) Trapped псевдо-гиф форма C. Albicans рядом с GFP-LC3 RAW клетки. Флуоресцентно меченных psuedohyphal форме СА (красный, AF647) оптически ловушке и переехал, прилегающих к GFP-LC3 выразил RAW макрофагов. CA организме перемещается вдоль траектории на что указывает белая стрелка.

Рисунок 3. Перехват и позиционирования А. fumigatus рядом с фагоцитарной RAW клетки. (А) Светлое образы ловушке А. fumigatus, о чем свидетельствует белая стрелка, переехал и располагается по пути на что указывает красная стрелка. Ловушке патогена немного не в фокусе из-за ловушки нажатием организма немного выше фокальной плоскости. A. fumigatus перемещается, пока он находится рядом с желаемой RAW клетки. (B) Гриппценции изображений фагоцитоза А. fumigatus на RAW клетки. После ловушке возбудитель находится рядом с RAW-клетки, фагоцитоз процесс активизируется. На 30 с, оболочка RAW клетка начинает изменяться и форма чаши вокруг частицы. На 60 с, чашка полностью сформирован. С 90-х годов до 150 с, А. fumigatus охвачен, и на 180 с, частица полной мере учитывался

Рисунок 4. Перехват первичных Т-клеток с образованием синапса с анти-CD3 покрытой бисером. DIC образы первичных Т-клеточных тронут оптической ловушки для позиции возле бусинка покрыты анти-CD3 антитела. Ячейки затем формирует иммунологического синапса, которые не могут быть легко различить в изображениях.
Access restricted. Please log in or start a trial to view this content.
Обсуждение
В этой работе мы используем оптическую ловушку, чтобы захватить патогенов с размерами от 3 мкм - 5 мкм. Хотя возбудители интерес к нашей лаборатории как правило, эти размеры, оптическая система пинцет, описанный здесь, гибкими, чтобы ловушка большой диапазон размеров. Действительно оптич...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Благодарности
Эта работа была поддержана Massachusetts General Hospital отделение медицины фонды Внутренняя (СГН, MKM, MLC, JMV), Национальный институт биомедицинской визуализации и биоинженерии грант T32EB006348 (ЦИК), центр Массачусетского общего госпиталя для вычислительной и интегративной фонда развития биологии и AI062773 ( RJH), гранты AI062773, DK83756 и DK 043 351 (RJX), NSF 0643745 (MJL), NIH R21CA133576 (MJL) и Национального института аллергии и инфекционных заболеваний (NIAID) из Национального института здоровья (NIH) AI057999 (JMV ). Мы благодарим Николая С. Йодер за полезные обсуждения, и Чарльз войлок (RPI, Inc) для оказания технической помощи.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | Комментарии (необязательно) |
|---|---|---|---|
| A. fumigatus | Альбино напряжения, B-5233/RGD12-8, подарок от KJ Kwon-Chung, NIH | ||
| C. Albicans | SSY50-B мутант, подарок от Элефтериос Mylonakis, MGH; SC5314 напряжения, подарок от Джеральда Финк, Уайтхед Институт | ||
| Alexa Fluor 488 | Invitrogen | A20000 | |
| Alexa Fluor 647 | Invitrogen | A20006 | |
| диметилформамиде | Сигма | D4551 | |
| Свежая кровь | Подарок от RJW Хит, MGH, HMS | ||
| Nikon инвертированного микроскопа | Nikon | Модель Ti-E | |
| Перехват лазер, ChromaLase | Синий исследований Sky | CLAS-106-STF02-02 | |
| Лазерного возбуждения флуоресценции | Когерентный | Модель Innova 70C | |
| Макеты для улавливания компонентов | Thorlabs | MB1224, MB1218 | |
| Оптический стол воздуха | Технические Manufacturing Corporation | ||
| Электронный затвор с педалью управления | Uniblitz | Приобретенные от Винсента Associates, Рочестер, штат Нью-Йорк | |
| Одномодовое оптическое волокно | Оз оптики | PMJ-3S3S-1064-6 | |
| Волоконно позиционером | Thorlabs | СУП-X-5-C | |
| Волоконно коллиматор | Оз оптики | HPUCO-23-1064-P-25AC | |
| Объективы для телескопов | Thorlabs | AC254-150-B | Фокусное расстояние 150 мм |
| Перевод этапов (х, у, г) | Ньюпорт | М-461-XYZ | |
| ИК дихроичных зеркал | Цветность | ET750-SP-2p8 | |
| Объектив (100X) | Nikon | NA = 1,49, нефть погружения, TIRF цель | |
| Конфокальной головы | Yokogawa | ХСС-XI | |
| Поляризатор | Nikon | MEN51941 | |
| Призмы Волластона | Nikon | MBH76190 | |
| EM-CCD камера | Hamamatsu | C9100-13 | |
| ПЗС-камера (ORCA ER) | Hamamatsu | C4742-80-12AG | |
| Фильтры колесо | Ludl | 99A353 | |
| Фильтры колесо | Саттер | LB10-NWE | |
| Патрон покровного стекла | Lab-Tek/Nunc | 155409 | |
| Dynabeads | Invitrogen | 111-51D | Покрытие анти-CD3 |
| Дульбеко изменение Орла среды (DMEM) | Invitrogen / Gibco | 10313 | |
| Пенициллин / стрептомицин | Invitrogen / Gibco | 15140-122 | |
| L-глютамин | Invitrogen / Gibco | 25030-081 | |
| Эмбриональной телячьей сыворотки (Hyclone) | ThermoScientific | SH30071.03 |
Ссылки
- Grakoui, A. The immunological synapse: A molecular machine controlling T cell activation. Science. 285, 221-227 (1999).
- Monks, C. R. Three-dimensional segregation of supramolecular activation clusters in T cells. Nature. 395, 82-86 (1998).
- Stuart, L. M., Ezekowitz, R. A. Phagocytosis and comparative innate immunity: Learning on the fly. Nat Rev Immunol. 8, 131-141 (2008).
- Neuman, K. C., Block, S. M. Optical trapping. Rev Sci Instrum. 75, 2787-2809 (2004).
- Ashkin, A. Optical trapping and manipulation of neutral particles using lasers. Proc Natl Acad Sci USA. 94, 4853-4860 (1997).
- Ashkin, A. Acceleration and trapping of particles by radiation pressure. Phys Rev Lett. 24, 156-159 (1970).
- Ashkin, A., Dziedzic, J. Optical trapping and manipulation of viruses and bacteria Science. Nature. 235, 1517-1520 (1987).
- Khalil, A. S. Single M13 bacteriophage tethering and stretching. Proc Natl Acad Sci USA. 104, 4892-4897 (2007).
- Khalil, A. S. Kinesin's cover-neck bundle folds forward to generate force. Proc Natl Acad Sci USA.. 105, 19247-19252 (2008).
- Li, Z. Membrane tether formation from outer hair cells with optical tweezers. Biophys J. , 1386-1395 (2002).
- Kim, S. The αβ T cell receptor is an anisotropic mechanosensor. J Biol Chem. 284, 31028-31028 (2009).
- Mohanty, S., Mohanty, K., Gupta, P. Dynamics of interaction of RBC with optical tweezers. Opt. Express. 13, 4745-4751 (2005).
- Tam, J. Control and manipulation of pathogens with an optical trap for live cell imaging of intercellular interactions. PLoS One. 5, e15215-e15215 (2010).
- Lin, S. J., Schranz, J., Teutsch, S. M. Aspergillosis case-fatality rate: Systematic review of the literature. Clin Infect Dis.. 32, 358-366 (2001).
- Wey, S. B. Hospital-acquired candidemia - the attributable mortality and excess length of stay. Arch. Intern. Med. 148, 2642-2645 (1988).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены