このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
動的な生細胞イメージングのための宿主 - 病原体相互作用の研究のための光トラップの使用
要約
メソッドは、個別に、選択した操作、および回転するディスクの顕微鏡に結合される光トラップを使用して画像ライブの病原体に記述されています。光トラップは、生物の空間的、時間的な制御を提供し、宿主細胞にそれらが隣接して配置されます。蛍光顕微鏡は、細胞への最小限の摂動で動的な細胞間相互作用をキャプチャします。
要約
動的な生細胞イメージングでは、免疫システム1、2のセル間のリアルタイムの相互作用の直接可視化することができますが、食細胞と微生物との間の空間的、時間的なコントロールの欠如は、病原体に対する宿主応答の初期相互作用に焦点を当てた観測をレンダリングしている困難。歴史的に、このような貪食3のような細胞間接触のイベントは、2種類の細胞を混合することにより撮像されており、その後継続的に相互作用の適切な段階で偶然細胞間の連絡先を見つけるために視野をスキャン。これらのイベントの確率的性質は、このプロセスは面倒なレンダリング、そしてそれはこのアプローチにより、細胞間接触の初期段階やつかの間のイベントを観察することは困難です。このメソッドはしない接触の危機に瀕しているセルのペアを見つけ、そして彼らは熟達した自分の連絡先まで、それらを観察する、または必要になります。これらの制限に対処するために、我々は、培養中の細胞を配置するために非侵襲的、非破壊的ですが、迅速かつ効果的な方法として、光トラッピングを使用してください。
光トラップ、または光ピンセットは、ますます三次元4で細胞や他のミクロンサイズの粒子を捕捉し、物理的に操作するために生物学的研究に利用されています。輻射圧は、最初の観察、1970年5、6に光ピンセットシステムに適用され、1987年7生物学的標本を制御するために使用されました。それ以来、光ピンセットは、生物学的現象を8月13日の様々なプローブする技術へと成長している。
我々は進歩がとしてによって決定される宿主細胞との相互作用を促進する生理学的環境における病原性微生物の絶妙な空間的、時間的な制御を提供するために、温度と湿度が制御されているディスク共焦点顕微鏡を回転して光トラップを統合することにより、細胞のイメージングを、生きている方法14を記述する演算子。ライブ、免疫低下個体15、16( 例えば AIDS、化学療法、および臓器移植患者)において潜在的に致命的、侵襲性感染症を引き起こす可能性カンジダおよびアスペルギルスフミガー 、、のような病原体は、光学的に隣接する非破壊レーザーの強度を使用してトラップされ、移動された病原体を貪食することができますマクロファージ、。光と蛍光ベースの動画を送信した高解像度は、生きた細胞の食作用の初期の事象を観察する能力を設立。免疫学の広範な適用性を実証するために、主要なT細胞はまた、トラップされ、in vivoでの抗CD3コーティングされたミクロスフェアとシナプスを形成する操作、およびシナプス形成のタイムラプスイメージングは、得られたれました。免疫細胞を基準にして、ライブの病原体の微細な空間的なコントロールを発揮する方法を提供することにより、細胞間相互作用は、細胞への最小限の摂動による蛍光顕微鏡で捉えることができますし、自然免疫と獲得免疫の初期応答に強力な洞察を得ることができる。
プロトコル
1。光トラッピングのための病原体の培養条件
- 3日間、30℃でSBD(サブローデキストロース)を含む半固体寒天培地上でA. フミを (B-5233/RGD12-8)成長する。
- C.を拡大30℃シェーカーインキュベーターで一晩100μg/ mlのアンピシリンを含有するYPDでアルビカンス (SC5314)(酵母ペプトンデキストロース)液体培養℃に
2。蛍光標識のための病原体の調製
- 収穫は、病原体の量を求め、1.5 mLの反応チューブに移す。
- リン酸塩の追加300μLを反応管に緩衝食塩水(PBS)。
- 30秒間混合物を超音波処理してください。
- 1分間4000 rpmで遠心する。
- ペレットを残す、上清を吸引除去する。
- リピート(2.4)と(2.5)をさらに2回。
- PBSの500μLに再懸濁します。
3。蛍光色素を用いて病原体のラベリング
- 100μLのジメチルホルムアミド(DMF)(10 mg / mLの濃度)に関心の色素(例えばのAlexa Fluor ® 488のAlexa Fluor 647)1mgを溶解する。
- 洗浄後の病原体を含む反応管に染料混合物を3μLを加える。
- ° Cで1時間の回転または37サンプルを振る。
- 1分間4000rpmで遠心分離することによってPBS 3Xでサンプルを洗浄してください。
- PBS 300μlで再懸濁します。
4。全血からT細胞を収穫
- 全血を(新鮮な)を取得。
- 暖かい血、PBS + 2%ウシ胎児血清(FBS)、および室温にhistopaque。
- 全血の50μL/ mLでRosetteSepヒトCD4 + T細胞の濃縮カクテルを追加。
- サンプルを回転させ、室温で20分間インキュベートする。
- PBS + 2%FBS等量のサンプルを希釈し、穏やかに混合する。
- 層は、混合を最小限に抑え、histopaqueの上にサンプルを希釈
- ブレーキオフ、室温で1,200 xgで20分間遠心。
- 豊かなセルを削除します。
- PBS + 2%FBS溶液で2倍濃縮された細胞を洗浄。
- 赤血球の溶解用緩衝液で2分間赤血球を溶解する
- PBS + 2%FBSを10 mLを加え、5分間1500rpmで溶解赤血球を遠心分離
- ペレットを乱さないように注意して、上清を吸引する
- 10%ウシ胎児血清を含むIMDM培地中に再懸濁します。
5。チャンバースライドにRAW 264.7マクロファージの調製
- DMEM(ダルベッコ改変イーグル培地)は10%FBS、1%ペニシリン/ストレプトマイシン、1%L -グルタミンを含むように準備します。
- 37〜温かいお風呂で暖かいメディア、トリプシン、およびPBS℃に
- PBSでプレートの2倍を洗う
- それぞれの洗浄の間にPBSを吸引除去する。
- (10cmの組織培養プレート用)表面を覆うようにプレートに5 mLのトリプシンを追加。
- 37℃で5分間インキュベート℃を
- 静かにプレート表面から細胞を分離するためにプレートの側面をノック。プレートの外側にトリプシンを飛散しないように注意してください。
- トリプシンのメディアを5 mLまたはそれに相当する額を追加。
- 反応管に混合物を吸引除去する。
- 3分間1,000 × gで遠心する。
- ペレットを乱さないように注意してメディアを、吸引除去する。
- メディアの10mLに再懸濁します。
- チャンバースライドの各チャンバーにメディア400μLを加える。
- 各チャンバーに細胞懸濁液5μLを加える。
- 37℃インキュベーターで一晩増殖℃、5%CO 2で。
6。サンプルへの病原体のほか
- チャンバーへの関心のラベルが付いた病原体のピペットで5〜10μlの(手順1〜3から)。
- アップペッティングでよく混合し、ダウン、付着したマクロファージを乱さないようにチャンバーの底部に触れないように注意してください。
7。ディスク共焦点顕微鏡を回転にサンプルをロードする(ビデオでは、コンポーネント全体をスキャン)
- 回転するディスク共焦点顕微鏡にすべてのコンポーネントの電源をオンにします。
- DICイメージングのための顕微鏡を合わせます。
- インキュベーターからチャンバースライドを削除します。
- 専門的な段階にチャンバースライドを挿入します。
- チャンバースライド(DICイメージングのために必要)の上部を取り外します。
8。光トラッピングのための準備が(ビデオでは、コンポーネントをスキャンし、それがどのように顕微鏡に統合されている)
- 光学トラップのためにシャッターをオンにします。
- IRレーザーをオンにします。
- 光トラップにシャッターを(レーザー)を開きます。
- IRレーザーの前でシャッターを確認するにはIRカードで確認することで閉じられます。
9。光トラップによる病原体の選択と操作
- 付着したスライド上にマクロファージに焦点を当てる。
- マクロファージに隣接する溶液中で自由に変動する病原体を見つける。
- 病原体は、トラップの近くにあるようなステージを移動する。
- シャッターを開いて、トラップを従事する。
- 固定トラップと接触マクロファージを持って来るためにサンプルを移動するペッドの病原体。
- DIC、蛍光、またはその両方の組み合わせのいずれかで、ディスク共焦点顕微鏡を回転すると画像。一般的に、トラップはDICで行われ、リアルタイムイメージングは、蛍光で行われます。
10。代表的な結果:
in vivoおよび in vitro の環境での病原体とビーズの完全な空間的、時間的なコントロールを発揮するために、我々は、回転するディスク共焦点顕微鏡(図に示す回路図1)に統合された特注のトラップ装置を考案。完全な強さで、レーザーはパワー350 mWを提供し、光学トラップ装置内に様々な光学部品と光をカップリングした後、のようなパワーメータで測定した全反射の目的での電力の約80 mWのは、、トラップを形成するために使用されチャンバーインチ
トラッピングレーザーと静止閉じ込められたオブジェクトを保持している間に閉じ込められたオブジェクトへの相対的なチャンバー内のオブジェクトを配置するためには、ステージが移動されました。ステージは、捕捉粒子上にドラッグ力が最大トラッピング力を超えないように、ゆっくりと十分な速度で移動させた。
C. albicansの独立した個体群(典型的なサイズ- 〜5μm)を、複数の蛍光チャネルでイメージングを説明するために三色のそれぞれ(AF488、AF568、AF647と、緑、青、に対応すると図中の赤、それぞれ)で標識した同時に光学的に病原体をトラッピングしながら。シングルC.灰色の矢印で示すようにカンジダアルビカンスはさらに混雑した環境でのオペレータによって選択された単一の病原体の特定の場所(図2A)をキャプチャし、操作する能力を示す、、他の酵母のクラスタを通じて、正方形のパターンの中に閉じ込めと移動された。
病原体が示すさまざまな形の形態をトラップするために、このシステムのさらなる柔軟性を説明するために、光ピンセットにもCを保持して位置づけることができたpseudohyphaeとアルビカンス粒子。 C. AF647(赤)で標識されたアルビは、白い矢印で概説し、蛍光GFP - LC3 - RAW細胞(図2B)の隣に置かれたとして軌道に沿って移動されました。 C.の酵母の部分pseudohyphaeが一緒に後塵としてアルビカンスがトラップされました。
また、この特定の細胞株と病原体(図3A)と貪食の絶対的な時間枠を分析するためにRAWマウスのマクロファージ細胞の隣にアスペルギルスフミと位置づけ。一度病原体が細胞に接触する、トラップがオフになっている、とタイムラプスイメージングが(図3B)、その後の細胞事象を観察するために用いられる。光トラップは一次T細胞は、血液から分離し、ビーズ(図4)と免疫学的シナプスを形成するT細胞ために、抗CD3抗体でコートされたビーズに隣接向け、追加を表示するキャプチャするために使用されていました直接免疫細胞をトラップして操作する汎用性。
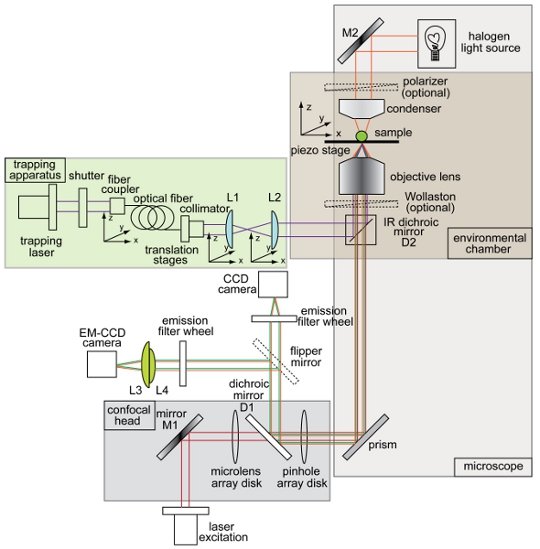
図1を組み合わせた光学トラップと回転するディスク共焦点顕微鏡のセットアップの概要と回路図。トラッピングビーム(紫)、電子乗算電荷結合素子(EM -明イメージング(オレンジ色)、蛍光励起ビーム(赤)、蛍光発光(緑)、電荷結合素子(CCD)カメラ用の照明のパスを示す計器のレイアウトCCD)カメラ、ダイクロイックミラー(D1とD2)、ミラー(M1とM2)、及びレンズ(L1、L2、L3、L4)。トラップ - 共焦点顕微鏡システムの他のすべてのコンポーネントは、図のラベルが付いています。
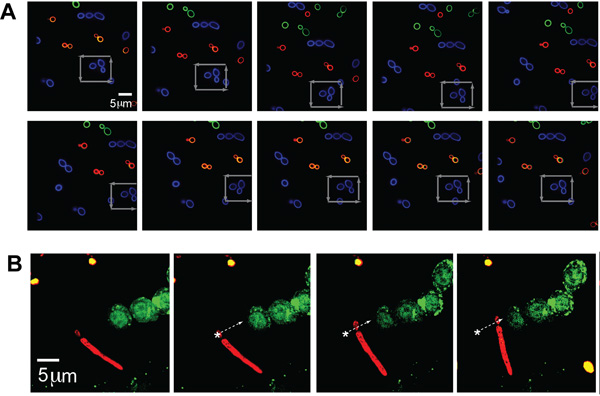
図2(A)の蛍光画像は、トラップとCを操作アルビカンス 。他の蛍光標識Cのフィールドに閉じ込められた蛍光標識(のAlexa Fluor ® 488(AF488)、青)の生物アルビカンス (AF568、緑とAF647、赤)。舞台は、灰色の矢印で示されるトラップ、青州の粒子の周りに移動されます。 C.の(B)閉じ込められた疑似菌糸形GFP - LC3 RAW細胞の隣にアルビカンス 。 CAの蛍光標識psuedohyphalフォーム(赤、AF647)光学的にトラップし、GFP - LC3の隣に移動するには、RAWマクロファージを表明した。白い矢印で示すように、CAの生物は、軌道に沿って移動する。

図3。トラップとAのポジショニング食RAWセルの隣のフミ 。トラップAの(A)明視野像フミ 、のように赤い矢印で示される経路に沿って移動すると位置付け、白い矢印で示されている。トラップされた病原体が少し外側にわずかに焦点面上に生物を押してトラップに起因する焦点のです。A.それは、目的のRAW細胞に隣接して配置されるまで、 フミが移動されます。 (B)インフルエンザA.の食作用のorescenceイメージングRAW細胞からフミ 。トラップされた病原体がRAW細胞の隣に配置された後、食作用のプロセスが起動されます。 30秒で、RAW細胞の膜は、粒子の周りにコップを変更し、形成するために開始されます。 60秒で、カップが完全に形成される。 90年代から150S、Aにフミが包まれている、と180秒で、粒子が完全に内面化され

図4。抗CD3コーティングしたビーズでシナプスを形成する主要なT細胞をトラップする。一次T細胞のDIC画像は、抗CD3抗体とビーズコーティングの隣に位置する光トラップによる移動。セルは、画像に簡単に識別することができない免疫学的シナプスを形成する。
Access restricted. Please log in or start a trial to view this content.
ディスカッション
5μmの - 本研究では、3μmの間の寸法で病原体を捕捉する光トラップを使用してください。私たちの研究室に興味のある病原体は通常、これらの次元を持っていますが、ここで説明した光ピンセットシステムは、サイズの大きい範囲をトラップする柔軟性があります。実際に光トラップは、単一の原子から、直径約10μmの細胞に至るまでの粒子を捕捉するために使用されている。球状、楕?...
Access restricted. Please log in or start a trial to view this content.
開示事項
謝辞
この作品は、医内科ファンドのマサチューセッツ総合病院部(JMT、MKM、MLC、JMV)、生体イメージングの国立研究所と生物工学助成T32EB006348(CEC)、マサチューセッツ総合病院の計算および統合生物の開発資金のためのセンターとAI062773(によってサポートされていましたRJH)、助成金AI062773、DK83756、そしてDK 043351(RJX)、NSF 0643745(MJL)、NIH R21CA133576(MJL)、および国立衛生研究所の国立アレルギー感染病研究所(NIAID)(NIH)AI057999(JMV )。我々は技術支援のために有用な議論をニコラスC.ユッダーに感謝、そしてチャールズフェルト(RPI社)。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント(省略可能) |
|---|---|---|---|
| A.フミ | アルビノ系統、B-5233/RGD12-8、KJクォン-チョン、NIHからの贈り物 | ||
| C. albicansの | SSY50 - B変異体、エレフテリオスMylonakis、MGHからの贈り物、SC5314株、ジェラルドフィンクからの贈り物、ホワイトヘッド研究所 | ||
| のAlexa Fluor ® 488 | インビトロジェン | A20000 | |
| のAlexa Fluor ® 647 | インビトロジェン | A20006 | |
| ジメチルホルムアミド | シグマ | D4551 | |
| 新鮮な血液 | RJWヒース、MGH、HMSからの贈り物 | ||
| ニコン倒立顕微鏡 | ニコン | モデルのTi - E | |
| トラッピングレーザー、ChromaLase | ブルースカイリサーチ | CLAS - 106 - STF02 - 02 | |
| 蛍光励起レーザー | コヒーレント | モデルイノーバ70C | |
| トラッピングコンポーネント用のブレッドボード | Thorlabs | MB1224、MB1218 | |
| 光学式エアテーブル | テクニカルマニュファクチャリング株式会社 | ||
| ペダル制御付電子シャッター | Uniblitz | ヴィンセントアソシエイツ、ロチェスター、ニューヨーク州から購入 | |
| シングルモード光ファイバ | オズオプティクス | PMJ - 3S3S - 1064〜6 | |
| ファイバーポジショナー | Thorlabs | PAF - X - 5 - C | |
| ファイバコリメータ | オズオプティクス | HPUCO - 23 - 1064 - P - 25℃ | |
| 望遠鏡用レンズ | Thorlabs | AC254 - 150 - B | 150mmの焦点距離 |
| 翻訳ステージ(X、Y、Z) | ニューポート | M - 461 - XYZ | |
| IRダイクロイックミラー | 彩度 | ET750 - SP - 2p8 | |
| 対物レンズ(100倍) | ニコン | NA = 1.49、油浸、TIRF客観 | |
| 共焦点ヘッド | 横河電機 | CSU - XI | |
| 偏光板 | ニコン | MEN51941 | |
| ウォラストンプリズム | ニコン | MBH76190 | |
| EM - CCDカメラ | 浜松市 | C9100 - 13 | |
| CCDカメラ(ORCA ER) | 浜松市 | C4742 - 80 - 12AG | |
| フィルターホイール | Ludl | 99A353 | |
| フィルターホイール | サター | LB10 - NWE | |
| チェンカバーガラス | Lab-Tek/Nunc | 155409 | |
| ダイナビーズ | インビトロジェン | 111 - 51D | 抗CD3でコーティング |
| ダルベッコ改変イーグル培地(DMEM) | インビトロジェン/ギブコ | 10313 | |
| ペニシリン/ストレプトマイシン | インビトロジェン/ギブコ | 15140-122 | |
| L -グルタミン | インビトロジェン/ギブコ | 25030-081 | |
| ウシ胎児血清(HyClone) | ThermoScientific | SH30071.03 |
参考文献
- Grakoui, A. The immunological synapse: A molecular machine controlling T cell activation. Science. 285, 221-227 (1999).
- Monks, C. R. Three-dimensional segregation of supramolecular activation clusters in T cells. Nature. 395, 82-86 (1998).
- Stuart, L. M., Ezekowitz, R. A. Phagocytosis and comparative innate immunity: Learning on the fly. Nat Rev Immunol. 8, 131-141 (2008).
- Neuman, K. C., Block, S. M. Optical trapping. Rev Sci Instrum. 75, 2787-2809 (2004).
- Ashkin, A. Optical trapping and manipulation of neutral particles using lasers. Proc Natl Acad Sci USA. 94, 4853-4860 (1997).
- Ashkin, A. Acceleration and trapping of particles by radiation pressure. Phys Rev Lett. 24, 156-159 (1970).
- Ashkin, A., Dziedzic, J. Optical trapping and manipulation of viruses and bacteria Science. Nature. 235, 1517-1520 (1987).
- Khalil, A. S. Single M13 bacteriophage tethering and stretching. Proc Natl Acad Sci USA. 104, 4892-4897 (2007).
- Khalil, A. S. Kinesin's cover-neck bundle folds forward to generate force. Proc Natl Acad Sci USA.. 105, 19247-19252 (2008).
- Li, Z. Membrane tether formation from outer hair cells with optical tweezers. Biophys J. , 1386-1395 (2002).
- Kim, S. The αβ T cell receptor is an anisotropic mechanosensor. J Biol Chem. 284, 31028-31028 (2009).
- Mohanty, S., Mohanty, K., Gupta, P. Dynamics of interaction of RBC with optical tweezers. Opt. Express. 13, 4745-4751 (2005).
- Tam, J. Control and manipulation of pathogens with an optical trap for live cell imaging of intercellular interactions. PLoS One. 5, e15215-e15215 (2010).
- Lin, S. J., Schranz, J., Teutsch, S. M. Aspergillosis case-fatality rate: Systematic review of the literature. Clin Infect Dis.. 32, 358-366 (2001).
- Wey, S. B. Hospital-acquired candidemia - the attributable mortality and excess length of stay. Arch. Intern. Med. 148, 2642-2645 (1988).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved