Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
El uso de una trampa óptica para el estudio de interacciones huésped-patógeno de imágenes dinámicas de células vivas
En este artículo
Resumen
Se describe un método para seleccionar de forma individual, manipular, y los agentes patógenos de imágenes en vivo con una trampa óptica acoplada a un microscopio de disco giratorio. La trampa óptica proporciona un control espacial y temporal de los organismos y los coloca junto a las células huésped. Microscopía de fluorescencia captura dinámica de interacciones intercelulares con perturbación mínima para las células.
Resumen
Imágenes dinámicas de células vivas permite la visualización directa de la interacción en tiempo real entre las células del sistema inmunológico 1, 2, sin embargo, la falta de control espacial y temporal entre los fagocitos y el microbio ha hecho observaciones se centró en las interacciones iniciales de la respuesta del huésped frente a patógenos difícil. Históricamente, los eventos intracelulares de contacto como la fagocitosis 3 han sido fotografiadas por la mezcla de dos tipos de células, y luego continua explorando el campo de visión para encontrar los contactos intercelulares casual en la fase adecuada de la interacción. La naturaleza estocástica de estos eventos hace que este proceso tedioso, y es difícil de observar los acontecimientos a principios o fugaces en contacto célula-célula por este enfoque. Este método requiere la búsqueda de pares de células que están en el punto de contacto, y observar hasta que consuman su contacto, o no. Para hacer frente a estas limitaciones, el uso captura óptica como un no-invasivo, método no destructivo, pero rápida y eficaz a la posición de las células en cultivo.
Trampas ópticas, o las pinzas ópticas, son cada vez más utilizada en la investigación biológica para capturar y manipular físicamente las células y otras partículas de tamaño micrométrico en tres dimensiones 4. La presión de radiación fue observado por primera vez y se aplican a los sistemas de pinzas ópticas en 1970, 5, 6, y fue utilizado por primera vez al control de las muestras biológicas en 1987 7. Desde entonces, las pinzas ópticas han madurado hasta convertirse en una tecnología para explorar una variedad de fenómenos biológicos 8-13.
Se describe un método de 14 que los avances en directo imágenes de células mediante la integración de una trampa óptica con el hilado de microscopía confocal de disco con control de temperatura y humedad para proporcionar un control exquisito espacial y temporal de los organismos patógenos en un entorno fisiológico para facilitar la interacción con las células huésped, según lo determine el operador. En vivo, los organismos patógenos, como Candida albicans y Aspergillus fumigatus, que puede causar potencialmente letal, infecciones invasivas en pacientes inmunocomprometidos, 15, 16 (por ejemplo, el SIDA, la quimioterapia y los pacientes de trasplante de órganos), quedaron atrapados ópticamente no destructiva utilizando intensidades de láser y se trasladó junto a macrófagos, que pueden fagocitar el patógeno. Alta resolución, transmite películas de luz y fluorescencia basada estableció la posibilidad de observar los primeros eventos de la fagocitosis de las células vivas. Para demostrar la amplia aplicabilidad en la inmunología, la primaria de células T también fueron atrapados y manipulados para formar sinapsis con anti-CD3 microesferas recubiertas en vivo, y el tiempo-lapse de imágenes de la formación de sinapsis se obtuvo también. Al proporcionar un método para ejercer un control preciso espacial de patógenos vivos con respecto a las células inmunes, las interacciones celulares pueden ser capturados por microscopía de fluorescencia con un mínimo de perturbación a las células y pueden producir una poderosa comprensión de las primeras respuestas de inmunidad innata y adaptativa.
Protocolo
1. Condiciones de cultivo de agentes patógenos para la captura óptica
- Crecer A. fumigatus (B-5233/RGD12-8) en un medio de agar semi-sólido que contiene SBD (Sabouraud dextrosa) a 30 ° C durante 3 días.
- Crecer C. albicans (SC5314) en YPD (levadura peptona dextrosa) de cultivo líquido que contiene 100 mg / ml ampicilina durante la noche en una incubadora de agitación a 30 ° C.
2. Preparación de los agentes patógenos para el etiquetado fluorescente
- Cosecha de la cantidad deseada de los patógenos y la transferencia a un tubo de 1,5 ml de reacción.
- Añadir 300 l de tampón fosfato salino (PBS) para tubo de reacción.
- Sonicar mezcla durante 30 segundos.
- Centrifugar a 4000 rpm durante 1 minuto.
- Aspirar el sobrenadante, dejando de pellets sin ser molestados.
- Repita (2,4) y (2,5) dos veces más.
- Resuspender en 500μL de PBS.
3. Etiquetado de los agentes patógenos con tinte fluorescente
- Disolver 1 mg de colorante de interés (por ejemplo, Alexa Fluor 488, Alexa Fluor 647) en 100 l dimetilformamida (DMF) (concentración de 10 mg / ml).
- Añadir 3 l de mezcla de colorantes a los tubos de reacción que contiene patógenos lavado.
- Girar o agitar la muestra a 37 ° C durante 1 hora.
- Lavar la muestra con PBS 3 veces por centrifugación a 4000 rpm durante 1 minuto.
- Resuspender en 300 l de PBS.
4. La recolección de células T de la sangre entera
- Obtener sangre entera (fresca).
- La sangre caliente, PBS + 2% de suero fetal bovino (SFB), y HISTOPAQUE a temperatura ambiente.
- Añadir CD4 + RosetteSep Humanos de células T Cóctel de enriquecimiento a 50 l / ml de sangre total.
- Rotar la muestra y se incuba durante 20 minutos a temperatura ambiente.
- Diluir la muestra con un volumen igual de PBS + 2% de SFB y mezclar suavemente.
- Capa diluida de la muestra en la parte superior de HISTOPAQUE, minimizando la mezcla
- Centrifugar durante 20 minutos a 1200 xg a temperatura ambiente con el freno de apagado.
- Eliminar las células enriquecido.
- Lavar las células 2 veces con PBS enriquecido + 2% de solución de SFB.
- Lisis de las células rojas de la sangre durante 2 minutos con tampón de lisis de glóbulos rojos
- Agregar 10 ml de PBS + 2% de SFB y centrifugar lisadas las células rojas de la sangre a 1500 rpm durante 5 minutos
- Aspirar el sobrenadante, cuidando de no alterar el pellet
- Resuspender en los medios de comunicación IMDM con 10% de suero fetal bovino
5. Preparación de los macrófagos RAW 264.7 en la cámara de diapositivas
- Prepare DMEM (Dulbecco modificado de Eagle) que contenga un 10% de SFB, 1% penicilina / estreptomicina, y el 1% de L-glutamina.
- Los medios de comunicación cálida, la tripsina, y PBS en baño de agua tibia a 37 ° C.
- Lavar 2 veces la placa con PBS
- Aspirar PBS entre cada lavado.
- Añadir 5 ml de tripsina a la placa para cubrir la superficie (para una placa de cultivo de 10 cm de tejido).
- Incubar durante 5 min a 37 ° C.
- Suavemente golpee lado de la placa para separar las células de la superficie de la placa. Tenga cuidado de no salpicar fuera de la tripsina de la placa.
- Añadir 5 ml o cantidad equivalente de los medios de comunicación a la tripsina.
- Aspirar la mezcla en un tubo de reacción.
- Centrifugar a 1000 xg durante 3 minutos.
- Aspirar los medios de comunicación, cuidado de no perturbar el sedimento.
- Resuspender en 10 ml de los medios de comunicación.
- Añadir 400 l de los medios de comunicación a cada cámara de la diapositiva de la cámara.
- Añadir 5 l de la suspensión celular a cada cámara.
- Crecen durante la noche en la incubadora a 37 ° C con 5% de CO 2.
6. Además de los agentes patógenos de la muestra
- Pipeta de 5.10 L de patógenos etiquetado de interés (de los pasos 1-3) en la cámara.
- Mezcle bien con la pipeta hacia arriba y abajo, con cuidado de no tocar la parte inferior de la cámara de molestar a los macrófagos adheridos.
7. Carga de la muestra a girar microscopio confocal de disco (en el video, escanear a través de los componentes)
- Encienda todos los componentes de spinning microscopio confocal de disco.
- Alinear microscopio en busca de imágenes DIC.
- Retire la cámara de diapositivas de la incubadora.
- Insertar una diapositiva de cámara en la etapa especializados.
- Quite la parte superior de la cámara de diapositivas (necesaria para la formación de imágenes DIC).
8. Preparación para la captura óptica (en el video, escanear a través de los componentes y la forma en que está integrado en microscopio)
- Encienda el obturador de trampa óptica.
- Encienda el láser IR.
- Obturador abierto (el láser) a trampa óptica.
- Confirmar disparo delante de láser IR se cierra mediante la comprobación con la tarjeta de IR.
9. Selección y manipulación de agentes patógenos con trampa óptica
- Centrarse en los macrófagos en la diapositiva adherido.
- Buscar patógenos fluctuando libremente en la solución junto a los macrófagos.
- Mueva la etapa de tal manera que el patógeno se encuentra en las inmediaciones de la trampa.
- Abrir obturador y participar en la trampa.
- Mover la muestra para que los macrófagos en contacto con la trampa estacionariaped patógeno.
- La imagen con el hilado microscopio confocal de disco, ya sea en la DIC, fluorescencia, o combinación de ambos. Por lo general, la captura se realiza en la DIC, y en tiempo real de imágenes se hace con fluorescencia.
10. Los resultados representativos:
Ejercer un pleno control espacial y temporal de los agentes patógenos y los granos en un estudio in vivo e in vitro en el medio ambiente, hemos diseñado un aparato de captura de costumbre-construido integrada en un microscopio confocal de disco giratorio (esquema que se muestra en la Fig. 1.). Con toda su fuerza, el láser proporciona 350 mW de potencia y después del acoplamiento a la luz con los componentes ópticos diferentes en el aparato de la trampa óptica, ~ 80 mW de potencia en el objetivo TIRF, medido con un medidor de potencia, fue utilizada para formar la trampa en la cámara.
Con el fin de colocar un objeto en la cámara en relación con el objeto atrapado, la etapa fue movida mientras se mantiene el objeto atrapado estacionario con el láser de captura. El escenario se trasladó a lenta velocidad suficiente, de modo que la fuerza de arrastre sobre la partícula atrapada no superó la fuerza máxima de captura.
Poblaciones separadas de C. albicans (típico tamaño - ~ 5 micras) se marcaron con cada uno de los tres colores (AF488, AF568, AF647 y, lo que corresponde a verde, azul y rojo en la figura, respectivamente) para ilustrar imágenes con múltiples canales de fluorescencia al mismo tiempo que ópticamente atrapando a los patógenos. Una sola C. albicans fue atrapado y trasladado en un cuadrado a través de un conjunto de otras levaduras, como indican las flechas grises, lo que demuestra la capacidad de capturar y manipular la ubicación específica de un patógeno único elegido por el operador, incluso en un ambiente lleno de gente (Fig. 2A) .
Para ilustrar aún más la flexibilidad de este sistema para atrapar a las morfologías diferentes formas exhibidas por los organismos patógenos, las pinzas ópticas también fue capaz de mantener y situar un C. albicans de partículas con un pseudohifas. El C. albicans etiquetados con AF647 (rojo) se trasladó a lo largo de una trayectoria como se indica por la flecha blanca y colocado junto a las células GFP-LC3-RAW fluorescentes (Fig. 2B). La porción de levadura de la C. albicans fue atrapado en la zaga a lo largo de pseudohifas.
También coloca Aspergillus fumigatus al lado de una célula de ratón macrófagos RAW con el fin de analizar el marco de tiempo absoluto de la fagocitosis con esta línea celular en particular y de los patógenos (Fig. 3). Una vez que el patógeno entra en contacto con la célula, la trampa está apagado, y el tiempo de imágenes a intervalos se emplea para observar los acontecimientos celulares posteriores (Fig. 3B). La trampa óptica también se utilizó para la captura primaria de células T aisladas de la sangre y dirigido junto a bolas recubiertas con anticuerpo anti-CD3 para que la célula T para formar una sinapsis inmunológica con el talón (Fig. 4), muestran los adicionales versatilidad para atrapar y manipular directamente las células inmunes.
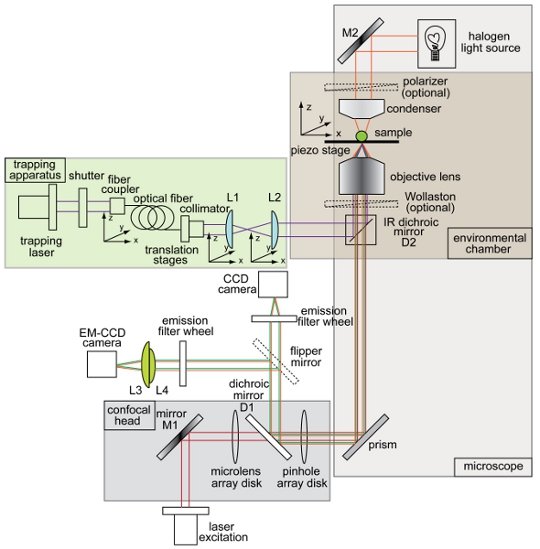
Figura 1. Información general y esquemática de la trampa óptica combinada y la configuración de disco giratorio confocal microscopio. Instrumento de diseño que muestra el haz de captura (púrpura), camino de iluminación de campo claro de imagen (color naranja), haz de excitación de fluorescencia (rojo), emisión de fluorescencia (verde), dispositivo de carga acoplada (CCD), electrones multiplicando dispositivo de carga acoplada (EM- CCD), espejos dicroicos (D1 y D2), espejos (M1 y M2), y lentes (L1, L2, L3, L4). Todos los demás componentes del sistema de trampa-microscopio confocal están etiquetados en la figura.
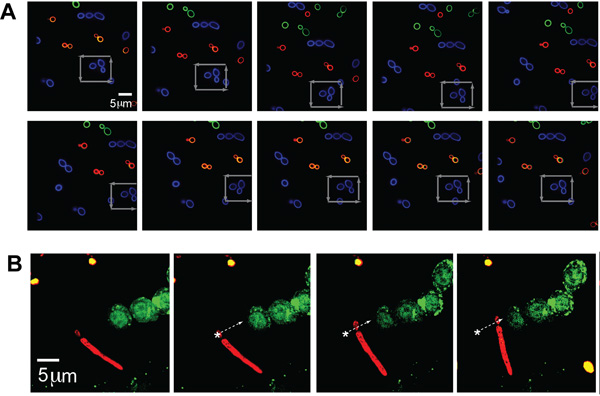
Figura 2. (A) las imágenes de fluorescencia de atrapado y manipulado C. albicans. Una atrapada fluorescente marcada con (Alexa Fluor 488 (AF488), azul) del organismo en un campo de otra fluorescente marcada con C albicans (AF568, AF647 y verde, rojo). El escenario se mueve alrededor de la partícula atrapada, azul CA según lo indicado por las flechas de color gris. (B) Atrapado pseudo-hifas forma de C. albicans al lado de GFP-LC3 células RAW. Formulario marcados con fluorescencia psuedohyphal de CA (rojo, AF647) ópticamente atrapados y se trasladó junto a GFP-LC3 expresado macrófagos RAW. El organismo CA se mueve a lo largo de la trayectoria indicada por la flecha blanca.

Figura 3. Trampeo y la posición de A. fumigatus al lado de una célula fagocítica RAW. (A) campo claro las imágenes de un A. atrapados fumigatus, según lo indicado por la flecha blanca, se trasladó y se coloca en el camino indicado por la flecha roja. El patógeno es atrapado ligeramente fuera de foco debido a la trampa de empujar el organismo ligeramente por encima del plano focal. A. fumigatus se mueve hasta que se coloca junto a la celda deseada RAW. (B) contra la gripeorescence imagen de la fagocitosis de A. fumigatus por células RAW. Después de que el patógeno se encuentra atrapada junto a una celda de RAW, el proceso de fagocitosis se activa. A los 30 s, la membrana de las células RAW comienza a cambiar y la forma de una taza alrededor de la partícula. A los 60 s, la taza está completamente formado. De 90 a 150 s, el A. fumigatus está envuelto, y de 180 s, la partícula es internalizado por completo

Figura 4. Captura de primaria de las células T para formar sinapsis con anti-CD3 bolas recubiertas. DIC imágenes de una primaria de células T movido por la trampa óptica a una posición al lado de una bola recubierta con anticuerpo anti-CD3. La célula se forma una sinapsis inmunológica, que no pueden ser fácilmente discernible en las imágenes.
Access restricted. Please log in or start a trial to view this content.
Discusión
En este trabajo se utiliza una trampa óptica para capturar los agentes patógenos, con dimensiones de 3 m - 5 micras. A pesar de los patógenos de interés para nuestro laboratorio suelen tener estas dimensiones, el sistema de pinzas ópticas se describe aquí es flexible para atrapar a una amplia gama de tamaños. De hecho trampas ópticas han sido utilizados para capturar las partículas que van desde los átomos individuales a las células de aproximadamente 10 micras de diámetro. Además, este sistema de captura ?...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Agradecimientos
Este trabajo fue apoyado por el Hospital General de Massachusetts Departamento de Medicina de Fondos Internos (JMT, MKM, MLC, JMV), Instituto Nacional de Imágenes Biomédicas y Bioingeniería conceder T32EB006348 (CEC), Centro de Hospital General de Massachusetts para el fondo de la biología del desarrollo de la Computación e Integrativa y AI062773 ( RJH), las subvenciones AI062773, DK83756, y DK 043 351 (RJX), NSF 0643745 (MJL), NIH R21CA133576 (MJL), y el Instituto Nacional de Alergias y Enfermedades Infecciosas (NIAID) de los Institutos Nacionales de Salud (NIH) AI057999 (JMV ). Damos las gracias a Nicholas C. Yoder útil para los debates, y Fieltros Charles (RPI, Inc.) para la asistencia técnica.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios (opcional) |
|---|---|---|---|
| A. fumigatus | Cepa albina, B-5233/RGD12-8, regalo de KJ Kwon-Chung, NIH | ||
| C. albicans | SSY50-B mutante, regalo de Eleftherios Mylonakis, MGH; SC5314 cepa, regalo de Gerald Fink, del Instituto Whitehead | ||
| Alexa Fluor 488 | Invitrogen | A20000 | |
| Alexa Fluor 647 | Invitrogen | A20006 | |
| dimetilformamida | Sigma | D4551 | |
| Sangre fresca | Regalo de RJW Heath, MGH, el HMS | ||
| Microscopio invertido Nikon | Nikon | Modelo Ti-E | |
| Láser de captura, ChromaLase | Azul Sky Research | CLAS-106-STF02-02 | |
| Láser de excitación de fluorescencia | Coherente | Innova modelo 70C | |
| Ayudas para diseño de componentes de captura | Thorlabs | MB1224, MB1218 | |
| Ópticos mesa de aire | Técnica Manufacturing Corporation | ||
| Obturador electrónico con pedal de control | Uniblitz | Adquiridos de los Asociados Vicente, Rochester, NY | |
| De fibra óptica monomodo | Oz Óptica | PMJ-3S3S-1064-6 | |
| Fibra posicionador | Thorlabs | PAF-X-5-C | |
| Fibra colimador | Oz Óptica | HPUCO-23-1064-P-25AC | |
| Lentes para telescopio | Thorlabs | AC254-150-B | Distancia focal de 150 mm |
| Etapas de la traducción (x, y, z) | Newport | M-461-XYZ | |
| IR espejo dicroico | Chroma | ET750-sp-2p8 | |
| Lente objetivo (100X) | Nikon | NA = 1,49, inmersión en aceite, el objetivo TIRF | |
| Cabeza confocal | Yokogawa | CSU-XI | |
| Polarizador | Nikon | MEN51941 | |
| Wollaston prisma | Nikon | MBH76190 | |
| EM-CCD de la cámara | Hamamatsu | C9100-13 | |
| Cámara CCD (ORCA ER) | Hamamatsu | C4742-80-12AG | |
| Rueda de filtros | Ludl | 99A353 | |
| Rueda de filtros | Sutter | LB10-ENO | |
| Cámaras cubreobjetos | Lab-Tek/Nunc | 155409 | |
| Dynabeads | Invitrogen | 111-51D | Recubiertas con anticuerpos anti-CD3 |
| Dulbecco modificado de Eagle (DMEM) | Invitrogen / Gibco | 10313 | |
| Penicilina / estreptomicina | Invitrogen / Gibco | 15140-122 | |
| L-glutamina | Invitrogen / Gibco | 25030-081 | |
| De suero fetal bovino (Hyclone) | ThermoScientific | SH30071.03 |
Referencias
- Grakoui, A. The immunological synapse: A molecular machine controlling T cell activation. Science. 285, 221-227 (1999).
- Monks, C. R. Three-dimensional segregation of supramolecular activation clusters in T cells. Nature. 395, 82-86 (1998).
- Stuart, L. M., Ezekowitz, R. A. Phagocytosis and comparative innate immunity: Learning on the fly. Nat Rev Immunol. 8, 131-141 (2008).
- Neuman, K. C., Block, S. M. Optical trapping. Rev Sci Instrum. 75, 2787-2809 (2004).
- Ashkin, A. Optical trapping and manipulation of neutral particles using lasers. Proc Natl Acad Sci USA. 94, 4853-4860 (1997).
- Ashkin, A. Acceleration and trapping of particles by radiation pressure. Phys Rev Lett. 24, 156-159 (1970).
- Ashkin, A., Dziedzic, J. Optical trapping and manipulation of viruses and bacteria Science. Nature. 235, 1517-1520 (1987).
- Khalil, A. S. Single M13 bacteriophage tethering and stretching. Proc Natl Acad Sci USA. 104, 4892-4897 (2007).
- Khalil, A. S. Kinesin's cover-neck bundle folds forward to generate force. Proc Natl Acad Sci USA.. 105, 19247-19252 (2008).
- Li, Z. Membrane tether formation from outer hair cells with optical tweezers. Biophys J. , 1386-1395 (2002).
- Kim, S. The αβ T cell receptor is an anisotropic mechanosensor. J Biol Chem. 284, 31028-31028 (2009).
- Mohanty, S., Mohanty, K., Gupta, P. Dynamics of interaction of RBC with optical tweezers. Opt. Express. 13, 4745-4751 (2005).
- Tam, J. Control and manipulation of pathogens with an optical trap for live cell imaging of intercellular interactions. PLoS One. 5, e15215-e15215 (2010).
- Lin, S. J., Schranz, J., Teutsch, S. M. Aspergillosis case-fatality rate: Systematic review of the literature. Clin Infect Dis.. 32, 358-366 (2001).
- Wey, S. B. Hospital-acquired candidemia - the attributable mortality and excess length of stay. Arch. Intern. Med. 148, 2642-2645 (1988).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados