Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Die Verwendung einer optischen Falle für das Studium der Wirt-Pathogen-Interaktionen für Dynamic Live Cell Imaging
In diesem Artikel
Zusammenfassung
Eine Methode ist beschrieben, einzeln auswählen, bearbeiten und Bild zu leben Erreger mit einer optischen Falle gekoppelt an eine sich drehende Scheibe Mikroskop. Die optische Falle bietet räumliche und zeitliche Steuerung von Organismen und legt sie neben Wirtszellen. Fluoreszenzmikroskopie erfasst dynamische interzelluläre Wechselwirkungen mit minimaler Störung der Zellen.
Zusammenfassung
Dynamische Live Cell Imaging ermöglicht die direkte Visualisierung von Echtzeit-Interaktionen zwischen den Zellen des Immunsystems 1, 2, aber der Mangel an räumlicher und zeitlicher Steuerung zwischen den Fresszellen und Mikroben geleistet hat Beobachtungen in den ersten Interaktionen von Wirt Reaktion auf Krankheitserreger konzentrieren schwierig. Historisch gesehen haben interzellulären Kontakt Veranstaltungen wie Phagozytose 3 durch Mischen von zwei Zelltypen abgebildet worden, und dann kontinuierlich Scannen der field-of-view, um serendipitous interzellulären Kontakte auf der entsprechenden Stufe der Interaktion zu finden. Die stochastische Natur dieser Ereignisse macht dieses Verfahren langwierig, und es ist schwer zu früh oder flüchtige Ereignisse in Zell-Zell-Kontakt durch diesen Ansatz zu beobachten. Diese Methode erfordert finden Zellpaaren, dass am Rande der Kontakt sind, und beobachtet sie, bis sie vollendet ihre Kontaktdaten, oder nicht. Um diese Einschränkungen nutzen wir optische Fallen als nicht-invasive, nicht-destruktive, sondern eine schnelle und effektive Methode, um Zellen in Kultur positionieren.
Optische Fallen oder optische Pinzette, sind zunehmend in der biologischen Forschung eingesetzt, um zu erfassen und physisch zu manipulieren Zellen und anderen Mikrometergröße Teilchen in drei Dimensionen 4. Strahlungsdruck wurde zum ersten Mal beobachtet und auf optische Pinzette-Systeme in 1970 5, 6, und wurde zum ersten Mal verwendet werden, um biologische Proben im Jahr 1987 7 zu steuern. Seither haben optische Pinzette in eine Technologie ausgereift, um eine Vielzahl biologischer Phänomene 8-13 Sonde.
Wir beschreiben eine Methode, 14, die Fortschritte Live Cell Imaging durch die Integration einer optischen Falle mit Spinning-Disk-konfokale Mikroskopie mit Temperatur und Luftfeuchtigkeit auf exquisite räumliche und zeitliche Steuerung von pathogenen Organismen in einer physiologischen Umgebung bieten, um Wechselwirkungen mit Wirtszellen, wie die ermittelten erleichtern Betreiber. Live, wurden pathogene Organismen wie Candida albicans und Aspergillus fumigatus, die tödlich enden, invasive Infektionen bei immungeschwächten Personen 15, 16 (z. B. AIDS, Chemotherapie und Organtransplantation Patienten) kann dazu führen, optisch gefangen mit zerstörungsfreien Laserintensitäten und zog neben Makrophagen, die den Erreger phagozytieren können. Hohe Auflösung, Durchlicht und Fluoreszenz-basierten Filmen etabliert die Fähigkeit zur frühen Ereignisse der Phagozytose in lebenden Zellen zu beobachten. Zur Demonstration der breiten Anwendbarkeit in der Immunologie, wurden primäre T-Zellen auch gefangen und manipuliert werden, um Synapsen mit anti-CD3 beschichteten Mikrokügelchen in vivo bilden und Zeitraffer-Bildgebung der Synapsenbildung wurde ebenfalls erhalten. Durch die Bereitstellung einer Methode, um feine räumliche Steuerung von Live-Erreger in Bezug auf Immunzellen ausüben können zelluläre Interaktionen mittels Fluoreszenzmikroskopie mit minimaler Störung von Zellen aufgenommen werden und können leistungsfähige Einblick in frühen Reaktionen der angeborenen und erworbenen Immunität zu erhalten.
Protokoll
1. Kultur Bedingungen von Krankheitserregern für optische Fallen
- Wachsen A. fumigatus (B-5233/RGD12-8) auf einem semi-Agar-Medien mit SBD (Sabouraud Dextrose) bei 30 ° C für 3 Tage.
- Wachsen C. albicans (SC5314) in YPD (Hefe-Pepton Dextrose) Flüssigkultur mit 100 ug / ml Ampicillin über Nacht in einem Schüttelinkubator bei 30 ° C.
2. Vorbereitung von Krankheitserregern für Fluoreszenzmarkierung
- Ernte gewünschten Betrag von Krankheitserregern und in ein 1,5 ml Reaktionsgefäß.
- Add 300 ul Phosphat-gepufferter Kochsalzlösung (PBS), um Reaktionsgefäß.
- Mit Ultraschall-Gemisch für 30 Sekunden.
- Zentrifugation bei 4000 rpm für 1 Minute.
- Saugen Sie den Überstand, so dass Pellets ungestört.
- Wiederholen (2,4) und (2,5) zwei weitere Male.
- Resuspendieren in 500μL PBS.
3. Labeling von Krankheitserregern mit Fluoreszenzfarbstoff
- 1 mg des Farbstoffs von Interesse (zB Alexa Fluor 488, Alexa Fluor 647) in 100 ul Dimethylformamid (DMF) (Konzentration von 10 mg / mL).
- Add 3 ul der Farbstoffmischung zur Reaktion Röhrchen gewaschen Krankheitserreger.
- Drehen oder Schütteln Probe bei 37 ° C für 1 Stunde.
- Wash Probe mit PBS 3X durch Zentrifugation bei 4000 rpm für 1 Minute.
- Resuspendieren in 300 ul PBS.
4. Harvesting T-Zellen aus Vollblut
- Erhalten Vollblut (frisch).
- Warmes Blut, PBS + 2% fötalem Rinderserum (FBS), und HISTOPAQUE auf Raumtemperatur.
- Add RosetteSep menschlichen CD4 + T-Zell-Anreicherung Cocktail bei 50 ul / ml Vollblut.
- Drehen Probe und Inkubation für 20 Minuten bei Raumtemperatur.
- Verdünnte Probe mit dem gleichen Volumen PBS + 2% FBS und vorsichtig mischen.
- Schicht verdünnten Probe auf der HISTOPAQUE, Minimierung Mischen
- Zentrifuge für 20 Minuten bei 1200 xg bei Raumtemperatur mit der Bremse ausgeschaltet.
- Entfernen Sie die angereicherten Zellen.
- Waschen Sie die angereicherten Zellen 2x mit PBS + 2% FBS Lösung.
- Lyse roter Blutkörperchen für 2 Minuten mit der roten Blutkörperchen Lysepuffer
- Fügen Sie 10 ml PBS + 2% FBS und Zentrifuge lysierten roten Blutzellen bei 1500 rpm für 5 Minuten
- Saugen Sie den Überstand, Achten Sie darauf, das Pellet stören
- Resuspendieren in IMDM Medien mit 10% fötalem Rinderserum
5. Vorbereitung von RAW 264.7 Makrophagen in die Kammer Dias
- Bereiten DMEM (Dulbecco modifiziertem Eagle-Medium) bis 10% FBS, 1% Penicillin / Streptomycin und 1% L-Glutamin enthalten.
- Warm Medien, Trypsin und PBS in warmes Bad auf 37 ° C.
- Wash Platte 2x mit PBS
- Absaugen PBS zwischen jedem Waschgang.
- Add 5 ml Trypsin-to-Plate zu bedecken (für eine 10 cm Zellkultur-Platte).
- Inkubieren für 5 min bei 37 ° C.
- Vorsichtig klopfte Seite der Platte, um Zellen von der Platte ablösen. Achten Sie darauf, Trypsin außerhalb der Platte spritzen.
- Add 5 ml oder eine äquivalente Menge von Medien, um Trypsin.
- Saugen Sie Mischung in ein Reaktionsrohr.
- Zentrifugation bei 1000 xg für 3 Minuten.
- Absaugen Medien Achten Sie darauf, das Pellet stören.
- Resuspendieren in 10 mL von Medien.
- Add 400 ul Medien zu jeder Kammer der Kammer schieben.
- Add 5 ul Zellsuspension zu jeder Kammer.
- Wachsen Sie über Nacht im Brutschrank bei 37 ° C mit 5% CO 2.
6. Addition von Krankheitserregern zu Probe
- Pipet 5-10 ul der markierten Krankheitserreger von Interesse (aus den Schritten 1-3) in die Kammer.
- Gründlich mischen durch Pipettieren rauf und runter, vorsichtig auf den Boden der Kammer berühren, die eingehalten Makrophagen zu stören.
7. Loading Probe auf Spinning-Disk-konfokalen Mikroskop (in Video-, Komponenten durch Scan)
- Schalten Sie alle Komponenten, um sich drehende Scheibe konfokalen Mikroskop.
- Align-Mikroskop für DIC Imaging.
- Entfernen Kammer Folie aus Inkubator.
- Legen Kammer gleiten in spezialisierten Bühne.
- Entfernen Sie die obere Kammer des Schlittens (notwendig für DIC Imaging).
8. Vorbereitung für optische Fallen (in Video-, Komponenten-Scan durch und wie es in Mikroskop integriert)
- Schalten Sie Auslöser für die optische Falle.
- Schalten Sie IR-Laser.
- Offene Blende (am Laser) zur optischen Falle.
- Bestätigen Blende vor IR-Laser wird durch die Überprüfung mit IR-Karte geschlossen.
9. Auswahl und Manipulation der Erreger mit optischen Falle
- Konzentrieren Sie sich auf Makrophagen auf Einhaltung gleiten.
- Suche Krankheitserreger frei schwankenden in Lösung neben Makrophagen.
- Bewegen der Bühne, so dass der Erreger in der Nähe der Falle ist.
- Offene Blende und greifen in die Falle.
- Bewegen Probe Makrophagen in Kontakt zu bringen mit der stationären Falleped Erregers.
- Bild mit Spinning-Disk-konfokalen Mikroskop, entweder in DIC, Fluoreszenz oder Kombination aus beidem. Typischerweise ist das Fallenstellen in DIC getan, und Echtzeit-Bildgebung mit Fluoreszenz getan.
10. Repräsentative Ergebnisse:
Zur Ausübung volle räumliche und zeitliche Kontrolle von Krankheitserregern und Perlen in einem in vivo und in vitro-Umgebung haben wir eine custom-built Trapping Apparat auf eine sich drehende Scheibe konfokalen Mikroskop (schematisch in Abb.. 1) integriert. Bei voller Stärke, vorausgesetzt, der Laser 350 mW Leistung und nach der Kopplung des Lichts mit den verschiedenen optischen Komponenten in der optischen Falle Apparat, ~ 80 mW Leistung bei der TIRF Ziel, als mit einem Leistungsmesser gemessen wurde, wurde verwendet, um die Falle zu bilden in der Kammer.
Um ein Objekt in der Kammer in Bezug auf die eingeschlossene Objekt zu positionieren, war die Bühne bewegt, während das eingeschlossene Objekt stationär mit der Trapping-Laser. Die Bühne war langsam genug Geschwindigkeiten bewegt, so dass die Zugkraft auf die eingeschlossene Partikel nicht über die maximale Klemmkraft.
Separate Populationen von C. albicans (typische Größe - ~ 5 um) wurden mit jeweils drei Farben (AF488, AF568, AF647 und, entsprechend grün, blau und rot in der Abbildung bezeichnet) versehen, die Bildgebung mit Mehrfach-Fluoreszenz-Kanäle zeigen gleichzeitig optisch Trapping des Erregers. Ein einziger C. albicans wurde gefangen und in einem quadratischen Muster durch ein Cluster von anderen Hefe bewegt, wie durch graue Pfeile angezeigt, was die Fähigkeit zur Erfassung und Manipulation der spezifischen Lage eines einzigen Erreger durch den Betreiber selbst in einem überfüllten Umgebung gewählt (Abb. 2A) .
Um zu veranschaulichen weiter die Flexibilität dieses Systems, die unterschiedliche Form Morphologien durch pathogene Organismen ausgestellt Falle wurde die optische Pinzette auch in der Lage zu halten und zu situieren ein C. albicans Partikel mit einem Pseudohyphen. Die C. albicans mit AF647 (rot) markiert war, wurde auf einer Bahn bewegt, wie durch den weißen Pfeil dargestellt und stellte neben fluoreszierende GFP-LC3-RAW-Zellen (Abb. 2B). Die Hefe Teil der C. albicans war gefangen wie die Pseudohyphen gezogene entlang.
Wir haben auch Aspergillus fumigatus neben einem RAW-Maus Makrophagenzelllinie, um die absolute Zeitrahmen der Phagozytose mit dieser speziellen Zell-Linie und Pathogen (Abb. 3A) analysieren positioniert. Sobald der Erreger in Kontakt mit der Zelle, ist die Falle abgeschaltet und Zeitraffer-Bildgebung verwendet wird, um die anschließende zelluläre Ereignisse zu beobachten (Abb. 3B). Die optische Falle wurde auch verwendet, um primäre T-Zellen zu erfassen isoliert aus dem Blut und den angrenzenden gerichtet, um die Kügelchen mit anti-CD3-Antikörper, um für die T-Zell-beschichtet, um einer immunologischen Synapse mit dem Wulst (Abb. 4) bilden, zeigen die zusätzlichen Vielseitigkeit direkt abzufangen und zu manipulieren Immunzellen.
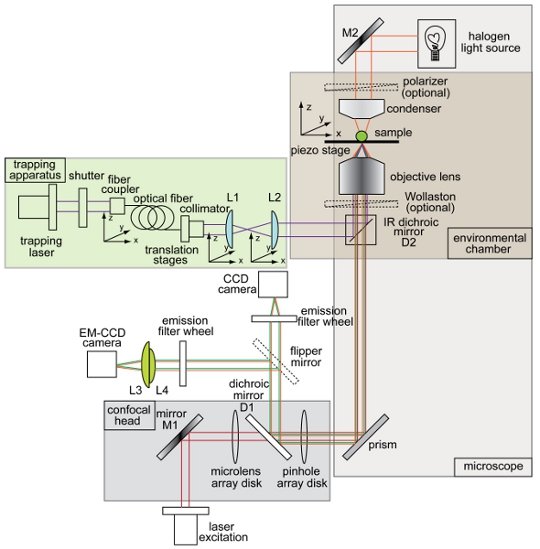
Abbildung 1. Übersicht und Schema der kombinierten optischen Falle und Spinning-Disk-konfokalen Mikroskop Setup. Instrument Layout zeigt die Trapping-Strahl (violett), Beleuchtungsweg für Hellfeld-Tomographie (orange), Fluoreszenz-Anregungs-(rot), Fluoreszenz-Emission (grün), charge-coupled device (CCD)-Kamera, Elektron-Multiplikation charge coupled device (EM- CCD-Kamera), dichroitische Spiegel (D1 und D2), Spiegel (M1 und M2) und Linsen (L1, L2, L3, L4). Alle anderen Komponenten des trap-konfokalen Mikroskop-System sind in der Abbildung gekennzeichnet.
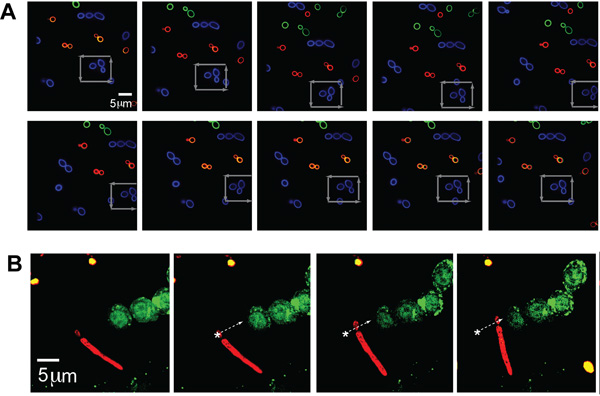
Abbildung 2. (A) Fluoreszenz-Bilder von gefangenen und manipuliert C. albicans. A gefangen fluoreszenzmarkierten (Alexa Fluor 488 (AF488), blau) Organismus in einem Feld von anderen fluoreszenzmarkierten C. albicans (AF568, Grün und AF647, rot). Die Bühne ist rund um die gefangen, blau CA Teilchen als durch die grauen Pfeile bewegt werden. (B) Trapped pseudo-Hyphenform von C. albicans neben GFP-LC3 RAW Zelle. Fluoreszenzmarkierten psuedohyphal Form von CA (rot, AF647) optisch gefangen und zog neben GFP-LC3 ausgedrückt RAW Makrophagen. Die CA Organismus ist entlang der Bahn bewegt, wie durch den weißen Pfeil gekennzeichnet.

Abbildung 3. Trapping und Positionierung von A. fumigatus neben einem phagocytic RAW Zelle. (A) Hellfeld Bilder der gefangenen A. fumigatus, als durch den weißen Pfeil angedeutet, bewegt und auf dem Weg durch den roten Pfeil angedeutet positioniert. Die eingeschlossenen Erreger ist leicht unscharf aus, um die Falle schieben den Organismus leicht oberhalb der Fokusebene. A. fumigatus bewegt wird, bis es neben platziert ist, um die gewünschte RAW-Zelle. (B) Fluorescence Bildgebung von Phagozytose von A. fumigatus von RAW-Zelle. Nach der eingeschlossenen Erreger neben einem RAW-Zelle gelegt wird, ist die Phagozytose-Prozess aktiviert. Mit 30 s, beginnt die Membran des RAW-Zelle zu verändern und bilden eine Tasse um das Teilchen. Bei 60 s, ist der Kelch voll ausgebildet. Von 90 auf 150s, die A. fumigatus ist verschlungen und von 180 s, die Partikel vollständig internalisiert

Abbildung 4. Trapping primären T-Zelle zu Synapse mit anti-CD3 beschichteten Beads zu bilden. DIC Bilder eines primären T-Zellen durch das optische Falle in eine Position neben einem Wulst beschichtet mit anti-CD3-Antikörper verschoben. Die Zelle bildet dann einer immunologischen Synapse, die nicht leicht zu erkennen in den Bildern.
Access restricted. Please log in or start a trial to view this content.
Diskussion
In dieser Arbeit verwenden wir einen optischen Falle auf Krankheitserreger mit Abmessungen zwischen 3 um einzufangen - 5 pm. Obwohl Krankheitserreger von Interesse für unser Labor in der Regel diese Dimensionen haben, ist die optische Pinzette hier beschriebene System flexibel auf eine Vielzahl von Größen Falle. In der Tat optische Fallen wurden verwendet, um Partikel von einzelnen Atomen, Zellen etwa 10 um im Durchmesser erfassen. Zusätzlich wurde diese optische Fallen System in der Lage, Partikel in verschiedenen ...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Danksagungen
Diese Arbeit wurde vom Massachusetts General Hospital Department of Medicine Internal Funds (JMT, MKM, MLC, JMV), National Institute of Biomedical Imaging and Bioengineering gewähren T32EB006348 (CEC), Massachusetts General Hospital Center for Computational and Integrative Biology Fonds für die Entwicklung und AI062773 unterstützt ( RJH), Zuschüsse AI062773, DK83756 und DK 043351 (RJX), NSF 0643745 (MJL), NIH R21CA133576 (MJL) und National Institute of Allergy and Infectious Diseases (NIAID) der National Institutes of Health (NIH) AI057999 (JMV ). Wir danken Nicholas C. Yoder für hilfreiche Diskussionen und Charles Filze (RPI, Inc.) für die technische Unterstützung.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare (optional) |
|---|---|---|---|
| A. fumigatus | Albino-Stamm, B-5233/RGD12-8, Geschenk von KJ Kwon-Chung, NIH | ||
| C. albicans | SSY50-B-Mutante, Geschenk von Eleftherios Mylonakis, MGH, SC5314-Stamm, Geschenk von Gerald Fink, Whitehead Institute | ||
| Alexa Fluor 488 | Invitrogen | ± 20000 | |
| Alexa Fluor 647 | Invitrogen | A20006 | |
| Dimethylformamid | Sigma | D4551 | |
| Frisches Blut | Gift aus RJW Heath, MGH, HMS | ||
| Nikon inversen Mikroskop | Nikon | Modell Ti-E | |
| Trapping-Laser, ChromaLase | Blue Sky Research | CLAS-106-STF02-02 | |
| Fluoreszenz-Anregungs-Laser | Kohärent | Modell Innova 70C | |
| Breadboards zum Einfangen von Komponenten | Thorlabs | MB1224, MB1218 | |
| Optische Lufttisch | Technische Manufacturing Corporation | ||
| Elektronischer Verschluss mit Pedal | Uniblitz | Gekauft von Vincent Associates, Rochester, NY | |
| Singlemode Glasfaser | Oz Optics | PMJ-3S3S-1064-6 | |
| Fiber Stellungsregler | Thorlabs | PAF-X-5-C | |
| Faserkollimator | Oz Optics | HPUCO-23 bis 1064-P-25AC | |
| Objektive für Teleskop | Thorlabs | AC254-150-B | Brennweite von 150 mm |
| Übersetzung Stufen (x, y, z) | Newport | M-461-XYZ | |
| IR dichroitischen Spiegel | Chroma | ET750-sp-2P8 | |
| Objektiv (100X) | Nikon | NA = 1,49, Öl-Immersion, TIRF Ziel | |
| Konfokale Kopf | Yokogawa | CSU-XI | |
| Polarizer | Nikon | MEN51941 | |
| Wollaston-Prisma | Nikon | MBH76190 | |
| EM-CCD-Kamera | Hamamatsu | C9100-13 | |
| CCD-Kamera (ORCA ER) | Hamamatsu | C4742-80-12AG | |
| Filterrad | Ludl | 99A353 | |
| Filterrad | Sutter | LB10-NWE | |
| Chambered Deckglas | Lab-Tek/Nunc | 155409 | |
| Dynabeads | Invitrogen | 111-51D | Beschichtet mit anti-CD3 |
| Dulbecco modifiziertem Eagle-Medium (DMEM) | Invitrogen / Gibco | 10313 | |
| Penicillin / Streptomycin | Invitrogen / Gibco | 15140-122 | |
| L-Glutamin | Invitrogen / Gibco | 25030-081 | |
| Fetal Bovine Serum (HyClone) | ThermoScientific | SH30071.03 |
Referenzen
- Grakoui, A. The immunological synapse: A molecular machine controlling T cell activation. Science. 285, 221-227 (1999).
- Monks, C. R. Three-dimensional segregation of supramolecular activation clusters in T cells. Nature. 395, 82-86 (1998).
- Stuart, L. M., Ezekowitz, R. A. Phagocytosis and comparative innate immunity: Learning on the fly. Nat Rev Immunol. 8, 131-141 (2008).
- Neuman, K. C., Block, S. M. Optical trapping. Rev Sci Instrum. 75, 2787-2809 (2004).
- Ashkin, A. Optical trapping and manipulation of neutral particles using lasers. Proc Natl Acad Sci USA. 94, 4853-4860 (1997).
- Ashkin, A. Acceleration and trapping of particles by radiation pressure. Phys Rev Lett. 24, 156-159 (1970).
- Ashkin, A., Dziedzic, J. Optical trapping and manipulation of viruses and bacteria Science. Nature. 235, 1517-1520 (1987).
- Khalil, A. S. Single M13 bacteriophage tethering and stretching. Proc Natl Acad Sci USA. 104, 4892-4897 (2007).
- Khalil, A. S. Kinesin's cover-neck bundle folds forward to generate force. Proc Natl Acad Sci USA.. 105, 19247-19252 (2008).
- Li, Z. Membrane tether formation from outer hair cells with optical tweezers. Biophys J. , 1386-1395 (2002).
- Kim, S. The αβ T cell receptor is an anisotropic mechanosensor. J Biol Chem. 284, 31028-31028 (2009).
- Mohanty, S., Mohanty, K., Gupta, P. Dynamics of interaction of RBC with optical tweezers. Opt. Express. 13, 4745-4751 (2005).
- Tam, J. Control and manipulation of pathogens with an optical trap for live cell imaging of intercellular interactions. PLoS One. 5, e15215-e15215 (2010).
- Lin, S. J., Schranz, J., Teutsch, S. M. Aspergillosis case-fatality rate: Systematic review of the literature. Clin Infect Dis.. 32, 358-366 (2001).
- Wey, S. B. Hospital-acquired candidemia - the attributable mortality and excess length of stay. Arch. Intern. Med. 148, 2642-2645 (1988).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten