A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
השימוש מלכודת אופטית לחקר מארח הפתוגן אינטראקציות עבור הדמיה דינמי תא חי
In This Article
Summary
השיטה מתוארת בנפרד לבחור, לתפעל, ומזיקים התמונה לחיות באמצעות מלכודת אופטי מצמידים את מיקרוסקופ דיסק מסתובב. מלכודת אופטי מספק שליטה במרחב ובזמן של אורגניזמים ומקומות אותם סמוך לתאי המארח. מיקרוסקופ פלואורסצנטי לוכדת אינטראקציות אינטר דינמי עם הפרעה מינימלית תאים.
Abstract
תא דינמי הדמיה לחיות מאפשר ראיה ישירה בזמן אמת אינטראקציות בין תאים של המערכת החיסונית 1, 2, עם זאת, חוסר שליטה במרחב ובזמן בין תא חיידק phagocytic ויש שניתנו ממוקד תצפיות לתוך אינטראקציות התגובה הראשונית של המארח פתוגנים קשה. מבחינה היסטורית, אירועים לפנות אינטר כגון phagocytosis 3 כבר צילמו על ידי ערבוב של שני סוגי התאים, ולאחר מכן ברציפות סריקת השדה של נוף למצוא קשר אינטר סרנדיפי בשלב המתאים של אינטראקציה. אופי סטוכסטיים של אירועים אלה הופך את התהליך מייגע, וקשה לצפות באירועים מוקדם או חולף על קשר תאים תאים על ידי גישה זו. שיטה זו מחייבת מציאת זוגות סלולריים, כי הם על סף מגע, והתבוננות לפנות אותם עד שהם המושלם שלהם, או לא. כדי לענות על המגבלות האלה, אנו משתמשים השמנה אופטי כשיטה, לא פולשנית ולא הרסנית, אבל מהיר ויעיל למצב התאים בתרבית.
מלכודות אופטי, או פינצטה אופטית, מנוצלים ויותר המחקר הביולוגי כדי ללכוד פיסית לתפעל תאים אחרים מיקרון חלקיקים בגודל בשלושה ממדים 4. לחץ קרינה נצפתה הראשון ליישם מערכות פינצטה אופטית ב -1970 5, 6, ושימש הראשון לשלוט דגימות ביולוגיות בשנת 1987 7. מאז, פינצטה אופטית הבשילו לתוך הטכנולוגיה כדי לבחון מגוון של תופעות ביולוגיות 8-13.
אנו מתארים שיטה 14 כי ההתקדמות לחיות הדמיה התא על ידי שילוב של מלכודת אופטי עם דיסק מסתובב מיקרוסקופיה confocal עם בקרת טמפרטורה ולחות כדי לספק שליטה במרחב ובזמן מעולה של אורגניזמים פתוגניים בסביבה פיזיולוגיים כדי להקל על אינטראקציות עם תאים המארח, כפי שנקבע על ידי המפעיל. Live, אורגניזמים פתוגניים כמו קנדידה אלביקנס, אספרגילוס fumigatus, אשר יכול לגרום פוטנציאל קטלני, זיהומים פולשניים בקרב אנשים immunocompromised 15, 16 (למשל איידס, כימותרפיה, השתלת איברים לחולים), היו לכודים אופטית באמצעות שאינו הרסני בעוצמות לייזר ועבר סמוך מקרופאגים, אשר יכול phagocytose את הפתוגן. רזולוציה גבוהה, המשודר בסרטים אור פלואורסצנטי מבוססי הקים את היכולת להתבונן באירועים הראשונים של phagocytosis בתאים חיים. כדי להדגים את תחולתם רחבה באימונולוגיה, העיקרי מתאי T נלכדו גם מניפולציות כדי ליצור סינפסות עם אנטי CD3 microspheres מצופה in vivo, וגם זמן לשגות הדמיה של היווצרות הסינפסה הושג גם. על ידי מתן שיטה להפעיל שליטה מרחבית קנס של פתוגנים לחיות ביחס תאים חיסוניים, אינטראקציות הסלולר יכול להיות שנתפסו על ידי מיקרוסקופ פלואורסצנטי עם הפרעה מינימלית תאים יכולה להניב תובנה עוצמה לתוך התגובות המוקדמות של חסינות מולדת ובעלי כושר הסתגלות.
Protocol
1. תרבות תנאים של פתוגנים עבור השמנה אופטי
- לגדול א fumigatus (B-5233/RGD12-8) על חצי מוצק מדיה אגר המכיל SBD (Sabouraud דקסטרוז) בשעה 30 ° C במשך 3 ימים.
- לגדול C. אלביקנס (SC5314) ב YPD (שמרים, Peptone דקסטרוז) תרבות נוזל המכיל 100 מיקרוגרם / מ"ל אמפיצילין לילה חממה שייקר ב 30 ° C.
2. הכנה של פתוגנים תיוג פלורסנט
- קציר כמות רצויה של פתוגנים להעביר צינור 1.5 תגובה מ"ל.
- הוספת 300 μL של פוספט שנאגרו מלוחים (PBS) אל צינור התגובה.
- Sonicate התערובת למשך 30 שניות.
- צנטריפוגה בסל"ד 4000 למשך 1 דקה.
- לשאוב supernatant, עוזב גלולה באין מפריע.
- חזור על (2.4) ו (2.5) עוד פעמיים.
- Resuspend ב 500μL של PBS.
3. תיוג של פתוגנים עם צבע פלואורסצנטי
- ממיסים 1 מ"ג של צבע של עניין (למשל אלקסה פלואוריד 488, Alexa פלואוריד 647) ב dimethylformamide 100 μL (DMF) (בריכוז של 10 מ"ג / מ"ל).
- הוסף 3 μL תערובת של צבען צינורות התגובה המכיל פתוגנים שטף.
- סיבוב או להתנער מדגם ב 37 מעלות צלזיוס במשך שעה 1.
- לשטוף עם מדגם PBS 3X ידי centrifuging בסל"ד 4000 למשך 1 דקה.
- Resuspend ב 300 μL של PBS.
4. מסיק T-תאים מהדם כולו
- השג דם שלם (טרי).
- דם חם, PBS + 2% עוברית שור בסרום (FBS), ו histopaque לטמפרטורת החדר.
- הוסף CD4 + RosetteSep האדם העשרה T קוקטייל נייד ב μL 50 / מ"ל של דם מלא.
- סובב מדגם דגירה במשך 20 דקות בטמפרטורת החדר.
- מדולל מדגם עם נפח שווה של PBS + 2% FBS ומערבבים בעדינות.
- שכבה מדוללת מדגם על גבי histopaque, מזעור ערבוב
- צנטריפוגה במשך 20 דקות ב 1200 XG בטמפרטורת החדר עם הבלם משם.
- הסרת תאים מועשר.
- לשטוף את התאים מועשר 2x עם פתרון PBS + FBS 2%.
- Lyse כדוריות דם אדומות למשך 2 דקות עם תא דם אדום חיץ lysing
- הוסף 10 מ"ל של PBS + 2% FBS ו lysed צנטריפוגות אדום דם תאים בסל"ד 1500 למשך 5 דקות
- לשאוב supernatant, נזהר לא להפריע גלולה
- Resuspend בתקשורת IMDM המכיל 10% בסרום שור העובר
5. הכנת 264.7 מקרופאגים הגלם לתוך שקופיות קאמרית
- הכן DMEM (מדיום שונה Dulbecco של הנשרים) להכיל 10% FBS, 1% פניצילין / סטרפטומיצין, ו 1% L-גלוטמין.
- מדיה חמים, טריפסין, ו pbs באמבט חם 37 ° C.
- לשטוף 2x צלחת עם PBS
- לשאוב PBS בין לשטוף כל אחד.
- הוסף 5 מ"ל טריפסין לצלחת כדי לכסות את פני השטח (עבור צלחת 10 ס"מ תרבות רקמות).
- דגירה של 5 דק 'ב 37 ° C.
- לדפוק בעדינות לצד הצלחת לנתק את התאים מפני השטח צלחת. היזהר לא להתיז טריפסין מחוץ לצלחת.
- הוסף 5 מ"ל או כמות זהה של התקשורת טריפסין.
- לשאוב תערובת לתוך צינור התגובה.
- צנטריפוגה XG ב 1000 במשך 3 דקות.
- לשאוב התקשורת, נזהר לא להפריע גלולה.
- Resuspend ב 10 מ"ל של התקשורת.
- הוספת 400 μL של התקשורת לתא אחד של השקופית קאמרית.
- הוסף 5 μL ההשעיה תא לתא אחד.
- לגדול בין לילה באינקובטור ב 37 מעלות צלזיוס עם 5% CO 2.
6. תוספת של פתוגנים לדגום
- Pipet μL 5-10 של פתוגנים שכותרתו עניין (מ צעדים 1-3) אל תוך החדר.
- מערבבים היטב על ידי pipeting למעלה ולמטה, נזהר שלא לגעת בקרקעית של החדר להפריע מקרופאגים דבק.
7. טוען מדגם על ספינינג מיקרוסקופ דיסק confocal (וידאו, סריקה באמצעות רכיבים)
- הפעל את כל הרכיבים על ספינינג מיקרוסקופ דיסק confocal.
- יישר מיקרוסקופ הדמיה DIC.
- הסר שקופיות קאמרית מן החממה.
- הוסף שקף קאמרית לשלב מיוחדים.
- הסרת החלק העליון של השקופית קאמרית (הכרחי הדמיה DIC).
8. הכנה השמנה אופטי (וידאו, סריקה באמצעות רכיבים איך זה להשתלב מיקרוסקופ)
- הפעל את תריס עבור מלכודת אופטית.
- הפעלת IR לייזר.
- תריס פתוח (על הלייזר) מלכודת אופטית.
- אשר תריס מול IR לייזר סגור על ידי סימון עם כרטיס IR.
9. בחירה מניפולציה של הפתוגן עם מלכודת אופטית
- פוקוס על מקרופאגים בשקופית דבק.
- מצא פתוגנים תנודות בחופשיות פתרון הסמוכים מקרופאגים.
- העבר בשלב כזה הפתוגן הוא בקרבת המלכודת.
- פתיחת תריס להעסיק את מלכודת.
- העבר מדגם להביא מקרופאגים במגע עם המלכודת נייחped הפתוגן.
- תמונה עם דיסק מסתובב מיקרוסקופ confocal, לא DIC, הקרינה, או שילוב של שניהם. בדרך כלל, השמנה נעשית DIC, בזמן אמת הדמיה נעשה עם פלואורסצנטי.
10. נציג תוצאות:
כדי להפעיל שליטה במרחב ובזמן מלא של פתוגנים וחרוזים ב in vivo ו בסביבה חוץ גופית, עיצבנו מנגנון שהותקן השמנה משולב על גבי מיקרוסקופ דיסק ספינינג confocal (סכמטי באיור. 1). במלוא העוצמה, לייזר סיפק 350 מגוואט של חשמל לאחר צימוד האור עם רכיבים אופטיים שונים במנגנון מלכודת אופטית, ~ 80 mW של כוח על המטרה TIRF, כפי שנמדד עם מד כוח, שימש בצורת מלכודת בחדר.
על מנת עמדה חפץ בחדר יחסי האובייקט לכודים, בשלב הועבר תוך כדי החזקת חפץ נייח עם לכודים לייזר השמנה. בשלב הועבר במהירויות די איטי, כך כוח הגרר על החלקיקים הלכודים לא יעלה על כוח השמנה מקסימלית.
אוכלוסיות נפרדות של C. albicans (גודל טיפוסי - ~ 5 מיקרומטר) תויגו עם כל אחד משלושת הצבעים (AF488, AF568, ו AF647, המתאים ירוק, כחול, אדום באיור, בהתאמה) כדי להמחיש הדמיה עם ערוצי הקרינה מרובים ובמקביל אופטית השמנה הפתוגן. יחיד ג אלביקנס נלכד ועבר בדפוס מרובע באמצעות מקבץ של שמרים אחרים, כפי שעולה חצי אפור, הוכחת את היכולת ללכוד ולתפעל את המיקום הספציפי של הפתוגן יחיד שנבחר על ידי המפעיל גם בסביבה צפופה (איור 2 א) .
כדי להמחיש עוד יותר את הגמישות של מערכת זו כדי ללכוד את הצורה מורפולוגיות שונות הוצגו על ידי אורגניזמים פתוגניים, פינצטה אופטית גם היה מסוגל להחזיק למקם ג אלביקנס חלקיק עם pseudohyphae. ג אלביקנס שכותרתו עם AF647 (אדום) היה נע לאורך מסלול כפי שתואר על ידי החץ הלבן והניח ליד התאים GFP-LC3-RAW ניאון (איור 2B). החלק שמרים של C. אלביקנס נלכד כמו pseudohyphae השתרך.
אנו ממוקמים גם אספרגילוס fumigatus ליד תא עכבר RAW macrophage על מנת לנתח את מסגרת הזמן המוחלט של phagocytosis עם הקו הזה תא הפתוגן מסוים (איור 3A). לאחר הפתוגן יוצר קשר עם התא, המלכודת כבוי, ואת זמן לשגות הדמיה מועסק לצפות אירועים הסלולר עוקבות (איור 3B). מלכודת אופטי שימש גם כדי ללכוד העיקרי T-תאים מבודדים מהדם וביים הסמוכים חרוזים מצופים נוגדני אנטי CD3 על מנת תא-T כדי ליצור הסינפסה האימונולוגית עם חרוז (איור 4), המופע נוספים צדדיות ישירות מלכודת מניפולציה בתאי מערכת החיסון.
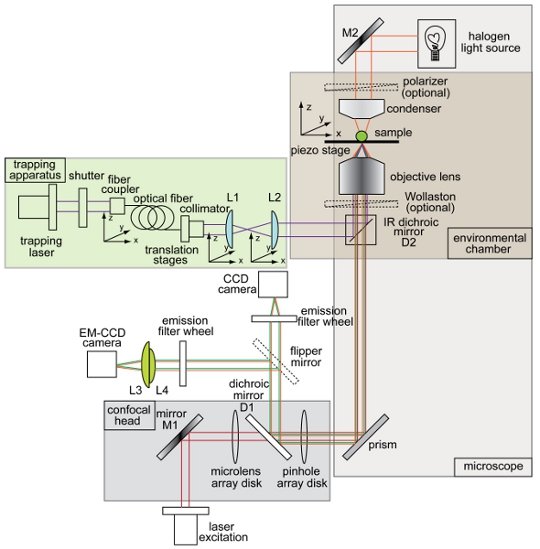
באיור 1. סקירה כללית סכימטי של מלכודת אופטי משולב ספינינג דיסק ההתקנה confocal מיקרוסקופ. כלי הפריסה מראה את הקורה השמנה (סגול), דרך תאורה עבור brightfield הדמיה (כתום), קרן עירור פלואורסצנטי (אדום), פליטת הקרינה (ירוק), תשלום מצמידים התקן (CCD) המצלמה, אלקטרונים הכפלת מכשיר תשלום מצמידים (EM- CCD) המצלמה, מראות dichroic (D1 ו-D2), מראות (M1 ו M2), ועדשות (L1, L2, L3, L4). כל הרכיבים האחרים של המערכת confocal מלכודת מיקרוסקופ מסומנים בתרשים.
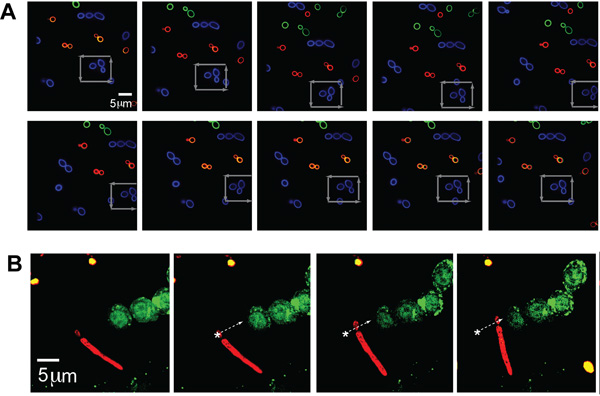
איור 2. (א) תמונות של הקרינה לכודים מניפולציות ג אלביקנס. לכודים fluorescently שכותרתו (אלקסה פלואוריד 488 (AF488), כחול) האורגניזם בשטח של כ fluorescently שכותרתו אחרים אלביקנס (AF568, ירוק AF647, אדום). הבמה נע סביב החלקיקים הלכודים, CA כחול כפי שצוין על ידי החצים אפור. (ב) לכודים פסאודו hyphal צורה של C. אלביקנס ליד תא GFP LC3-RAW. טופס psuedohyphal שכותרתו fluorescently של CA (אדום, AF647) לכודים אופטית ועבר סמוך GFP-LC3 הביע מקרופאגים RAW. האורגניזם CA הוא נע לאורך מסלול כפי שצוין על ידי החץ הלבן.

איור 3. השמנה ומיצוב של א ' fumigatus ליד תא RAW phagocytic. (א) brightfield תמונות של א 'לכוד fumigatus, כפי שצוין על ידי החץ הלבן, עברה ואת מיקומו לאורך השביל כפי שצוין על ידי החץ האדום. הפתוגן לכודים מעט מחוץ לפוקוס בגלל המלכודת דוחפים את האורגניזם מעט מעל המטוס מוקד א. fumigatus מועבר עד ממוקמת סמוך לתא הגלם המבוקש. (ב) שפעתהדמיה של orescence phagocytosis א fumigatus על ידי תא RAW. לאחר הפתוגן לכודים ממוקם ליד תא הגלם, תהליך phagocytosis מופעל. בשעה 30 s, הממברנה של התא RAW מתחיל לשנות צורה כוס סביב החלקיקים. בשעה 60 s, כוס נוצר במלואו. מ -90 ל 150s, א ' fumigatus נבלע, ועל ידי 180 s, החלקיק מופנם במלואו

איור 4. השמנה העיקרי T-cell כדי ליצור סינפסה עם אנטי CD3 חרוזים מצופים. DIC תמונות של ראשוני T-cell עבר על ידי מלכודת אופטית למיקום ליד מצופה חרוז עם נוגדן אנטי CD3. לאחר מכן התא מהווה סינפסה החיסונית, אשר לא ניתן להבחין בקלות את התמונות.
Access restricted. Please log in or start a trial to view this content.
Discussion
בעבודה זו אנו משתמשים מלכודת אופטי ללכוד פתוגנים עם ממדים בין 3 מיקרומטר - 5 מיקרומטר. אמנם פתוגנים עניין במעבדה שלנו בדרך כלל יש ממדים אלה, מערכת פינצטה אופטית המתוארת כאן היא גמישה ללכוד מגוון רחב של גדלים. ואכן מלכודות אופטיות שימשו כדי ללכוד חלקיקים הנעים בין אטומי...
Access restricted. Please log in or start a trial to view this content.
Disclosures
Acknowledgements
עבודה זו נתמכה על ידי החולים הכללי במסצ'וסטס מחלקת קופות לרפואה פנימית (JMT, MKM, MLC, JMV), המכון הלאומי הדמיה ביו Bioengineering מענק T32EB006348 (CEC), המרכז הכללי של מסצ'וסטס של החולים לקרן חישובית אינטגרטיבית פיתוח ביולוגיה AI062773 ( RJH), מענקים AI062773, DK83756 ו DK 043,351 (RJX), NSF 0,643,745 (MJL), NIH R21CA133576 (MJL), ואת המכון הלאומי לאלרגיה ומחלות זיהומיות (NIAID) של המכון הלאומי לבריאות (NIH) AI057999 (JMV ). אנו מודים ניקולס C. Yoder לדיונים מועיל, צ'רלס פלטס (RPI, Inc) לקבלת סיוע טכני.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | מספר קטלוגי | הערות (אופציונלי) |
|---|---|---|---|
| א fumigatus | זן אלבינו, B-5233/RGD12-8, מתנה KJ Kwon-Chung, NIH | ||
| C. albicans | SSY50-B מוטציה, מתנה אלפתריוס Mylonakis, MGH; SC5314 זן, מתנה ג'רלד פינק, וייטהד במכון | ||
| אלקסה פלואוריד 488 | Invitrogen | A20000 | |
| אלקסה פלואוריד 647 | Invitrogen | A20006 | |
| dimethylformamide | סיגמא | D4551 | |
| דם טרי | מתנה RJW הית, MGH, HMS | ||
| Nikon הפוכה מיקרוסקופ | ניקון | דגם TI-E | |
| לייזר השמנה, ChromaLase | מחקר Blue Sky | CLAS-106-02-STF02 | |
| עירור פלואורסצנטי לייזר | קוהירנט | דגם Innova 70C | |
| Breadboards עבור רכיבים השמנה | Thorlabs | MB1224, MB1218 | |
| שולחן אופטי אוויר | טכני ייצור Corporation | ||
| תריס שליטה אלקטרונית עם דוושת | Uniblitz | שנרכשו וינסנט Associates, רוצ'סטר, ניו יורק | |
| Singlemode סיב אופטי | עוז אופטיקה | PMJ-3S3S-1064-6 | |
| סיבים positioner | Thorlabs | PAF-X-5-C | |
| סיבים collimator | עוז אופטיקה | HPUCO-23-1064-P-25AC | |
| עדשות עבור טלסקופ | Thorlabs | AC254-150-B | אורך מוקד של 150 מ"מ |
| תרגום שלבים (x, y, z) | ניופורט | M-461-XYZ | |
| IR dichroic במראה | Chroma | ET750-SP-2p8 | |
| המטרה העדשה (100x) | ניקון | NA = 1.49, טבילה שמן, המטרה TIRF | |
| Confocal ראש | Yokogawa | CSU-XI | |
| מקטב | ניקון | MEN51941 | |
| וולאסטון פריזמה | ניקון | MBH76190 | |
| EM-CCD המצלמה | Hamamatsu | C9100-13 | |
| מצלמת CCD (ORCA ER) | Hamamatsu | C4742-80-12AG | |
| סנן גלגל | Ludl | 99A353 | |
| סנן גלגל | סאטר | LB10-NWE | |
| החדרים coverglass | Lab-Tek/Nunc | 155409 | |
| Dynabeads | Invitrogen | 111-51D | מצופה עם אנטי CD3 |
| שונה Dulbecco הנשר של המדיום (DMEM) | Invitrogen / Gibco | 10313 | |
| פניצילין / סטרפטומיצין | Invitrogen / Gibco | 15140-122 | |
| L-גלוטמין | Invitrogen / Gibco | 25030-081 | |
| עוברית שור סרום (HyClone) | ThermoScientific | SH30071.03 |
References
- Grakoui, A. The immunological synapse: A molecular machine controlling T cell activation. Science. 285, 221-227 (1999).
- Monks, C. R. Three-dimensional segregation of supramolecular activation clusters in T cells. Nature. 395, 82-86 (1998).
- Stuart, L. M., Ezekowitz, R. A. Phagocytosis and comparative innate immunity: Learning on the fly. Nat Rev Immunol. 8, 131-141 (2008).
- Neuman, K. C., Block, S. M. Optical trapping. Rev Sci Instrum. 75, 2787-2809 (2004).
- Ashkin, A. Optical trapping and manipulation of neutral particles using lasers. Proc Natl Acad Sci USA. 94, 4853-4860 (1997).
- Ashkin, A. Acceleration and trapping of particles by radiation pressure. Phys Rev Lett. 24, 156-159 (1970).
- Ashkin, A., Dziedzic, J. Optical trapping and manipulation of viruses and bacteria Science. Nature. 235, 1517-1520 (1987).
- Khalil, A. S. Single M13 bacteriophage tethering and stretching. Proc Natl Acad Sci USA. 104, 4892-4897 (2007).
- Khalil, A. S. Kinesin's cover-neck bundle folds forward to generate force. Proc Natl Acad Sci USA.. 105, 19247-19252 (2008).
- Li, Z. Membrane tether formation from outer hair cells with optical tweezers. Biophys J. , 1386-1395 (2002).
- Kim, S. The αβ T cell receptor is an anisotropic mechanosensor. J Biol Chem. 284, 31028-31028 (2009).
- Mohanty, S., Mohanty, K., Gupta, P. Dynamics of interaction of RBC with optical tweezers. Opt. Express. 13, 4745-4751 (2005).
- Tam, J. Control and manipulation of pathogens with an optical trap for live cell imaging of intercellular interactions. PLoS One. 5, e15215-e15215 (2010).
- Lin, S. J., Schranz, J., Teutsch, S. M. Aspergillosis case-fatality rate: Systematic review of the literature. Clin Infect Dis.. 32, 358-366 (2001).
- Wey, S. B. Hospital-acquired candidemia - the attributable mortality and excess length of stay. Arch. Intern. Med. 148, 2642-2645 (1988).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved