É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Uso de uma armadilha óptica de Estudos de Interações Hospedeiro-Patógeno para imagens de células dinâmica ao vivo
Neste Artigo
Resumo
Um método é descrito para selecionar individualmente, manipular e patógenos imagem ao vivo usando uma armadilha óptica acoplada a um microscópio disco giratório. A armadilha óptica fornece controle espacial e temporal dos organismos e os coloca ao lado células hospedeiras. Microscopia de fluorescência captura dinâmica interações intercelulares com perturbação mínima para as células.
Resumo
Imagens de células ao vivo dinâmica permite a visualização direta de tempo-real interações entre as células do sistema imunitário 1, 2, no entanto, a falta de controle espacial e temporal entre a célula fagocítica e micróbio tornou foco observações sobre a interação inicial de resposta do hospedeiro a patógenos difícil. Historicamente, os eventos de contato intercelular tais como fagocitose 3 foram fotografadas pela mistura de dois tipos de células, e depois continuamente digitalização do campo de visão para encontrar serendipitous contatos intercelulares no estágio apropriado de interação. A natureza estocástica desses eventos torna este processo tedioso, e é difícil de observar eventos cedo ou fugazes em contato célula-célula por esta abordagem. Este método requer encontrar pares de células que estão à beira de contato, e observá-los até que entre em contato com consumado, ou não. Para lidar com essas limitações, nós usamos a captura óptica como um método não invasivo, não-destrutivo, mas rápido e eficaz para a posição células em cultura.
Armadilhas ópticas, ou pinças ópticas, estão cada vez mais utilizados em pesquisa biológica para capturar e manipular fisicamente as células e outros micro-empresas partículas em três dimensões 4. Pressão de radiação foi observada pela primeira vez e aplicada a sistemas de pinça óptica em 1970 5, 6, e foi usado pela primeira vez para controlar espécimes biológicos em 1987 7. Desde então, a pinça óptica amadureceram em uma tecnologia para sondar uma variedade de fenômenos biológicos 13/08.
Nós descrevemos um método de 14 que avanços ao vivo imagens de células através da integração de uma armadilha óptica com spinning microscopia confocal de disco com controle de temperatura e umidade para fornecer controle espacial e temporal requintada de organismos patogênicos em um ambiente fisiológico para facilitar a interação com células hospedeiras, como determinado pelo operador. Live, organismos patogênicos, como Candida albicans e Aspergillus fumigatus, que pode causar potencialmente letal, infecções invasivas em indivíduos imunocomprometidos 15, 16 (por exemplo, AIDS, quimioterapia e transplante de órgãos doentes), foram presos opticamente usando intensidades não-destrutivo a laser e mudou-se junto ao macrófagos, o que pode fagocitam o patógeno. De alta resolução, transmitido filmes de luz e de fluorescência baseada estabelecida a capacidade de observar os primeiros eventos de fagocitose em células vivas. Para demonstrar a ampla aplicabilidade em imunologia, principais células T também foram presos e manipulados para formar sinapses com anti-CD3 microesferas revestidas in vivo, e lapso de tempo de imagem de formação de sinapses também foi obtida. Ao fornecer um método para exercer o controle de patógenos espaciais bem viver com respeito às células imunológicas, as interações celulares podem ser capturados por microscopia de fluorescência com perturbação mínima para as células e pode render uma visão poderosa em respostas iniciais de imunidade inata e adaptativa.
Protocolo
1. Condições de cultivo de patógenos para a captura óptica
- Crescer A. fumigatus (B-5233/RGD12-8) em uma mídia semi-sólido de ágar contendo SBD (Sabouraud dextrose) a 30 ° C durante 3 dias.
- Crescer C. albicans (SC5314) em YPD (Yeast-peptona Dextrose) de cultura líquido contendo 100 mg / mL ampicilina durante a noite em uma incubadora shaker a 30 ° C.
2. Preparação de agentes patogênicos para a rotulagem fluorescentes
- Colheita desejada quantidade de patógenos e transferir para um tubo de reação 1,5 mL.
- Adicionar mL 300 de tampão fosfato (PBS) ao tubo de reação.
- Sonicate mistura por 30 segundos.
- Centrifugar a 4000 rpm por 1 minuto.
- Aspirar o sobrenadante, deixando pellet imperturbável.
- Repita (2.4) e (2,5) mais duas vezes.
- Ressuspender em 500μL de PBS.
3. Rotulagem de patógenos com corante fluorescente
- Dissolver 1 mg de corante de interesse (por exemplo, Alexa Fluor 488, Alexa Fluor 647) em 100 mL dimetilformamida (DMF) (concentração de 10 mg / mL).
- Adicionar 3 mL da mistura de corante para tubos de reação contendo patógenos lavada.
- Girar ou agitar amostra a 37 ° C por 1 hora.
- Lavar amostra com PBS 3X por centrifugação a 4000 rpm por 1 minuto.
- Ressuspender em 300 mL de PBS.
4. A colheita de células T do sangue total
- Obtenção de sangue total (fresco).
- Sangue quente, PBS + 2% de soro fetal bovino (FBS), e Histopaque à temperatura ambiente.
- Adicionar CD4 + T RosetteSep Human Enrichment Cocktail celular a 50 mL / mL de sangue total.
- Rode a amostra e incubar por 20 minutos em temperatura ambiente.
- Diluir a amostra com igual volume de PBS + 2% de SFB e misture delicadamente.
- Camada de amostra diluída em cima do Histopaque, minimizando mistura
- Centrifugar por 20 minutos a 1200 xg à temperatura ambiente com o freio.
- Remover as células enriquecido.
- Lavar as células com PBS enriquecido 2x + solução FBS 2%.
- Lisar as células vermelhas do sangue durante 2 minutos com vermelho tampão de lise de glóbulos
- Adicionar 10 mL de PBS + 2% de SFB e lisadas centrífuga células vermelhas do sangue a 1500 rpm por 5 minutos
- Aspirar o sobrenadante, cuidado para não perturbar o pellet
- Ressuspender em media IMDM contendo 10% de soro fetal bovino
5. Preparação de macrófagos RAW 264,7 em slides câmara
- Prepare DMEM (meio modificado Dulbecco Eagle) para conter 10% de SFB, 1% de penicilina / estreptomicina, e 1% L-glutamina.
- Media quente, tripsina e PBS em banho quente a 37 ° C.
- Lavar 2x placa com PBS
- Aspirar PBS entre cada lavagem.
- Adicionar 5 mL de tripsina a placa de cobertura da superfície (para a 10 centímetros placa de cultura de tecidos).
- Incubar por 5 min a 37 ° C.
- Suavemente knock lado da placa para retirar as células da superfície da placa. Tenha cuidado para não espirrar tripsina fora do prato.
- Adicionar 5 mL ou quantidade equivalente de mídia para tripsina.
- Aspirar a mistura em um tubo de reação.
- Centrifugar a 1000 xg por 3 minutos.
- Media aspirado, cuidado para não perturbar o sedimento.
- Ressuspender em 10 ml de mídia.
- Adicionar 400 mL de mídia para cada uma das câmaras do slide câmara.
- Adicionar 5 mL de suspensão celular para cada câmara.
- Crescer durante a noite em estufa a 37 ° C com 5% de CO 2.
6. Além de patógenos para amostra
- Pipete 10/05 de patógenos rotulados de interesse (dos passos 1-3) na câmara.
- Misturar bem por pipetagem cima e para baixo, cuidado para não tocar o fundo da câmara de perturbar os macrófagos aderidos.
7. Carregamento de amostras para spinning microscópio confocal de disco (em vídeo, digitalização através de componentes)
- Ligue todos os componentes para spinning microscópio confocal de disco.
- Microscópio para alinhar imagens DIC.
- Remover slide câmara da incubadora.
- Inserir slides em câmara de estágio especializado.
- Remover topo da câmara de corrediça (necessário para geração de imagens DIC).
8. Preparação para a captura óptica (em vídeo, digitalização através de componentes e como ele é integrado em microscópio)
- Ligue obturador para armadilha óptica.
- Ligue IR laser.
- Obturador aberto (no laser) para armadilha óptica.
- Confirmar obturador na frente de IR laser é fechado, verificando com cartão de IR.
9. Seleção e manipulação de patógeno com armadilha óptica
- Concentre-se em macrófagos no slide aderido.
- Encontrar patógenos livremente flutuante em solução adjacente a macrófagos.
- Mova estágio tal que o patógeno é nas proximidades da armadilha.
- Obturador aberto e se engajar na armadilha.
- Mova amostra para trazer macrófagos em contato com a armadilha estacionáriapatógeno ped.
- Imagem com spinning microscópio confocal de disco, seja em DIC, fluorescência, ou combinação de ambos. Tipicamente, prendendo é feito em DIC, e imagens em tempo real é feita com fluorescência.
10. Resultados representativos:
Para exercer o controle espacial e temporal total de patógenos e contas em um in vivo e in vitro ambiente, nós projetamos um aparelho de captura custom-built integrados em um microscópio confocal disco giratório (esquemático mostrado na Figura 1.). Em plena força, o laser forneceu 350 mW de potência e após o acoplamento da luz com os diversos componentes ópticos no aparelho de armadilha óptica, ~ 80 mW de potência, no objetivo TIRF, medida com um medidor de potência, foi usado para formar a armadilha na câmara.
, A fim de posicionar um objeto na câmara em relação ao objeto preso, o palco foi movido, mantendo o objeto preso estável, com o laser de aprisionamento. O palco foi movido em velocidades lentas o suficiente, de modo que a força de arrasto sobre a partícula preso não exceder a força máxima armadilhas.
Populações separadas de C. albicans (tamanho típico - ~ 5 mm) foram marcados com cada uma das três cores (AF488, AF568, AF647 e, correspondente ao verde, azul e vermelha na figura, respectivamente) para ilustrar de imagem com múltiplos canais de fluorescência ao mesmo tempo visualmente prendendo o patógeno. A única C. albicans foi preso e transferido em um padrão quadrado por meio de um aglomerado de outra levedura, conforme indicado pelas setas cinza, demonstrando a capacidade de capturar e manipular a localização específica de um único patógeno escolhido pelo operador mesmo em um ambiente aglomerado (Fig. 2A) .
Para ilustrar ainda mais a flexibilidade deste sistema para prender as morfologias forma diferente exibido por organismos patogênicos, a pinça óptica também foi capaz de segurar e situar um C. albicans de partículas com um pseudo. O C. albicans rotulados com AF647 (vermelho) foi movido ao longo de uma trajetória descrita pela seta branca e colocado ao lado de células GFP-LC3-RAW fluorescente (Fig. 2B). A porção de fermento da C. albicans foi preso como o pseudo arrastou junto.
Nós também posicionados Aspergillus fumigatus ao lado de uma célula do rato macrófagos RAW, a fim de analisar a estrutura de tempo absoluto de fagocitose com esta linha celular particular e patógeno (Fig. 3A). Uma vez que o patógeno entra em contato com a célula, a armadilha é desligado, e lapso de tempo de imagem é utilizado para observar os eventos subseqüentes celular (Fig. 3B). A armadilha óptica também foi usado para captação primária células T isoladas do sangue e dirigido adjacentes aos grânulos revestidos com anticorpo anti-CD3 para que as células T para formar uma sinapse imunológica com o talão (Fig. 4), mostram o adicional versatilidade diretamente armadilha e manipular células imunitárias.
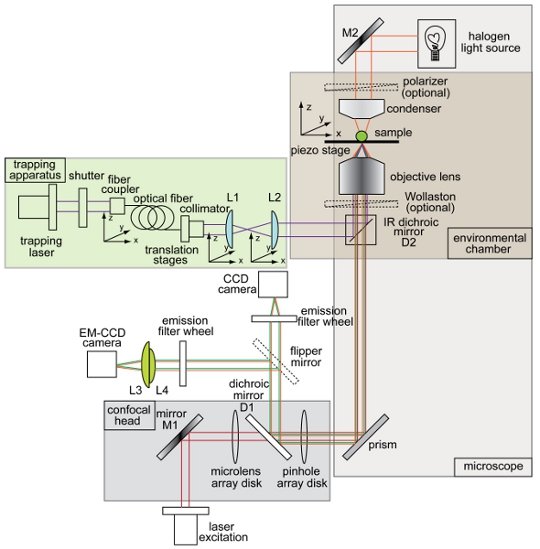
Figura 1. Descrições e esquemática de armadilha óptica combinada e girando disco de instalação do microscópio confocal. Layout do instrumento mostrando o feixe de captura (roxo), caminho para a iluminação de campo claro de imagem (laranja), feixe de excitação de fluorescência (vermelho), emissão de fluorescência (verde), charge-coupled device (CCD) da câmera, elétron-multiplicando dispositivo de carga acoplado (EM- CCD da câmera), espelhos dicróicos (D1 e D2), espelhos (M1 e M2) e lentes (L1, L2, L3, L4). Todos os outros componentes do sistema de microscópio confocal armadilha são rotulados na figura.
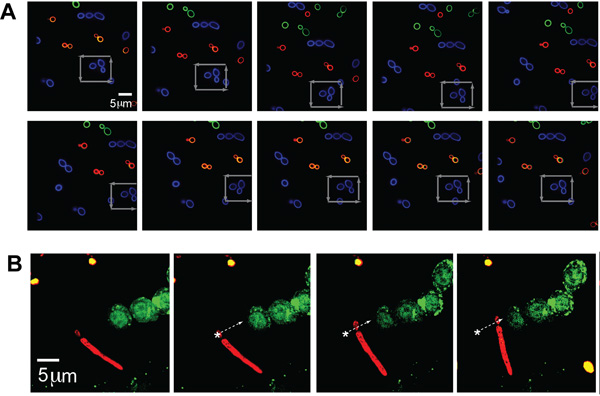
Figura 2. (A) imagens de fluorescência de presos e manipulados C. albicans. Um preso fluorescente marcado organismo (Alexa Fluor 488 (AF488), azul) em um campo de outros C. fluorescente marcado albicans (AF568, AF647 verde e vermelho). O estágio é movido em torno da partícula presa CA, azul, conforme indicado pelas setas cinza. (B) Preso forma pseudo-hifas de C. albicans ao lado de GFP-LC3 células RAW. Fluorescente etiquetado forma psuedohyphal de CA (vermelho, AF647) opticamente preso e mudou-se junto ao GFP-LC3 expressa macrófagos RAW. O organismo CA é movido ao longo da trajetória como indicado pela seta branca.

Figura 3. Trapping e posicionamento de A. fumigatus ao lado de uma célula fagocitária RAW. (A) Brightfield imagens de um preso A. fumigatus, como indicado pela seta branca, movido e posicionado ao longo do caminho, como indicado pela seta vermelha. O patógeno é preso ligeiramente fora de foco devido à armadilha empurrando o organismo ligeiramente acima do plano focal. A. fumigatus é movido até que ele é colocado ao lado da célula desejada RAW. (B) Fluimagem orescence de fagocitose de A. fumigatus por célula RAW. Após o patógeno preso é colocado próximo a uma célula RAW, o processo de fagocitose é ativado. Em 30 s, a membrana da célula RAW começa a mudar e formar um copo ao redor da partícula. Em 60 s, o copo está completamente formado. De 90 a 150s, a A. fumigatus é engolida, e por 180 s, a partícula é totalmente internalizado

Figura 4. Trapping primários de células T para formar sinapses com anti-CD3 grânulos revestidos. DIC imagens de um primário de células T movido pela armadilha óptica para uma posição ao lado de um cordão revestido com anticorpo anti-CD3. A célula, então, forma uma sinapse imunológica, que não pode ser facilmente percebido nas imagens.
Access restricted. Please log in or start a trial to view this content.
Discussão
Neste trabalho nós usamos uma armadilha óptica para capturar patógenos com dimensões entre 3 mm - 5 mm. Apesar de patógenos de interesse para o nosso laboratório normalmente têm estas dimensões, o sistema de pinça óptica aqui descrito é flexível para capturar uma grande variedade de tamanhos. Na verdade armadilhas ópticas têm sido usados para capturar partículas que variam de átomos individuais para as células de aproximadamente 10 m de diâmetro. Além disso, este sistema de captura óptica foi c...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Agradecimentos
Este trabalho foi financiado pelo Massachusetts General Hospital Departamento de Fundos de Medicina Interna (JMT, MKM, MLC, JMV), Instituto Nacional de Imagem Biomédica e Bioengenharia conceder T32EB006348 (CEC), Centro de Massachusetts General Hospital para financiar Computacional e Integrative Biology desenvolvimento e AI062773 ( rjh), concede AI062773, DK83756, e DK 043351 (RJX), NSF 0.643.745 (MJL), NIH R21CA133576 (MJL), e Instituto Nacional de Alergia e Doenças Infecciosas (NIAID) dos Institutos Nacionais de Saúde (NIH) AI057999 (JMV ). Agradecemos a Nicholas C. Yoder para discussões úteis, e Charles Felts (RPI, Inc.) para obter assistência técnica.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários (opcional) |
|---|---|---|---|
| A. fumigatus | Tensão Albino, B-5233/RGD12-8, dom de KJ Kwon-Chung, NIH | ||
| C. albicans | SSY50-B mutante, presente de Eleftherios Mylonakis, MGH; SC5314 tensão, presente de Gerald Fink, Whitehead Institute | ||
| Alexa Fluor 488 | Invitrogen | A20000 | |
| Alexa Fluor 647 | Invitrogen | A20006 | |
| dimetilformamida | Sigma | D4551 | |
| Sangue fresco | Dom de RJW Heath, MGH, HMS | ||
| Nikon microscópio invertido | Nikon | Modelo Ti-E | |
| Laser de aprisionamento, ChromaLase | Pesquisa Blue Sky | CLAS-106-STF02-02 | |
| Laser de excitação de fluorescência | Coerente | Innova modelo 70C | |
| Breadboards para componentes armadilhas | Thorlabs | MB1224, MB1218 | |
| Mesa de ar óptica | Técnico Manufacturing Corporation | ||
| Obturador eletrônico com controle de pedal | Uniblitz | Comprado de Vincent Associates, Rochester, NY | |
| Fibra óptica monomodo | Oz Optics | PMJ-3S3S-1064-6 | |
| Posicionador de fibra | Thorlabs | PAF-X-5-C | |
| Colimador de fibra | Oz Optics | HPUCO-23-1064-P-25AC | |
| Lentes para o telescópio | Thorlabs | AC254-150-B | Distância focal de 150 mm |
| Estágios de tradução (x, y, z) | Newport | M-461-XYZ | |
| IR dichroic espelho | Chroma | ET750-sp-2p8 | |
| Lente objetiva (100X) | Nikon | NA = 1,49, imersão em óleo, o objetivo TIRF | |
| Cabeça confocal | Yokogawa | CSU-XI | |
| Polarizador | Nikon | MEN51941 | |
| Wollaston prisma | Nikon | MBH76190 | |
| EM-câmera CCD | Hamamatsu | C9100-13 | |
| CCD da câmera (ORCA ER) | Hamamatsu | C4742-80-12AG | |
| Roda de filtros | Ludl | 99A353 | |
| Roda de filtros | Sutter | LB10-NWE | |
| Chambered lamela | Lab-Tek/Nunc | 155409 | |
| Dynabeads | Invitrogen | 111-51D | Revestidas com anti-CD3 |
| Meio modificado Dulbecco Águia (DMEM) | Invitrogen / Gibco | 10313 | |
| Penicilina / estreptomicina | Invitrogen / Gibco | 15140-122 | |
| L-glutamina | Invitrogen / Gibco | 25030-081 | |
| De soro fetal bovino (HyClone) | ThermoScientific | SH30071.03 |
Referências
- Grakoui, A. The immunological synapse: A molecular machine controlling T cell activation. Science. 285, 221-227 (1999).
- Monks, C. R. Three-dimensional segregation of supramolecular activation clusters in T cells. Nature. 395, 82-86 (1998).
- Stuart, L. M., Ezekowitz, R. A. Phagocytosis and comparative innate immunity: Learning on the fly. Nat Rev Immunol. 8, 131-141 (2008).
- Neuman, K. C., Block, S. M. Optical trapping. Rev Sci Instrum. 75, 2787-2809 (2004).
- Ashkin, A. Optical trapping and manipulation of neutral particles using lasers. Proc Natl Acad Sci USA. 94, 4853-4860 (1997).
- Ashkin, A. Acceleration and trapping of particles by radiation pressure. Phys Rev Lett. 24, 156-159 (1970).
- Ashkin, A., Dziedzic, J. Optical trapping and manipulation of viruses and bacteria Science. Nature. 235, 1517-1520 (1987).
- Khalil, A. S. Single M13 bacteriophage tethering and stretching. Proc Natl Acad Sci USA. 104, 4892-4897 (2007).
- Khalil, A. S. Kinesin's cover-neck bundle folds forward to generate force. Proc Natl Acad Sci USA.. 105, 19247-19252 (2008).
- Li, Z. Membrane tether formation from outer hair cells with optical tweezers. Biophys J. , 1386-1395 (2002).
- Kim, S. The αβ T cell receptor is an anisotropic mechanosensor. J Biol Chem. 284, 31028-31028 (2009).
- Mohanty, S., Mohanty, K., Gupta, P. Dynamics of interaction of RBC with optical tweezers. Opt. Express. 13, 4745-4751 (2005).
- Tam, J. Control and manipulation of pathogens with an optical trap for live cell imaging of intercellular interactions. PLoS One. 5, e15215-e15215 (2010).
- Lin, S. J., Schranz, J., Teutsch, S. M. Aspergillosis case-fatality rate: Systematic review of the literature. Clin Infect Dis.. 32, 358-366 (2001).
- Wey, S. B. Hospital-acquired candidemia - the attributable mortality and excess length of stay. Arch. Intern. Med. 148, 2642-2645 (1988).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados