A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
كشف إزفاء السمية في العصارة الخلوية المضيف بواسطة الرنين مأكل السطح
In This Article
Summary
في هذا التقرير ، ونحن تصف كيفية استخدام سطح مأكل صدى للكشف عن دخول السم في العصارة الخلوية المضيف. هذا الأسلوب يمكن حساسة للغاية تقديم بيانات كمية عن مقدار السم عصاري خلوي ، ويمكن تطبيقه على مجموعة من السموم.
Abstract
السموم AB تتألف من الأنزيمية والوحيدات والوحيدات الخلية B - 1 ملزم. تفرز هذه السموم في الوسط خارج الخلية ، لكنها تتصرف على أهداف داخل العصارة الخلوية حقيقية النواة. بعض السموم السفر AB بناقلات حويصلة من سطح الخلية إلى شبكية هيولي باطني (ER) قبل دخول العصارة الخلوية 2-4. في لائحة ، والحفاز سلسلة تنأى عن بقية السم ويتحرك من خلال قناة البروتين إجراء للوصول إلى هدفه عصاري خلوي 5. و، عصاري خلوي translocated سلسلة من الصعب الكشف عن الاتجار غير المشروع بسبب السم لائحة هو عملية غير فعالة للغاية : يتم توجيه معظم السم المنضوية في lysosomes للتدهور ، وذلك فقط جزءا صغيرا من سطح محدد السم تصل إلى جهاز جولجي ، والنتيجة المتوقعة 6 -12.
لرصد إزفاء السم من لائحة لالعصارة الخلوية في الخلايا المستزرعة ، جنبا إلى جنب لدينا بروتوكول تجزيء التحت خلوية مع highlذ طريقة الكشف الحساسة من مأكل السطح بالرنين (SPR) 13-15. غير انتقائي permeabilized غشاء البلازما من خلايا السم المعاملة مع ديجيتونين ، مما يسمح بجمع جزء عصاري خلوي وهو perfused في وقت لاحق على جهاز استشعار SPR المغلفة مع توكسين A الأضداد المضادة للسلسلة. يمكن للاستشعار الأجسام المضادة المغلفة التقاط وكشف جزء من الغرام / مل كميات من السم عصاري خلوي. مع هذا البروتوكول ، فمن الممكن أن يتبع حركية دخول السم في العصارة الخلوية ولتوصيف الآثار المثبطة على الحدث إزفاء. ويمكن أيضا تركيز السم عصاري خلوي تحسب من المنحنى القياسي إنشاؤها مع كميات معروفة لسلسلة المعايير التي تم على مدى perfused الاستشعار. أسلوبنا يمثل السريع ، ونظام كشف حساسة ، والكمية التي لا تتطلب تعديلات أو radiolabeling أخرى لالسم الهدف.
Protocol
1. إعداد ديجيتونين
- إضافة 500 ميليلتر من الإيثانول بنسبة 100 ٪ لأنبوب microcentrifuge ووضعه في كتلة وضعت في حرارة 80 درجة مئوية لمدة 10 دقيقة.
- حل 2.5 ملغ من ديجيتونين في 250 ميليلتر من الإيثانول ساخنة لإنتاج محلول المخزون 1 ٪ من ديجيتونين.
- لإنشاء حل عمل ديجيتونين 0.04 ٪ ، إضافة 40 ميكرولتر من محلول المخزون ديجيتونين إلى 960 ميكروليتر من العازلة HCN (Hepes 50 مم درجة الحموضة 7.5 ، 150 مم كلوريد الصوديوم ، CaCl 2 2 ملم ، 10 ملم N - ethylmaleimide ، ومثبط البروتياز الكوكتيل).
2. تسمم الخلايا وpermeabilization
ويمكن تطبيق مقايسة لدينا إزفاء إلى مجموعة من السموم وخطوط الخلية. أدناه ، ونحن نقدم على بروتوكول مفصلة للكشف عن سموم الكوليرا (CT). وتقدم لمحة عامة عن الإجراءات المتبعة في الشكل 1.
- هي خلايا هيلا المصنفة في 6 لوحات تتضمن أيضا 1 مل DMEM تستكمل مع 10 ٪ الجنين البقري المصل المضاد الحيوي ومضاد فطري.لتحقيق 1x10 6 خلايا / جيد بعد الحضانة بين عشية وضحاها في 37 درجة مئوية. لتوليد ما يكفي من السم عصاري خلوي للكشف عن استنساخه ، مطلوبة الآبار ثلاث نسخ عن كل شرط.
- بعد الحضانة بين عشية وضحاها ، استبدل مستنبت مع 1 مل يحتوي على 100 DMEM نانوغرام / مل من غانغليوزيد GM1. هذا يزيد من عدد من المواقع ملزمة لCT ، كما مستقبلات GM1 من CT سوف يقحم في غشاء البلازما من الخلايا المعرضة لإيجاد حل لGM1.
- بعد ساعة 1 الحضانة عند 37 درجة مئوية ، وإزالة المتوسطة GM1 المحتوية على الخلايا ، ويغسل مرتين مع DMEM. ثم ، ومكان الخلايا عند 4 درجة مئوية لمدة 30 دقيقة في 1 مل DMEM تحتوي على 1 ميكروغرام / مل من التصوير المقطعي.
- إزالة المتوسطة التي تحتوي على السم ، وغسل الخلايا مرتين مع DMEM ، واحتضان الخلايا في DMEM 1 مل عند 37 درجة مئوية لمدة الفاصل الزمني المطلوب (ق).
- في نهاية كل فترة المطاردة ، وغسل الخلايا مع برنامج تلفزيوني واحتضان كل بئر مع 250 ميكرولتر من EDTA 0.5 مم في برنامج تلفزيوني. السماح للخلايا الجلوس لمدة 10 دقيقة في درجة حرارة الغرفة ثم إخراجها من لوحة 6 - جيدا سحن قوية مع pipetman P1000. بعد أن تم جمع بئر واحدة من الخلايا ، والجمع بين ذلك مع الثانية والثالثة ثم كذلك من نفس الحالة. ويمكن أيضا أن تستخدم مكاشط خلية لجمع الخلايا.
- وضع تعليق خلية مشتركة من ثلاثة آبار تكرار (750 إجمالي حجم ميكرولتر) في أنبوب microcentrifuge واحد ، وتدور عليه في microcentrifuge الطاولة لمدة 5 دقائق في ز س 5000 وينبغي الحصول على خلية من حجم الكريات يعادل تقريبا لجميع شروطه.
- تجاهل وطاف resuspend الكرية الخلية في 100 ميكروليتر من محلول 0.04 ٪ من العاملين ديجيتونين. وضع تعليق خلية على الجليد لمدة 10 دقيقة.
- تدور الخلايا ديجيتونين - 16000 في permeabilized XG لمدة 10 دقيقة في microcentrifuge الطاولة. نقل جزء العصارة الخلوية التي تحتوي على أنبوب لطاف microcentrifuge العذبة ، والإبقاء على جزء بيليه العضية المحتوية.
- مخففة العصارة الخلوية التي تحتوي على كسور طاف في المخزن HCN إلى الحجم النهائي من 1 مل. حجم العينة ما لا يقل عن 1 مل ضرورية لضمان تطهير الهواء من الحلقة 500 عينة ميكرولتر قبل الحقن.
- ومعلق العضية التي تحتوي على كسور بيليه في 1 مل من HCN العازلة التي تحتوي على 1 ٪ تريتون X - 100. بالإضافة إلى ذلك من المنظفات هو ضروري للافراج عن تجمع غشاء المغطى من المواد السامة.
- وتعد المعايير السم بتركيزات 100 ، 10 ، 1 ، و 0.1 نانوغرام / مل في HCN العازلة.
- وتعد مجموعات متوازية من الكسور عصاري خلوي والعضية لتجربة مراقبة لتأكيد الولاء للتجزئة الإجراء. ولدت الكسور كما هو موضح في القسم 2 ومعلق في 20 ميكروليتر من عينة 4X العازلة (كسر عصاري خلوي) أو 120 ميكروليتر من عينة العازلة 1X (العضية الكسر). يتم حل يعادل حجم كل جزء الكهربائي بواسطة سلفات الصوديوم دوديسيل هلام بولي أكريلاميد وبحث بذ تحليل لطخة غربية لشرح تقسيم بروتين عصاري خلوي في الكسر وطاف للذوبان وبروتين ER المقيمين في جزء بيليه 16-19.
4. SPR إعداد الشريحة
- يستخدم SR7000 رايشرت SPR الإنكسار للتجارب SPR.
- وضع شريحة زجاجية مطلية بالذهب مع أحادي الطبقة الذاتي تجميعها في صك SPR. لتفعيل الشريحة الاستشعار ، ويروي (V : V) 01:01 حل EDC M 0.4 و 0.1 NHS M على شريحة لمدة 10 دقيقة في معدل التدفق من 41 ميكروليتر / دقيقة. ستكون جميع perfusions اللاحقة استخدام نفس معدل التدفق.
- لإزالة EDC : NHS العازلة التنشيط ، وغسل لوحة لمدة 5 دقائق مع برنامج تلفزيوني يحتوي على 0.05 ٪ توين 20 (PBST). لوحة تحتوي الآن على الحبال أميد بسبب رد الفعل من جانب uncapping EDC : NHS الحل.
- يروي جسم مكافحة CTA على شريحة استشعار تفعيلها في التخفيف من 1:20،000 في 20 ملي خلات الصوديوم (الرقم الهيدروجيني 5.5) لمدة 15 دقيقة. هبوط أولية في الانكسار فيسيتبين DEX الوحدة (RIU) نتيجة لتغير درجة الحموضة. وسيتبع ذلك من خلال زيادة في RIU كما استولت على الضد من الحبال أميد التفاعل على الشريحة الاستشعار.
- إزالة الأجسام المضادة غير منضم من الشريحة مع أجهزة الاستشعار غسل PBST 5 دقائق. سوف إشارة RIU التي تنتجها الأجسام المضادة هضبة احتلتها والاستقرار ، وتوفير الأساس إشارة جديدة.
- يروي إيثانولامين 1 م (الرقم الهيدروجيني 8.5) على شريحة استشعار لمدة 5 دقائق. هذه القبعات ويعطل أي الحبال غير منضم اليسار على الشريحة الاستشعار.
5. SPR تحليل العينات
- لإنشاء خط الأساس القراءة ، PBST يروي على مدى استشعار الأجسام المضادة المغلفة لمدة 5 دقائق.
- يروي عينة تجريبية أو معيار السم على مدى استشعار لمدة 300 ثانية. إزالة يجند من PBST العازلة ويروي على مدى استشعار لمدة ثانية 200.
- عقب كل التروية ، تتم إزالة سموم ملزمة من أجهزة الاستشعار عن طريق غسل ثوانى 100 مع PBST عند pH 5.0. وهذه العودة إشارةلقراءة خط الأساس الأولي ، وبالتالي السماح لتتم معالجتها عينة أخرى على استشعار نفسه.
- قبل تحميل عينة جديدة ، ودفع كمية صغيرة من الهواء من خلال حلقة عينة لطرد أي السائل المتبقية من العينة السابقة. باستخدام الإجراء المذكورة في 5،2-5،4 ، ونحن تشغيل ما يصل الى 12 عينات على شريحة واحدة من دون خسارة كبيرة في إشارة الأساس.
- يتم إجراء تحليل البيانات مع برنامج الغسيل 2 ، ويستخدم البرنامج لإعداد ايغور الرقم.
6. ممثل النتائج
ذيفان الشاهوق (PT) هو السم AB التي تتحرك من سطح الخلية إلى ER قبل به سلسلة (PTS1) يدخل في العصارة الخلوية 3 و 12. كما هو مبين في الشكل 2 ، ويمكن مقايسة لدينا إزفاء SPR المستندة إلى كشف PTS1 في العصارة الخلوية للخلايا شو مخمورا. ولدت أي إشارة من العصارة الخلوية للخلايا unintoxicated ، مما يؤكد الأضداد المضادة للPTS1 لم مع مكون من العصارة الخلوية المضيف عبر التفاعل. وعصاري خلوي جزء من الخلايا في حالة سكر وجود brefeldin (شينخوا) فشلت أيضا لإنتاج إشارة إيجابية. منتدى بواو الاسيوى يمنع النقل السم إلى موقع إزفاء ER 6-8 ، 12 ، 20-25 ، وبالتالي تسليم السلسلة إلى العصارة الخلوية. في نهاية كل تشغيل ، يتم تجريده من السم ملزمة الشريحة الاستشعار. لفحص هذه العينات يسمح متعددة على شريحة واحدة ، وقدمت أجهزة الاستشعار بذلك المقارنة المباشرة بين النتائج التي تم الحصول عليها مع ظروف تجريبية مختلفة.
CT هو آخر من نوع AB ، ER - 4 translocating السم. 3A في الشكل ، تم الكشف عن CTA1 في جزء من خلايا هيلا عصاري خلوي CT المعاملة. وأكد أن هذه المنهجية لدينا يعمل مع أنواع خلايا متعددة ، ويمكن تطبيقه على أي السم الذي مضاد - A سلسلة الأضداد هو متاح. لم يتم اكتشاف أي إشارة عندما perfused الكسر عصاري خلوي من CT - تعامل الخلايا على جهاز استشعار SPR مغلفة بأجسام مضادة لمكافحة CTB (الشكل 3B) ، مما يدل على أن CTA1ولكن ليس الوحيدات الخلية ملزم CTB مخموس يدخل العصارة الخلوية. ويبين الشكل 3C الإشارة من الكسر العضية هو خارج النطاق بالمقارنة مع أضعف إشارة من الكسر عصاري خلوي. وهذا يتسق مع عدم كفاءة وسائل النقل المعروفة CT إلى موقع إزفاء ER 6 و 7 ، والذي بدوره يحد من كمية السم الذي يمكن أن تصل إلى العصارة الخلوية. وعلاوة على ذلك ، فإن هذا الجزء يحتوي على العضية CT holotoxin فضلا ER - CTA1 المترجمة ، بحيث يتم تضخيم الإشارة SPR الناتجة عن الكسر عضية عن كتلة إضافية من مخموس CTB holotoxin المرتبطة. وهكذا ، فإنه ليس من العملي لرسم البيانات من الكسور وعضية عصاري خلوي على sensorgram نفسه.
ويمكن رصد مقايسة لدينا تراكم تعتمد على الوقت من السم ، translocated عصاري خلوي (الشكل 4). تعرضت الخلايا لCT عند 4 درجة مئوية ، وهي درجة الحرارة التي يسمح السم ملزما للغشاء البلازما ولكن يمنع استيعاب السم الخلية المرتبطة. بعد ريموفال من السم غير منضم ، وارتفعت درجة حرارة الخلايا إلى 37 درجة مئوية. يمكن نقل كل من السم لائحة وألف سلسلة إزفاء إلى العصارة الخلوية يحدث في درجة الحرارة هذه. لم يتم اكتشاف أي السم في العصارة الخلوية بعد 15 دقيقة درجات الحرارة الى 37 درجة مئوية. ينعكس هذا الفارق الزمني المطلوب للاتجار holotoxin (ط) إلى ER ، (ب) وحدة فرعية B / التفكك في لائحة ، و (ج) وتصدير سلسلة من العصارة الخلوية. تم الكشف عن تجمع صغير من السم عصاري خلوي بعد 30 دقيقة عند 37 درجة مئوية ، واكتشفت كميات أكبر من المواد السامة تدريجيا عصاري خلوي بعد فترات 45 و 60 مطاردة دقيقة. تم الكشف عن مستويات أكبر من السم عصاري خلوي بعد فاصل 5 مطاردة 17 ساعة ، مما يدل بالتالي المستمر وطويل الأجل تسليم الخلية المرتبطة السم في العصارة الخلوية المضيف.
ويمكن مقايسة كشف لنا أيضا تثبيط سموم إزفاء إلى العصارة الخلوية (الشكل 5). خلايا تعامل مع سلفوكسيد ثنائي ميثيل 10 ٪ (DMSO) ، وكوصي الكيميائية التي تمنع disord الحراريةتعافي من الوحيدات CTA1 معزولة (T. بانيرجي وتيتر K. ، الملاحظات غير منشورة) ، أظهرت انخفاض مستويات CTA1 عصاري خلوي بالمقارنة مع الخلايا غير المعالجة السيطرة. تتكشف من السم سلسلة شرط أساسي لإزفاء إلى العصارة الخلوية 16-18 ، وبالتالي فإن الاستقرار الناجم من DMSO CTA1 منع حركتها وفقا لذلك من لائحة لالعصارة الخلوية.
معدل الارتباط المستمر (ك أ) محسوبة من التجارب SPR يتناسب طرديا مع تركيز يجند في المنطقة العازلة الارواء 14 ، 15 ، 26. وهكذا ، فإنه من الممكن تحديد تركيز السم عصاري خلوي من الرسم البياني أن يرسم ك قيم للمعايير السم كدالة للتركيز السم. وقد استخدم هذا الإجراء لقياس كتلة DMSO التي يسببها إزفاء من السم المعروضة في الشكل (5) : تم استخدام المنحنى القياسي المتولدة من تركيزات معروفة من السم لحساب عصاري خلوي CTA1 concentratايون قدره 0.3 نانوغرام / مل لعلاج الخلايا و 0.1 نانوغرام / مل لDMSO معاملة الخلايا (الشكل 6). وتثبيط CTA1 تتكشف من خلال إنشاء DMSO بالتالي الحد من 3 أضعاف في إزفاء ER إلى العصارة الخلوية من CTA1.

نظرة عامة على البروتوكول الرقم 1. (أ) يتم تحضين الخلايا مع السم AB في 4 درجات مئوية ، وهي درجة الحرارة التي يسمح السم ملزمة على سطح الخلية ولكن يمنع الإلتقام السم. يتم تمثيل مفارز ألف وباء من المادة السامة من قبل الدوائر الحمراء والزرقاء ، على التوالي. (ب) تتم إزالة سموم غير منضم من المتوسط ، وارتفعت درجة حرارة الخلايا إلى 37 درجة مئوية من أجل تعزيز وسائل النقل الإلتقام الوراء من holotoxin إلى ER. Holotoxin تفارق يحدث في لائحة ، مما يسمح للعزل سلسلة للدخول في العصارة الخلوية التي تمر عبر قناة البروتين إجراء (s) في الغشاء ER. (ج) يتم التعامل مع خلايا ديجيتونين بغية permeabilize انتقائي البلازماالغشاء. (د) يستخدم الطرد المركزي لتقسيم الخلايا في فصل الكسور عصاري خلوي والعضية. محشورة في العصارة الخلوية من خلال مسام الخلايا المولدة ديجيتونين ويقع في طاف. وجدت سليمة ، والغشاء المتجهة العضيات في جزء بيليه. (ه) الكشف عن تجمع translocated سلسلة السم في العصارة الخلوية المضيفة ، perfused الكسر طاف أكثر من جهاز استشعار SPR المغلفة مع الأجسام المضادة والمعادية للسلسلة.
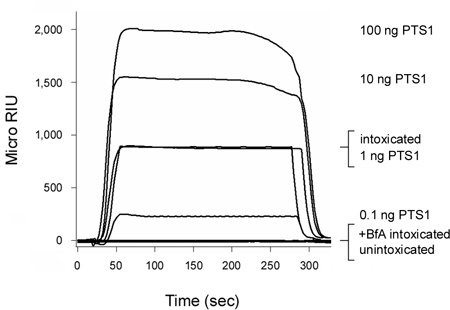
الشكل 2. الكشف عن PTS1 إزفاء في العصارة الخلوية المضيف. وكانت الخلايا CHO نبض المسمى عند 4 درجة مئوية لمدة 30 دقيقة مع 1 ميكروغرام / مل من حزب العمال. ثم طرد الخلايا لمدة 3 ساعة على 37 درجة مئوية في المتوسط خالية من السموم التي لا تحتوي على اضافات (مخمورا) أو 5 لمنتدى بواو الاسيوى ميكروغرام / مل (+ منتدى بواو الاسيوى مخمورا). وقد استخدم Permeabilization للغشاء البلازما مع ديجيتونين لمقتطفات الخلية في قسم منفصل وعضية fracti عصاري خلويإضافات. تم استخدام جهاز استشعار SPR مغلفة بأجسام مضادة لمكافحة PTS1 للكشف عن تجمع من PTS1 عصاري خلوي من الخلايا غير المعالجة أو المعالجة لمنتدى بواو الاسيوى. وكانت perfused PTS1 المعايير على استشعار والضوابط الإيجابية ، في حين كان perfused الكسر عصاري خلوي من الخلايا unintoxicated على شريحة استشعار كعنصر تحكم سلبية. في نهاية كل تشغيل ، وجرد عينة من الشريحة ملزمة الاستشعار.

الشكل 3. الكشف عن CTA1 إزفاء في العصارة الخلوية المضيف. خلايا هيلا نبض المسمى عند 4 درجة مئوية مع طرد 1 ميكروغرام / مل من التصوير المقطعي لمدة 2 ساعة على 37 درجة مئوية في المتوسط خالية من السموم التي لا تحتوي على اضافات (مخمورا) أو 5 لمنتدى بواو الاسيوى ميكروغرام / مل (+ منتدى بواو الاسيوى مخمورا). وقد استخدم Permeabilization للغشاء البلازما مع ديجيتونين لمقتطفات الخلية في قسم منفصل عضية والكسور عصاري خلوي. (أ) كانت perfused والكسور عصاري خلوي خلال جهاز استشعار SPR مغلفة بأجسام مضادة لمكافحة CTA. معروفواستخدمت كميات CTA والضوابط الإيجابية ، في حين تم استخدام العصارة الخلوية من خلايا unintoxicated كعنصر تحكم سلبية. (ب) كان perfused عصاري خلوي وجزء من خلايا مخمورا في غياب أكثر من جهاز استشعار لمنتدى بواو الاسيوى SPR مغلفة بأجسام مضادة لمكافحة CTB. وكان perfused CTB المنقى مخموس على الشريحة كعنصر تحكم إيجابية. (C) وكان solubilized الكسر 1 ٪ مع العضية تريتون X - 100 قبل نضح على جهاز استشعار SPR مغلفة بأجسام مضادة لمكافحة CTA. لأغراض المقارنة ، كانت أيضا جزءا perfused عصاري خلوي (1 مل الحجم النهائي) من نفس الخلية واستخراج معيار CTA على الاستشعار. لجميع لوحات ، تم تجريده من عينة ملزمة من أجهزة الاستشعار في نهاية كل تشغيل.

الشكل 4. حركية CTA1 دخول العصارة الخلوية. خلايا هيلا نبض المسمى عند 4 درجة مئوية مع طرد 1 ميكروغرام / مل من التصوير المقطعي لمدة 15 ، 45 ، 30 ، أو 60 دقيقة عند 37 درجة مئوية في mediu خالية من السمومم. للكشف عن تجمع translocated من السم ، والكسور perfused عصاري خلوي من ديجيتونين - permeabilized الخلايا عبر جهاز استشعار SPR مغلفة بأجسام مضادة لمكافحة CTA. وكانت المعايير perfused CTA على استشعار كذلك. في نهاية كل تشغيل ، وجرد عينة من الشريحة ملزمة الاستشعار.
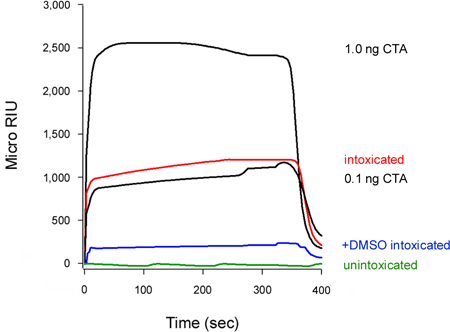
الشكل 5. تثبيط CTA1 إزفاء بواسطة DMSO. خلايا هيلا نبض المسمى عند 4 درجة مئوية مع طرد 1 ميكروغرام / مل من التصوير المقطعي لمدة 2 ساعة على 37 درجة مئوية في المتوسط خالية من السموم التي لا تحتوي على اضافات (مخمورا) أو DMSO 10 ٪ (+ DMSO مخمورا). للكشف عن تجمع translocated من السم ، والكسور perfused عصاري خلوي من ديجيتونين - permeabilized الخلايا عبر جهاز استشعار SPR مغلفة بأجسام مضادة لمكافحة CTA. وكانت المعايير perfused CTA (100 ، 10 ، 1 ، و 0.1 نانوغرام / مل) على مدى استشعار والضوابط الإيجابية ، لا تظهر إلا في 1 و 0.1 نانوغرام / مل المعايير لأغراض التوسع. العصارة الخلوية من unintoxicateتم استخدام الخلايا د كعنصر تحكم سلبية. في نهاية كل تشغيل ، وجرد عينة من الشريحة ملزمة الاستشعار.
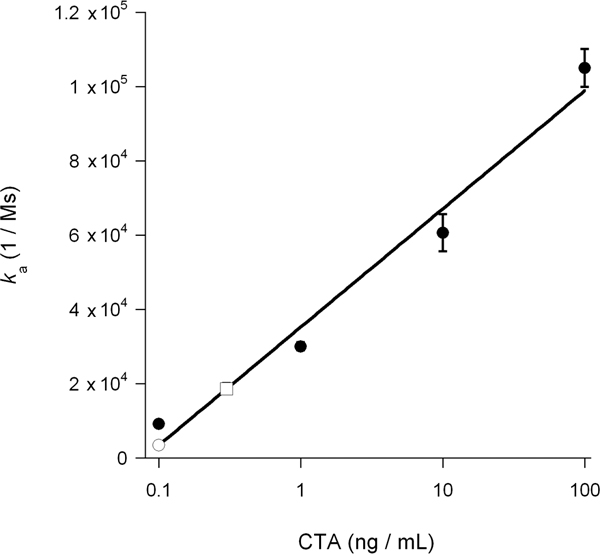
الشكل 6. حساب CTA1 عصاري خلوي. ك قيم للمعايير CTA من الشكل 5 تم التخطيط بوصفها وظيفة من تركيز المادة السامة. وقد استخدم معيار الناتج منحنى لتحديد ، على أساس ك قيم العينات التجريبية من الشكل (5) ، وتركيز CTA1 عصاري خلوي في الخلايا غير المعالجة وDMSO المعاملة. وترد المعايير السم كدوائر شغلها ؛ يتم تقديم العصارة الخلوية المعالجة باعتبارها ساحة مفتوحة ، ويتم تقديم العصارة الخلوية DMSO المعالجة باعتبارها دائرة مفتوحة. وتظهر متوسطات ± نطاقات تجربتين مستقلة.
Access restricted. Please log in or start a trial to view this content.
Discussion
بالمقارنة مع المنهجية القائمة
مقايسة لدينا إزفاء SPR المستندة يمثل السريع ، وطريقة حساسة ، والكمي للكشف عن تقديم السم في العصارة الخلوية المضيف. هذه التقنية لا تتطلب radiolabeling أو تعديلات أخرى لالسم ، ويمكن تطبيقه على أي السم الذي مضا?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
وقد تم تمويل هذا العمل من قبل المعاهد الوطنية للصحة منح R01 AI073783 إلى تيتر ك. نشكر الدكتور شين ماسي للمساعدة في تطوير بروتوكول تجزيء التحت خلوية وهيلين [بورس] لقراءة نقدية للمخطوطة.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| اسم الكاشف | شركة | فهرس العدد | |
| ديجيتونين | سيغما | D141 | |
| الإيثانول | Acros | 61509-0010 | |
| DMEM | Invitrogen | 11995065 | |
| المصل البقري الجنين | اتلانتا البيولوجية | S11550 | |
| غانغليوزيد GM1 | سيغما | G7641 | |
| CTA | سيغما | C2398 | |
| PTS1 | قائمة | 182 | |
| NHS (N - Hydroxysuccinimide) | ثقب | 24500 | |
| EDC (1 - الأثيل - 3 - (3 - dimethylaminopropyl) carbodiimide) | الحرارية العلمية | 22981 | |
| إيثانولامين | سيGMA | E0135 | |
| PBST | Medicago | 09-8903-100 | |
| الأضداد المضادة للCTA | سانتا كروز في مجال التكنولوجيا الحيوية | SC - 80747 | |
| الأضداد المضادة للCTB | Calbiochem | 227040 | |
| الأضداد المضادة للPTS1 | سانتا كروز في مجال التكنولوجيا الحيوية | SC - 57639 | |
| الإنكسار | رايشرت | SR7000 ، SR7000DC | |
| SPR استشعار الشرائح | رايشرت | 13206060 | |
| المحاقن مضخة | كول بالمر | 780200C |
References
- Sandvig, K., van Deurs, B. Membrane traffic exploited by protein toxins. Annu. Rev. Cell Dev. Biol. 18, 1-24 (2002).
- Watson, P., Spooner, R. A. Toxin entry and trafficking in mammalian cells. Adv. Drug Deliv. Rev. 58, 1581-1596 (2006).
- Carbonetti, N. H. Pertussis toxin and adenylate cyclase toxin: key virulence factors of Bordetella pertussis and cell biology tools. Future Microbiol. 5, 455-469 (2010).
- Wernick, N. L. B., Chinnapen, D. J. -F., Cho, J. A., Lencer, W. I. Cholera toxin: an intracellular journey into the cytosol by way of the endoplasmic reticulum. Toxins. 2, 310-325 (2010).
- Lord, J. M., Roberts, L. M., Lencer, W. I. Entry of protein toxins into mammalian cells by crossing the endoplasmic reticulum membrane: co-opting basic mechanisms of endoplasmic reticulum-associated degradation. Curr. Top. Microbiol. Immunol. 300, 149-168 (2005).
- Lencer, W. I. Entry of cholera toxin into polarized human intestinal epithelial cells. Identification of an early brefeldin A sensitive event required for A1-peptide generation. J. Clin. Invest. 92, 2941-2951 (1993).
- Orlandi, P. A., Curran, P. K., Fishman, P. H. Brefeldin A blocks the response of cultured cells to cholera toxin. Implications for intracellular trafficking in toxin action. J. Biol. Chem. 268, 12010-12016 (1993).
- Sandvig, K., Prydz, K., Hansen, S. H., van Deurs, B. Ricin transport in brefeldin A-treated cells: correlation between Golgi structure and toxic effect. J. Cell. Biol. 115, 971-981 (1991).
- Sandvig, K., Prydz, K., Ryd, M., van Deurs, B. Endocytosis and intracellular transport of the glycolipid-binding ligand Shiga toxin in polarized MDCK cells. J. Cell Biol. 113, 553-562 (1991).
- van Deurs, B. Estimation of the amount of internalized ricin that reaches the trans-Golgi network. J. Cell Biol. 106, 253-267 (1988).
- Tam, P. J., Lingwood, C. A. Membrane cytosolic translocation of verotoxin A1 subunit in target cells. Microbiology. 153, 2700-2710 (2007).
- Plaut, R. D., Carbonetti, N. H. Retrograde transport of pertussis toxin in the mammalian cell. Cell. Microbiol. 10, 1130-1139 (2008).
- Willander, M., Al-Hilli, S. Analysis of biomolecules using surface plasmons. Methods Mol. Biol. 544, 201-229 (2009).
- Homola, J. Present and future of surface plasmon resonance biosensors. Anal. Bioanal. Chem. 377, 528-539 (2003).
- Medaglia, M. V., Fisher, R. J. Protein-Protein Interactions. Golemis, E. , Cold Spring Harbor Laboratory Press. Cold Spring Harbor, New York. 255-272 (2002).
- Banerjee, T. Contribution of subdomain structure to the thermal stability of the cholera toxin A1 subunit. Biochemistry. 49, 8839-8846 (2010).
- Massey, S. Stabilization of the tertiary structure of the cholera toxin A1 subunit inhibits toxin dislocation and cellular intoxication. J. Mol. Biol. 393, 1083-1096 (2009).
- Taylor, M. A therapeutic chemical chaperone inhibits cholera intoxication and unfolding/translocation of the cholera toxin A1 subunit. PLoS ONE. 6, e18825-e18825 (2011).
- Taylor, M. Hsp90 is required for transfer of the cholera toxin A1 subunit from the endoplasmic reticulum to the cytosol. J. Biol. Chem. 285, 31261-31267 (2010).
- Donta, S. T., Beristain, S., Tomicic, T. K. Inhibition of heat-labile cholera and Escherichia coli enterotoxins by brefeldin A. Infect. Immun. 61, 3282-3286 (1993).
- Donta, S. T., Tomicic, T. K., Donohue-Rolfe, A. Inhibition of Shiga-like toxins by brefeldin. A. J. Infect. Dis. 171, 721-724 (1995).
- Nambiar, M. P., Oda, T., Chen, C., Kuwazuru, Y., Wu, H. C. Involvement of the Golgi region in the intracellular trafficking of cholera toxin. J. Cell. Physiol. 154, 222-228 (1993).
- Rapak, A., Falnes, P. O., Olsnes, S. Retrograde transport of mutant ricin to the endoplasmic reticulum with subsequent translocation to cytosol. Proc. Natl. Acad. Sci. U. S. A. 94, 3783-3788 (1997).
- Xu, Y., Barbieri, J. T. Pertussis toxin-mediated ADP-ribosylation of target proteins in Chinese hamster ovary cells involves a vesicle trafficking mechanism. Infect. Immun. 63, 825-832 (1995).
- Yoshida, T., Chen, C. C., Zhang, M. S., Wu, H. C. Disruption of the Golgi apparatus by brefeldin A inhibits the cytotoxicity of ricin, modeccin, and Pseudomonas toxin. Exp. Cell Res. 192, 389-395 (1991).
- Godber, B. Direct quantification of analyte concentration by resonant acoustic profiling. Clin. Chem. 51, 1962-1972 (2005).
- Bernardi, K. M., Forster, M. L., Lencer, W. I., Tsai, B. Derlin-1 facilitates the retro-translocation of cholera toxin. Mol. Biol. Cell. 19, 877-884 (2008).
- Wernick, N. L., De Luca, H., Kam, W. R., Lencer, W. I. N-terminal Extension of the Cholera Toxin A1-chain Causes Rapid Degradation after Retrotranslocation from Endoplasmic Reticulum to Cytosol. J. Biol. Chem. 285, 6145-6152 (2010).
- Simpson, J. C. Ricin A chain utilises the endoplasmic reticulum-associated protein degradation pathway to enter the cytosol of yeast. FEBS. Lett. 459, 80-84 (1999).
- Veithen, A., Raze, D., Locht, C. Intracellular trafficking and membrane translocation of pertussis toxin into host cells. Int. J. Med. Microbiol. 290, 409-413 (2000).
- Castro, M. G., McNamara, U., Carbonetti, N. H. Expression, activity and cytotoxicity of pertussis toxin S1 subunit in transfected mammalian cells. Cell. Microbiol. 3, 45-54 (2001).
- Schmitz, A., Herrgen, H., Winkeler, A., Herzog, V. Cholera toxin is exported from microsomes by the Sec61p complex. J. Cell Biol. 148, 1203-1212 (2000).
- Teter, K., Allyn, R. L., Jobling, M. G., Holmes, R. K. Transfer of the cholera toxin A1 polypeptide from the endoplasmic reticulum to the cytosol is a rapid process facilitated by the endoplasmic reticulum-associated degradation pathway. Infect. Immun. 70, 6166-6171 (2002).
- Winkeler, A., Godderz, D., Herzog, V., Schmitz, A. BiP-dependent export of cholera toxin from endoplasmic reticulum-derived microsomes. FEBS Lett. 554, 439-442 (2003).
- Yu, M., Haslam, D. B. Shiga toxin is transported from the endoplasmic reticulum following interaction with the luminal chaperone HEDJ/ERdj3. Infect. Immun. 73, 2524-2532 (2005).
- LaPointe, P., Wei, X., Gariepy, J. A role for the protease-sensitive loop region of Shiga-like toxin 1 in the retrotranslocation of its A1 domain from the endoplasmic reticulum lumen. J. Biol. Chem. 280, 23310-23318 (2005).
- Teter, K., Jobling, M. G., Sentz, D., Holmes, R. K. The cholera toxin A13 subdomain is essential for interaction with ADP-ribosylation factor 6 and full toxic activity but is not required for translocation from the endoplasmic reticulum to the cytosol. Infect. Immun. 74, 2259-2267 (2006).
- Redmann, V. Dislocation of ricin toxin a chains in human cells utilizes selective cellular factors. J. Biol. Chem. 286, 21231-21238 (2011).
- Yamaizumi, M., Mekada, E., Uchida, T., Okada, Y. One molecule of diphtheria toxin fragment A introduced into a cell can kill the cell. Cell. 15, 245-250 (1978).
- Bellisola, G. Reductive activation of ricin and ricin A-chain immunotoxins by protein disulfide isomerase and thioredoxin reductase. Biochem. Pharmacol. 67, 1721-1731 (2004).
- McKee, M. L., FitzGerald, D. J. Reduction of furin-nicked Pseudomonas exotoxin A: an unfolding story. Biochemistry. 38, 16507-16513 (1999).
- Orlandi, P. A. Protein-disulfide isomerase-mediated reduction of the A subunit of cholera toxin in a human intestinal cell line. J. Biol. Chem. 272, 4591-4599 (1997).
- Spooner, R. A. Protein disulphide-isomerase reduces ricin to its A and B chains in the endoplasmic reticulum. Biochem. J. 383, 285-293 (2004).
- Fujinaga, Y. Gangliosides that associate with lipid rafts mediate transport of cholera and related toxins from the plasma membrane to endoplasmic reticulm. Mol. Biol. Cell. 14, 4783-4793 (2003).
- Guerra, L. Cellular internalization of cytolethal distending toxin: a new end to a known pathway. Cell. Microbiol. 7, 921-934 (2005).
- Johannes, L., Tenza, D., Antony, C., Goud, B. Retrograde transport of KDEL-bearing B-fragment of Shiga toxin. J. Biol. Chem. 272, 19554-19561 (1997).
- Deeks, E. D. The low lysine content of ricin A chain reduces the risk of proteolytic degradation after translocation from the endoplasmic reticulum to the cytosol. Biochemistry. 41, 3405-3413 (2002).
- Hazes, B., Read, R. J. Accumulating evidence suggests that several AB-toxins subvert the endoplasmic reticulum-associated protein degradation pathway to enter target cells. Biochemistry. 36, 11051-11054 (1997).
- Rodighiero, C., Tsai, B., Rapoport, T. A., Lencer, W. I. Role of ubiquitination in retro-translocation of cholera toxin and escape of cytosolic degradation. EMBO Rep. 3, 1222-1227 (2002).
- Worthington, Z. E., Carbonetti, N. H. Evading the proteasome: absence of lysine residues contributes to pertussis toxin activity by evasion of proteasome degradation. Infect. Immun. 75, 2946-2953 (2007).
- Pande, A. H., Moe, D., Jamnadas, M., Tatulian, S. A., Teter, K. The pertussis toxin S1 subunit is a thermally unstable protein susceptible to degradation by the 20S proteasome. Biochemistry. 45, 13734-13740 (2006).
- Pande, A. H. Conformational instability of the cholera toxin A1 polypeptide. J. Mol. Biol. 374, 1114-1128 (2007).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved