JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
표면 Plasmon 공명하여 호스트 Cytosol에 독소를 Translocation의 감지
요약
이 보고서에서는, 우리는 표면 plasmon 공명이 호스트 cytosol에 독소 항목을 검색하는 데 사용됩니다 방법에 대해 설명합니다. 이것은 매우 민감한 방법은 cytosolic 독소의 양에 양적 데이터를 제공할 수 있으며,이 독소의 범위에 적용할 수 있습니다.
초록
AB의 독소 subunit 효소와 세포 결합의 B subunit 1로 구성되어 있습니다. 이러한 독소는 세포 환경으로 분비하지만, 그들은 진핵세포 cytosol 내의 대상에 따라 행동하고 있습니다. 세포 표면에서 cytosol 2-4 들어가기 전에 endoplasmic reticulum (ER)에 소포 항공사에 의해 일부 AB 독소 여행. 응급실에서 독소와 이동의 나머지 부분에서 단백질 실시 채널을 통해 촉매 체인 dissociates은 cytosolic 목표 5에 도달합니다. 응급실에 독소 거래가 매우 비효율적 프로세스이기 때문에 translocated, cytosolic 체인은 감지하기가 어렵습니다 : 대부분의 내면 독소는 잠돌군 Zz 장치 및 ER 6에 도달 표면 바운드 독소의 작은 파편 때문에 전용 저하에 대한 lysosomes로 라우팅됩니다 -12.
응급실에서 교양 세포의 cytosol에 독소의 translocation을 모니터하기 위해, 우리는 highl과 subcellular 분획화 프로토콜을 결합표면 plasmon 공명 (SPR) 13-15의 Y 민감한 검출 방법. 독소 - 치료 세포의 플라즈마 막은 선택 후 해독제 체인 항체와 코팅 SPR 센서를 통해 perfused하는 cytosolic 분수의 컬렉션을 수 있도록 digitonin와 permeabilized 있습니다. 항체 - 코팅 센서 cytosolic 독소의 PG / ML 수량을 캡처하여 검색할 수 있습니다. 이 프로토콜로, 그것은 cytosol에 독소 항목의 속도론를 수행하고 translocation 이벤트에 대한 억제 효과를 특성화 수 있습니다. cytosolic 독소의 농도는 또한 센서를 통해 perfused되었습니다 체인 표준의 알려진 수량과 생성된 표준 곡선으로부터 계산하실 수 있습니다. 우리의 방법은 radiolabeling 또는 대상 독소 다른 수정을 요구하지 않는 빠른, 민감한, 그리고 양적 탐지 시스템을 나타냅니다.
프로토콜
1. digitonin의 준비
- microcentrifuge 튜브에 100 % 에탄올 500 μL를 추가하고 80 ° C 10 분에 대해 설정된 열 블록에 넣습니다.
- digitonin의 1 % 주식 솔루션을 생산하는 온수 에탄올 250 μL에 digitonin 2.5 MG를 해산.
- 0.04 %의 digitonin의 작업 솔루션을 생성하려면, HCN 버퍼 960 μL (50 MM의 Hepes 산도 7.5, 150 MM NaCl, 2 MM CaCl 2, 10 MM N - ethylmaleimide, 그리고 테아제 억제제에 digitonin 주식 솔루션 40 μL를 추가 칵테일).
2. 휴대폰 중독과 permeabilization
우리 translocation 분석은 독소와 세포 라인의 범위에 적용할 수 있습니다. 아래, 우리는 콜레라 독소 (중부 표준시)의 검출에 대한 자세한 프로토콜을 제공합니다. 절차의 개요는 그림 1에서 제공됩니다.
- HELA 세포는 10 % 보충 한 ML DMEM을 포함하는 6 자 접시에 씨앗을 품고 아르 태아 소 혈청과 항생제 - antimycotic1x10 6 세포를 달성하기 위해 / 잘 후에 37 하룻밤 인큐베이션 ° C. 재현성 감지하기에 충분한 cytosolic 독소를 생성하려면, 세중의 위 각 조건이 필요합니다.
- 하룻밤 부화 다음, 1 ML DMEM이 ganglioside GM1의 100 NG / ML을 포함하는으로 배지를 교체하십시오. 중부 표준시의 GM1 수용체가 GM1의 솔루션에 노출된 세포의 플라즈마 막에 사이에 끼어 넣다하므로 이것은, CT에 대한 구속력이있는 사이트의 수를 증가합니다.
- 37 1 시간 보육 후에 ° C, GM1 - 포함된 매체를 제거하고 DMEM과 함께 두 번 세포를 씻으십시오. 그런 다음, 4 셀 배치 ° C 일 ML DMEM 1 μg / 중부 표준시의 ML을 포함에서 30 분.
- 37, 독소 함유 매체를 제거 DMEM과 함께 두 번 세포를 씻어, 1 ML DMEM으로 세포를 품어 ° 원하는 시간 간격 (S)에 대한 C.
- 각 추적 기간의 끝에, PBS로 세포를 씻어하고 PBS에 0.5 밀리미터 EDTA (에틸렌 다이아 민 테트라 초산) 250 μL와 각각 잘 품어. 세포가 10 앉아서 보자 다음 상온에서 분 및 P1000 pipetman로 활발한 분쇄하여 6 잘 플레이트에서 제거합니다. 세포 중 하나를 잘 수집되고 나면 잘 같은 상태에서 두 번째 그리고 셋째로 결합되어 있습니다. 세포기구 또한 세포를 수집하는 데 사용할 수 있습니다.
- 단일 microcentrifuge 튜브의 세 가지 복제 우물 (750 μL 총 볼륨)에서 결합된 세포 현탁액을 놓고 5000 X G.에서 5 분 탁상 microcentrifuge에 스핀 대략 동등한 크기의 셀 알약은 모든 조건을 획득해야합니다.
- 뜨는을 취소하고 digitonin의 0.04 % 작업 솔루션을 100 μL의 세포 펠렛을 resuspend. 10 분 얼음에 세포 현탁액을 놓습니다.
- 탁상 microcentrifuge 10 분 16,000 XG에서 digitonin - permeabilized 세포를 돌린다. 새로운 microcentrifuge 튜브에 cytosol 함유 뜨는 분수를 전송하고, organelle 함유 펠렛 분율을 유지합니다.
- Cytosol 함유 뜨는 분수는 1 ML의 최종 볼륨 HCN 버퍼에 희석 수 있습니다. 최소한 1 ML의 샘플 볼륨은 공기가 주입되기 전에 500 μL 시료 루프에서 정화되도록하기 위해 필요합니다.
- Organelle 함유 펠렛의 분수는 1퍼센트 트리톤 X - 100을 포함하는 HCN 버퍼 1 ML에 resuspended 있습니다. 세제의 추가는 독소의 멤브레인 - 쌌다는 수영장을 공개하는 것이 필요합니다.
- 100 농도, 10, 1, 0.1 NG / ML에서 독소 기준은 HCN 버퍼에 준비가되어 있습니다.
- cytosolic 및 organelle 분수의 양대 세트 분획화 절차의 충실도를 확인하기 위해 제어 실험을 준비하고 있습니다. 분수는 4X 샘플 버퍼 (cytosolic 분율) 또는 1X 샘플 버퍼 (organelle 분율) 120 μL의 20 μL에 resuspended 아르 제 2에 설명되어 생성. 각 분획의 상응하는 볼륨은 나트륨 dodecyl 황산염의 polyacrylamide 겔 전기 영동에 의해 해결하고 B를 탐색할 아르Y 서양 얼룩 분석 뜨는 분수에서 cytosolic 단백질의 파티션 및 펠렛 분율 16-19에 용해, 주민 ER 단백질을 설명합니다.
4. SPR 슬라이드 준비
- Reichert SR7000 SPR 굴절계는 SPR 실험에 사용됩니다.
- SPR의 악기에 자기 조립 monolayer와 금도금 유리 슬라이드를 설정합니다. 41 μL / 분의 유량 10 분 슬라이드를 통해 0.4 M 및 0.1 M EDC의 보건국의 솔루션 : 센서 슬라이드를 활성화하려면, 1:1 (V V)를 perfuse. 이후의 모든 perfusions 같은 유량을 사용합니다.
- EDC 제거하려면 다음 보건국 활성화 버퍼를, PBS는 0.05 %에게 십대 초반 20 (PBST)을 포함하는 5 분 접시를 씻으십시오. 보건국 솔루션 : 접시는 현재 EDC로 uncapping에 의한 반응 아미드 tethers가 포함되어 있습니다.
- 15 분 20 MM의 아세트산 나트륨 (산도 5.5)에서 1:20,000의 희석에 활성화된 센서 슬라이드를 통해 안티 CTA 항체를 Perfuse. 의 굴절률에 초기 드롭덱스 단위 (RIU)은 산도의 변화로 인해 보여줄 것입니다. 항체가 센서 슬라이드에있는 아미드 반응 tethers 점령므로 이것은 RIU 증가가 뒤따라갈 겁니다.
- 5 분 PBST 세척과 센서 슬라이드에서 언바운드 항체를 제거합니다. 캡처한 항체에 의해 만들어진 RIU 신호 고원과 안정화는 새로운 기준 신호를 제공합니다.
- 5 분 센서 슬라이드를 통해 Perfuse 1 M ethanolamine (산도 8.5). 이 모자와 센서 슬라이드에 남아있는 언바운드 tethers을 inactivates.
5. 샘플 SPR 분석
- 5 분 항체 - 코팅 센서를 통해 기본적인 읽기, perfuse의 PBST을 설정합니다.
- 300 초에 대한 센서를 통해 실험 샘플이나 독소 표준을 Perfuse. 또 200 초에 대한 센서를 통해 버퍼와 perfuse의 PBST에서 리간드를 제거합니다.
- 각 재관류 후, 행 독소는 산도 5.0에서 PBST로 100 초 세척하여 센서에서 제거됩니다. 이것은 신호를 반환합니다따라서 다른 샘플이 동일한 센서 처리 수 있도록. 초기 기준 읽기에
- 새로운 샘플을로드하기 전에, 이전 예제에서 잔여 액을 추방하기 위해 샘플 루프를 통해 공기의 작은 금액을 밀어. 5.2-5.4에서 설명한 절차를 사용하여, 우리는 기준 신호의 실질적 손실없이 슬라이드 12 샘플까지 실행합니다.
- 데이터 분석은 스크러버이 소프트웨어와 함께 수행하고, 이고르 소프트웨어는 그림 준비에 사용됩니다.
6. 대표 결과
백일해 독소 (PT)는 체인 (PTS1)는 cytosol 세, 12를 입력하기 전에 응급실로 세포 표면에서 이동 AB 독소입니다. 그림 2에 표시된 우리 SPR 기반 translocation 분석은 음주 CHO 세포의 cytosol에 PTS1를 검색할 수 있습니다. 신호는 안티 - PTS1 항체는 호스트 cytosol의 구성 요소와 교차 반응하지 않았 확인 unintoxicated 세포의 cytosol에서 생성되지 않았습니다.brefeldin (BfA)의 존재에 취한 세포에서 cytosolic 분수는 또한 긍정적인 신호를 생성하지 못했습니다. BfA는 ER의 translocation 사이트 6-8, 12, 20-25, 그리고 따라서, cytosol에 체인 전송 독소 전송을 방지합니다. 각 실행의 끝에 행 독소는 센서 슬라이드에서 제거됩니다. 이 허용되는 복수의 샘플은 하나의 센서 슬라이드 상영함으로써 다양한 실험 조건에 얻은 결과 사이에 직접적인 비교를 제공합니다.
CT도 다른 AB 형, ER - translocating 독소 4. 그림 3A에서 CTA1는 CT - 치료 HELA 세포에서 cytosolic 분수에서 발견되었다. 이것은 우리의 방법론은 여러 세포 유형에서 작동하고 방지 체인 항체를 사용할 수있는 모든 독소에 적용할 수 있습니다 강조했다. CT - 처리된 세포에서 cytosolic 분수가 안티 CTB 항체 (그림 3B)로 코팅된 SPR 센서를 통해 perfused 때 아무 신호 따라서 그런 CTA1에게 보여주는 감지되지 않았습니다subunit는하지만 셀 바인딩 CTB pentamer는 cytosol를 입력하지 않습니다. 그림 3C는 organelle 분획에서 신호가 cytosolic 분수에서 약한 신호에 비해 오프 규모입니다 보여줍니다. 이것은 차례로 cytosol에 도달할 수있는 독소의 양을 제한 ER translocation 사이트 6, 7에 중부 표준시 교통의 알려진 비효율과 일치했다. 또한, organelle 분율은 중부 표준시의 holotoxin뿐만 아니라 ER -화된 CTA1가 있으므로, organelle 분율에 대한 결과 SPR 신호 holotoxin - 관련 CTB pentamer의 추가 질량에 의해 증가됩니다 포함되어 있습니다. 그러므로, 그것은 같은 sensorgram에 organelle과 cytosolic 분수에서 데이터를 계획하기 위해 실용적되지 않습니다.
우리의 분석은 translocated, cytosolic 독소 (그림 4)의 시간 의존 축적을 모니터링할 수 있습니다. 전지는 4 중부 표준시에 노출되었습니다 ° C, 플라즈마 막에 독소가 구속 수 있지만 휴대 관련된 독소의 내면화를 방지 온도를. remo 후언바운드 독소의 발은, 세포는 37 ° C.에 따뜻하게했다 응급실에 독소 운송 및 cytosol에 체인 translocation 모두는이 온도에서 발생할 수 있습니다. 아무도 독소는 온난 후 37 ° C.에 cytosol 15 분만에 감지되지 않았습니다 이것은 응급실에은 (i) holotoxin 거래에 필요한 지연 시간을 반영하며 응급실에서 (2) A / B의 subunit의 분리 및 cytosol에 (3) 체인 내보낼 수 있습니다. cytosolic 독소의 작은 수영장이 C는 37 ° 30 분 후에 발견되었고, cytosolic 독소 점차적으로 큰 수량은 45 60분 체이스 간격 이후에 발견되었다. cytosolic 독소의 더욱 수준 때문에 호스트 cytosol로 휴대 관련된 독소의 지속, 장기적인 납품을 보여주는, 5시간 추격 간격 17 이후에 발견되었다.
우리의 분석은 또한 cytosol에 독소의 translocation의 억제 (그림 5) 검색할 수 있습니다. 세포 10 % 디메틸 sulfoxide (DMSO), 열 disord을 방지하는 화학 보호자로 치료격리 CTA1 subunit (T. Banerjee와 K. Teter, 관찰되지 않은)의 ering, 치료 제어 세포에 비해 cytosolic CTA1의 낮은 수준을 전시. 독소의 전개 체인은 cytosol 16-18로 translocation을위한 필수 조건이다, CTA1의 DMSO 유발 안정화가 따라 응급실에서 cytosol하기 위해 운동을 방해하므로.
SPR 실험에서 계산 협회 속도 상수 (K)는 재관류 버퍼 14, 15, 26 리간드의 농도에 직접 비례합니다. 그러므로, 그것은 그래프에서 cytosolic 독소의 농도를 결정하기 위해 가능한 것을 플롯 K 독소 농도의 함수로 독소 표준 값. 이 절차는 그림 5에 제시 독소의 translocation의 DMSO 유도 블록을 계량하는 데 사용되었습니다 독소 알려진 농도에서 생성된 표준 곡선은 cytosolic CTA1 concentrat를 계산하는 데 사용되었다의 이온 0.3 치료 세포와 DMSO - 대우 전지 0.1 NG / ML (그림 6) NG / ML. DMSO에 의해 전개 CTA1의 억제 따라서 CTA1의 ER - 투 - cytosol translocation의 3 배 감소 생성.

그림 1. 프로토콜 개요. (A) 세포 4 AB 독소와 incubated 아르 ° C, 세포 표면에 독소가 구속 수 있지만 독소의 endocytosis을 방지하는 온도. 독소 A와 B subunits는 각각 빨간색과 파란색 동그라미로 표시됩니다. (B) 언바운드 독소가 미디어에서 제거하고, 세포 ° C 응급실에 holotoxin의 endocytosis와 역행 수송을 촉진하기 위해 37 기까지입니다. Holotoxin 분리는 절연 체인 ER 막에 단백질 실시 채널 (S)를 통해 전달하여 cytosol를 입력할 수 응급실에서 발생합니다. (C) 세포 선택적으로 플라즈마를 permeabilize하기 위해 digitonin로 취급됩니다막. (D) 원심 분리는 별도의 cytosolic 및 organelle 분수로 파티션 세포를하는 데 사용됩니다. cytosol은 digitonin 생성 모공을 통해 세포 밖으로 압착하여 뜨는에 위치하고 있습니다. 그대로, 멤브레인 바인딩된 organelles은 펠렛 분획에서 발견됩니다. (E) 호스트 cytosol에서 독소 체인의 translocated 수영장를 검색하려면, 뜨는 분수는 안티 - 체인 항체와 코팅 SPR 센서를 통해 perfused입니다.
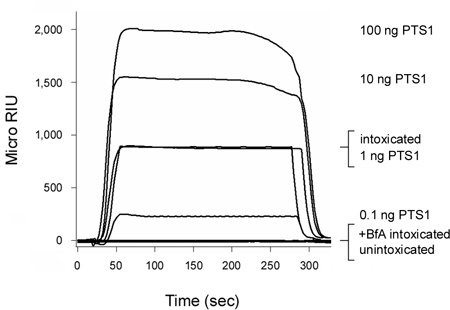
그림 2. 호스트 cytosol에 PTS1 translocation의 감지. CHO 세포되었습니다 펄스 분류 4 ° 1 μg / 태평양 표준시의 ML 30 분 C. 세포는 다음 37 3 시간에 대한 추격했다 더 추가 (음주) 5 μg BfA / ML을 (+ BfA 음주) 포함하지 ° C에서 독소 무료 매체. digitonin와 플라즈마 막의 Permeabilization은 별도의 organelle과 cytosolic fracti로 파티션 세포 추출물에 사용된기능. 안티 PTS1 항체로 코팅된 SPR 센서는 치료 또는 BfA - 처리 세포에서 PTS1의 cytosolic 수영장를 검색하는 데 사용되었다. unintoxicated 세포에서 cytosolic 분율이 대조군으로 센서 슬라이드를 통해 perfused 동안 PTS1 기준은, 긍정적인 컨트롤로 센서를 통해 perfused했다. 각 실행의 끝에 행 예제는 센서 슬라이드에서 뺏겼어요.

그림 3. 호스트 cytosol에 CTA1 translocation의 감지. HELA 세포 펄스 분류 4 ° 1 μg / 중부 표준시의 ML와 C가 37 2 시간에 대한 추격했다 더 추가 (음주) 5 μg BfA / ML을 (+ BfA 음주) 포함하지 ° C에서 독소 무료 매체. digitonin와 플라즈마 막의 Permeabilization은 별도의 organelle과 cytosolic 분수로 파티션 세포 추출물로 사용되었습니다. (A) cytosolic 분수는 안티 CTA 항체로 코팅된 SPR 센서를 통해 perfused했다. 알려진unintoxicated 세포의 cytosol가 대조군으로 사용하는 동안 CTA의 수량은 긍정적인 컨트롤로 사용되었습니다. (B) BfA의 부재에서 술에 취한 세포에서 cytosolic 분수는 안티 CTB 항체로 코팅된 SPR 센서를 통해 perfused되었습니다. 정화 CTB pentamer은 긍정적인 제어로 슬라이드를 통해 perfused되었습니다. (C) organelle 분율이 함께 solubilized했습니다 1% 트리톤 X - 100 안티 CTA 항체로 코팅된 SPR 센서를 통해 재관류 전에. 비교 목적을 위해, 동일한 세포 추출물 및 CTA 표준에서 cytosolic 분수 (1 ML 최종 볼륨)도 센서를 통해 perfused했다. 모든 패널, 행 예제는 각 실행의 끝에 센서에서 뺏겼어요.

그림 4. cytosol에 CTA1 항목의 속도론. HELA 세포 펄스 표시 ° 1 μg / 중부 표준시의 ML과 C 15, 30, 45 추격, 또는 37 60 분되었습니다 ° C 독소 무료 mediu 4시M. 독소의 translocated 수영장를 검색하려면 digitonin - permeabilized 세포에서 cytosolic 분수는 안티 CTA 항체로 코팅된 SPR 센서를 통해 perfused했다. CTA 표준뿐만 아니라 센서를 통해 perfused했다. 각 실행의 끝에 행 예제는 센서 슬라이드에서 뺏겼어요.
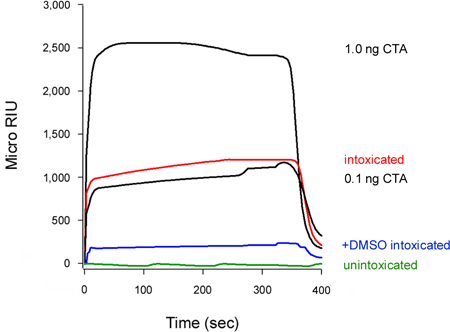
그림 5. DMSO에 의해 CTA1 translocation의 억제. HELA 세포 펄스 분류 4 ° 1 μg / 중부 표준시의 ML와 C가 37 2 시간에 대한 추격했다 더 추가 (음주) 또는 10% DMSO를 (+ DMSO 음주) 포함하지 ° C에서 독소 무료 매체. 독소의 translocated 수영장를 검색하려면 digitonin - permeabilized 세포에서 cytosolic 분수는 안티 CTA 항체로 코팅된 SPR 센서를 통해 perfused했다. CTA 기준은 (100, 10, 1, 0.1 NG / ML) 긍정적인 컨트롤로 센서를 통해 perfused 있었다, 오직 1과 0.1 NG / ML 표준 확장 목적으로 표시됩니다. unintoxicate에서 cytosolD 세포는 대조군으로 사용되었다. 각 실행의 끝에 행 예제는 센서 슬라이드에서 뺏겼어요.
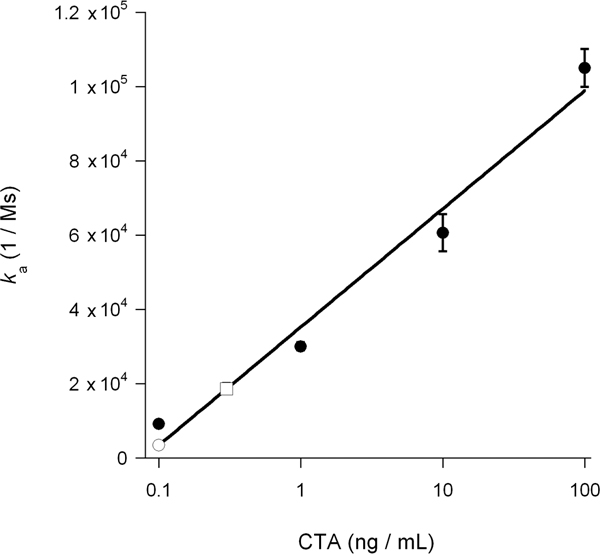
그림 6. cytosolic CTA1의 계산. 그림 5에서 CTA 표준 값 K 독소 농도의 함수로 꾸몄다되었습니다. 그 결과 표준 곡선은 K에 따라 결정하는 데 사용되었다 그림 5, 치료 및 DMSO - 처리 세포에서 cytosolic CTA1의 농도에서 실험 샘플의 값. 치료 cytosol은 열린 광장으로 제시되며, 독소 기준은 채워진 동그라미로 표시되며 DMSO - 대우 cytosol은 오픈 원으로 제공됩니다. 평균 ± 범위 두 개의 독립적인 실험이 표시됩니다.
Access restricted. Please log in or start a trial to view this content.
토론
기존의 방법론 비교
우리 SPR 기반 translocation 분석은 호스트 cytosol에 독소 전송을 감지하는 빠른, 민감한, 그리고 양적 방법을 나타냅니다. 기술 radiolabeling이나 독소에 다른 수정을 요구하지 않으며, 그것은 체인 항체를 사용할 수있는 해독제에 대한 독소를 적용할 수 있습니다. cytosol에 독소 통로를 모니터링하는 기존 방법은 별도의 cytosol과 막 분수 11, 23, 27, 28으로 파?...
Access restricted. Please log in or start a trial to view this content.
공개
관심 없음 충돌 선언하지 않습니다.
감사의 말
이 작품은 K. Teter에 NIH R01 부여 AI073783에 의해 투자되었다. 우리는 원고의 중요한 읽기위한 subcellular 분별화 프로토콜과 헬렌 Burress의 개발에 도움 박사 쉐인 메시 감사합니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 시약의 이름 | 회사 | 카탈로그 번호 | |
| Digitonin | 시그마 | D141 | |
| 에탄올 | Acros | 61509-0010 | |
| DMEM | Invitrogen | 11995065 | |
| 태아 소 혈청 | 애틀랜타 체액 | S11550 | |
| Ganglioside GM1 | 시그마 | G7641 | |
| CTA | 시그마 | C2398 | |
| PTS1 | 목록 | 182 | |
| NHS (N - Hydroxysuccinimide) | 찌르다 | 24,500 | |
| EDC (1 - 에틸 -3 - (3 - 디메틸 아미노) carbodiimide) | 써모 과학 | 22,981 | |
| Ethanolamine | 시GMA | E0135 | |
| PBST | Medicago | 09-8903-100 | |
| 안티 CTA 항체 | 산타 크루즈 생명 공학 | SC - 80747 | |
| 안티 CTB 항체 | Calbiochem | 227,040 | |
| 안티 PTS1 항체 | 산타 크루즈 생명 공학 | SC - 57639 | |
| 굴절계 | Reichert | SR7000, SR7000DC | |
| SPR 센서는 슬라이드 | Reichert | 13206060 | |
| 주사기 펌프 | 콜 팔머 | 780200C |
참고문헌
- Sandvig, K., van Deurs, B. Membrane traffic exploited by protein toxins. Annu. Rev. Cell Dev. Biol. 18, 1-24 (2002).
- Watson, P., Spooner, R. A. Toxin entry and trafficking in mammalian cells. Adv. Drug Deliv. Rev. 58, 1581-1596 (2006).
- Carbonetti, N. H. Pertussis toxin and adenylate cyclase toxin: key virulence factors of Bordetella pertussis and cell biology tools. Future Microbiol. 5, 455-469 (2010).
- Wernick, N. L. B., Chinnapen, D. J. -F., Cho, J. A., Lencer, W. I. Cholera toxin: an intracellular journey into the cytosol by way of the endoplasmic reticulum. Toxins. 2, 310-325 (2010).
- Lord, J. M., Roberts, L. M., Lencer, W. I. Entry of protein toxins into mammalian cells by crossing the endoplasmic reticulum membrane: co-opting basic mechanisms of endoplasmic reticulum-associated degradation. Curr. Top. Microbiol. Immunol. 300, 149-168 (2005).
- Lencer, W. I. Entry of cholera toxin into polarized human intestinal epithelial cells. Identification of an early brefeldin A sensitive event required for A1-peptide generation. J. Clin. Invest. 92, 2941-2951 (1993).
- Orlandi, P. A., Curran, P. K., Fishman, P. H. Brefeldin A blocks the response of cultured cells to cholera toxin. Implications for intracellular trafficking in toxin action. J. Biol. Chem. 268, 12010-12016 (1993).
- Sandvig, K., Prydz, K., Hansen, S. H., van Deurs, B. Ricin transport in brefeldin A-treated cells: correlation between Golgi structure and toxic effect. J. Cell. Biol. 115, 971-981 (1991).
- Sandvig, K., Prydz, K., Ryd, M., van Deurs, B. Endocytosis and intracellular transport of the glycolipid-binding ligand Shiga toxin in polarized MDCK cells. J. Cell Biol. 113, 553-562 (1991).
- van Deurs, B. Estimation of the amount of internalized ricin that reaches the trans-Golgi network. J. Cell Biol. 106, 253-267 (1988).
- Tam, P. J., Lingwood, C. A. Membrane cytosolic translocation of verotoxin A1 subunit in target cells. Microbiology. 153, 2700-2710 (2007).
- Plaut, R. D., Carbonetti, N. H. Retrograde transport of pertussis toxin in the mammalian cell. Cell. Microbiol. 10, 1130-1139 (2008).
- Willander, M., Al-Hilli, S. Analysis of biomolecules using surface plasmons. Methods Mol. Biol. 544, 201-229 (2009).
- Homola, J. Present and future of surface plasmon resonance biosensors. Anal. Bioanal. Chem. 377, 528-539 (2003).
- Medaglia, M. V., Fisher, R. J. Protein-Protein Interactions. Golemis, E. , Cold Spring Harbor Laboratory Press. Cold Spring Harbor, New York. 255-272 (2002).
- Banerjee, T. Contribution of subdomain structure to the thermal stability of the cholera toxin A1 subunit. Biochemistry. 49, 8839-8846 (2010).
- Massey, S. Stabilization of the tertiary structure of the cholera toxin A1 subunit inhibits toxin dislocation and cellular intoxication. J. Mol. Biol. 393, 1083-1096 (2009).
- Taylor, M. A therapeutic chemical chaperone inhibits cholera intoxication and unfolding/translocation of the cholera toxin A1 subunit. PLoS ONE. 6, e18825-e18825 (2011).
- Taylor, M. Hsp90 is required for transfer of the cholera toxin A1 subunit from the endoplasmic reticulum to the cytosol. J. Biol. Chem. 285, 31261-31267 (2010).
- Donta, S. T., Beristain, S., Tomicic, T. K. Inhibition of heat-labile cholera and Escherichia coli enterotoxins by brefeldin A. Infect. Immun. 61, 3282-3286 (1993).
- Donta, S. T., Tomicic, T. K., Donohue-Rolfe, A. Inhibition of Shiga-like toxins by brefeldin. A. J. Infect. Dis. 171, 721-724 (1995).
- Nambiar, M. P., Oda, T., Chen, C., Kuwazuru, Y., Wu, H. C. Involvement of the Golgi region in the intracellular trafficking of cholera toxin. J. Cell. Physiol. 154, 222-228 (1993).
- Rapak, A., Falnes, P. O., Olsnes, S. Retrograde transport of mutant ricin to the endoplasmic reticulum with subsequent translocation to cytosol. Proc. Natl. Acad. Sci. U. S. A. 94, 3783-3788 (1997).
- Xu, Y., Barbieri, J. T. Pertussis toxin-mediated ADP-ribosylation of target proteins in Chinese hamster ovary cells involves a vesicle trafficking mechanism. Infect. Immun. 63, 825-832 (1995).
- Yoshida, T., Chen, C. C., Zhang, M. S., Wu, H. C. Disruption of the Golgi apparatus by brefeldin A inhibits the cytotoxicity of ricin, modeccin, and Pseudomonas toxin. Exp. Cell Res. 192, 389-395 (1991).
- Godber, B. Direct quantification of analyte concentration by resonant acoustic profiling. Clin. Chem. 51, 1962-1972 (2005).
- Bernardi, K. M., Forster, M. L., Lencer, W. I., Tsai, B. Derlin-1 facilitates the retro-translocation of cholera toxin. Mol. Biol. Cell. 19, 877-884 (2008).
- Wernick, N. L., De Luca, H., Kam, W. R., Lencer, W. I. N-terminal Extension of the Cholera Toxin A1-chain Causes Rapid Degradation after Retrotranslocation from Endoplasmic Reticulum to Cytosol. J. Biol. Chem. 285, 6145-6152 (2010).
- Simpson, J. C. Ricin A chain utilises the endoplasmic reticulum-associated protein degradation pathway to enter the cytosol of yeast. FEBS. Lett. 459, 80-84 (1999).
- Veithen, A., Raze, D., Locht, C. Intracellular trafficking and membrane translocation of pertussis toxin into host cells. Int. J. Med. Microbiol. 290, 409-413 (2000).
- Castro, M. G., McNamara, U., Carbonetti, N. H. Expression, activity and cytotoxicity of pertussis toxin S1 subunit in transfected mammalian cells. Cell. Microbiol. 3, 45-54 (2001).
- Schmitz, A., Herrgen, H., Winkeler, A., Herzog, V. Cholera toxin is exported from microsomes by the Sec61p complex. J. Cell Biol. 148, 1203-1212 (2000).
- Teter, K., Allyn, R. L., Jobling, M. G., Holmes, R. K. Transfer of the cholera toxin A1 polypeptide from the endoplasmic reticulum to the cytosol is a rapid process facilitated by the endoplasmic reticulum-associated degradation pathway. Infect. Immun. 70, 6166-6171 (2002).
- Winkeler, A., Godderz, D., Herzog, V., Schmitz, A. BiP-dependent export of cholera toxin from endoplasmic reticulum-derived microsomes. FEBS Lett. 554, 439-442 (2003).
- Yu, M., Haslam, D. B. Shiga toxin is transported from the endoplasmic reticulum following interaction with the luminal chaperone HEDJ/ERdj3. Infect. Immun. 73, 2524-2532 (2005).
- LaPointe, P., Wei, X., Gariepy, J. A role for the protease-sensitive loop region of Shiga-like toxin 1 in the retrotranslocation of its A1 domain from the endoplasmic reticulum lumen. J. Biol. Chem. 280, 23310-23318 (2005).
- Teter, K., Jobling, M. G., Sentz, D., Holmes, R. K. The cholera toxin A13 subdomain is essential for interaction with ADP-ribosylation factor 6 and full toxic activity but is not required for translocation from the endoplasmic reticulum to the cytosol. Infect. Immun. 74, 2259-2267 (2006).
- Redmann, V. Dislocation of ricin toxin a chains in human cells utilizes selective cellular factors. J. Biol. Chem. 286, 21231-21238 (2011).
- Yamaizumi, M., Mekada, E., Uchida, T., Okada, Y. One molecule of diphtheria toxin fragment A introduced into a cell can kill the cell. Cell. 15, 245-250 (1978).
- Bellisola, G. Reductive activation of ricin and ricin A-chain immunotoxins by protein disulfide isomerase and thioredoxin reductase. Biochem. Pharmacol. 67, 1721-1731 (2004).
- McKee, M. L., FitzGerald, D. J. Reduction of furin-nicked Pseudomonas exotoxin A: an unfolding story. Biochemistry. 38, 16507-16513 (1999).
- Orlandi, P. A. Protein-disulfide isomerase-mediated reduction of the A subunit of cholera toxin in a human intestinal cell line. J. Biol. Chem. 272, 4591-4599 (1997).
- Spooner, R. A. Protein disulphide-isomerase reduces ricin to its A and B chains in the endoplasmic reticulum. Biochem. J. 383, 285-293 (2004).
- Fujinaga, Y. Gangliosides that associate with lipid rafts mediate transport of cholera and related toxins from the plasma membrane to endoplasmic reticulm. Mol. Biol. Cell. 14, 4783-4793 (2003).
- Guerra, L. Cellular internalization of cytolethal distending toxin: a new end to a known pathway. Cell. Microbiol. 7, 921-934 (2005).
- Johannes, L., Tenza, D., Antony, C., Goud, B. Retrograde transport of KDEL-bearing B-fragment of Shiga toxin. J. Biol. Chem. 272, 19554-19561 (1997).
- Deeks, E. D. The low lysine content of ricin A chain reduces the risk of proteolytic degradation after translocation from the endoplasmic reticulum to the cytosol. Biochemistry. 41, 3405-3413 (2002).
- Hazes, B., Read, R. J. Accumulating evidence suggests that several AB-toxins subvert the endoplasmic reticulum-associated protein degradation pathway to enter target cells. Biochemistry. 36, 11051-11054 (1997).
- Rodighiero, C., Tsai, B., Rapoport, T. A., Lencer, W. I. Role of ubiquitination in retro-translocation of cholera toxin and escape of cytosolic degradation. EMBO Rep. 3, 1222-1227 (2002).
- Worthington, Z. E., Carbonetti, N. H. Evading the proteasome: absence of lysine residues contributes to pertussis toxin activity by evasion of proteasome degradation. Infect. Immun. 75, 2946-2953 (2007).
- Pande, A. H., Moe, D., Jamnadas, M., Tatulian, S. A., Teter, K. The pertussis toxin S1 subunit is a thermally unstable protein susceptible to degradation by the 20S proteasome. Biochemistry. 45, 13734-13740 (2006).
- Pande, A. H. Conformational instability of the cholera toxin A1 polypeptide. J. Mol. Biol. 374, 1114-1128 (2007).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유