Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Nachweis von Toxin Translokation in den Host-Cytosol von Surface Plasmon Resonance
In diesem Artikel
Zusammenfassung
In diesem Bericht beschreiben wir, wie Oberflächen-Plasmon-Resonanz verwendet wird, um Toxin Einreise in den Aufnahmemitgliedstaat Zytosol zu erkennen. Dieser hochempfindliche Methode lassen sich quantitative Daten über die Höhe der zytosolischen Toxin geben, und es kann zu einer Reihe von Toxinen eingesetzt werden.
Zusammenfassung
AB Toxine bestehen aus einer enzymatischen A-Untereinheit und einer Zell-bindenden B-Untereinheit 1. Diese Toxine sind in das extrazelluläre Milieu ausgeschieden, aber sie wirken auf Ziele innerhalb der eukaryotischen Cytosol. Einige AB Toxine Reise durch Vesikel Träger von der Zelloberfläche zum Endoplasmatischen Retikulum (ER) vor dem Eintritt in das Zytosol 2-4. In der Notaufnahme, um die katalytische A-Kette distanziert sich von dem Rest des Toxins und bewegt sich durch ein Protein-leitenden Kanals erreichen ihren zytosolischen Ziel 5. Die transloziert, cytosolische Eine Kette ist nur schwer zu erkennen, weil Toxin Menschenhandel, die ER ist ein sehr ineffizienter Prozess: Die meisten verinnerlicht Toxin wird zu den Lysosomen zum Abbau geführt, so dass nur ein kleiner Bruchteil der Oberflächen-gebundenen Toxin gelangt der Golgi-Apparat und ER 6 -12.
Zur Überwachung Toxin Translokation aus dem ER ins Zytosol in kultivierten Zellen, kombinierten wir eine subzelluläre Fraktionierung-Protokoll mit den highly empfindliche Nachweismethode der Surface Plasmon Resonance (SPR) 13-15. Die Plasmamembran der Toxin-behandelten Zellen selektiv mit Digitonin permeabilisiert, wodurch Sammlung eines zytosolischen Fraktion, die anschließend über einen SPR-Sensor mit einer Anti-Toxin A-Antikörper beschichtet ist, perfundiert. Die Antikörper-beschichteten Sensor kann erfassen und erkennen pg / mL Mengen von zytosolischen Toxin. Mit diesem Protokoll ist es möglich, die Kinetik der Toxin-Eintrag in das Zytosol zu folgen und hemmende Wirkung auf die Translokation Ereignis zu charakterisieren. Die Konzentration der zytosolischen Toxin kann auch aus einer Standardkurve mit bekannten Mengen von A-Kette Standards, die über den Sensor wurden perfundiert, festgesetzt werden. Unsere Methode stellt eine schnelle, empfindliche und quantitative Nachweis-System, das keine radioaktiven Markierung oder andere Änderungen an der Ziel-Toxin.
Protokoll
1. Vorbereitung der Digitonin
- Add 500 mL 100% Ethanol zu einem Mikrozentrifugenröhrchen und legen Sie sie in einem Heizblock bei 80 ° C für 10 min eingestellt.
- Lösen von 2,5 mg Digitonin in 250 ul der beheizten Ethanol bis zu einer 1% Stammlösung von Digitonin zu produzieren.
- So generieren Sie eine funktionierende Lösung von 0,04% Digitonin, dann werden 40 ul der Digitonin-Stammlösung zu 960 ul der HCN-Puffer (50 mM Hepes pH 7,5, 150 mM NaCl, 2 mM CaCl 2, 10 mM N-Ethylmaleimid, und ein Protease-Inhibitor Cocktail).
2. Zell-Rausch und Permeabilisierung
Unsere Translokation Test kann auf eine Reihe von Toxinen und Zelllinien verwendet werden. Im Folgenden stellen wir ein detailliertes Protokoll für den Nachweis von Cholera-Toxin (CT). Eine Übersicht über die Vorgehensweise ist in Abbildung 1 dargestellt.
- HeLa-Zellen werden in 6-well-Platten mit 1 ml DMEM ausgesät ergänzt mit 10% fötalem Rinderserum und Antibiotika-Antimykotikumzu erreichen, 1x10 6 Zellen / Well nach einer Inkubation über Nacht bei 37 ° C. So generieren Sie genug zytosolische Toxin für reproduzierbare Detektion werden dreifachen Wells für jede Bedingung erforderlich.
- Nach einer Inkubation über Nacht, ersetzen Sie das Kulturmedium mit 1 mL DMEM mit 100 ng / mL Gangliosid GM1. Dadurch erhöht sich die Anzahl der Bindungsstellen für CT, da die GM1-Rezeptor von CT in der Plasmamembran von Zellen, die eine Lösung von GM1 einlagern wird.
- Nach einer 1 Std. Inkubation bei 37 ° C, entfernen Sie die GM1-haltigem Medium und die Zellen zweimal mit DMEM. Legen Sie dann die Zellen bei 4 ° C für 30 min in 1 ml DMEM mit 1 ug / ml CT.
- Entfernen Sie das Toxin-haltigem Medium, waschen Sie die Zellen zweimal mit DMEM und inkubieren Sie die Zellen in 1 ml DMEM bei 37 ° C für das gewünschte Zeitintervall (s).
- Am Ende jeder Periode jagen, waschen Sie die Zellen mit PBS und Inkubation jede Vertiefung mit 250 ul 0,5 mM EDTA in PBS. Lassen Sie die Zellen sitzen für 10 min bei Raumtemperatur und entfernen Sie sie aus der 6-Well-Platte durch kräftiges Reiben mit einem p1000 Pipetman. Nach einem gut von Zellen gesammelt worden ist, kombinieren Sie es mit der zweiten und dann die dritte und aus dem gleichen Zustand. Zellschaber kann auch verwendet werden, um die Zellen zu sammeln.
- Legen Sie der kombinierten Zellsuspension aus den drei replizieren Brunnen (750 ul Gesamtvolumen) in einem einzigen Mikrozentrifugenröhrchen, und drehen Sie es in eine Tischplatte Mikrozentrifuge für 5 min bei 5.000 x g. Die Zellpellets der entspricht in etwa Größe sollte für alle Bedingungen erhalten werden.
- Überstand verwerfen und Zellpellet in 100 ul des 0,04% funktionierende Lösung von Digitonin. Legen Sie die Zellsuspension auf Eis für 10 min.
- Drehen Sie das Digitonin-permeabilisierten Zellen bei 16.000 xg für 10 min in eine Tischplatte Mikrozentrifuge. Übertragen Sie die Cytosol-haltigen Überstandsfraktion eine frische Mikrozentrifugenröhrchen, und behalten die Organellen-Pellet-Fraktion.
- Cytosol-haltige Überstand-Fraktionen werden in HCN-Puffer auf ein Endvolumen von 1 mL verdünnt. Probenvolumina von mindestens 1 mL sind notwendig, um sicherzustellen, Luft aus dem 500 mL-Probenschleife vor der Injektion gespült wird.
- Organellen-Pellet-Fraktionen werden in 1 ml HCN-Puffer mit 1% Triton X-100 resuspendiert. Der Zusatz von Waschmittel ist notwendig, um die Membran-umhüllten Pool Freisetzung von Toxinen.
- Toxin-Standards in Konzentrationen von 100, 10, 1 und 0,1 ng / mL sind in HCN-Puffer hergestellt.
- Parallel setzt der cytosolischen und Organellen-Fraktionen werden für einen Kontroll-Versuch bereit, die Treue der Fraktionierung Verfahren zu bestätigen. Fraktionen erzeugt, wie in Abschnitt 2 beschrieben sind, in 20 ul 4x Probenpuffer (cytosolische Fraktion) oder 120 ul 1x Probenpuffer (Organell-Fraktion) resuspendiert. Äquivalente Volumina der einzelnen Fraktionen werden durch Natriumdodecylsulfat-Polyacrylamid-Gelelektrophorese aufgelöst und sondiert by Western-Blot-Analyse zeigen, die Partitionierung einer zytosolischen Protein im Überstand-Fraktion und eine lösliche, wohnhaft ER-Protein in der Pelletfraktion 16-19.
4. SPR Präparat
- Die Reichert SR7000 SPR Refraktometer ist für SPR-Experimenten verwendet.
- Legen Sie eine vergoldete Glasträger mit einer selbstorganisierten Monoschicht in die SPR Instrument. So aktivieren Sie den Sensor schieben, perfuse einer 1:1 (v: v) Lösung von 0,4 M EDC und 0,1 M NHS über die Rutsche für 10 min bei einer Flussrate von 41 ul / min. Alle nachfolgenden Infusionen wird die gleiche Durchflussmenge.
- Zum Entfernen des EDC: NHS-Aktivierung Puffer, waschen Sie die Platte für 5 min mit PBS mit 0,05% Tween 20 (PBST). Die Platte enthält jetzt reaktiven Amid Anbindehaltung durch Entdeckeln durch die EDC: NHS-Lösung.
- Perfundieren ein Anti-CTA-Antikörper über den aktivierten Sensor gleiten bei einer Verdünnung von 1:20.000 in 20 mM Natriumacetat (pH 5,5) für 15 min. Ein erster Tropfen auf den refraktiven index-Einheit (RIU) wird aufgrund der pH-Änderung zu sehen. Dies wird durch eine Erhöhung der RIU gefolgt werden, da die Antikörper durch die Amid-reaktive Anbindehaltung auf den Sensor schieben erfasst wird.
- Entfernen ungebundener Antikörper aus dem Sensor Folie mit einem 5 Minuten PBST waschen. Die RIU-Signal durch das aufgenommene Antikörper produziert werden Plateau und zu stabilisieren, die Bereitstellung einer neuen Baseline-Signal.
- Perfundieren 1 M Ethanolamin (pH 8,5) über den Sensor schieben für 5 min. Diese Kappen und inaktiviert alle ungebundenen Anbindehaltung auf den Sensor gleiten gelassen.
5. SPR-Analyse von Proben
- Um eine Baseline Lesen, perfuse PBST über den Antikörper-beschichteten Sensor für 5 min.
- Perfundieren einer experimentellen Probe oder Toxin-Standard über den Sensor für 300 Sekunden. Entfernen Sie die Liganden aus dem Puffer und perfuse PBST über den Sensor für weitere 200 sek.
- Nach jeder Perfusion, gebunden ist Toxin vom Sensor durch eine 100 sec waschen mit PBST bei pH 5,0 entfernt. Damit wird das Signalseine ursprüngliche Grundlinie Lesen, so dass eine weitere Probe auf dem gleichen Sensor verarbeitet werden.
- Vor dem Laden einer neuen Probe, drücken Sie eine kleine Menge Luft durch die Probenschleife, um restliche Flüssigkeit aus dem Stand der Probe zu vertreiben. Unter Verwendung des Verfahrens in 5,2-5,4 dargelegt, haben wir bis zu 12 Proben auf einer Folie laufen ohne wesentlichen Verlust der Baseline-Signal.
- Datenanalyse mit dem Scrubber 2-Software durchgeführt, und die Igor-Software ist für Abbildung der Herstellung verwendet.
6. Repräsentative Ergebnisse
Pertussis-Toxin (PT) ist ein AB-Toxin, das von der Zelloberfläche bewegt sich die ER vor der A-Kette (PTS1) tritt das Zytosol 3, 12. Wie in Abbildung 2 dargestellt, könnten unsere SPR-basierter Assay Translokation PTS1 im Cytosol berauscht CHO-Zellen zu erkennen. Es wurde kein Signal aus dem Cytosol von unintoxicated Zellen, die die anti-PTS1 Antikörper nicht mit einer Komponente des Host-Cytosol Kreuzreaktion bestätigt generiert. Diecytosolische Fraktion aus Zellen berauscht in Gegenwart von Brefeldin A (BfA) auch nicht, ein positives Signal zu erzeugen. BfA verhindert Toxin Transport zum ER-Translokation Seite 6-8, 12, 20-25 und damit eine Kette Auslieferung an das Cytosol. Am Ende eines jeden Versuchs, gebunden ist Toxin vom Sensor schieben beraubt. Dies erlaubt mehrere Proben auf einem einzigen Sensor gleiten zu sehen sein und dadurch zur Verfügung gestellt direkten Vergleich zwischen den Ergebnissen mit verschiedenen experimentellen Bedingungen.
CT ist ein weiterer AB-Typ, ER-Translokation Toxin 4. In Abbildung 3A, wurde CTA1 in der cytosolischen Fraktion aus CT-behandelte HeLa-Zellen nachgewiesen. Dieser betonte, dass unsere Methodik mit mehreren Zelltypen funktioniert und kann an jeden Toxin, für die eine anti-A-Antikörper zur Verfügung angewendet werden. Es wurde kein Signal erkannt wird, wenn die cytosolische Fraktion von CT-behandelten Zellen über einen SPR-Sensor mit einer Anti-CTB-Antikörper (Abb. 3B) beschichtet perfundiert wurde und bewiesen damit, dass die CTA1Untereinheit, nicht aber die Zell-Bindung CTB Pentamer betritt das Cytosol. 3C zeigt das Signal vom Organell-Fraktion wird off-Skala im Vergleich zu den schwächeren Signal von der cytosolischen Fraktion. Dies stand im Einklang mit den bekannten Ineffizienz der CT Transport zum ER-Translokation Seite 6, 7, die wiederum begrenzt die Menge des Toxins, das Cytosol erreichen können. Darüber hinaus enthält der Organellen Bruchteil CT Holotoxins sowie ER-lokalisierte CTA1, so dass die resultierende SPR-Signal für die Organellen-Fraktion wird durch die zusätzliche Masse des Holotoxins-assoziierten CTB Pentamer aufgeblasen. So ist es nicht sinnvoll, Daten aus der Organellen und cytosolischen Fraktionen auf der gleichen Sensorgramm Grundstück.
Unser Test kann überwachen die zeitabhängige Akkumulation von transloziert, zytosolische Toxin (Abb. 4). Die Zellen wurden nach CT bei 4 ° C ausgesetzt, eine Temperatur, die Toxin-Bindung an die Plasmamembran ermöglicht, sondern verhindert, dass die Internalisierung der Zell-assoziierten Toxins. Nach dem removal des ungebundenen Toxin, wurden die Zellen auf 37 ° C erwärmt Beide Toxin Transport zum ER und eine Kette Translokation in das Cytosol kann bei dieser Temperatur auftreten. Kein Toxin wurde im Cytosol 15 Minuten nach dem Erwärmen auf 37 ° C festgestellt Dies spiegelt die Verzögerungszeit für (i) Holotoxins Menschenhandel zum ER erforderlich; (ii) A / B-Untereinheit Dissoziation in der Notaufnahme, und (iii) Eine Kette Export in das Zytosol. Ein kleiner Pool von zytosolischen Toxin wurde nach 30 Minuten bei 37 ° C nachgewiesen, und nach und nach größere Mengen an zytosolische Toxin wurden nach dem 45 und 60 Minuten jagen Abständen erfasst. Selbst ein höheres Maß an zytosolische Toxin wurden nach einer 5-stündigen Verfolgungsjagd Intervall 17 erfasst und bewiesen damit, eine kontinuierliche, langfristige Lieferung von Zell-assoziierten Toxins an die Host-Cytosol.
Unser Test kann auch erkennen, die Hemmung des Toxins Translokation in das Cytosol (Abb. 5). Zellen mit 10% Dimethylsulfoxid (DMSO), ein chemisches Chaperon, dass die thermische Disord verhindert behandeltEring der isolierten CTA1 Untereinheit (T. Banerjee und K. Teter, unveröffentlichte Beobachtungen) zeigten niedrige cytosolische CTA1 im Vergleich zu den unbehandelten Kontrollzellen. Entfaltung des Toxin A-Kette eine Voraussetzung für die Translokation in das Cytosol 16-18, so dass die DMSO-induzierte Stabilisierung von CTA1 entsprechend verhindert die Bewegung aus dem ER ins Zytosol.
Der Verein Geschwindigkeitskonstante (k a) von SPR Experimenten berechnet ist direkt proportional zur Konzentration des Liganden in der Perfusionspuffer 14, 15, 26. So ist es möglich, die Konzentration der cytosolischen Toxin aus einem Graphen bestimmen, dass Grundstücke der k-Werte für die Toxin-Standards als eine Funktion der Toxin-Konzentration. Dieses Verfahren wurde verwendet, um die DMSO-induzierte Block des Toxins Translokation in Abbildung 5 dargestellt quantifizieren: die Standardkurve aus bekannten Konzentrationen des Toxins erzeugt wurde verwendet, um eine cytosolische CTA1 konzen berechnenion von 0,3 ng / mL für unbehandelte Zellen und 0,1 ng / mL für DMSO-behandelten Zellen (Abb. 6). Die Hemmung der CTA1 Entfaltung von DMSO so erzeugte eine 3-fache Reduktion der ER-to-Cytosol Translokation von CTA1.

Abbildung 1. Protocol Überblick. (A) Zellen werden mit dem AB-Toxin bei 4 ° C, eine Temperatur, die Toxin-Bindung an die Zelloberfläche ermöglicht, sondern verhindert Toxin Endozytose. Die A-und B-Untereinheiten des Toxins durch rote und blaue Kreise dargestellt, jeweils. (B) Unbound Toxin wird aus dem Medium entfernt und die Zellen werden auf 37 ° C erwärmt, um Endozytose und retrograden Transport des Holotoxins die ER zu fördern. Holotoxin Dissoziation erfolgt in der Notaufnahme, die den isolierten A-Kette ins Zytosol, indem sie durch ein Protein-leitenden Kanals (s) in der ER-Membran eingeben können. (C) werden die Zellen mit Digitonin behandelt, um selektiv permeabilisieren das PlasmaMembran. (D) ist die Zentrifugation zur Partitionierung der Zellen in verschiedene cytosolische und Organellen Fraktionen verwendet. Das Cytosol ist aus der Zelle durch die Digitonin-generated Poren gepresst und ist in der Überstand entfernt. Die intakte, membrangebundenen Organellen sind in der Pellet-Fraktion gefunden. (E) Um die transloziert Pool von Toxin A-Kette in den Host-Cytosol zu detektieren, wird die überstehende Fraktion über einen SPR-Sensor mit einem Anti-A-Antikörper beschichtet perfundiert.
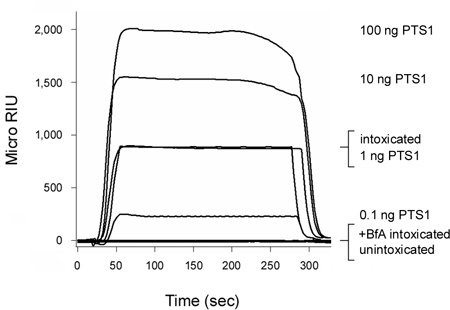
Abbildung 2. Erkennung von PTS1 Translokation in den Host-Cytosol. CHO-Zellen wurden Puls-markierten bei 4 ° C für 30 min mit 1 ug / ml PT. Die Zellen wurden dann für 3 Stunden bei 37 ° C verfolgt in Toxin-freiem Medium enthält keine Zusätze (betrunken) oder 5 ug BfA / mL (+ BfA berauscht). Permeabilisierung der Plasmamembran mit Digitonin wurde Partition Zellextrakten in einzelne Organellen und Cytosol fracti verwendetons. Ein SPR-Sensor mit einer Anti-PTS1 Antikörper beschichtet wurde verwendet, um die cytosolische Pool von PTS1 aus unbehandelten oder BfA-behandelten Zellen zu erkennen. PTS1 Standards wurden über den Sensor als positive Kontrollen perfundiert, während die cytosolische Fraktion von unintoxicated Zellen über den Sensor schieben als negative Kontrolle perfundiert wurde. Am Ende eines jeden Versuchs, mußte Probe vom Sensor schieben beraubt.

Abbildung 3. Erkennung von CTA1 Translokation in den Host-Cytosol. HeLa-Zellen Puls-markierten bei 4 ° C mit 1 ug / ml CT wurden für 2 Stunden bei 37 ° C verfolgt in Toxin-freiem Medium enthält keine Zusätze (betrunken) oder 5 ug BfA / mL (+ BfA berauscht). Permeabilisierung der Plasmamembran mit Digitonin wurde Partition Zellextrakten in einzelne Organellen und cytosolischen Fraktionen verwendet. (A) Die cytosolische Fraktionen wurden über einen SPR-Sensor mit einer Anti-CTA-Antikörper beschichtet perfundiert. BekanntMengen von CTA wurden als positive Kontrollen verwendet, während das Cytosol von unintoxicated Zellen als negative Kontrolle verwendet wurde. (B) Die cytosolische Fraktion aus Zellen berauscht in der Abwesenheit von BfA wurde über einen SPR-Sensor mit einer Anti-CTB Antikörper beschichtet perfundiert. Ein gereinigter CTB Pentamer wurde über die Folie als eine positive Kontrolle perfundiert. (C) Die Organellen-Fraktion wurde mit solubilisierten 1% Triton X-100 vor Perfusion über einen SPR-Sensor mit einer Anti-CTA-Antikörper beschichtet. Zum Zwecke der Vergleichbarkeit wurden die cytosolische Fraktion (1 ml Endvolumen) aus dem gleichen Zellextrakt und ein CTA-Standard auch über den Sensor durchströmt. Für alle Platten, mußte Probe aus dem Sensor am Ende eines jeden Laufs beraubt.

Abbildung 4. Kinetik der CTA1 Eintrag in das Zytosol. HeLa-Zellen Puls-markierten bei 4 ° C mit 1 ug / ml CT wurden für 15, 30, 45 gejagt, oder 60 min bei 37 ° C in giftfrei mediuMeter Zum Nachweis der Translokation Pool des Toxins wurden zytosolischen Fraktionen aus Digitonin-permeabilisierten Zellen über einen SPR-Sensor mit einer Anti-CTA-Antikörper beschichtet perfundiert. CTA-Standards wurden über den Sensor durchströmt als auch. Am Ende eines jeden Versuchs, mußte Probe vom Sensor schieben beraubt.
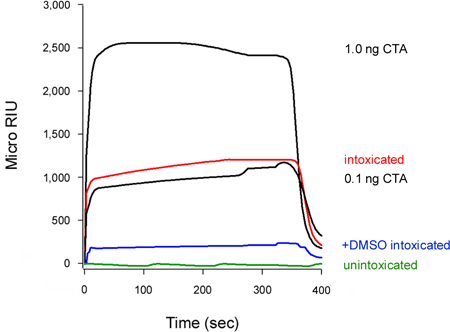
Abbildung 5. Hemmung der CTA1 Translokation von DMSO. HeLa-Zellen Puls-markierten bei 4 ° C mit 1 ug / ml CT wurden für 2 Stunden bei 37 ° C verfolgt in Toxin-freiem Medium enthält keine Zusätze (betrunken) oder 10% DMSO (+ DMSO berauscht). Zum Nachweis der Translokation Pool des Toxins wurden zytosolischen Fraktionen aus Digitonin-permeabilisierten Zellen über einen SPR-Sensor mit einer Anti-CTA-Antikörper beschichtet perfundiert. CTA-Standards (100, 10, 1 und 0,1 ng / ml) wurden über den Sensor als positive Kontrollen perfundiert, nur die 1 und 0,1 ng / mL Standards sind für die Skalierung Zwecke gezeigt. Das Cytosol aus unintoxicated-Zellen wurde als negative Kontrolle verwendet. Am Ende eines jeden Versuchs, mußte Probe vom Sensor schieben beraubt.
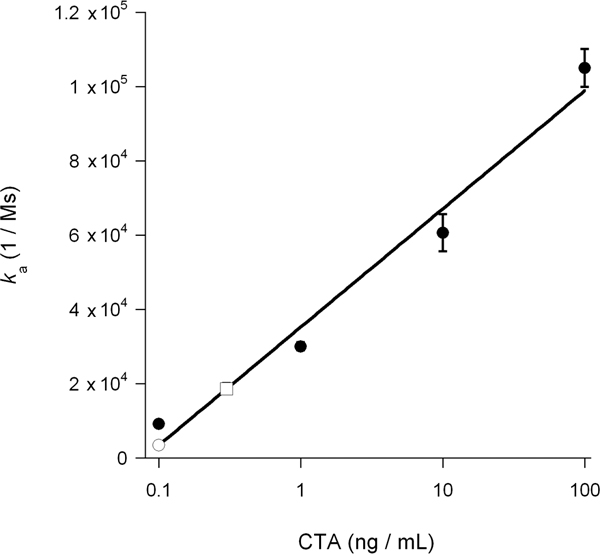
Abbildung 6. Berechnung der zytosolischen CTA1. K-Werten für die CTA-Standards aus Abbildung 5 wurden als Funktion des Toxins Konzentration aufgetragen. Die daraus resultierende Standardkurve wurde verwendet, um festzustellen, basierend auf den k-Werten der experimentellen Proben aus Abbildung 5, die Konzentration der zytosolischen CTA1 in unbehandelten und DMSO-behandelten Zellen. Toxin-Standards sind als ausgefüllte Kreise dargestellt; der unbehandelten Cytosol ist als offenes Quadrat dargestellt, und die DMSO-behandelten Cytosol ist als offener Kreis vorgestellt. Die Mittelwerte ± reicht von zwei unabhängigen Experimenten gezeigt.
Access restricted. Please log in or start a trial to view this content.
Diskussion
Vergleich zu bestehenden Methoden
Unsere SPR-basierter Assay Translokation stellt eine schnelle, empfindliche und quantitative Methode zur Toxin Lieferung in die Host-Cytosol zu erkennen. Die Technik erfordert keine radioaktiven Markierung oder sonstige Änderungen, um das Toxin, und es kann auf jeden Toxin, für die eine anti-Toxin A-Antikörper zur Verfügung angewendet werden. Bestehende Methoden zur Toxin Passage in das Zytosol Monitor beruhen auch auf eine subzelluläre Fraktionierung Pro...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Diese Arbeit wurde vom NIH R01 AI073783 K. Teter finanziert. Wir danken Dr. Shane Massey um Hilfe bei der Entwicklung der subzellulären Fraktionierung-Protokoll und Helen Burress für die kritische Durchsicht des Manuskripts.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | |
| Digitonin | Sigma | D141 | |
| Ethanol | Acros | 61509-0010 | |
| DMEM | Invitrogen | 11995065 | |
| Fetal Bovine Serum | Atlanta Biologicals | S11550 | |
| Gangliosid GM1 | Sigma | G7641 | |
| CTA | Sigma | C2398 | |
| PTS1 | Liste | 182 | |
| NHS (N-Hydroxysuccinimid) | Durchstechen | 24500 | |
| EDC (1-Ethyl-3-(3-dimethylaminopropyl) carbodiimid) | Thermo Scientific | 22981 | |
| Ethanolamine | Sigma | E0135 | |
| PBST | Medicago | 09-8903-100 | |
| Anti-CTA-Antikörper | Santa Cruz Biotech | sc-80747 | |
| Anti-CTB Antikörper | Calbiochem | 227040 | |
| Anti-PTS1 Antikörper | Santa Cruz Biotech | sc-57639 | |
| Refraktometer | Reichert | SR7000, SR7000DC | |
| SPR-Sensor Dias | Reichert | 13206060 | |
| Spritzenpumpe | Cole Palmer | 780200C |
Referenzen
- Sandvig, K., van Deurs, B. Membrane traffic exploited by protein toxins. Annu. Rev. Cell Dev. Biol. 18, 1-24 (2002).
- Watson, P., Spooner, R. A. Toxin entry and trafficking in mammalian cells. Adv. Drug Deliv. Rev. 58, 1581-1596 (2006).
- Carbonetti, N. H. Pertussis toxin and adenylate cyclase toxin: key virulence factors of Bordetella pertussis and cell biology tools. Future Microbiol. 5, 455-469 (2010).
- Wernick, N. L. B., Chinnapen, D. J. -F., Cho, J. A., Lencer, W. I. Cholera toxin: an intracellular journey into the cytosol by way of the endoplasmic reticulum. Toxins. 2, 310-325 (2010).
- Lord, J. M., Roberts, L. M., Lencer, W. I. Entry of protein toxins into mammalian cells by crossing the endoplasmic reticulum membrane: co-opting basic mechanisms of endoplasmic reticulum-associated degradation. Curr. Top. Microbiol. Immunol. 300, 149-168 (2005).
- Lencer, W. I. Entry of cholera toxin into polarized human intestinal epithelial cells. Identification of an early brefeldin A sensitive event required for A1-peptide generation. J. Clin. Invest. 92, 2941-2951 (1993).
- Orlandi, P. A., Curran, P. K., Fishman, P. H. Brefeldin A blocks the response of cultured cells to cholera toxin. Implications for intracellular trafficking in toxin action. J. Biol. Chem. 268, 12010-12016 (1993).
- Sandvig, K., Prydz, K., Hansen, S. H., van Deurs, B. Ricin transport in brefeldin A-treated cells: correlation between Golgi structure and toxic effect. J. Cell. Biol. 115, 971-981 (1991).
- Sandvig, K., Prydz, K., Ryd, M., van Deurs, B. Endocytosis and intracellular transport of the glycolipid-binding ligand Shiga toxin in polarized MDCK cells. J. Cell Biol. 113, 553-562 (1991).
- van Deurs, B. Estimation of the amount of internalized ricin that reaches the trans-Golgi network. J. Cell Biol. 106, 253-267 (1988).
- Tam, P. J., Lingwood, C. A. Membrane cytosolic translocation of verotoxin A1 subunit in target cells. Microbiology. 153, 2700-2710 (2007).
- Plaut, R. D., Carbonetti, N. H. Retrograde transport of pertussis toxin in the mammalian cell. Cell. Microbiol. 10, 1130-1139 (2008).
- Willander, M., Al-Hilli, S. Analysis of biomolecules using surface plasmons. Methods Mol. Biol. 544, 201-229 (2009).
- Homola, J. Present and future of surface plasmon resonance biosensors. Anal. Bioanal. Chem. 377, 528-539 (2003).
- Medaglia, M. V., Fisher, R. J. Protein-Protein Interactions. Golemis, E. , Cold Spring Harbor Laboratory Press. Cold Spring Harbor, New York. 255-272 (2002).
- Banerjee, T. Contribution of subdomain structure to the thermal stability of the cholera toxin A1 subunit. Biochemistry. 49, 8839-8846 (2010).
- Massey, S. Stabilization of the tertiary structure of the cholera toxin A1 subunit inhibits toxin dislocation and cellular intoxication. J. Mol. Biol. 393, 1083-1096 (2009).
- Taylor, M. A therapeutic chemical chaperone inhibits cholera intoxication and unfolding/translocation of the cholera toxin A1 subunit. PLoS ONE. 6, e18825-e18825 (2011).
- Taylor, M. Hsp90 is required for transfer of the cholera toxin A1 subunit from the endoplasmic reticulum to the cytosol. J. Biol. Chem. 285, 31261-31267 (2010).
- Donta, S. T., Beristain, S., Tomicic, T. K. Inhibition of heat-labile cholera and Escherichia coli enterotoxins by brefeldin A. Infect. Immun. 61, 3282-3286 (1993).
- Donta, S. T., Tomicic, T. K., Donohue-Rolfe, A. Inhibition of Shiga-like toxins by brefeldin. A. J. Infect. Dis. 171, 721-724 (1995).
- Nambiar, M. P., Oda, T., Chen, C., Kuwazuru, Y., Wu, H. C. Involvement of the Golgi region in the intracellular trafficking of cholera toxin. J. Cell. Physiol. 154, 222-228 (1993).
- Rapak, A., Falnes, P. O., Olsnes, S. Retrograde transport of mutant ricin to the endoplasmic reticulum with subsequent translocation to cytosol. Proc. Natl. Acad. Sci. U. S. A. 94, 3783-3788 (1997).
- Xu, Y., Barbieri, J. T. Pertussis toxin-mediated ADP-ribosylation of target proteins in Chinese hamster ovary cells involves a vesicle trafficking mechanism. Infect. Immun. 63, 825-832 (1995).
- Yoshida, T., Chen, C. C., Zhang, M. S., Wu, H. C. Disruption of the Golgi apparatus by brefeldin A inhibits the cytotoxicity of ricin, modeccin, and Pseudomonas toxin. Exp. Cell Res. 192, 389-395 (1991).
- Godber, B. Direct quantification of analyte concentration by resonant acoustic profiling. Clin. Chem. 51, 1962-1972 (2005).
- Bernardi, K. M., Forster, M. L., Lencer, W. I., Tsai, B. Derlin-1 facilitates the retro-translocation of cholera toxin. Mol. Biol. Cell. 19, 877-884 (2008).
- Wernick, N. L., De Luca, H., Kam, W. R., Lencer, W. I. N-terminal Extension of the Cholera Toxin A1-chain Causes Rapid Degradation after Retrotranslocation from Endoplasmic Reticulum to Cytosol. J. Biol. Chem. 285, 6145-6152 (2010).
- Simpson, J. C. Ricin A chain utilises the endoplasmic reticulum-associated protein degradation pathway to enter the cytosol of yeast. FEBS. Lett. 459, 80-84 (1999).
- Veithen, A., Raze, D., Locht, C. Intracellular trafficking and membrane translocation of pertussis toxin into host cells. Int. J. Med. Microbiol. 290, 409-413 (2000).
- Castro, M. G., McNamara, U., Carbonetti, N. H. Expression, activity and cytotoxicity of pertussis toxin S1 subunit in transfected mammalian cells. Cell. Microbiol. 3, 45-54 (2001).
- Schmitz, A., Herrgen, H., Winkeler, A., Herzog, V. Cholera toxin is exported from microsomes by the Sec61p complex. J. Cell Biol. 148, 1203-1212 (2000).
- Teter, K., Allyn, R. L., Jobling, M. G., Holmes, R. K. Transfer of the cholera toxin A1 polypeptide from the endoplasmic reticulum to the cytosol is a rapid process facilitated by the endoplasmic reticulum-associated degradation pathway. Infect. Immun. 70, 6166-6171 (2002).
- Winkeler, A., Godderz, D., Herzog, V., Schmitz, A. BiP-dependent export of cholera toxin from endoplasmic reticulum-derived microsomes. FEBS Lett. 554, 439-442 (2003).
- Yu, M., Haslam, D. B. Shiga toxin is transported from the endoplasmic reticulum following interaction with the luminal chaperone HEDJ/ERdj3. Infect. Immun. 73, 2524-2532 (2005).
- LaPointe, P., Wei, X., Gariepy, J. A role for the protease-sensitive loop region of Shiga-like toxin 1 in the retrotranslocation of its A1 domain from the endoplasmic reticulum lumen. J. Biol. Chem. 280, 23310-23318 (2005).
- Teter, K., Jobling, M. G., Sentz, D., Holmes, R. K. The cholera toxin A13 subdomain is essential for interaction with ADP-ribosylation factor 6 and full toxic activity but is not required for translocation from the endoplasmic reticulum to the cytosol. Infect. Immun. 74, 2259-2267 (2006).
- Redmann, V. Dislocation of ricin toxin a chains in human cells utilizes selective cellular factors. J. Biol. Chem. 286, 21231-21238 (2011).
- Yamaizumi, M., Mekada, E., Uchida, T., Okada, Y. One molecule of diphtheria toxin fragment A introduced into a cell can kill the cell. Cell. 15, 245-250 (1978).
- Bellisola, G. Reductive activation of ricin and ricin A-chain immunotoxins by protein disulfide isomerase and thioredoxin reductase. Biochem. Pharmacol. 67, 1721-1731 (2004).
- McKee, M. L., FitzGerald, D. J. Reduction of furin-nicked Pseudomonas exotoxin A: an unfolding story. Biochemistry. 38, 16507-16513 (1999).
- Orlandi, P. A. Protein-disulfide isomerase-mediated reduction of the A subunit of cholera toxin in a human intestinal cell line. J. Biol. Chem. 272, 4591-4599 (1997).
- Spooner, R. A. Protein disulphide-isomerase reduces ricin to its A and B chains in the endoplasmic reticulum. Biochem. J. 383, 285-293 (2004).
- Fujinaga, Y. Gangliosides that associate with lipid rafts mediate transport of cholera and related toxins from the plasma membrane to endoplasmic reticulm. Mol. Biol. Cell. 14, 4783-4793 (2003).
- Guerra, L. Cellular internalization of cytolethal distending toxin: a new end to a known pathway. Cell. Microbiol. 7, 921-934 (2005).
- Johannes, L., Tenza, D., Antony, C., Goud, B. Retrograde transport of KDEL-bearing B-fragment of Shiga toxin. J. Biol. Chem. 272, 19554-19561 (1997).
- Deeks, E. D. The low lysine content of ricin A chain reduces the risk of proteolytic degradation after translocation from the endoplasmic reticulum to the cytosol. Biochemistry. 41, 3405-3413 (2002).
- Hazes, B., Read, R. J. Accumulating evidence suggests that several AB-toxins subvert the endoplasmic reticulum-associated protein degradation pathway to enter target cells. Biochemistry. 36, 11051-11054 (1997).
- Rodighiero, C., Tsai, B., Rapoport, T. A., Lencer, W. I. Role of ubiquitination in retro-translocation of cholera toxin and escape of cytosolic degradation. EMBO Rep. 3, 1222-1227 (2002).
- Worthington, Z. E., Carbonetti, N. H. Evading the proteasome: absence of lysine residues contributes to pertussis toxin activity by evasion of proteasome degradation. Infect. Immun. 75, 2946-2953 (2007).
- Pande, A. H., Moe, D., Jamnadas, M., Tatulian, S. A., Teter, K. The pertussis toxin S1 subunit is a thermally unstable protein susceptible to degradation by the 20S proteasome. Biochemistry. 45, 13734-13740 (2006).
- Pande, A. H. Conformational instability of the cholera toxin A1 polypeptide. J. Mol. Biol. 374, 1114-1128 (2007).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten