Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
La détection des toxines translocation dans le cytosol hôte par résonance plasmonique de surface
Dans cet article
Résumé
Dans ce rapport, nous décrivons comment résonance plasmonique de surface est utilisé pour détecter l'entrée de toxine dans le cytosol hôte. Cette méthode très sensible peuvent fournir des données quantitatives sur la quantité de toxine cytosolique, et elle peut être appliquée à une gamme de toxines.
Résumé
Toxines AB se composent d'un sous-unité enzymatique Un cellulaire et d'une sous-contraignante B 1. Ces toxines sont sécrétées dans le milieu extracellulaire, mais ils agissent sur des cibles dans le cytosol des eucaryotes. Certains voyages AB toxines par les transporteurs vésiculaires de la surface cellulaire vers le réticulum endoplasmique (RE) avant d'entrer dans le cytosol 2-4. Dans l'urgence, le dissocie catalytique Une chaîne du reste de la toxine et se déplace à travers un canal protéique-conducteurs pour atteindre sa cible cytosolique 5. La translocation, cytosolique Une chaîne est difficile à détecter car le trafic de toxine à l'ER est un processus extrêmement inefficace: la toxine la plus intériorisé est acheminé vers les lysosomes de dégradation, alors seulement une petite fraction de la surface de la toxine liée atteint l'appareil de Golgi et ER 6 -12.
Pour surveiller la translocation de la toxine de ER dans le cytosol des cellules en culture, nous avons combiné un protocole avec le fractionnement subcellulaire highlméthode de détection sensible y résonance plasmonique de surface (SPR) 13-15. La membrane plasmique des cellules traitées toxine est sélectivement perméabilisées à la digitonine, permettant la collecte d'une fraction cytosolique qui est ensuite perfusé au cours d'un capteur SPR recouvert d'une anti-toxine un anticorps à chaîne. Le capteur revêtues d'anticorps peut capturer et détecter pg / mL quantités de toxines cytosolique. Avec ce protocole, il est possible de suivre la cinétique d'entrée de toxine dans le cytosol et de caractériser des effets inhibiteurs sur l'événement de translocation. La concentration de la toxine cytosolique peut également être calculé à partir d'une courbe standard générée avec des quantités connues d'une chaîne de normes qui ont été perfusés sur le capteur. Notre méthode représente un système rapide de détection sensible et quantitative qui ne nécessite pas de radiomarquage ou d'autres modifications à la toxine cible.
Protocole
1. Préparation de la digitonine
- Ajouter 500 ul d'éthanol à 100% à un microtube et le placer dans un bloc thermique fixée à 80 ° C pendant 10 min.
- Dissoudre 2,5 mg de digitonine dans 250 uL d'éthanol chauffé pour produire une solution stock de 1% de digitonine.
- Pour générer une solution de travail de digitonine 0,04%, ajouter 40 ul de la solution stock à 960 uL digitonine de HCN tampon (50 mM Hepes pH 7,5, NaCl 150 mM, 2 mM de CaCl2, 10 mM de N-éthylmaléimide, et un inhibiteur de protéase cocktail).
2. L'intoxication cellulaire et de perméabilisation
Notre test de translocation peut être appliquée à une gamme de toxines et de lignées cellulaires. Ci-dessous, nous fournissons un protocole détaillé pour la détection de la toxine cholérique (CT). Un aperçu de la procédure est prévue dans la figure 1.
- Des cellules HeLa sont ensemencées en plaques 6 puits contenant 1 ml de DMEM supplémenté avec 10% de sérum bovin fœtal et les antibiotiques antimycosiquespour atteindre 1x10 6 cellules / puits, après une nuit d'incubation à 37 ° C. Pour générer assez de toxine cytosolique pour la détection reproductible, trois puits sont nécessaires pour chaque condition.
- Après une nuit d'incubation, de remplacer le milieu de culture avec 1 ml de DMEM contenant 100 ng / mL de GM1. Cela augmente le nombre de sites de liaison pour la TDM, comme le récepteur GM1 de la CT sera s'intercaler dans la membrane plasmique des cellules exposées à une solution de GM1.
- Après une incubation de 1 h à 37 ° C, éliminer le milieu GM1 contenant et laver les cellules deux fois avec du DMEM. Ensuite, placer les cellules à 4 ° C pendant 30 min dans 1 ml de DMEM contenant 1 ug / ml de CT.
- Retirez le support contenant la toxine, se laver les cellules deux fois avec du DMEM et incuber les cellules dans 1 ml de DMEM à 37 ° C pour l'intervalle de temps souhaité (s).
- A la fin de chaque période de chasse, laver les cellules avec du PBS et incuber chaque puits avec 250 uL d'EDTA 0,5 mM dans du PBS. Laissez reposer pendant 10 cellules min à température ambiante, puis les retirer de la plaque de 6 puits par trituration vigoureuse avec un P1000 Pipetman. Après un puits de cellules ont été recueillies, le combiner avec le deuxième puis troisième puits de la même condition. Grattoirs cellulaire peut également être utilisé pour collecter les cellules.
- Placer la suspension cellulaire combinée des trois puits de reproduire (750 uL du volume total) dans un microtube unique, et la faire tourner dans une microcentrifugeuse de table pendant 5 min à 5000 x g. Les culots cellulaires de taille à peu près équivalente devrait être obtenue pour toutes les conditions.
- Jeter le surnageant et remettre le culot cellulaire dans 100 ul de la solution de 0,04% de travail de digitonine. Placer la suspension cellulaire sur la glace pendant 10 min.
- Spin cellules perméabilisées digitonine à 16.000 xg pendant 10 min dans une microcentrifugeuse de table. Transférer la fraction cytosolique contenant le surnageant dans un microtube frais, et de conserver la fraction organite contenant de granules.
- Cytosol fractions contenant le surnageant sont dilués dans un tampon de HCN à un volume final de 1 ml. Volumes d'échantillon d'au moins 1 ml sont nécessaires pour assurer de l'air est purgé de la boucle de 500 échantillons uL avant l'injection.
- Organite fractions contenant granulés sont remises en suspension dans 1 ml de tampon contenant 1% de HCN Triton X-100. Ajout de détergent est nécessaire pour libérer la piscine membrane encastrée de la toxine.
- Normes toxines à des concentrations de 100, 10, 1 et 0,1 ng / mL sont préparées dans un tampon de HCN.
- Séries parallèles des fractions cytosoliques et des organites sont préparés pour une expérience de contrôle pour confirmer la fidélité de la procédure de fractionnement. Les fractions générée comme décrit dans la section 2 sont remis en suspension dans 20 pl de tampon d'échantillon 4x (fraction cytosolique) ou 120 pi de tampon d'échantillon 1x (fraction organite). Volumes équivalents de chaque fraction sont résolus par électrophorèse sur gel de sulfate de sodium dodécyl polyacrylamide et sondé bl'analyse par Western blot y démontrer le partitionnement d'une protéine cytosolique dans la fraction surnageante et solubles, des protéines résidentes ER dans la fraction granulés 16-19.
4. Préparation des lames de SPR
- La SPR Reichert SR7000 Réfractomètre est utilisé pour des expériences de SPR.
- Régler une lame de verre plaqué or avec une monocouche auto-assemblée dans l'instrument de SPR. Pour activer le capteur de glissière, perfuser de 1:1 (v: v) solution de 0,4 M d'EDC et 0,1 M NHS sur la lame pendant 10 min à un débit de 41 ul / min. Tous les perfusions ultérieures utiliseront le même débit.
- Pour enlever la SEE: tampon d'activation du NHS, laver la plaque pendant 5 min avec du PBS contenant 0,05% de Tween 20 (PBST). La plaque contient maintenant longes amide réactive due à désoperculer par la SEE: solution de NHS.
- Perfuser un anticorps anti-CTA sur la lame du capteur activé à une dilution de 1:20,000 dans 20 mM acétate de sodium (pH 5,5) pendant 15 min. Une chute initiale de la réfraction dansdex unité (RIU) seront vus en raison du changement de pH. Cette étape sera suivie par une augmentation de la RIU que l'anticorps est capturé par les longes amide-réactive sur la lame du capteur.
- Retirer les anticorps non liés de la diapositive du capteur avec un lavage PBST 5 minutes. Le signal produit par RIU l'anticorps capturée plateau et se stabiliser, fournissant un signal de base de nouvelles.
- Perfuser 1 M éthanolamine (pH 8,5) sur la lame du capteur pendant 5 min. Cette casquettes et inactive les attaches non liée à gauche sur la diapositive capteur.
5. L'analyse d'échantillons de SPR
- Pour établir une lecture de base, PBST perfuser sur le capteur revêtues d'anticorps pendant 5 min.
- Perfuser un échantillon expérimental ou standard toxine sur le capteur pour 300 sec. Retirez le ligand de la mémoire tampon et de PBST perfuser sur le capteur pour un autre sec 200.
- Après chaque perfusion, la toxine liée est retiré de la sonde par un lavage avec PBST 100 sec à pH 5,0. Ce sera de retour le signalà sa lecture initiale de référence, permettant ainsi à un autre échantillon d'être traitées sur le même capteur.
- Avant de charger un nouvel échantillon, pousser une petite quantité d'air à travers la boucle d'échantillonnage d'expulser tout liquide résiduel provenant de l'échantillon précédent. En utilisant la procédure décrite dans 5.2 à 5.4, nous avons exécuté jusqu'à 12 échantillons sur une lame sans perte substantielle du signal de référence.
- L'analyse des données est réalisée avec le laveur deux logiciels, et le logiciel Igor est utilisé pour la préparation des figures.
6. Les résultats représentatifs
La toxine de pertussis (PT) est une toxine AB qui se déplace de la surface des cellules à l'urgence avant son d'une chaîne (PTS1) pénètre dans le cytosol 3, 12. Comme le montre la figure 2, notre test de translocation SPR basé pouvait détecter PTS1 dans le cytosol des cellules CHO ébriété. Aucun signal n'a été généré à partir du cytosol des cellules unintoxicated, qui a confirmé l'anticorps anti-PTS1 n'a pas de réaction croisée avec une composante du cytosol hôte. L'fraction cytosolique des cellules d'ébriété dans la présence de bréfeldine A (BfA) a également échoué à produire un signal positif. BfA empêche le transport de toxines au site de translocation ER 6-8, 12, 20-25 et, par conséquent, une livraison de la chaîne vers le cytosol. A la fin de chaque cycle, la toxine liée est dépouillé de la diapositive du capteur. Cette échantillons a permis plusieurs à être projeté sur une lame de capteur unique et ainsi fourni une comparaison directe entre les résultats obtenus avec différentes conditions expérimentales.
CT est un autre type AB, ER-translocation de toxine 4. Dans la figure 3A, CTA1 a été détecté dans la fraction cytosolique de cellules HeLa CT-traitée. Cette souligner que notre méthodologie fonctionne avec plusieurs types de cellules et peut être appliquée à toute toxine pour laquelle un anticorps anti-A anticorps à chaîne est disponible. Aucun signal n'a été détecté lors de la fraction cytosolique de CT-cellules traitées a été perfusé au cours d'un capteur SPR recouvert d'un anticorps anti-CTB (figure 3B), démontrant ainsi que le CTA1sous-unité, mais pas la cellule contraignant CTB pentamère entre dans le cytosol. La figure 3C montre le signal de la fraction organelle est hors échelle en comparaison à la faiblesse du signal de la fraction cytosolique. Cela était conforme à l'inefficacité connue de CT transport vers le site de translocation ER 6, 7, ce qui limite la quantité de toxine qui peut atteindre le cytosol. Par ailleurs, la fraction organite contient holotoxine CT ainsi que ER-localisées CTA1, de sorte que le signal résultant de SPR pour la fraction organite est gonflé par la masse supplémentaire de l'holotoxine pentamère CTB-associés. Ainsi, il n'est pas pratique pour tracer des données à partir des fractions organite et cytosoliques sur la sensorgramme mêmes.
Notre test peut surveiller l'accumulation dépendant du temps de translocation, la toxine cytosolique (figure 4). Les cellules ont été exposées à CT à 4 ° C, une température qui permet liaison de la toxine à la membrane plasmique, mais empêche l'internalisation de la toxine associée aux cellules. Après le remoVal de toxine non consolidées, les cellules ont été réchauffée à 37 ° C. Les deux toxines de transport à l'urgence et une translocation de la chaîne vers le cytosol peut se produire à cette température. Aucune toxine n'a été détectée dans le cytosol 15 minutes après l'échauffement à 37 ° C. Cela reflète le décalage requis pour le trafic holotoxine (i) à l'ER, (ii) Un / dissociation sous-unité B de l'ER, et (iii) Une chaîne de l'exportation vers le cytosol. Une piscine de toxine mineure cytosolique a été détectée après 30 minutes à 37 ° C, et les quantités progressivement plus de toxine cytosolique ont été détectés après le 45 et 60 intervalles minute chase. Même des niveaux plus de toxine cytosolique ont été détectés après un intervalle de 5 heures 17 chase, démontrant ainsi une constante, à long terme la livraison de toxine associée aux cellules vers le cytosol hôte.
Notre test peut également détecter l'inhibition de la translocation de la toxine dans le cytosol (Fig. 5). Les cellules traitées avec du diméthylsulfoxyde 10% (DMSO), un chaperon chimique qui empêche le Disord thermiquesEring de l'isolement CTA1 sous-unité (T. Banerjee et K. Teter, observations non publiées), présentaient de faibles niveaux de CTA1 cytosolique en comparaison aux cellules témoins non traitées. Déroulement de la toxine Une chaîne est une condition préalable pour la translocation vers le cytosol 16-18, afin de stabiliser le DMSO-induite de CTA1 conséquence empêché son mouvement à partir du RE vers le cytosol.
L'association constante de vitesse (k a) calculée à partir des expériences SPR est directement proportionnelle à la concentration de ligand dans le tampon de perfusion 14, 15, 26. Ainsi, il est possible de déterminer la concentration cytosolique de la toxine à partir d'un graphe qui trace les valeurs de k une toxine comme les normes en fonction de la concentration des toxines. Cette procédure a été utilisée pour quantifier le bloc DMSO induit la translocation de la toxine présenté dans la Figure 5: la courbe standard générée à partir des concentrations connues de toxine a été utilisée pour calculer un cytosolique CTA1 CONCENTRATion de 0,3 ng / ml pour les cellules non traitées et 0,1 ng / mL pour le DMSO cellules traitées (Fig. 6). L'inhibition de la CTA1 déroulement par le DMSO ainsi généré une réduction de 3 fois dans la translocation ER-à-cytosol des CTA1.

Figure 1. Aperçu Protocole. (A) Les cellules sont incubées avec de la toxine AB à 4 ° C, une température qui permet liaison de la toxine à la surface cellulaire, mais empêche l'endocytose toxine. Les sous-unités A et B de la toxine sont représentés par des cercles rouges et bleus, respectivement. (B) de toxine non lié est éliminé du milieu, et les cellules sont chauffées à 37 ° C afin de promouvoir endocytose et le transport rétrograde de l'holotoxine à l'urgence. Holotoxine de dissociation se produit dans l'urgence, qui permet l'isolement Une chaîne pour entrer dans le cytosol en passant à travers un canal protéique conducteur (s) dans la membrane du RE. (C) Les cellules sont traitées avec de la digitonine, afin de perméabiliser de façon sélective le plasmamembrane. (D) La centrifugation est utilisée pour les cellules dans une partition séparée des fractions cytosoliques et des organites. Le cytosol est évincé de la cellule par les pores digitonine-générée et est situé dans le surnageant. Le intacte, liée à la membrane des organites se trouvent dans la fraction de granules. (E) Pour détecter la piscine translocation de la toxine Une chaîne dans le cytosol hôte, la fraction surnageante est perfusé au cours d'un capteur SPR recouvert d'un anticorps anti-A anticorps à chaîne.
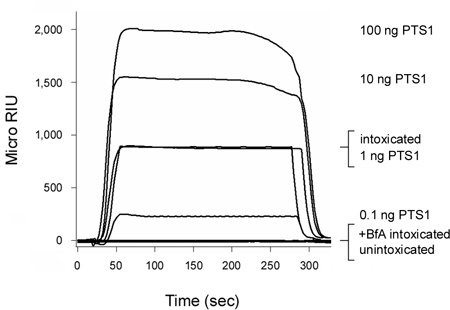
Figure 2. Détection de PTS1 translocation dans le cytosol hôte. Les cellules CHO ont été étiquetés par impulsions à 4 ° C pendant 30 min avec 1 ug / ml de PT. Les cellules ont ensuite été pourchassé pendant 3 heures à 37 ° C dans un milieu exempt de toxines contenant aucun ajout (ivresse) ou 5 ug BfA / mL (+ BfA intoxiqué). Perméabilisation de la membrane plasmique à la digitonine a été utilisé pour des extraits de cellules séparées partition en organite et cytosoliques fractions. Un capteur SPR recouvert d'un anticorps anti-PTS1 a été utilisé pour détecter la piscine cytosolique de PTS1 partir de cellules non traitées ou traitées BfA. PTS1 normes ont été perfusés sur le capteur comme contrôles positifs, tandis que la fraction cytosolique des cellules unintoxicated a été perfusé sur la lame du capteur comme un contrôle négatif. A la fin de chaque cycle, l'échantillon a été dépouillé liés partir de la diapositive du capteur.

Figure 3. Détection de CTA1 translocation dans le cytosol hôte. Des cellules HeLa impulsions marquées à 4 ° C avec 1 ug / ml de CT ont été chassés pendant 2 heures à 37 ° C dans un milieu exempt de toxines contenant aucun ajout (ivresse) ou 5 ug BfA / mL (+ BfA intoxiqué). Perméabilisation de la membrane plasmique à la digitonine a été utilisé pour des extraits de cellules séparées partition en organite et les fractions cytosoliques. (A) Les fractions cytosoliques ont été perfusés au cours d'un capteur SPR recouvert d'un anticorps anti-CTA. Connuquantités de LTC ont été utilisés comme contrôles positifs, tandis que le cytosol des cellules unintoxicated a été utilisé comme contrôle négatif. (B) la fraction cytosolique des cellules ébriété en l'absence de BFA a été perfusé au cours d'un capteur SPR recouvert d'un anticorps anti-CTB. A purifié CTB pentamère a été perfusé sur la lame comme un contrôle positif. (C) La fraction organite a été solubilisé avec 1% de Triton X-100 avant la perfusion sur un capteur SPR recouvert d'un anticorps anti-CTA. Pour fins de comparaison, la fraction cytosolique (1 ml de volume final) de l'extrait même cellule et un standard du CTA ont également été perfusé sur le capteur. Pour tous les panneaux, l'échantillon a été dépouillé liée à partir du capteur à la fin de chaque course.

Figure 4. Cinétique de CTA1 entrée dans le cytosol. Des cellules HeLa impulsions marquées à 4 ° C avec 1 ug / ml de CT ont été chassés pour 15, 30, 45 ou 60 min à 37 ° C de la toxine sans Medium. Pour détecter la piscine translocation de la toxine, fractions cytosoliques des cellules perméabilisées digitonine ont été perfusés au cours d'un capteur SPR recouvert d'un anticorps anti-CTA. Normes du CTA ont été perfusés sur le capteur ainsi. A la fin de chaque cycle, l'échantillon a été dépouillé liés partir de la diapositive du capteur.
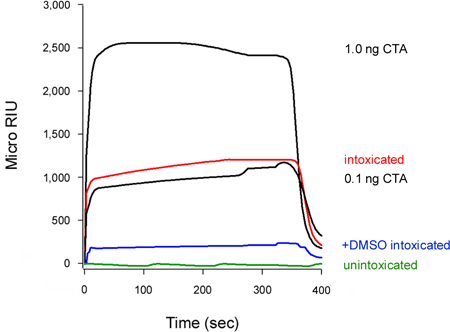
Figure 5. Inhibition de CTA1 translocation par le DMSO. Des cellules HeLa impulsions marquées à 4 ° C avec 1 ug / ml de CT ont été chassés pendant 2 heures à 37 ° C dans un milieu exempt de toxines contenant aucun ajout (ivresse) ou 10% de DMSO (+ DMSO intoxiqué). Pour détecter la piscine translocation de la toxine, fractions cytosoliques des cellules perméabilisées digitonine ont été perfusés au cours d'un capteur SPR recouvert d'un anticorps anti-CTA. Normes du CTA (100, 10, 1 et 0,1 ng / mL) ont été perfusés sur le capteur comme contrôles positifs, seul le 1 et 0,1 ng / mL normes sont indiquées à des fins de mise à l'échelle. Le cytosol à partir unintoxicatecellules D a été utilisé comme contrôle négatif. A la fin de chaque cycle, l'échantillon a été dépouillé liés partir de la diapositive du capteur.
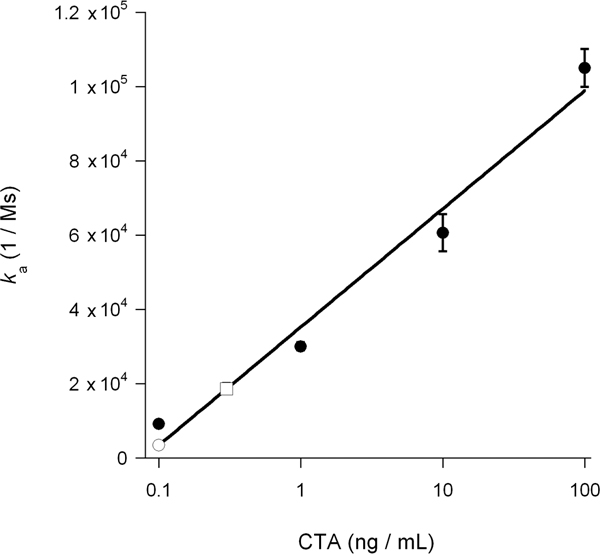
Figure 6. Calcul de CTA1 cytosolique. K une des valeurs pour les normes du CTA de la figure 5 ont été tracées en fonction de la concentration de toxine. La courbe ainsi obtenue standard a été utilisé pour déterminer, sur la base des valeurs de k une des échantillons expérimentaux de la figure 5, la concentration de CTA1 cytosolique dans les cellules non traitées et traitées DMSO. Normes toxines sont présentés comme des cercles remplis; le cytosol non traité est présenté comme une place ouverte, et le cytosol DMSO-traité est présenté comme un cercle ouvert. Les moyennes ± gammes de deux expériences indépendantes sont présentés.
Access restricted. Please log in or start a trial to view this content.
Discussion
Comparaison à la méthodologie existante
Notre test de translocation SPR à base représente une méthode rapide, sensible, et quantitatives pour détecter administration de la toxine dans le cytosol hôte. La technique ne nécessite pas de radiomarquage ou d'autres modifications à la toxine, et il peut être appliqué à toute toxine pour lequel un anti-toxine A anticorps à chaîne est disponible. Les méthodes existantes pour surveiller le passage de toxines dans le cytosol se fondent...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Ce travail a été financé par NIH R01 AI073783 à K. Teter. Nous remercions le Dr Shane Massey pour l'aide au développement de l'fractionnement subcellulaire protocole et Helen Burress pour la lecture critique du manuscrit.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Société | Numéro de catalogue | |
| Digitonine | Sigma | D141 | |
| Éthanol | Acros | 61509-0010 | |
| DMEM | Invitrogen | 11995065 | |
| Sérum de veau fœtal | Atlanta Biologicals | S11550 | |
| GM1 | Sigma | G7641 | |
| CTA | Sigma | C2398 | |
| PTS1 | Liste | 182 | |
| NHS (N-hydroxysuccinimide) | Pierce | 24500 | |
| EDC (1-éthyl-3-(3-diméthylaminopropyl) carbodiimide) | Thermo Scientific | 22981 | |
| L'éthanolamine | Sigma | E0135 | |
| PBST | Medicago | 09-8903-100 | |
| Anti-CTA d'anticorps | Santa Cruz Biotech | sc-80747 | |
| D'anticorps anti-CTB | Calbiochem | 227040 | |
| Anti-PTS1 d'anticorps | Santa Cruz Biotech | sc-57639 | |
| Réfractomètre | Reichert | SR7000, SR7000DC | |
| SPR capteur de diapositives | Reichert | 13206060 | |
| Pompe à seringue | Cole Palmer | 780200C |
Références
- Sandvig, K., van Deurs, B. Membrane traffic exploited by protein toxins. Annu. Rev. Cell Dev. Biol. 18, 1-24 (2002).
- Watson, P., Spooner, R. A. Toxin entry and trafficking in mammalian cells. Adv. Drug Deliv. Rev. 58, 1581-1596 (2006).
- Carbonetti, N. H. Pertussis toxin and adenylate cyclase toxin: key virulence factors of Bordetella pertussis and cell biology tools. Future Microbiol. 5, 455-469 (2010).
- Wernick, N. L. B., Chinnapen, D. J. -F., Cho, J. A., Lencer, W. I. Cholera toxin: an intracellular journey into the cytosol by way of the endoplasmic reticulum. Toxins. 2, 310-325 (2010).
- Lord, J. M., Roberts, L. M., Lencer, W. I. Entry of protein toxins into mammalian cells by crossing the endoplasmic reticulum membrane: co-opting basic mechanisms of endoplasmic reticulum-associated degradation. Curr. Top. Microbiol. Immunol. 300, 149-168 (2005).
- Lencer, W. I. Entry of cholera toxin into polarized human intestinal epithelial cells. Identification of an early brefeldin A sensitive event required for A1-peptide generation. J. Clin. Invest. 92, 2941-2951 (1993).
- Orlandi, P. A., Curran, P. K., Fishman, P. H. Brefeldin A blocks the response of cultured cells to cholera toxin. Implications for intracellular trafficking in toxin action. J. Biol. Chem. 268, 12010-12016 (1993).
- Sandvig, K., Prydz, K., Hansen, S. H., van Deurs, B. Ricin transport in brefeldin A-treated cells: correlation between Golgi structure and toxic effect. J. Cell. Biol. 115, 971-981 (1991).
- Sandvig, K., Prydz, K., Ryd, M., van Deurs, B. Endocytosis and intracellular transport of the glycolipid-binding ligand Shiga toxin in polarized MDCK cells. J. Cell Biol. 113, 553-562 (1991).
- van Deurs, B. Estimation of the amount of internalized ricin that reaches the trans-Golgi network. J. Cell Biol. 106, 253-267 (1988).
- Tam, P. J., Lingwood, C. A. Membrane cytosolic translocation of verotoxin A1 subunit in target cells. Microbiology. 153, 2700-2710 (2007).
- Plaut, R. D., Carbonetti, N. H. Retrograde transport of pertussis toxin in the mammalian cell. Cell. Microbiol. 10, 1130-1139 (2008).
- Willander, M., Al-Hilli, S. Analysis of biomolecules using surface plasmons. Methods Mol. Biol. 544, 201-229 (2009).
- Homola, J. Present and future of surface plasmon resonance biosensors. Anal. Bioanal. Chem. 377, 528-539 (2003).
- Medaglia, M. V., Fisher, R. J. Protein-Protein Interactions. Golemis, E. , Cold Spring Harbor Laboratory Press. Cold Spring Harbor, New York. 255-272 (2002).
- Banerjee, T. Contribution of subdomain structure to the thermal stability of the cholera toxin A1 subunit. Biochemistry. 49, 8839-8846 (2010).
- Massey, S. Stabilization of the tertiary structure of the cholera toxin A1 subunit inhibits toxin dislocation and cellular intoxication. J. Mol. Biol. 393, 1083-1096 (2009).
- Taylor, M. A therapeutic chemical chaperone inhibits cholera intoxication and unfolding/translocation of the cholera toxin A1 subunit. PLoS ONE. 6, e18825-e18825 (2011).
- Taylor, M. Hsp90 is required for transfer of the cholera toxin A1 subunit from the endoplasmic reticulum to the cytosol. J. Biol. Chem. 285, 31261-31267 (2010).
- Donta, S. T., Beristain, S., Tomicic, T. K. Inhibition of heat-labile cholera and Escherichia coli enterotoxins by brefeldin A. Infect. Immun. 61, 3282-3286 (1993).
- Donta, S. T., Tomicic, T. K., Donohue-Rolfe, A. Inhibition of Shiga-like toxins by brefeldin. A. J. Infect. Dis. 171, 721-724 (1995).
- Nambiar, M. P., Oda, T., Chen, C., Kuwazuru, Y., Wu, H. C. Involvement of the Golgi region in the intracellular trafficking of cholera toxin. J. Cell. Physiol. 154, 222-228 (1993).
- Rapak, A., Falnes, P. O., Olsnes, S. Retrograde transport of mutant ricin to the endoplasmic reticulum with subsequent translocation to cytosol. Proc. Natl. Acad. Sci. U. S. A. 94, 3783-3788 (1997).
- Xu, Y., Barbieri, J. T. Pertussis toxin-mediated ADP-ribosylation of target proteins in Chinese hamster ovary cells involves a vesicle trafficking mechanism. Infect. Immun. 63, 825-832 (1995).
- Yoshida, T., Chen, C. C., Zhang, M. S., Wu, H. C. Disruption of the Golgi apparatus by brefeldin A inhibits the cytotoxicity of ricin, modeccin, and Pseudomonas toxin. Exp. Cell Res. 192, 389-395 (1991).
- Godber, B. Direct quantification of analyte concentration by resonant acoustic profiling. Clin. Chem. 51, 1962-1972 (2005).
- Bernardi, K. M., Forster, M. L., Lencer, W. I., Tsai, B. Derlin-1 facilitates the retro-translocation of cholera toxin. Mol. Biol. Cell. 19, 877-884 (2008).
- Wernick, N. L., De Luca, H., Kam, W. R., Lencer, W. I. N-terminal Extension of the Cholera Toxin A1-chain Causes Rapid Degradation after Retrotranslocation from Endoplasmic Reticulum to Cytosol. J. Biol. Chem. 285, 6145-6152 (2010).
- Simpson, J. C. Ricin A chain utilises the endoplasmic reticulum-associated protein degradation pathway to enter the cytosol of yeast. FEBS. Lett. 459, 80-84 (1999).
- Veithen, A., Raze, D., Locht, C. Intracellular trafficking and membrane translocation of pertussis toxin into host cells. Int. J. Med. Microbiol. 290, 409-413 (2000).
- Castro, M. G., McNamara, U., Carbonetti, N. H. Expression, activity and cytotoxicity of pertussis toxin S1 subunit in transfected mammalian cells. Cell. Microbiol. 3, 45-54 (2001).
- Schmitz, A., Herrgen, H., Winkeler, A., Herzog, V. Cholera toxin is exported from microsomes by the Sec61p complex. J. Cell Biol. 148, 1203-1212 (2000).
- Teter, K., Allyn, R. L., Jobling, M. G., Holmes, R. K. Transfer of the cholera toxin A1 polypeptide from the endoplasmic reticulum to the cytosol is a rapid process facilitated by the endoplasmic reticulum-associated degradation pathway. Infect. Immun. 70, 6166-6171 (2002).
- Winkeler, A., Godderz, D., Herzog, V., Schmitz, A. BiP-dependent export of cholera toxin from endoplasmic reticulum-derived microsomes. FEBS Lett. 554, 439-442 (2003).
- Yu, M., Haslam, D. B. Shiga toxin is transported from the endoplasmic reticulum following interaction with the luminal chaperone HEDJ/ERdj3. Infect. Immun. 73, 2524-2532 (2005).
- LaPointe, P., Wei, X., Gariepy, J. A role for the protease-sensitive loop region of Shiga-like toxin 1 in the retrotranslocation of its A1 domain from the endoplasmic reticulum lumen. J. Biol. Chem. 280, 23310-23318 (2005).
- Teter, K., Jobling, M. G., Sentz, D., Holmes, R. K. The cholera toxin A13 subdomain is essential for interaction with ADP-ribosylation factor 6 and full toxic activity but is not required for translocation from the endoplasmic reticulum to the cytosol. Infect. Immun. 74, 2259-2267 (2006).
- Redmann, V. Dislocation of ricin toxin a chains in human cells utilizes selective cellular factors. J. Biol. Chem. 286, 21231-21238 (2011).
- Yamaizumi, M., Mekada, E., Uchida, T., Okada, Y. One molecule of diphtheria toxin fragment A introduced into a cell can kill the cell. Cell. 15, 245-250 (1978).
- Bellisola, G. Reductive activation of ricin and ricin A-chain immunotoxins by protein disulfide isomerase and thioredoxin reductase. Biochem. Pharmacol. 67, 1721-1731 (2004).
- McKee, M. L., FitzGerald, D. J. Reduction of furin-nicked Pseudomonas exotoxin A: an unfolding story. Biochemistry. 38, 16507-16513 (1999).
- Orlandi, P. A. Protein-disulfide isomerase-mediated reduction of the A subunit of cholera toxin in a human intestinal cell line. J. Biol. Chem. 272, 4591-4599 (1997).
- Spooner, R. A. Protein disulphide-isomerase reduces ricin to its A and B chains in the endoplasmic reticulum. Biochem. J. 383, 285-293 (2004).
- Fujinaga, Y. Gangliosides that associate with lipid rafts mediate transport of cholera and related toxins from the plasma membrane to endoplasmic reticulm. Mol. Biol. Cell. 14, 4783-4793 (2003).
- Guerra, L. Cellular internalization of cytolethal distending toxin: a new end to a known pathway. Cell. Microbiol. 7, 921-934 (2005).
- Johannes, L., Tenza, D., Antony, C., Goud, B. Retrograde transport of KDEL-bearing B-fragment of Shiga toxin. J. Biol. Chem. 272, 19554-19561 (1997).
- Deeks, E. D. The low lysine content of ricin A chain reduces the risk of proteolytic degradation after translocation from the endoplasmic reticulum to the cytosol. Biochemistry. 41, 3405-3413 (2002).
- Hazes, B., Read, R. J. Accumulating evidence suggests that several AB-toxins subvert the endoplasmic reticulum-associated protein degradation pathway to enter target cells. Biochemistry. 36, 11051-11054 (1997).
- Rodighiero, C., Tsai, B., Rapoport, T. A., Lencer, W. I. Role of ubiquitination in retro-translocation of cholera toxin and escape of cytosolic degradation. EMBO Rep. 3, 1222-1227 (2002).
- Worthington, Z. E., Carbonetti, N. H. Evading the proteasome: absence of lysine residues contributes to pertussis toxin activity by evasion of proteasome degradation. Infect. Immun. 75, 2946-2953 (2007).
- Pande, A. H., Moe, D., Jamnadas, M., Tatulian, S. A., Teter, K. The pertussis toxin S1 subunit is a thermally unstable protein susceptible to degradation by the 20S proteasome. Biochemistry. 45, 13734-13740 (2006).
- Pande, A. H. Conformational instability of the cholera toxin A1 polypeptide. J. Mol. Biol. 374, 1114-1128 (2007).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon