É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Detecção de translocação Toxina no Citosol host por ressonância plasmon de superfície
Neste Artigo
Resumo
Neste relatório, nós descrevemos como ressonância de plasma de superfície é usado para detectar a entrada de toxinas para o citosol host. Este método altamente sensível pode fornecer dados quantitativos sobre a quantidade de toxina citosólica, e pode ser aplicado a uma variedade de toxinas.
Resumo
Toxinas AB consistem de uma subunidade enzimática A e uma célula de ligação da subunidade B 1. Estas toxinas são secretadas para o meio extracelular, mas agir de acordo com as metas dentro do citosol eucarióticas. Algumas viagens AB toxinas pelas transportadoras vesícula da superfície da célula para o retículo endoplasmático (ER) antes de entrar no citosol 2-4. Na ER, o dissocia catalítico Uma cadeia do resto da toxina e se move através de um canal condutor de proteína para atingir o seu objectivo citosólica 5. O translocados, a cadeia A citosólica é difícil de detectar porque o tráfico de toxinas para o ER é um processo extremamente ineficiente: a toxina mais internalizado é encaminhado para a lisossomos para degradação, portanto, apenas uma pequena fração da superfície-bound toxina atinge o aparelho de Golgi e ER 6 -12.
Para monitorar a translocação da toxina da ER para o citosol em cultura de células, nós combinamos um protocolo de fracionamento subcelular com o highly método de detecção sensível de ressonância plasmon de superfície (SPR) 13-15. A membrana plasmática das células tratadas com a toxina é seletivamente permeabilizadas com digitonina, permitindo cobrança de uma fração citosólica que posteriormente é perfundido durante um sensor de SPR revestido com uma toxina anti-Um anticorpo cadeia. O sensor de anticorpos revestido pode capturar e detectar pg / mL quantidades de toxina citosólica. Com este protocolo, é possível acompanhar a cinética de entrada de toxinas para o citosol e caracterizar efeitos inibitórios sobre o evento de translocação. A concentração de toxina citosólica também pode ser calculado a partir de uma curva padrão gerada com quantidades conhecidas de A cadeia de padrões que foram perfundidos sobre o sensor. Nosso método representa uma resposta rápida, sensível sistema de detecção e quantitativas que não requer marcação radioactiva ou outras modificações à toxina alvo.
Protocolo
1. Preparação de digitonina
- Adicionar 500 mL de etanol a 100% para um tubo de microcentrífuga e colocá-lo em um bloco de aquecimento fixado em 80 ° C por 10 min.
- Dissolver 2,5 mg de digitonina em 250 mL de etanol aquecido para produzir uma solução estoque de 1% do digitonina.
- Para gerar uma solução de trabalho de digitonina 0,04%, adicionar 40 mL da solução estoque para 960 mL digitonina de HCN tampão (50 mM Hepes pH 7,5, 150 mM NaCl, 2 mM CaCl 2, 10 mM N-etilmaleimida, e um inibidor de protease cocktail).
2. Intoxicação celular e permeabilização
Nosso ensaio translocação pode ser aplicado a uma variedade de toxinas e linhas celulares. Abaixo, fornecemos um protocolo detalhado para a detecção de toxina da cólera (CT). Uma visão geral do processo é fornecido na Figura 1.
- Células HeLa são semeados em 6 bem-placas contendo 1 mL DMEM suplementado com 10% de soro fetal bovino e antibiótico antimicóticopara alcançar 1x10 6 células / poço após uma incubação overnight a 37 ° C. Para gerar a toxina citosólica suficiente para a detecção reprodutível, poços triplicado são necessários para cada condição.
- Após uma incubação durante a noite, substituir o meio de cultura com 1 mL DMEM contendo 100 ng / mL de gangliosídeo GM1. Isso aumenta o número de sítios de ligação para CT, como o receptor GM1 de CT irá intercalar na membrana plasmática das células expostas a uma solução de GM1.
- Após incubação de 1 hora a 37 ° C, remova a mídia contendo GM1 e lavar as células duas vezes com DMEM. Em seguida, coloque as células a 4 ° C por 30 min em 1 mL DMEM contendo 1 mg / mL de CT.
- Remover o meio-toxina contendo, lave as células duas vezes com DMEM, e incubar as células em 1 mL DMEM a 37 ° C para o intervalo de tempo desejado (s).
- No final de cada período de perseguição, lavar as células com PBS e incubar cada poço com 250 mL de 0,5 mM EDTA em PBS. Permitir que as células se sentar por 10 min à temperatura ambiente e depois removê-los da placa de 6 poços por trituração com um vigoroso Pipetman p1000. Depois de um bem de células tiver sido coletado, combiná-lo com o segundo eo terceiro, em seguida, bem de mesma condição. Raspadores de células também pode ser usado para coletar as células.
- Coloque a suspensão de células combinadas dos três poços replicar (750 mL de volume total) em um tubo de microcentrífuga único, e girá-lo em uma microcentrífuga de mesa por 5 min a 5.000 x g. Pellets de células de tamanho equivalente deve ser obtido para todas as condições.
- Desprezar o sobrenadante e ressuspender o pellet celular em 100 mL da solução de trabalho de 0,04% digitonina. Coloque a suspensão de células em gelo por 10 min.
- Spin the células digitonina-permeabilizadas a 16.000 xg por 10 min em uma microcentrífuga de mesa. Alienar a fração citosol contendo sobrenadante para um tubo de microcentrífuga fresco e manter a organela contendo fração pellet.
- Citosol contendo frações sobrenadante são diluídos em tampão HCN para um volume final de 1 mL. Volumes de amostra de pelo menos 1 mL são necessários para assegurar o ar é extraído do loop de amostra 500 mL antes da injeção.
- Frações organela contendo pellet ressuspenso estão em 1 mL de HCN tampão contendo 1% Triton X-100. Além de detergente é necessário para liberar o pool de membrana-nham de toxina.
- Padrões de toxina em concentrações de 100, 10, 1 e 0,1 ng / mL são preparadas em tampão HCN.
- Conjuntos paralelos de frações citosólica e organela estão preparados para um experimento de controle para confirmar a fidelidade do processo de fracionamento. Frações gerados conforme descrito na Seção 2 são ressuspenso em 20 mL de tampão de amostra 4x (fração citosólica) ou 120 mL de 1x tampão de amostra (fração organela). Volumes equivalentes de cada fração são resolvidos por eletroforese em gel de sulfato de sódio dodecil poliacrilamida e sondado by análise de Western blot para demonstrar a separação de uma proteína citosólica na fração sobrenadante e um solúvel, proteína ER residente na fração pellet 16-19.
4. SPR preparação da lâmina
- A Reichert SR7000 Refratômetro SPR é usada para experimentos SPR.
- Definir uma lâmina de vidro banhado a ouro com uma monocamada auto-montada no instrumento SPR. Para ativar o slide sensor, perfundir de 1:1 (v: v) solução de 0,4 M EDC e 0,1 M NHS sobre a lâmina por 10 min a uma vazão de 41 mL / min. Todas as perfusões subsequentes irão utilizar o mesmo caudal.
- Para remover o EDC: NHS tampão de ativação, lavar a placa por 5 minutos com PBS contendo 0,05% Tween 20 (PBST). A placa contém agora amarras amida reativa devido a desoperculação pela EDC: solução NHS.
- Perfundir um anticorpo anti-CTA sobre o slide sensor ativado com uma diluição de 1:20.000 em 20 mM de acetato de sódio (pH 5,5) por 15 min. Uma queda inicial na refração emdex unidade (RIU) serão vistos devido à mudança de pH. Isto será seguido por um aumento no RIU como o anticorpo é capturado pelos amarras amida-reativa no slide sensor.
- Remover os anticorpos não ligados a partir do slide sensor com uma lavagem PBST 5 minutos. RIU o sinal produzido pelo anticorpo captada planalto e estabilizar, fornecendo um sinal de nova linha de base.
- Perfundir 1 M etanolamina (pH 8,5) sobre o slide sensor para 5 min. Este bonés e inativa qualquer amarras unbound esquerdo no slide sensor.
5. SPR análise de amostras
- Para estabelecer uma leitura inicial, PBST perfundir sobre o sensor de anticorpos revestido por 5 min.
- Perfundir uma amostra ou padrão experimental da toxina sobre o sensor de 300 seg. Remover o ligante do buffer e PBST perfundir sobre o sensor para outra sec 200.
- Após cada perfusão, a toxina ligada é removida do sensor por uma lavagem sec 100 com PBST, pH 5.0. Isso irá retornar o sinala sua leitura inicial básica, permitindo assim uma outra amostra a ser processada no mesmo sensor.
- Antes de carregar uma nova amostra, empurrar uma pequena quantidade de ar através do loop de amostra para expulsar qualquer líquido residual da amostra anterior. Usando o procedimento descrito em 5,2-5,4, temos executado até 12 amostras em um slide sem perda substancial do sinal de linha de base.
- A análise dos dados é realizada com o 2 Scrubber software, eo software Igor é usado para a preparação de figura.
6. Resultados representante
Toxina pertussis (PT) é uma toxina AB que se move a partir da superfície da célula para o ER antes de sua Uma cadeia (PTS1) entra no citosol 3, 12. Conforme mostrado na Figura 2, o nosso ensaio de translocação SPR baseado poderia detectar PTS1 no citosol de células CHO intoxicado. Nenhum sinal foi gerado a partir do citosol de células unintoxicated, que confirmou o anticorpo anti-PTS1 não reagem de forma cruzada com um componente do citosol host. Ofração citosólica das células intoxicadas na presença de brefeldin A (BFA) também não conseguiu produzir um sinal positivo. BfA impede o transporte de toxinas para a translocação ER 6-8 site, 12, 20-25 e, assim, uma cadeia de fornecimento para o citosol. No final de cada execução, a toxina ligada é despojado do slide sensor. Este amostras permitiu múltiplas para ser exibido em um slide único sensor e, assim, desde uma comparação direta entre os resultados obtidos com diferentes condições experimentais.
CT é um outro tipo AB-, ER-translocação de toxinas 4. Na Figura 3A, CTA1 foi detectada na fração citosólica das células HeLa CT-tratados. Este enfatizou que a nossa metodologia trabalha com vários tipos de células e pode ser aplicado a qualquer toxina para o qual um anticorpo anti-A cadeia está disponível. Nenhum sinal foi detectado quando a fração citosólica de CT células tratadas foi perfundido durante um sensor de SPR revestido com um anticorpo anti-CTB (Fig. 3B), demonstrando assim que o CTA1subunidade, mas não a célula-binding CTB pentâmero entra no citosol. Figura 3C mostra o sinal da fração organela é fora de escala em comparação com o sinal mais fraco da fração citosólica. Isto foi consistente com a ineficiência conhecida de CT transporte para o local de translocação ER 6, 7, que por sua vez limita a quantidade de toxina que pode chegar ao citosol. Além disso, a fração organela contém CT holotoxin bem como ER-CTA1 localizada, de modo que o sinal resultante SPR para a fração organela é inflado pela massa adicional do holotoxin associado CTB pentâmero. Assim, não é prático para plotar dados das frações organela e citosólico na sensorgram mesmo.
Nosso ensaio pode monitorar o acúmulo dependente do tempo de toxina, translocado citosólica (Fig. 4). As células foram expostas à CT a 4 ° C, uma temperatura que permite a ligação da toxina para a membrana plasmática, mas impede a internalização da toxina associados a células. Após a removal de toxina não ligada, as células foram aquecidos a 37 ° C. Tanto o transporte de toxinas para o ER e A translocação da cadeia para o citosol pode ocorrer nesta temperatura. Nenhuma toxina foi detectado no citosol 15 minutos após o aquecimento a 37 ° C. Isso é reflexo do tempo de atraso necessário para (i) tráfico holotoxin ao ER, (ii) A / dissociação da subunidade B na ER, e (iii) Uma cadeia de exportação para o citosol. A piscina pequena de toxina citosólica foi detectada após 30 minutos a 37 ° C, e as quantidades progressivamente maiores de toxina citosólicas foram detectados após o 45 e 60 minutos de intervalo perseguição. Níveis ainda maiores de toxina citosólicos foram detectados após um intervalo de cinco horas de perseguição 17, demonstrando assim um contínuo, entrega a longo prazo de células associadas a toxina para o citosol host.
Nosso ensaio também pode detectar a inibição da translocação de toxinas para o citosol (Fig. 5). Células tratadas com 10% de dimetil sulfóxido (DMSO), uma chaperone químico que impede a Disord térmicaEring da subunidade CTA1 isolado (T. e K. Banerjee Teter, observações não publicadas), apresentaram níveis baixos de CTA1 citosólica em comparação às células não tratadas. Desdobramento da toxina A cadeia é um pré-requisito para a translocação para o citosol 16-18, para a estabilização DMSO induzida de CTA1 consequentemente impedido o seu movimento a partir do ER para o citosol.
A taxa de associação constante (k a) calculado a partir de experimentos SPR é diretamente proporcional à concentração de ligante no buffer de perfusão 14, 15, 26. Assim, é possível determinar a concentração de toxina citosólica a partir de um gráfico que traça o k a valores para os padrões de toxinas como uma função da concentração de toxina. Este procedimento foi utilizado para quantificar o bloco DMSO induzida por toxina de translocação apresentados na Figura 5: a curva padrão gerada a partir de concentrações conhecidas de toxina foi utilizada para calcular uma citosólica CTA1 concentration de 0,3 ng / mL para células não tratadas e 0,1 ng / mL para células tratadas com DMSO (Fig. 6). A inibição da CTA1 desdobramento de DMSO, portanto, gerou uma redução de 3 vezes na translocação ER-to-citosol de CTA1.

Figura 1. Protocolo Geral. (A) As células são incubadas com a toxina AB a 4 ° C, uma temperatura que permite a ligação da toxina à superfície da célula, mas impede endocitose toxina. As subunidades A e B da toxina são representados por círculos vermelho e azul, respectivamente. (B) A toxina não ligado é removido do meio, e as células são aquecidas a 37 ° C, a fim de promover o transporte endocitose e retrógrada da holotoxin ao pronto-socorro. Holotoxin dissociação ocorre na ER, o que permite que a corrente Um isolado para entrar no citosol pela passagem através de um canal condutor de proteína (s) na membrana ER. (C) As células são tratadas com digitonina seletivamente, a fim de permeabilizar o plasmamembrana. (D) A centrifugação é usada para particionar as células em separado frações citosólica e organela. O citosol é espremido para fora da célula através dos poros digitonina gerado e está localizado no sobrenadante. O intactos, ligada à membrana organelas são encontradas na fração pellet. (E) Para detectar a piscina translocado da cadeia de toxina no citosol anfitrião, a fração sobrenadante é perfundido durante um sensor de SPR revestido com um anti-A cadeia de anticorpo.
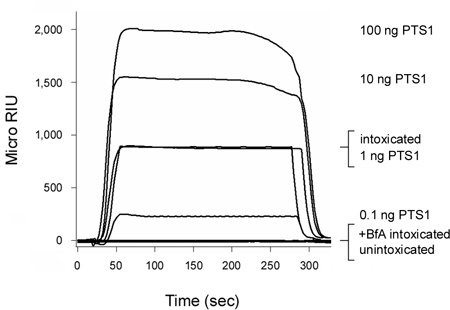
Figura 2. Detecção de PTS1 translocação para o citosol host. Células CHO foram de pulso marcado com a 4 ° C por 30 min com 1 mg / mL da PT. As células foram então perseguidos por 3 hr a 37 ° C em meio livre de toxinas que não contenham adições (embriagado) ou 5 mg BfA / mL (+ BfA intoxicado). Permeabilização da membrana plasmática com digitonina foi usado para extratos de células partição em separado e organela fracti citosólicaons. Um sensor de SPR revestido com um anticorpo anti-PTS1 foi usado para detectar a piscina citosólica de PTS1 a partir de células não tratadas ou BfA-tratada. PTS1 padrões foram perfundidos sobre o sensor como controle positivo, enquanto a fração citosólica das células unintoxicated foi perfundido sobre o slide do sensor como controle negativo. No final de cada execução, a amostra foi obrigado despojado do slide sensor.

Figura 3. Detecção de CTA1 translocação para o citosol host. Células HeLa pulso marcado com a 4 ° C com 1 mg / mL de CT foram perseguidos por 2 horas a 37 ° C em meio livre de toxinas que não contenham adições (embriagado) ou 5 mg BfA / mL (+ BfA intoxicado). Permeabilização da membrana plasmática com digitonina foi usado para extratos de células partição em separado organela e frações citosólica. (A) As frações citosólica foram perfundidos por um sensor de SPR revestido com um anticorpo anti-CTA. Conhecidoquantidades de CTA foram utilizados como controle positivo, enquanto o citosol das células unintoxicated foi usada como controle negativo. (B) A fração citosólica das células intoxicadas na ausência de BfA foi perfundido durante um sensor de SPR revestido com um anticorpo anti-CTB. A purificada CTB pentâmero foi perfundido sobre o slide como um controle positivo. (C) A fração organela foi solubilizado com 1% Triton X-100 antes de perfusão mais de um sensor de SPR revestido com um anticorpo anti-CTA. Para fins comparativos, a fração citosólica (1 volume mL final) a partir do extrato mesma célula e um padrão CTA também foram perfundidos sobre o sensor. Para todos os painéis, a amostra foi obrigado despojado do sensor no final de cada execução.

Figura 4. Cinética de CTA1 entrada no citosol. Células HeLa pulso marcado com a 4 ° C com 1 mg / mL de CT foram perseguidos por 15, 30, 45 ou 60 min a 37 ° C em toxina-livre medium. Para detectar a piscina translocado da toxina, frações citosólica de digitonina-permeabilizadas células foram perfundidos mais de um sensor de SPR revestido com um anticorpo anti-CTA. Padrões CTA foram perfundidos sobre o sensor também. No final de cada execução, a amostra foi obrigado despojado do slide sensor.
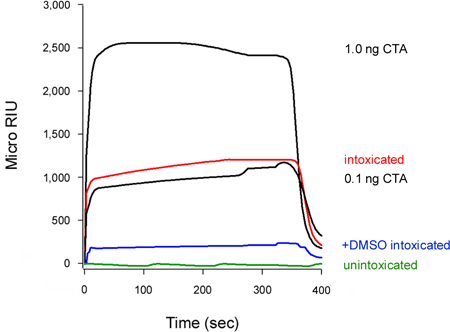
Figura 5. Inibição da translocação CTA1 pelo DMSO. Células HeLa pulso marcado com a 4 ° C com 1 mg / mL de CT foram perseguidos por 2 horas a 37 ° C em meio livre de toxinas que não contenham adições (embriagado) ou DMSO 10% (+ DMSO intoxicado). Para detectar a piscina translocado da toxina, frações citosólica de digitonina-permeabilizadas células foram perfundidos mais de um sensor de SPR revestido com um anticorpo anti-CTA. CTA padrões (100, 10, 1 e 0,1 ng / mL) foram perfundidos sobre o sensor como controle positivo, apenas a 1 e 0,1 ng / mL padrões são apresentados para fins de dimensionamento. Citosol de unintoxicated células foi usada como controle negativo. No final de cada execução, a amostra foi obrigado despojado do slide sensor.
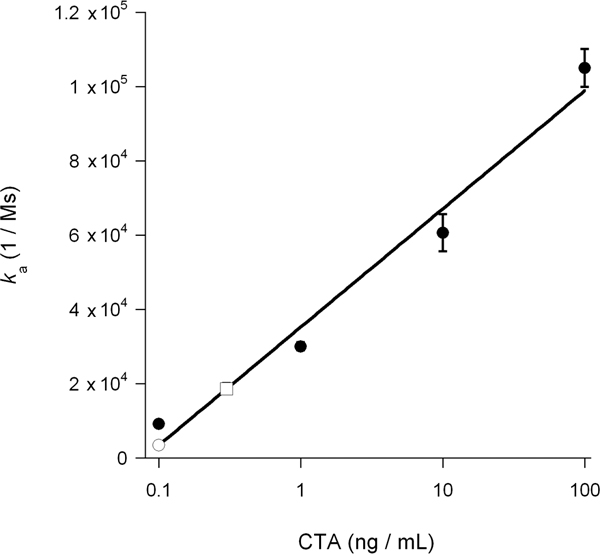
Figura 6. Cálculo do CTA1 citosólica. K a valores das normas CTA da Figura 5 foram plotados em função da concentração da toxina. A curva resultante padrão foi usado para determinar, com base nos valores k uma das amostras experimentais da Figura 5, a concentração de CTA1 citosólico em células não tratadas e tratadas com DMSO. Padrões de toxinas são apresentados como círculos preenchidos; citosol não tratada é apresentado como uma praça aberta, eo citosol DMSO-tratada é apresentado como um círculo aberto. As médias ± intervalos de dois experimentos independentes são mostrados.
Access restricted. Please log in or start a trial to view this content.
Discussão
Comparação com a metodologia existente
Nosso ensaio translocação SPR baseado representa um método rápido, sensível, e quantitativa para detectar entrega toxina no citosol host. A técnica não requer marcação radioactiva ou outras modificações à toxina, e pode ser aplicado a qualquer toxina para o qual um anti-toxina Um anticorpo cadeia está disponível. Métodos existentes para monitorar a passagem de toxinas para o citosol também dependem de um protocolo de fracionamento subcel...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Este trabalho foi financiado pelo NIH conceder R01 AI073783 para K. Teter. Agradecemos ao Dr. Shane Massey para obter assistência no desenvolvimento do fracionamento subcelular de protocolo e Helen Burress para a leitura crítica do manuscrito.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | |
| Digitonina | Sigma | D141 | |
| Etanol | Acros | 61509-0010 | |
| DMEM | Invitrogen | 11995065 | |
| Soro fetal bovino | Atlanta Biologicals | S11550 | |
| Gangliosídeo GM1 | Sigma | G7641 | |
| CTA | Sigma | C2398 | |
| PTS1 | Lista | 182 | |
| NHS (N-Hydroxysuccinimide) | Perfurar | 24500 | |
| EDC (1-etil-3-(3-dimetilaminopropil) carbodiimida) | Thermo Scientific | 22981 | |
| Etanolamina | Sigma | E0135 | |
| PBST | Medicago | 09-8903-100 | |
| Anti-CTA de anticorpos | Santa Cruz Biotech | sc-80747 | |
| Anticorpo anti-CTB | Calbiochem | 227040 | |
| Anticorpos anti-PTS1 | Santa Cruz Biotech | sc-57639 | |
| Refratômetro | Reichert | SR7000, SR7000DC | |
| SPR sensor de slides | Reichert | 13206060 | |
| Bomba de seringa | Cole Palmer | 780200C |
Referências
- Sandvig, K., van Deurs, B. Membrane traffic exploited by protein toxins. Annu. Rev. Cell Dev. Biol. 18, 1-24 (2002).
- Watson, P., Spooner, R. A. Toxin entry and trafficking in mammalian cells. Adv. Drug Deliv. Rev. 58, 1581-1596 (2006).
- Carbonetti, N. H. Pertussis toxin and adenylate cyclase toxin: key virulence factors of Bordetella pertussis and cell biology tools. Future Microbiol. 5, 455-469 (2010).
- Wernick, N. L. B., Chinnapen, D. J. -F., Cho, J. A., Lencer, W. I. Cholera toxin: an intracellular journey into the cytosol by way of the endoplasmic reticulum. Toxins. 2, 310-325 (2010).
- Lord, J. M., Roberts, L. M., Lencer, W. I. Entry of protein toxins into mammalian cells by crossing the endoplasmic reticulum membrane: co-opting basic mechanisms of endoplasmic reticulum-associated degradation. Curr. Top. Microbiol. Immunol. 300, 149-168 (2005).
- Lencer, W. I. Entry of cholera toxin into polarized human intestinal epithelial cells. Identification of an early brefeldin A sensitive event required for A1-peptide generation. J. Clin. Invest. 92, 2941-2951 (1993).
- Orlandi, P. A., Curran, P. K., Fishman, P. H. Brefeldin A blocks the response of cultured cells to cholera toxin. Implications for intracellular trafficking in toxin action. J. Biol. Chem. 268, 12010-12016 (1993).
- Sandvig, K., Prydz, K., Hansen, S. H., van Deurs, B. Ricin transport in brefeldin A-treated cells: correlation between Golgi structure and toxic effect. J. Cell. Biol. 115, 971-981 (1991).
- Sandvig, K., Prydz, K., Ryd, M., van Deurs, B. Endocytosis and intracellular transport of the glycolipid-binding ligand Shiga toxin in polarized MDCK cells. J. Cell Biol. 113, 553-562 (1991).
- van Deurs, B. Estimation of the amount of internalized ricin that reaches the trans-Golgi network. J. Cell Biol. 106, 253-267 (1988).
- Tam, P. J., Lingwood, C. A. Membrane cytosolic translocation of verotoxin A1 subunit in target cells. Microbiology. 153, 2700-2710 (2007).
- Plaut, R. D., Carbonetti, N. H. Retrograde transport of pertussis toxin in the mammalian cell. Cell. Microbiol. 10, 1130-1139 (2008).
- Willander, M., Al-Hilli, S. Analysis of biomolecules using surface plasmons. Methods Mol. Biol. 544, 201-229 (2009).
- Homola, J. Present and future of surface plasmon resonance biosensors. Anal. Bioanal. Chem. 377, 528-539 (2003).
- Medaglia, M. V., Fisher, R. J. Protein-Protein Interactions. Golemis, E. , Cold Spring Harbor Laboratory Press. Cold Spring Harbor, New York. 255-272 (2002).
- Banerjee, T. Contribution of subdomain structure to the thermal stability of the cholera toxin A1 subunit. Biochemistry. 49, 8839-8846 (2010).
- Massey, S. Stabilization of the tertiary structure of the cholera toxin A1 subunit inhibits toxin dislocation and cellular intoxication. J. Mol. Biol. 393, 1083-1096 (2009).
- Taylor, M. A therapeutic chemical chaperone inhibits cholera intoxication and unfolding/translocation of the cholera toxin A1 subunit. PLoS ONE. 6, e18825-e18825 (2011).
- Taylor, M. Hsp90 is required for transfer of the cholera toxin A1 subunit from the endoplasmic reticulum to the cytosol. J. Biol. Chem. 285, 31261-31267 (2010).
- Donta, S. T., Beristain, S., Tomicic, T. K. Inhibition of heat-labile cholera and Escherichia coli enterotoxins by brefeldin A. Infect. Immun. 61, 3282-3286 (1993).
- Donta, S. T., Tomicic, T. K., Donohue-Rolfe, A. Inhibition of Shiga-like toxins by brefeldin. A. J. Infect. Dis. 171, 721-724 (1995).
- Nambiar, M. P., Oda, T., Chen, C., Kuwazuru, Y., Wu, H. C. Involvement of the Golgi region in the intracellular trafficking of cholera toxin. J. Cell. Physiol. 154, 222-228 (1993).
- Rapak, A., Falnes, P. O., Olsnes, S. Retrograde transport of mutant ricin to the endoplasmic reticulum with subsequent translocation to cytosol. Proc. Natl. Acad. Sci. U. S. A. 94, 3783-3788 (1997).
- Xu, Y., Barbieri, J. T. Pertussis toxin-mediated ADP-ribosylation of target proteins in Chinese hamster ovary cells involves a vesicle trafficking mechanism. Infect. Immun. 63, 825-832 (1995).
- Yoshida, T., Chen, C. C., Zhang, M. S., Wu, H. C. Disruption of the Golgi apparatus by brefeldin A inhibits the cytotoxicity of ricin, modeccin, and Pseudomonas toxin. Exp. Cell Res. 192, 389-395 (1991).
- Godber, B. Direct quantification of analyte concentration by resonant acoustic profiling. Clin. Chem. 51, 1962-1972 (2005).
- Bernardi, K. M., Forster, M. L., Lencer, W. I., Tsai, B. Derlin-1 facilitates the retro-translocation of cholera toxin. Mol. Biol. Cell. 19, 877-884 (2008).
- Wernick, N. L., De Luca, H., Kam, W. R., Lencer, W. I. N-terminal Extension of the Cholera Toxin A1-chain Causes Rapid Degradation after Retrotranslocation from Endoplasmic Reticulum to Cytosol. J. Biol. Chem. 285, 6145-6152 (2010).
- Simpson, J. C. Ricin A chain utilises the endoplasmic reticulum-associated protein degradation pathway to enter the cytosol of yeast. FEBS. Lett. 459, 80-84 (1999).
- Veithen, A., Raze, D., Locht, C. Intracellular trafficking and membrane translocation of pertussis toxin into host cells. Int. J. Med. Microbiol. 290, 409-413 (2000).
- Castro, M. G., McNamara, U., Carbonetti, N. H. Expression, activity and cytotoxicity of pertussis toxin S1 subunit in transfected mammalian cells. Cell. Microbiol. 3, 45-54 (2001).
- Schmitz, A., Herrgen, H., Winkeler, A., Herzog, V. Cholera toxin is exported from microsomes by the Sec61p complex. J. Cell Biol. 148, 1203-1212 (2000).
- Teter, K., Allyn, R. L., Jobling, M. G., Holmes, R. K. Transfer of the cholera toxin A1 polypeptide from the endoplasmic reticulum to the cytosol is a rapid process facilitated by the endoplasmic reticulum-associated degradation pathway. Infect. Immun. 70, 6166-6171 (2002).
- Winkeler, A., Godderz, D., Herzog, V., Schmitz, A. BiP-dependent export of cholera toxin from endoplasmic reticulum-derived microsomes. FEBS Lett. 554, 439-442 (2003).
- Yu, M., Haslam, D. B. Shiga toxin is transported from the endoplasmic reticulum following interaction with the luminal chaperone HEDJ/ERdj3. Infect. Immun. 73, 2524-2532 (2005).
- LaPointe, P., Wei, X., Gariepy, J. A role for the protease-sensitive loop region of Shiga-like toxin 1 in the retrotranslocation of its A1 domain from the endoplasmic reticulum lumen. J. Biol. Chem. 280, 23310-23318 (2005).
- Teter, K., Jobling, M. G., Sentz, D., Holmes, R. K. The cholera toxin A13 subdomain is essential for interaction with ADP-ribosylation factor 6 and full toxic activity but is not required for translocation from the endoplasmic reticulum to the cytosol. Infect. Immun. 74, 2259-2267 (2006).
- Redmann, V. Dislocation of ricin toxin a chains in human cells utilizes selective cellular factors. J. Biol. Chem. 286, 21231-21238 (2011).
- Yamaizumi, M., Mekada, E., Uchida, T., Okada, Y. One molecule of diphtheria toxin fragment A introduced into a cell can kill the cell. Cell. 15, 245-250 (1978).
- Bellisola, G. Reductive activation of ricin and ricin A-chain immunotoxins by protein disulfide isomerase and thioredoxin reductase. Biochem. Pharmacol. 67, 1721-1731 (2004).
- McKee, M. L., FitzGerald, D. J. Reduction of furin-nicked Pseudomonas exotoxin A: an unfolding story. Biochemistry. 38, 16507-16513 (1999).
- Orlandi, P. A. Protein-disulfide isomerase-mediated reduction of the A subunit of cholera toxin in a human intestinal cell line. J. Biol. Chem. 272, 4591-4599 (1997).
- Spooner, R. A. Protein disulphide-isomerase reduces ricin to its A and B chains in the endoplasmic reticulum. Biochem. J. 383, 285-293 (2004).
- Fujinaga, Y. Gangliosides that associate with lipid rafts mediate transport of cholera and related toxins from the plasma membrane to endoplasmic reticulm. Mol. Biol. Cell. 14, 4783-4793 (2003).
- Guerra, L. Cellular internalization of cytolethal distending toxin: a new end to a known pathway. Cell. Microbiol. 7, 921-934 (2005).
- Johannes, L., Tenza, D., Antony, C., Goud, B. Retrograde transport of KDEL-bearing B-fragment of Shiga toxin. J. Biol. Chem. 272, 19554-19561 (1997).
- Deeks, E. D. The low lysine content of ricin A chain reduces the risk of proteolytic degradation after translocation from the endoplasmic reticulum to the cytosol. Biochemistry. 41, 3405-3413 (2002).
- Hazes, B., Read, R. J. Accumulating evidence suggests that several AB-toxins subvert the endoplasmic reticulum-associated protein degradation pathway to enter target cells. Biochemistry. 36, 11051-11054 (1997).
- Rodighiero, C., Tsai, B., Rapoport, T. A., Lencer, W. I. Role of ubiquitination in retro-translocation of cholera toxin and escape of cytosolic degradation. EMBO Rep. 3, 1222-1227 (2002).
- Worthington, Z. E., Carbonetti, N. H. Evading the proteasome: absence of lysine residues contributes to pertussis toxin activity by evasion of proteasome degradation. Infect. Immun. 75, 2946-2953 (2007).
- Pande, A. H., Moe, D., Jamnadas, M., Tatulian, S. A., Teter, K. The pertussis toxin S1 subunit is a thermally unstable protein susceptible to degradation by the 20S proteasome. Biochemistry. 45, 13734-13740 (2006).
- Pande, A. H. Conformational instability of the cholera toxin A1 polypeptide. J. Mol. Biol. 374, 1114-1128 (2007).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados