需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
表面等离子体共振检测到宿主细胞质的毒素易位
摘要
在这份报告中,我们描述了表面等离子体共振是如何用来检测输入到宿主细胞质中的毒素。胞浆内毒素量,这个高度敏感的方法可以提供定量数据,并可以应用到一系列的毒素。
摘要
AB毒素组成的酶的A亚单位和一个细胞结合B 亚基 1 。这些毒素分泌到细胞外的环境,但他们的行为于真核细胞质内的目标。有些AB毒素旅游载体囊泡从细胞表面的内质网(ER),才进入细胞质2-4。在急诊室,不赞成从其余的毒素和移动通过一种蛋白质,在进行渠道的催化A链,以达到其胞质目标 5 。易位,胞质链是难以察觉,因为毒素贩运到急诊室是一个非常低效的过程:路由到最内在毒素降解的溶酶体,所以只有一小部分的表面结合的毒素达到高尔基体和ER 6 -12。
为了监视从ER在培养细胞的细胞质中的毒素易位,我们结合highl亚细胞分馏协议y的表面等离子体共振(SPR)13-15敏感的检测方法。毒素处理细胞的细胞膜选择性通透与毛地黄皂苷,使收集的一个细胞质部分,这是对涂有抗毒素A链抗体的SPR传感器随后灌注。抗体包传感器,可以捕捉和检测pg / mL的胞浆内毒素的数量。有了这个协议,它是可以遵循的毒素进入到细胞质的动力学特征易位事件的抑制作用。胞浆内毒素的浓度也可以从已知数量的A链已灌注在传感器的标准生成标准曲线计算。我们的方法代表了一种快速,敏感,定量检测系统不需要放射性标记或其他修改目标毒素。
研究方案
1。对毛地黄皂苷的制备
- 离心管加入500μL100%的乙醇,并将其放置在在80℃10分钟的热块。
- 溶解在加热乙醇250μL2.5毫克毛地黄皂苷产生的毛地黄皂苷1%原液。
- 要产生0.04%毛地黄皂苷的工作液,添加40μL毛地黄皂苷原液HCN的缓冲液960μL(50 mM的HEPES pH值7.5,150 mM氯化钠,氯化钙2 2毫米,10毫米的N - ethylmaleimide,和一种蛋白酶抑制剂鸡尾酒)。
2。细胞中毒和通透性
我们的易位检测可应用于一系列的毒素和细胞株。下面,我们提供了一个详细的协议检测霍乱毒素(CT)。在图1提供程序概述。
- HeLa细胞接种于6孔板,含有1毫升的DMEM,10%的补充小牛血清和抗生素antimycotic要达到1 × 10 6细胞/后孵育过夜,于37 ° C。为了产生足够的重复性检测胞浆内毒素,一式三份井要求每个条件。
- 孵育过夜后,更换培养液,用DMEM培养液1毫升含有100毫微克/毫升神经节苷脂。这增加了CT结合位点的数量,神经节苷脂受体的CT插质膜进入细胞暴露到GM1的解决方案。
- 1小时孵化后在37 ° C,删除GM1介质中,用DMEM洗细胞两次。然后,将细胞在4 ° C为30分钟,在1毫升的DMEM含有1微克/毫升的CT。
- 毒素介质中取出,用DMEM洗细胞两次,在1毫升的DMEM培养的细胞,在37 ° C为所需的时间间隔(S)。
- 在每个程序期间结束,用PBS洗涤细胞,每孔250μL0.5 mM的EDTA的PBS孵育。让细胞坐在10 min,室温,然后从6孔板,他们积极与P1000 pipetman trituration。一个细胞以及已被收集后,结合第二,以及来自相同的条件下,然后第三。细胞刮刀也可用于收集细胞。
- 从三个复制井在一个单一的离心管(750μL总体积),合并后的细胞悬液,并在桌面离心5分钟旋转5000小工规模大致相当于细胞沉淀应获得的所有条件。
- 弃上清,重悬细胞沉淀在100μL0.04%毛地黄皂苷的解决方案。将细胞悬液,冰浴10分钟。
- 旋转16,000桌面离心10分钟XG毛地黄皂苷透细胞。细胞质含有上清转移到一个新的离心管中,并保留的细胞器中的颗粒分数。
- 胞浆含上清组分HCN的缓冲区最终体积为1 mL稀释。至少有1毫升的样本量是必要的,以确保空气是从500μL样品环注射前清除。
- 细胞器含颗粒组分悬浮于1毫升氢氰酸含有1%的Triton X - 100的缓冲。洗涤剂除了是要释放的毒素膜包裹池。
- 毒素在浓度为100,10,1,和0.1毫微克/毫升的标准,是在HCN的缓冲区。
- 细胞质和细胞器组分的并行准备对照实验,以确认的分馏过程中的保真度。分数产生重悬于20μL4倍样品缓冲液(细胞质分数)或120μL1X上样缓冲液(细胞器的一小部分),在第2节描述。每个分数的等效卷十二烷基硫酸钠聚丙烯酰胺凝胶电泳和探讨解决bŸ Western blot分析证明胞浆蛋白在上清分区和一个可溶性,居民中ER蛋白的颗粒分数16-19。
4。 SPR幻灯片准备
- 赖克特SR7000 SPR折射用于SPR的实验。
- 设置在自组装膜的SPR仪器的镀金玻片上。要激活传感器的幻灯片,灌注一个1:1(V:V),0.4 M EDC和0.1 M的NHS的解决方案在41μL/ min的流速在10分钟的幻灯片。所有后续灌注将使用相同的流速。
- 要删除的EDC:NHS的激活缓冲区,洗5分钟,用含0.05%吐温20(PBST)的板块。现在该板块包含活性酰胺系绳由于uncapping由EDC:NHS的解决方案。
- 灌注反注册税务师抗体在20毫米醋酸钠(pH值5.5)15分钟的幻灯片在1:20,000稀释激活传感器。在屈光的初始下降DEX单位(区情报组)将被视为由于pH值的变化。这之后,将增加在区情报组的抗体捕获传感器幻灯片酰胺反应的系绳。
- PBST洗涤5分钟的传感器幻灯片中删除未结合抗体。 RIU信号捕获抗体的产生将高原和稳定,提供了一个新的基准信号。
- 灌注1米乙醇胺(pH值8.5),超过5分钟的传感器幻灯片。这帽子和灭活任何未绑定的传感器幻灯片上留下的系绳。
5。 SPR的分析样本
- 要建立一个基线阅读,超过5分钟的抗体包被传感器灌注PBST。
- 300秒,灌注实验样品在传感器或毒素标准。删除从200秒的配体的缓冲区,并在传感器灌注PBST。
- 每个灌注,势必毒素是从传感器,100秒,在pH值5.0 PBST洗涤。这将返回的信号其初始基准读数,从而使另一个样品相同的传感器处理。
- 在加载一个新的样品,通过样品回路推了少量空气,驱逐从之前样品的任何残留液。使用在5.2-5.4所述的程序,我们已经运行12个样品上一张幻灯片没有重大损失的基准信号。
- 搓擦2软件进行数据分析,和伊图编制软件。
6。代表性的成果
百日咳毒素(PT)是一种AB毒素从细胞表面移动到急诊室前一个链(PTS1)进入细胞质中,12。正如图2所示,我们基于SPR -易位检测可以检测PTS1陶醉CHO细胞的细胞质。无信号产生unintoxicated细胞的细胞质中,证实反PTS1抗体没有交叉反应与主机细胞质的一个组成部分。 “从陶醉中brefeldin A(BFA)存在的细胞的细胞质部分也未能产生一个积极的信号。博鳌亚洲论坛的ER易位网站6-8,12,20-25,因此,A链传递到细胞质防止毒素运输。在每次运行结束时,势必毒素去除传感器幻灯片。这允许多个样品上的一个传感器幻灯片进行筛选,从而提供了一个与不同实验条件下得到的结果之间的直接比较。
CT是另一个AB型,ER转位毒素4。图3A,CTA1检测从CT处理的HeLa细胞的细胞质部分。这强调我们的方法与多种细胞类型,并可以应用到任何毒素的抗- A链抗体可。检测无信号时从CT治疗的细胞胞质部分灌注对涂有反城巴抗体(图3B)的SPR传感器,从而表现出的CTA1亚基,而不是细胞结合城巴五聚体进入细胞质。图3C显示信号从细胞器的一小部分是规模比较弱信号从胞质分数。这是已知的CT运输效率低下的ER易位网站6,7,这反过来又限制的毒素量,可以达到细胞质一致。此外,细胞器的一小部分包含的CT holotoxin以及ER本地化CTA1,因此所产生的SPR信号的细胞器的一小部分的holotoxin相关城巴五聚体的附加质量充气。因此,这是不切合实际的情节上相同sensorgram的细胞器和细胞质组分数据。
我们的检测可以监测易位,胞浆内毒素(图4)随时间变化的的积累。细胞暴露于CT在4 ° C,温度,让毒素结合到质膜,但阻止细胞相关毒素的内化。经过的圣雷莫VAL未结合的毒素,细胞被加热到37 ° C这两种毒素运输ER和A链移位到细胞质可以在此温度下发生的。没有检测到毒素在细胞质15分钟后升温至37 ° C这反映滞后的(I)holotoxin贩运到急诊室所需的时间;(II)的A / B在急诊室亚基解离;及(iii)A链出口到细胞质。轻微池的胞浆内毒素检测30分钟后在37 ° C,胞浆内毒素的数量逐渐变大后,45和60分钟的追逐间隔检测。检测后5小时的追逐间隔 17更大的胞浆内毒素水平,从而表现出一个持续的,长期的细胞相关毒素主机细胞质交付。
我们的检测,还可以检测出毒素易位抑制细胞质(图5)。细胞治疗与10%二甲基亚砜(DMSO),化学伴侣,防止热disord化工e圈隔离CTA1亚基(T. Banerjee和K. Teter,未发表意见),在未经处理的对照细胞相比展示的细胞质CTA1低的水平。展开毒素A链移位到细胞质16-18的先决条件,因此CTA1二甲基亚砜诱导稳定相应阻止其从ER到细胞质的运动。
该协会的速率常数(K)从SPR的实验计算灌注缓冲区14,15,26配体浓度成正比。因此,它是可能的胞浆内毒素的浓度,以确定从图图的 K毒素毒素浓度的函数标准一个值。这一程序是用来量化在图5中的毒素易位二甲基亚砜诱导块:已知浓度的毒素产生的标准曲线来计算一个细胞质CTA1 concentrat离子0.3毫微克/毫升未经处理的细胞和二甲基亚砜处理细胞的0.1纳克/毫升(图6)。二甲基亚砜开展CTA1抑制,从而产生了在雌激素受体细胞质易位的CTA1的减少了3倍。

图1。协议概述。 (一)细胞培养与AB毒素在4 ° C时,允许毒素结合到细胞表面的温度,但会阻止毒素的内吞作用。毒素A和B亚基是由红色和蓝色圆圈,分别代表。 (二)不作承诺毒素是从介质中删除,并加热到37℃,以促进内吞作用和逆行holotoxin运输到ER细胞。 Holotoxin解离发生在ER,它使孤立的A链进入细胞质,通过一种蛋白质在ER膜的导电沟道(S)。 (三)细胞与毛地黄皂苷处理,以选择性通透血浆膜。 (四)离心用于对细胞进行分区成单独的细胞质和细胞器的分数。细胞质被挤压出细胞通过毛地黄皂苷产生毛孔位于上清中。完整的膜结合细胞器中发现的颗粒分数。 (五)检测毒素A链在宿主细胞质易位池,上清灌注对涂抗- A链抗体的SPR传感器。
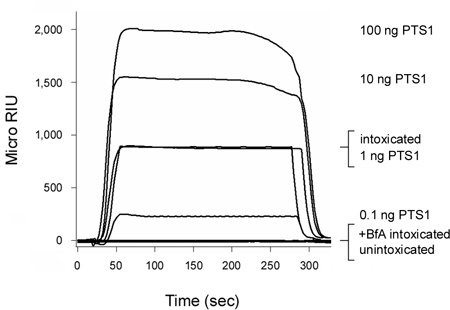
图2。PTS1进入宿主细胞质易位的检测。 CHO细胞脉冲标记,在4 ° C为1微克/毫升的PT 30分钟。细胞,然后3小时的追逐,在37 ° C的毒素培养基中含有没有增加(陶醉)或5博鳌亚洲论坛微克/毫升(+博鳌亚洲论坛陶醉)。与毛地黄皂苷的细胞膜的通透性,使用分区细胞提取到单独的细胞器和胞质fracti项。一个涂有反PTS1抗体的SPR传感器是用来检测PTS1从未经处理或治疗的博鳌亚洲论坛的细胞的细胞质池。 PTS1标准灌流在传感器作为阳性对照,而从unintoxicated细胞的胞浆中的一小部分是在传感器作为阴性对照幻灯片灌注。在每次运行结束时,势必样品被剥离来自传感器的幻灯片。

图3。CTA1进入宿主细胞质易位的检测。脉冲标记HeLa细胞在4 ° C组与1微克/毫升的CT 2小时的追逐,在37 ° C的毒素培养基中含有没有增加(陶醉)或5博鳌亚洲论坛微克/毫升(+博鳌亚洲论坛陶醉)。与毛地黄皂苷的细胞膜的通透性,使用分区细胞提取到单独的细胞器和细胞质组分。 (一)细胞质组分灌注了涂有反注册税务师抗体的SPR传感器。已知注册税务师的数量被用来作为阳性对照,而从unintoxicated细胞的细胞质作为阴性对照。 (二)陶醉在博鳌亚洲论坛的情况下从细胞的细胞质部分灌注了涂有反城巴抗体的SPR传感器。一个纯化的CTB五聚体灌注在幻灯片作为阳性对照。 (三)细胞器的一小部分被溶解,用1%Triton X - 100的的前灌注超过SPR传感器与反注册税务师抗体涂。为便于比较,胞质部分(1毫升最终卷)从同一个细胞中提取和注册税务师标准也灌注在传感器。所有面板,势必样品被剥离传感器在每次运行结束。

图4。CTA1到细胞质进入动力学。 HeLa细胞在4 ° C组与1微克/毫升的CT追为15,30,45,在37分钟或60℃,无毒mediu脉冲标记米。要检测的毒素易位池,从毛地黄皂苷-透细胞的细胞质组分灌注了涂有反注册税务师抗体的SPR传感器。灌注在传感器以及注册税务师标准。在每次运行结束时,势必样品被剥离来自传感器的幻灯片。
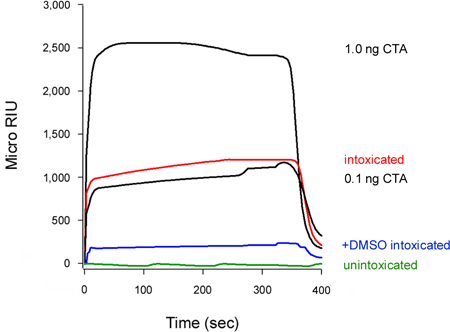
图5。CTA1二甲基亚砜易位的抑制作用。脉冲标记HeLa细胞在4 ° C组与1微克/毫升的CT 2小时的追逐,在37 ° C的毒素培养基中含有没有增加(陶醉)或10%DMSO(+二甲基亚砜陶醉)。要检测的毒素易位池,从毛地黄皂苷-透细胞的细胞质组分灌注了涂有反注册税务师抗体的SPR传感器。 CTA的标准(100,10,1,和0.1毫微克/毫升)灌注在传感器作为阳性对照,只有1和0.1 ng / mL的标准缩放显示。从unintoxicate细胞质D细胞被用来作为阴性对照。在每次运行结束时,势必样品被剥离来自传感器的幻灯片。
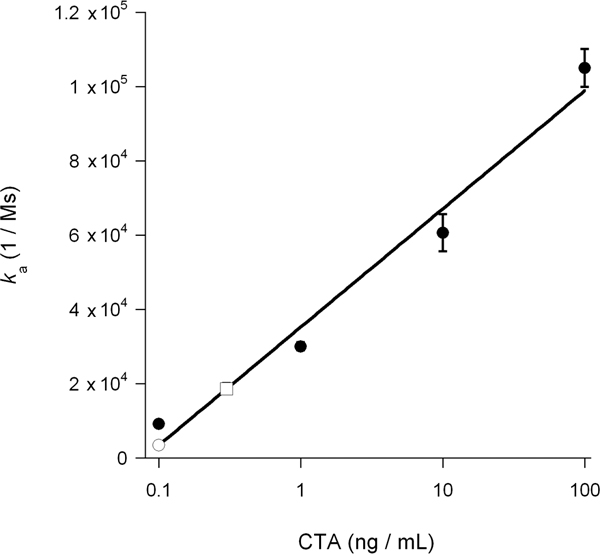
图6。胞浆CTA1计算,K从图5中的一个注册税务师标准值绘制毒素浓度的函数。由此产生的标准曲线是用来判断的基础上 K从图5中,在未经处理和DMSO处理的细胞的细胞质CTA1浓度的实验样品的一个值。毒素类标准为实心圆;未经处理的细胞质是作为一个开放的广场;二甲基亚砜处理的细胞质是作为一个开放的圆圈。两个独立的实验范围的平均值±所示。
Access restricted. Please log in or start a trial to view this content.
讨论
与现有方法的比较
我们基于SPR -易位检测的一种快速,敏感,定量的方法来检测毒素进入宿主细胞质交付。该技术并不需要放射性标记或其他修改的毒素,它可以应用到任何毒素,抗毒素A链抗体可。监测到细胞质的毒素通过现有的方法还依赖于一个分区成单独的细胞质和膜组分11,23,27,28的细胞提取物的亚细胞分馏协议。这些方法使用免疫印迹或radiolabels检测胞浆内?...
Access restricted. Please log in or start a trial to view this content.
披露声明
没有利益冲突的声明。
致谢
这项工作是由美国国立卫生研究院授予R01 AI073783光Teter。我们感谢援助,发展批判性阅读的手稿中的亚细胞分馏协议和海伦布瑞斯博士谢恩梅西。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | |
| 毛地黄皂苷 | 西格玛 | D141 | |
| 乙醇 | 阿库罗斯福冈 | 61509-0010 | |
| DMEM培养液 | Invitrogen公司 | 11995065 | |
| 胎牛血清 | 亚特兰大生物 | S11550 | |
| 神经节苷脂 | 西格玛 | G7641 | |
| 注册税务师 | 西格玛 | C2398 | |
| PTS1 | 名单 | 182 | |
| NHS(N -羟基) | 刺穿 | 24500 | |
| EDC(1 - 乙基-3 - (3 - dimethylaminopropyl)亚胺) | Thermo Scientific的 | 22981 | |
| 乙醇胺 | 泗GMA | E0135 | |
| PBST | 紫花苜蓿 | 09-8903-100 | |
| 反CTA抗体 | 圣克鲁斯生物技术 | SC - 80747 | |
| 反城巴抗体 | Calbiochem | 227040 | |
| 抗PTS1抗体 | 圣克鲁斯生物技术 | SC - 57639 | |
| 折射 | 赖克特 | SR7000,SR7000DC | |
| SPR传感器幻灯片 | 赖克特 | 13206060 | |
| 注射泵 | 科尔帕尔默 | 780200C |
参考文献
- Sandvig, K., van Deurs, B. Membrane traffic exploited by protein toxins. Annu. Rev. Cell Dev. Biol. 18, 1-24 (2002).
- Watson, P., Spooner, R. A. Toxin entry and trafficking in mammalian cells. Adv. Drug Deliv. Rev. 58, 1581-1596 (2006).
- Carbonetti, N. H. Pertussis toxin and adenylate cyclase toxin: key virulence factors of Bordetella pertussis and cell biology tools. Future Microbiol. 5, 455-469 (2010).
- Wernick, N. L. B., Chinnapen, D. J. -F., Cho, J. A., Lencer, W. I. Cholera toxin: an intracellular journey into the cytosol by way of the endoplasmic reticulum. Toxins. 2, 310-325 (2010).
- Lord, J. M., Roberts, L. M., Lencer, W. I. Entry of protein toxins into mammalian cells by crossing the endoplasmic reticulum membrane: co-opting basic mechanisms of endoplasmic reticulum-associated degradation. Curr. Top. Microbiol. Immunol. 300, 149-168 (2005).
- Lencer, W. I. Entry of cholera toxin into polarized human intestinal epithelial cells. Identification of an early brefeldin A sensitive event required for A1-peptide generation. J. Clin. Invest. 92, 2941-2951 (1993).
- Orlandi, P. A., Curran, P. K., Fishman, P. H. Brefeldin A blocks the response of cultured cells to cholera toxin. Implications for intracellular trafficking in toxin action. J. Biol. Chem. 268, 12010-12016 (1993).
- Sandvig, K., Prydz, K., Hansen, S. H., van Deurs, B. Ricin transport in brefeldin A-treated cells: correlation between Golgi structure and toxic effect. J. Cell. Biol. 115, 971-981 (1991).
- Sandvig, K., Prydz, K., Ryd, M., van Deurs, B. Endocytosis and intracellular transport of the glycolipid-binding ligand Shiga toxin in polarized MDCK cells. J. Cell Biol. 113, 553-562 (1991).
- van Deurs, B. Estimation of the amount of internalized ricin that reaches the trans-Golgi network. J. Cell Biol. 106, 253-267 (1988).
- Tam, P. J., Lingwood, C. A. Membrane cytosolic translocation of verotoxin A1 subunit in target cells. Microbiology. 153, 2700-2710 (2007).
- Plaut, R. D., Carbonetti, N. H. Retrograde transport of pertussis toxin in the mammalian cell. Cell. Microbiol. 10, 1130-1139 (2008).
- Willander, M., Al-Hilli, S. Analysis of biomolecules using surface plasmons. Methods Mol. Biol. 544, 201-229 (2009).
- Homola, J. Present and future of surface plasmon resonance biosensors. Anal. Bioanal. Chem. 377, 528-539 (2003).
- Medaglia, M. V., Fisher, R. J. Protein-Protein Interactions. Golemis, E. , Cold Spring Harbor Laboratory Press. Cold Spring Harbor, New York. 255-272 (2002).
- Banerjee, T. Contribution of subdomain structure to the thermal stability of the cholera toxin A1 subunit. Biochemistry. 49, 8839-8846 (2010).
- Massey, S. Stabilization of the tertiary structure of the cholera toxin A1 subunit inhibits toxin dislocation and cellular intoxication. J. Mol. Biol. 393, 1083-1096 (2009).
- Taylor, M. A therapeutic chemical chaperone inhibits cholera intoxication and unfolding/translocation of the cholera toxin A1 subunit. PLoS ONE. 6, e18825-e18825 (2011).
- Taylor, M. Hsp90 is required for transfer of the cholera toxin A1 subunit from the endoplasmic reticulum to the cytosol. J. Biol. Chem. 285, 31261-31267 (2010).
- Donta, S. T., Beristain, S., Tomicic, T. K. Inhibition of heat-labile cholera and Escherichia coli enterotoxins by brefeldin A. Infect. Immun. 61, 3282-3286 (1993).
- Donta, S. T., Tomicic, T. K., Donohue-Rolfe, A. Inhibition of Shiga-like toxins by brefeldin. A. J. Infect. Dis. 171, 721-724 (1995).
- Nambiar, M. P., Oda, T., Chen, C., Kuwazuru, Y., Wu, H. C. Involvement of the Golgi region in the intracellular trafficking of cholera toxin. J. Cell. Physiol. 154, 222-228 (1993).
- Rapak, A., Falnes, P. O., Olsnes, S. Retrograde transport of mutant ricin to the endoplasmic reticulum with subsequent translocation to cytosol. Proc. Natl. Acad. Sci. U. S. A. 94, 3783-3788 (1997).
- Xu, Y., Barbieri, J. T. Pertussis toxin-mediated ADP-ribosylation of target proteins in Chinese hamster ovary cells involves a vesicle trafficking mechanism. Infect. Immun. 63, 825-832 (1995).
- Yoshida, T., Chen, C. C., Zhang, M. S., Wu, H. C. Disruption of the Golgi apparatus by brefeldin A inhibits the cytotoxicity of ricin, modeccin, and Pseudomonas toxin. Exp. Cell Res. 192, 389-395 (1991).
- Godber, B. Direct quantification of analyte concentration by resonant acoustic profiling. Clin. Chem. 51, 1962-1972 (2005).
- Bernardi, K. M., Forster, M. L., Lencer, W. I., Tsai, B. Derlin-1 facilitates the retro-translocation of cholera toxin. Mol. Biol. Cell. 19, 877-884 (2008).
- Wernick, N. L., De Luca, H., Kam, W. R., Lencer, W. I. N-terminal Extension of the Cholera Toxin A1-chain Causes Rapid Degradation after Retrotranslocation from Endoplasmic Reticulum to Cytosol. J. Biol. Chem. 285, 6145-6152 (2010).
- Simpson, J. C. Ricin A chain utilises the endoplasmic reticulum-associated protein degradation pathway to enter the cytosol of yeast. FEBS. Lett. 459, 80-84 (1999).
- Veithen, A., Raze, D., Locht, C. Intracellular trafficking and membrane translocation of pertussis toxin into host cells. Int. J. Med. Microbiol. 290, 409-413 (2000).
- Castro, M. G., McNamara, U., Carbonetti, N. H. Expression, activity and cytotoxicity of pertussis toxin S1 subunit in transfected mammalian cells. Cell. Microbiol. 3, 45-54 (2001).
- Schmitz, A., Herrgen, H., Winkeler, A., Herzog, V. Cholera toxin is exported from microsomes by the Sec61p complex. J. Cell Biol. 148, 1203-1212 (2000).
- Teter, K., Allyn, R. L., Jobling, M. G., Holmes, R. K. Transfer of the cholera toxin A1 polypeptide from the endoplasmic reticulum to the cytosol is a rapid process facilitated by the endoplasmic reticulum-associated degradation pathway. Infect. Immun. 70, 6166-6171 (2002).
- Winkeler, A., Godderz, D., Herzog, V., Schmitz, A. BiP-dependent export of cholera toxin from endoplasmic reticulum-derived microsomes. FEBS Lett. 554, 439-442 (2003).
- Yu, M., Haslam, D. B. Shiga toxin is transported from the endoplasmic reticulum following interaction with the luminal chaperone HEDJ/ERdj3. Infect. Immun. 73, 2524-2532 (2005).
- LaPointe, P., Wei, X., Gariepy, J. A role for the protease-sensitive loop region of Shiga-like toxin 1 in the retrotranslocation of its A1 domain from the endoplasmic reticulum lumen. J. Biol. Chem. 280, 23310-23318 (2005).
- Teter, K., Jobling, M. G., Sentz, D., Holmes, R. K. The cholera toxin A13 subdomain is essential for interaction with ADP-ribosylation factor 6 and full toxic activity but is not required for translocation from the endoplasmic reticulum to the cytosol. Infect. Immun. 74, 2259-2267 (2006).
- Redmann, V. Dislocation of ricin toxin a chains in human cells utilizes selective cellular factors. J. Biol. Chem. 286, 21231-21238 (2011).
- Yamaizumi, M., Mekada, E., Uchida, T., Okada, Y. One molecule of diphtheria toxin fragment A introduced into a cell can kill the cell. Cell. 15, 245-250 (1978).
- Bellisola, G. Reductive activation of ricin and ricin A-chain immunotoxins by protein disulfide isomerase and thioredoxin reductase. Biochem. Pharmacol. 67, 1721-1731 (2004).
- McKee, M. L., FitzGerald, D. J. Reduction of furin-nicked Pseudomonas exotoxin A: an unfolding story. Biochemistry. 38, 16507-16513 (1999).
- Orlandi, P. A. Protein-disulfide isomerase-mediated reduction of the A subunit of cholera toxin in a human intestinal cell line. J. Biol. Chem. 272, 4591-4599 (1997).
- Spooner, R. A. Protein disulphide-isomerase reduces ricin to its A and B chains in the endoplasmic reticulum. Biochem. J. 383, 285-293 (2004).
- Fujinaga, Y. Gangliosides that associate with lipid rafts mediate transport of cholera and related toxins from the plasma membrane to endoplasmic reticulm. Mol. Biol. Cell. 14, 4783-4793 (2003).
- Guerra, L. Cellular internalization of cytolethal distending toxin: a new end to a known pathway. Cell. Microbiol. 7, 921-934 (2005).
- Johannes, L., Tenza, D., Antony, C., Goud, B. Retrograde transport of KDEL-bearing B-fragment of Shiga toxin. J. Biol. Chem. 272, 19554-19561 (1997).
- Deeks, E. D. The low lysine content of ricin A chain reduces the risk of proteolytic degradation after translocation from the endoplasmic reticulum to the cytosol. Biochemistry. 41, 3405-3413 (2002).
- Hazes, B., Read, R. J. Accumulating evidence suggests that several AB-toxins subvert the endoplasmic reticulum-associated protein degradation pathway to enter target cells. Biochemistry. 36, 11051-11054 (1997).
- Rodighiero, C., Tsai, B., Rapoport, T. A., Lencer, W. I. Role of ubiquitination in retro-translocation of cholera toxin and escape of cytosolic degradation. EMBO Rep. 3, 1222-1227 (2002).
- Worthington, Z. E., Carbonetti, N. H. Evading the proteasome: absence of lysine residues contributes to pertussis toxin activity by evasion of proteasome degradation. Infect. Immun. 75, 2946-2953 (2007).
- Pande, A. H., Moe, D., Jamnadas, M., Tatulian, S. A., Teter, K. The pertussis toxin S1 subunit is a thermally unstable protein susceptible to degradation by the 20S proteasome. Biochemistry. 45, 13734-13740 (2006).
- Pande, A. H. Conformational instability of the cholera toxin A1 polypeptide. J. Mol. Biol. 374, 1114-1128 (2007).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。