Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Обнаружение токсинного транслокации в хост цитозоля от поверхностного плазменного резонанса
В этой статье
Резюме
В этом докладе мы описываем, как поверхностного плазменного резонанса используется для обнаружения токсина вступления в хост цитозоле. Этот высокочувствительный метод может обеспечить количественные данные о количестве цитозольного токсин, и он может быть применен к различным токсинам.
Аннотация
AB токсины состоят из ферментативной субъединицы и клетка-связывающий B субъединицы 1. Эти токсины секретируются во внеклеточную среду, но они действуют на цели в пределах эукариотической цитозоле. Некоторые туристические AB токсинов пузырьков носителей от поверхности клетки, чтобы эндоплазматический ретикулум (ER), перед входом в цитозоле 2-4. В ER, каталитический диссоциирует цепь от остальной токсина и движется через белок-проводящий канал, чтобы достичь своей целевой цитозольного 5. Перемещаться, цитозольного цепи трудно обнаружить, поскольку токсин торговли людьми ER является крайне неэффективный процесс: большинство внутренним токсин направляется лизосом для деградации, так что только небольшая часть поверхности связанного токсина достигает аппарат Гольджи и ОР 6 -12.
Для контроля перемещения токсинов из ЭР в цитозоле в культуре клеток, мы объединили субклеточных протокол фракционирования с highlу чувствительный метод обнаружения поверхностного плазменного резонанса (SPR) 13-15. Плазматической мембраны токсин-обработанных клеток избирательно проницаемыми с дигитонин, позволяя коллекция цитозольного фракцию, которая впоследствии перфузии за датчик SPR покрыты анти-токсин цепи антитела. Покрытых антителами датчик может захватить и выявления пг / мл количество цитозольного токсина. С этим протоколом, то можно проследить кинетику токсин вступления в цитозоле и охарактеризовать тормозящее действие на транслокацию события. Концентрация цитозольного токсин может быть вычислена по стандартной кривой, полученной с известными количествами цепочке стандартов, которые были перфузии по датчику. Наш метод представляет собой быстрый, чувствительный и количественного определения системы, которая не требует радиоактивной метки или другие изменения целевой токсин.
протокол
1. Подготовка дигитонин
- Добавить 500 мкл 100% этанола микроцентрифужных трубки и поместить его в тепло блок установлен на уровне 80 ° С в течение 10 мин.
- Растворите 2,5 мг дигитонин в 250 мкл этанола подогревом для производства 1% исходного раствора дигитонин.
- Для создания рабочего раствора 0,04% дигитонин, добавить 40 мкл исходного раствора дигитонин до 960 мкл HCN буфера (50 мМ Hepes рН 7,5, 150 мМ NaCl, 2 мМ CaCl 2, 10 мМ N-ethylmaleimide, и ингибитор протеазы коктейль).
2. Интоксикация клеток и пермеабилизации
Наши транслокации анализа может быть применена к целому ряду токсинов и клеточных линий. Ниже мы приводим подробный протокол для обнаружения холерного токсина (CT). Обзор процедура предусмотрена на рисунке 1.
- HeLa клетки высевают в 6-луночных планшетах, содержащих 1 мл DMEM с добавлением 10% эмбриональной телячьей сыворотки и антибиотиков противогрибковыхдля достижения 1x10 6 клеток / лунку после инкубации в течение ночи при температуре 37 ° C. Для создания достаточно цитозольного токсина для воспроизводимых обнаружения, трех экземплярах скважин, необходимых для каждого состояния.
- После инкубации в течение ночи заменить культуральной среде с 1 мл DMEM, содержащей 100 нг / мл ганглиозида GM1. Это увеличивает число сайтов связывания КТ, как GM1 рецепторов СТ будет прибавлять в плазматической мембране клетки подвергаются решение GM1.
- После 1 часа инкубации при 37 ° С, удалить GM1 среде, содержащей и промыть клетки дважды DMEM. Затем поместите клетки при температуре 4 ° С в течение 30 мин в 1 мл DMEM, содержащей 1 мкг / мл КТ.
- Удалить токсин среде, содержащей, мыть клетки дважды DMEM, и инкубировать клеток в 1 мл DMEM при 37 ° C для желаемого интервала времени (ы).
- В конце каждого периода погони, мыть клетки с PBS и инкубировать в каждую лунку по 250 мкл 0,5 мМ ЭДТА в PBS. Пусть клетках сидят в течение 10 мин при комнатной температуре, а затем удалить их с 6-луночный планшет энергичным растиранием с P1000 pipetman. После одной скважины клеток была собрана, объединить его со вторым, а затем третий и из того же состояния. Сотовые скребки также может быть использована для сбора клеток.
- Место комбинированной суспензии клеток из трех одинаковых скважин (750 мкл общего объема), в одной трубке микроцентрифужных, и раскручивать ее в настольный микроцентрифужных в течение 5 мин при 5000 х g. Сотовые гранул примерно соответствует размеру должен быть получен на любых условиях.
- Удалите супернатант и ресуспендируют осадок клеток в 100 мкл 0,04% рабочего раствора дигитонин. Место клеточной суспензии на льду в течение 10 мин.
- Спиновые дигитонин-проницаемыми клеток на 16 000 мкг в течение 10 мин в настольной микроцентрифужных. Передача цитозоле содержащих надосадочной фракции новую пробирку микроцентрифужных и сохранить органелл, содержащих гранулы фракции.
- Цитозоля содержащих надосадочной фракции разводят в буфере HCN до конечного объема 1 мл. Пример объемами не менее 1 мл, необходимые для обеспечения воздухом удаляется из 500 мкл цикла образца до инъекции.
- Органелл, содержащих гранулы фракции ресуспендировали в 1 мл HCN буфер, содержащий 1% Тритон Х-100. Добавление моющих средств необходимо освободить мембраной заключенная пул токсина.
- Токсин стандартов в концентрациях 100, 10, 1 и 0,1 нг / мл готовят в буфер HCN.
- Параллельные наборы цитозольного и органелл фракций готовы к контрольным экспериментом для подтверждения верности фракционирования процедуры. Фракции порожденных, как описано в разделе 2 ресуспендируют в 20 мкл буфера 4x образца (цитозольного фракции) или 120 мкл 1x образца буфера (органелл фракция). Эквивалентный объема каждой фракции решаются натрия додецилсульфата электрофореза в полиакриламидном геле сульфата и исследовали бу Вестерн-блот анализ, чтобы продемонстрировать разбиения цитозольного белка в надосадочной фракции и растворимый, житель белка ЭР во фракции гранул 16-19.
4. SPR слайд подготовки
- Reichert SR7000 SPR Рефрактометр используется для экспериментов SPR.
- Установить позолоченные стекло с самоорганизующихся монослоя в инструмент SPR. Чтобы активировать датчик слайдов, заливать 1:1 (по объему) раствор 0.4 М EDC и 0,1 М NHS за слайд течение 10 мин при расходе 41 мкл / мин. Все последующие перфузии будет использовать те же скорости потока.
- Для удаления EDC: NHS активации буфера, вымыть пластины в течение 5 мин с PBS, содержащем 0,05% Твин 20 (PBST). Пластину в настоящее время содержит реактивную тросов амида из-за uncapping от EDC: NHS решение.
- Заливать анти-CTA антител через активированный датчик слайдов в разведении 1:20,000 в 20 мМ ацетата натрия (рН 5,5) в течение 15 мин. Начальное падение показателя преломленияDEX единицы (РИУ) будет видно из-за изменения рН. Это будет сопровождаться увеличением RIU как антитело захватывается амид-реактивного тросов на датчике слайда.
- Удаление несвязанных антител от датчика слайд с 5 минут PBST стирки. Сигнал RIU производства захватили антитело плато и стабилизации, обеспечивая новый сигнал базовой линии.
- Заливать 1 М этаноламина (рН 8,5) над датчиком слайд в течение 5 мин. Это колпачки и инактивирует любые несвязанные тросов налево на датчик слайдов.
5. SPR анализа проб
- Чтобы установить базовые чтение, заливать PBST над антителами датчика в течение 5 мин.
- Заливать опытного образца или токсина в течение стандартного датчика на 300 сек. Удалить лиганд из буфера и заливать PBST над датчиком для еще 200 сек.
- После каждого перфузии, связанные токсины удаляются из датчика 100 сек промыть PBST при рН 5,0. Это вернет сигналав первоначальное чтение базового уровня, что позволяет другим образцом для обработки на одном датчике.
- Перед загрузкой нового образца, нажмите небольшое количество воздуха через образец петля исключить любой остаточной жидкости по сравнению с предыдущим образцом. Использование процедуры, описанной в 5.2-5.4, у нас работать до 12 образцов на одном слайде без существенной потери базового сигнала.
- Анализ данных осуществляется с помощью 2 Поломоечные программного обеспечения и программного обеспечения Игорь используется для фигурного подготовки.
6. Представитель Результаты
Коклюш токсина (РТ) является токсином AB, который перемещается от поверхности клеток к ER до его цепи (PTS1) входит в цитозоле 3, 12. Как показано на рисунке 2, наши SPR основе транслокации анализ может обнаружить PTS1 в цитозоле клеток СНО опьянения. Сигнал не был создан из цитозоле unintoxicated клетки, которые подтвердили анти-PTS1 антител не перекрестно реагируют с компонентом принимающей цитозоле.цитозольного фракции из клетки опьянения в присутствии brefeldin (BFA) также не привели к позитивным сигналом. BfA предотвращает токсин транспорте к месту ER транслокации 6-8, 12, 20-25 и, таким образом, цепочка доставки цитозоле. В конце каждого запуска, связаны токсинов удаляются от датчика слайдов. Это позволило несколько образцов, чтобы пройти обследование на одном слайде датчика и тем самым обеспечил прямое сравнение результатов, полученных при различных экспериментальных условиях.
КТ другой АВ-типа, ER-translocating токсин 4. На рисунке 3А, CTA1 был обнаружен в цитозольного фракции CT-обработанных клеток HeLa. Это подчеркнул, что наша методика работает с несколькими типами клеток и может быть применен к любой токсин, для которых анти-цепи антитела доступна. Сигнал не был обнаружен, когда цитозольного фракции CT-обработанных клеток было перфузии за датчик SPR покрыты анти-CTB антител (рис. 3В), тем самым демонстрируя, что CTA1субъединицы, но не клетка-связывающий CTB пентамера входит в цитозоле. Рис 3C показывает сигнал от фракции органелл выключен масштабах по сравнению с более слабым сигналом от цитозольного фракции. Это согласуется с известным неэффективности КТ транспорта ER сайта транслокации 6, 7, которая в свою очередь ограничивает количество токсинов, которые могут достигать цитозоле. Кроме того, фракция органелл содержит КТ holotoxin а также ER-локализованных CTA1, так что результирующий сигнал SPR для фракции органелл надувается от дополнительных масс holotoxin связанных CTB пентамера. Таким образом, это не практично для построения данных из органелл и цитоплазмы фракций на том же sensorgram.
Наш анализ может контролировать время-зависимое накопление перемещаться, цитозольного токсина (рис. 4). Клетки подвергались КТ при 4 ° С, температуры, что позволяет токсин привязки к мембране, но и предотвращает интернализации клеточно-ассоциированных токсина. После РемоВал несвязанного токсина, клетки нагревают до 37 ° C. Оба токсина транспорта в ЭР и цепи транслокации в цитозоль может произойти при этой температуре. Нет токсин был обнаружен в цитозоле через 15 минут после нагревания до 37 ° C. Это отражало лаг времени, необходимого для (я) holotoxin торговли в ЭР, (II) / B субъединицы диссоциации в ER, и (III) цепочки экспорта в цитозоле. Незначительных пул цитозольного токсин был обнаружен через 30 минут при температуре 37 ° С, и постепенно большего количества цитозольного токсина были выявлены после 45 и 60-минутными интервалами погони. Даже более высокие уровни цитозольного токсина были выявлены после 5 часов погони интервал 17, что свидетельствует о постоянной, долгосрочной доставки клеточно-ассоциированных токсина хост цитозоле.
Наш анализ также может обнаруживать ингибирование транслокации токсинов в цитозоле (рис. 5). Клетки обрабатывают 10% диметилсульфоксида (ДМСО), химических шаперонов, который предотвращает тепловое disordering выделенных CTA1 субъединицы (Т. и К. Банерджи Тетер, неопубликованные данные), выставлены низкие уровни цитозольного CTA1 по сравнению с необработанными клетками контроля. Происходящий из токсина цепи является необходимым условием для транслокации в цитозоле 16-18, так что ДМСО-индуцированной стабилизации CTA1 соответственно предотвратить его движение от ER к цитозоле.
Скорость константа ассоциации (к), рассчитанные из эксперимента SPR прямо пропорциональна концентрации лиганда в перфузии буфера 14, 15, 26. Таким образом, можно определить концентрацию цитозольного токсина из графика, участков к значениям для токсина стандартов в зависимости от концентрации токсина. Эта процедура используется для количественной ДМСО-индуцированной блок транслокации токсинов представлена на рисунке 5: стандартный кривой, полученной от известных концентраций токсин используется для расчета цитозольного CTA1 concentratион 0,3 нг / мл для необработанных клетках и 0,1 нг / мл для ДМСО-обработанных клеток (рис. 6). Ингибирование CTA1 разворачивается на ДМСО тем самым оказались в 3-кратное снижение ЭР-на-цитозоле транслокации CTA1.

Рисунок 1. Обзор протокола. (А) Клетки инкубировали с токсином АБ при температуре 4 ° С, температуры, что позволяет токсин связывания с клеточной поверхности, но и предотвращает токсин эндоцитоза. И В субъединицы токсинов представлены красные и синие круги, соответственно. (B) Unbound токсин удаляется из среды, и клетки нагревают до 37 ° С в целях содействия эндоцитоза и ретроградного транспорта holotoxin в РП. Holotoxin диссоциации происходит в ЭР, что позволяет изолированной цепи, чтобы войти в цитозоле, проходя через белок-проводящий канал (ы) в мембране ЭР. (C) клетки обрабатывают дигитонин для того, чтобы выборочно permeabilize плазмымембрану. (D) Центрифугирование используется для разделения клеток в отдельных органелл цитоплазмы и фракций. Цитозоле выдавливается из клетки через дигитонин генерируемых пор и находится в супернатант. Нетронутыми, мембраносвязанных органеллы находятся во фракции гранул. (Е) Для обнаружения транслоцируется бассейн токсина цепи в принимающей цитозоле, надосадочной фракции перфузии за датчик SPR покрыты анти-цепи антитела.
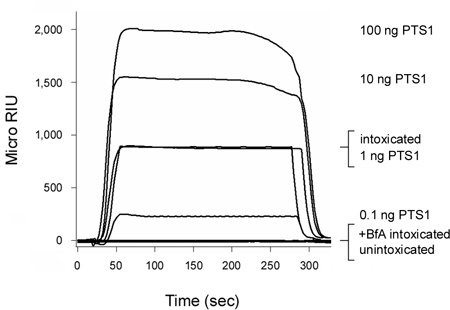
Рисунок 2. Обнаружение PTS1 транслокации в принимающее цитозоле. СНО клетки импульсно-меченых при 4 ° С в течение 30 мин с 1 мкг / мл PT. Клетки затем преследовали в течение 3 ч при температуре 37 ° С в токсина среде без, не содержащие добавок (опьянения) или 5 мкг BfA / мл (+ BfA состоянии опьянения). Пермеабилизации плазменной мембраны с дигитонин был использован для экстракты раздела клетки в отдельных органелл и цитоплазмы fractiдополнений. Датчик SPR покрыты анти-PTS1 антител был использован для обнаружения цитозольного пул PTS1 из необработанных или БФА-обработанных клеток. PTS1 стандарты перфузии над датчиком как положительного контроля, в то время цитозольного фракции из unintoxicated клеток перфузии над датчиком слайдов в качестве отрицательного контроля. В конце каждого запуска, связанного образец был лишен от датчика слайдов.

Рисунок 3. Обнаружение CTA1 транслокации в принимающее цитозоле. HeLa клетки импульсно-меченых при 4 ° С с 1 мкг / мл КТ были изгнаны в течение 2 часов при температуре 37 ° С в токсин-среде, свободной, не содержащие добавок (опьянения) или 5 мкг BfA / мл (+ BfA состоянии опьянения). Пермеабилизации плазменной мембраны с дигитонин был использован для экстракты раздела клетки в отдельных органелл и цитоплазмы фракций. (А) цитозольного фракции перфузии за датчик SPR покрыты анти-CTA антител. Известныйколичества CTA были использованы в качестве положительного контроля, в то время цитозоле из unintoxicated клетки был использован в качестве отрицательного контроля. (B) цитозольного фракции из клетки опьянения при отсутствии BfA был перфузии за датчик SPR покрыты анти-CTB антител. Очищенный CTB пентамера был перфузии более слайд в качестве положительного контроля. (C) фракция органелл был солюбилизированного с 1% Тритон Х-100 до перфузии за датчик SPR покрыты анти-CTA антител. Для сравнения, цитозольного дробь (1 мл конечного объема) из того же экстракта клеток и CTA стандартный также перфузии над датчиком. Для всех панелей, связанный образец был лишен от датчика в конце каждого запуска.

Рисунок 4. Кинетика CTA1 вступления в цитозоле. HeLa клетки импульсно-меченых при 4 ° С с 1 мкг / мл КТ были изгнаны на 15, 30, 45, или 60 мин при 37 ° С в токсина без mediuметр Для обнаружения транслоцируется пул токсин, цитозольного фракций из дигитонин-проницаемыми клетки перфузии за датчик SPR покрыты анти-CTA антител. CTA стандарты перфузии на сенсор, а также. В конце каждого запуска, связанного образец был лишен от датчика слайдов.
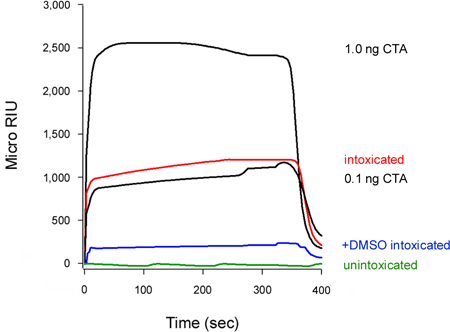
Рисунок 5. Ингибирование CTA1 транслокации по ДМСО. HeLa клетки импульсно-меченых при 4 ° С с 1 мкг / мл КТ были изгнаны в течение 2 часов при температуре 37 ° С в токсин-среде, свободной, не содержащие добавок (опьянения) или 10% ДМСО (+ ДМСО состоянии опьянения). Для обнаружения транслоцируется пул токсин, цитозольного фракций из дигитонин-проницаемыми клетки перфузии за датчик SPR покрыты анти-CTA антител. CTA стандартов (100, 10, 1 и 0,1 нг / мл) перфузии над датчиком как положительного контроля, и только 1 и 0,1 нг / мл стандартов показаны для масштабирования целей. Цитозоле из unintoxicateг клетки был использован в качестве отрицательного контроля. В конце каждого запуска, связанного образец был лишен от датчика слайдов.
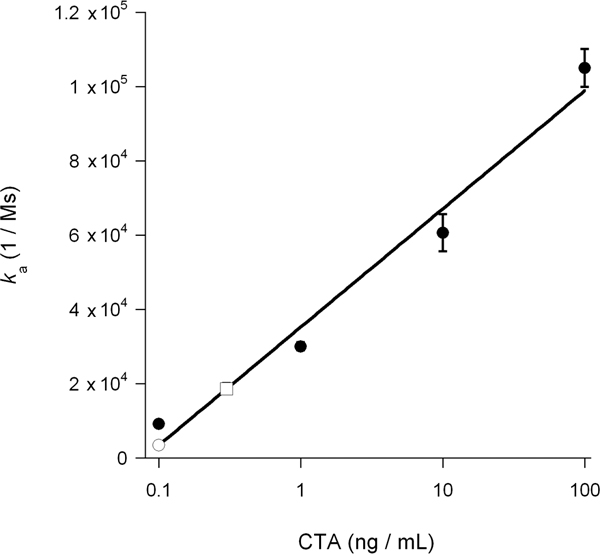
Рисунок 6. Расчет цитозольного CTA1. А значения стандартов CTA на рисунке 5 были построены в зависимости от концентрации токсина. В результате стандартной кривой был использован для определения, на основе к значениям экспериментальных образцов на рисунке 5, концентрация цитозольного CTA1 в необработанных и обработанных ДМСО клеток. Токсин стандарты представлены в виде кружки, необработанной цитозоле представлена как открытая площадь, и ДМСО обработанных цитозоле представлена как открытая круг. Средние ± диапазонов двух независимых экспериментов.
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Сравнение с существующей методологии
Наши SPR основе анализа транслокации представляет быстрый, чувствительный и количественный метод для обнаружения токсина доставку в принимающее цитозоле. Техника не требует радиоактивной метки или другие изменения токсин, и он може?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Эта работа финансировалась NIH грант R01 AI073783 К. Тетер. Мы благодарим доктора Шейна Massey за помощь в развитии субклеточного фракционирования протокол и Хелен Burress за критическое прочтение рукописи.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | |
| Дигитонин | Сигма | D141 | |
| Этанол | Acros | 61509-0010 | |
| DMEM | Invitrogen | 11995065 | |
| Эмбриональной бычьей сыворотки | Атланты биологические препараты | S11550 | |
| Ганглиозидов GM1 | Сигма | G7641 | |
| CTA | Сигма | C2398 | |
| PTS1 | Список | 182 | |
| Государственная служба здравоохранения (N-гидроксисукцинимида) | Прокалывать | 24500 | |
| EDC (1-этил-3-(3-диметиламинопропил) карбодиимида) | Thermo Scientific | 22981 | |
| Ethanolamine | СиGMA | E0135 | |
| PBST | Medicago | 09-8903-100 | |
| Анти-CTA антител | Санта-Крус-Biotech | SC-80747 | |
| Анти-CTB антител | Calbiochem | 227040 | |
| Анти-PTS1 антител | Санта-Крус-Biotech | SC-57639 | |
| Рефрактометр | Reichert | SR7000, SR7000DC | |
| SPR датчик слайдов | Reichert | 13206060 | |
| Шприц насос | Коул Палмер | 780200C |
Ссылки
- Sandvig, K., van Deurs, B. Membrane traffic exploited by protein toxins. Annu. Rev. Cell Dev. Biol. 18, 1-24 (2002).
- Watson, P., Spooner, R. A. Toxin entry and trafficking in mammalian cells. Adv. Drug Deliv. Rev. 58, 1581-1596 (2006).
- Carbonetti, N. H. Pertussis toxin and adenylate cyclase toxin: key virulence factors of Bordetella pertussis and cell biology tools. Future Microbiol. 5, 455-469 (2010).
- Wernick, N. L. B., Chinnapen, D. J. -F., Cho, J. A., Lencer, W. I. Cholera toxin: an intracellular journey into the cytosol by way of the endoplasmic reticulum. Toxins. 2, 310-325 (2010).
- Lord, J. M., Roberts, L. M., Lencer, W. I. Entry of protein toxins into mammalian cells by crossing the endoplasmic reticulum membrane: co-opting basic mechanisms of endoplasmic reticulum-associated degradation. Curr. Top. Microbiol. Immunol. 300, 149-168 (2005).
- Lencer, W. I. Entry of cholera toxin into polarized human intestinal epithelial cells. Identification of an early brefeldin A sensitive event required for A1-peptide generation. J. Clin. Invest. 92, 2941-2951 (1993).
- Orlandi, P. A., Curran, P. K., Fishman, P. H. Brefeldin A blocks the response of cultured cells to cholera toxin. Implications for intracellular trafficking in toxin action. J. Biol. Chem. 268, 12010-12016 (1993).
- Sandvig, K., Prydz, K., Hansen, S. H., van Deurs, B. Ricin transport in brefeldin A-treated cells: correlation between Golgi structure and toxic effect. J. Cell. Biol. 115, 971-981 (1991).
- Sandvig, K., Prydz, K., Ryd, M., van Deurs, B. Endocytosis and intracellular transport of the glycolipid-binding ligand Shiga toxin in polarized MDCK cells. J. Cell Biol. 113, 553-562 (1991).
- van Deurs, B. Estimation of the amount of internalized ricin that reaches the trans-Golgi network. J. Cell Biol. 106, 253-267 (1988).
- Tam, P. J., Lingwood, C. A. Membrane cytosolic translocation of verotoxin A1 subunit in target cells. Microbiology. 153, 2700-2710 (2007).
- Plaut, R. D., Carbonetti, N. H. Retrograde transport of pertussis toxin in the mammalian cell. Cell. Microbiol. 10, 1130-1139 (2008).
- Willander, M., Al-Hilli, S. Analysis of biomolecules using surface plasmons. Methods Mol. Biol. 544, 201-229 (2009).
- Homola, J. Present and future of surface plasmon resonance biosensors. Anal. Bioanal. Chem. 377, 528-539 (2003).
- Medaglia, M. V., Fisher, R. J. Protein-Protein Interactions. Golemis, E. , Cold Spring Harbor Laboratory Press. Cold Spring Harbor, New York. 255-272 (2002).
- Banerjee, T. Contribution of subdomain structure to the thermal stability of the cholera toxin A1 subunit. Biochemistry. 49, 8839-8846 (2010).
- Massey, S. Stabilization of the tertiary structure of the cholera toxin A1 subunit inhibits toxin dislocation and cellular intoxication. J. Mol. Biol. 393, 1083-1096 (2009).
- Taylor, M. A therapeutic chemical chaperone inhibits cholera intoxication and unfolding/translocation of the cholera toxin A1 subunit. PLoS ONE. 6, e18825-e18825 (2011).
- Taylor, M. Hsp90 is required for transfer of the cholera toxin A1 subunit from the endoplasmic reticulum to the cytosol. J. Biol. Chem. 285, 31261-31267 (2010).
- Donta, S. T., Beristain, S., Tomicic, T. K. Inhibition of heat-labile cholera and Escherichia coli enterotoxins by brefeldin A. Infect. Immun. 61, 3282-3286 (1993).
- Donta, S. T., Tomicic, T. K., Donohue-Rolfe, A. Inhibition of Shiga-like toxins by brefeldin. A. J. Infect. Dis. 171, 721-724 (1995).
- Nambiar, M. P., Oda, T., Chen, C., Kuwazuru, Y., Wu, H. C. Involvement of the Golgi region in the intracellular trafficking of cholera toxin. J. Cell. Physiol. 154, 222-228 (1993).
- Rapak, A., Falnes, P. O., Olsnes, S. Retrograde transport of mutant ricin to the endoplasmic reticulum with subsequent translocation to cytosol. Proc. Natl. Acad. Sci. U. S. A. 94, 3783-3788 (1997).
- Xu, Y., Barbieri, J. T. Pertussis toxin-mediated ADP-ribosylation of target proteins in Chinese hamster ovary cells involves a vesicle trafficking mechanism. Infect. Immun. 63, 825-832 (1995).
- Yoshida, T., Chen, C. C., Zhang, M. S., Wu, H. C. Disruption of the Golgi apparatus by brefeldin A inhibits the cytotoxicity of ricin, modeccin, and Pseudomonas toxin. Exp. Cell Res. 192, 389-395 (1991).
- Godber, B. Direct quantification of analyte concentration by resonant acoustic profiling. Clin. Chem. 51, 1962-1972 (2005).
- Bernardi, K. M., Forster, M. L., Lencer, W. I., Tsai, B. Derlin-1 facilitates the retro-translocation of cholera toxin. Mol. Biol. Cell. 19, 877-884 (2008).
- Wernick, N. L., De Luca, H., Kam, W. R., Lencer, W. I. N-terminal Extension of the Cholera Toxin A1-chain Causes Rapid Degradation after Retrotranslocation from Endoplasmic Reticulum to Cytosol. J. Biol. Chem. 285, 6145-6152 (2010).
- Simpson, J. C. Ricin A chain utilises the endoplasmic reticulum-associated protein degradation pathway to enter the cytosol of yeast. FEBS. Lett. 459, 80-84 (1999).
- Veithen, A., Raze, D., Locht, C. Intracellular trafficking and membrane translocation of pertussis toxin into host cells. Int. J. Med. Microbiol. 290, 409-413 (2000).
- Castro, M. G., McNamara, U., Carbonetti, N. H. Expression, activity and cytotoxicity of pertussis toxin S1 subunit in transfected mammalian cells. Cell. Microbiol. 3, 45-54 (2001).
- Schmitz, A., Herrgen, H., Winkeler, A., Herzog, V. Cholera toxin is exported from microsomes by the Sec61p complex. J. Cell Biol. 148, 1203-1212 (2000).
- Teter, K., Allyn, R. L., Jobling, M. G., Holmes, R. K. Transfer of the cholera toxin A1 polypeptide from the endoplasmic reticulum to the cytosol is a rapid process facilitated by the endoplasmic reticulum-associated degradation pathway. Infect. Immun. 70, 6166-6171 (2002).
- Winkeler, A., Godderz, D., Herzog, V., Schmitz, A. BiP-dependent export of cholera toxin from endoplasmic reticulum-derived microsomes. FEBS Lett. 554, 439-442 (2003).
- Yu, M., Haslam, D. B. Shiga toxin is transported from the endoplasmic reticulum following interaction with the luminal chaperone HEDJ/ERdj3. Infect. Immun. 73, 2524-2532 (2005).
- LaPointe, P., Wei, X., Gariepy, J. A role for the protease-sensitive loop region of Shiga-like toxin 1 in the retrotranslocation of its A1 domain from the endoplasmic reticulum lumen. J. Biol. Chem. 280, 23310-23318 (2005).
- Teter, K., Jobling, M. G., Sentz, D., Holmes, R. K. The cholera toxin A13 subdomain is essential for interaction with ADP-ribosylation factor 6 and full toxic activity but is not required for translocation from the endoplasmic reticulum to the cytosol. Infect. Immun. 74, 2259-2267 (2006).
- Redmann, V. Dislocation of ricin toxin a chains in human cells utilizes selective cellular factors. J. Biol. Chem. 286, 21231-21238 (2011).
- Yamaizumi, M., Mekada, E., Uchida, T., Okada, Y. One molecule of diphtheria toxin fragment A introduced into a cell can kill the cell. Cell. 15, 245-250 (1978).
- Bellisola, G. Reductive activation of ricin and ricin A-chain immunotoxins by protein disulfide isomerase and thioredoxin reductase. Biochem. Pharmacol. 67, 1721-1731 (2004).
- McKee, M. L., FitzGerald, D. J. Reduction of furin-nicked Pseudomonas exotoxin A: an unfolding story. Biochemistry. 38, 16507-16513 (1999).
- Orlandi, P. A. Protein-disulfide isomerase-mediated reduction of the A subunit of cholera toxin in a human intestinal cell line. J. Biol. Chem. 272, 4591-4599 (1997).
- Spooner, R. A. Protein disulphide-isomerase reduces ricin to its A and B chains in the endoplasmic reticulum. Biochem. J. 383, 285-293 (2004).
- Fujinaga, Y. Gangliosides that associate with lipid rafts mediate transport of cholera and related toxins from the plasma membrane to endoplasmic reticulm. Mol. Biol. Cell. 14, 4783-4793 (2003).
- Guerra, L. Cellular internalization of cytolethal distending toxin: a new end to a known pathway. Cell. Microbiol. 7, 921-934 (2005).
- Johannes, L., Tenza, D., Antony, C., Goud, B. Retrograde transport of KDEL-bearing B-fragment of Shiga toxin. J. Biol. Chem. 272, 19554-19561 (1997).
- Deeks, E. D. The low lysine content of ricin A chain reduces the risk of proteolytic degradation after translocation from the endoplasmic reticulum to the cytosol. Biochemistry. 41, 3405-3413 (2002).
- Hazes, B., Read, R. J. Accumulating evidence suggests that several AB-toxins subvert the endoplasmic reticulum-associated protein degradation pathway to enter target cells. Biochemistry. 36, 11051-11054 (1997).
- Rodighiero, C., Tsai, B., Rapoport, T. A., Lencer, W. I. Role of ubiquitination in retro-translocation of cholera toxin and escape of cytosolic degradation. EMBO Rep. 3, 1222-1227 (2002).
- Worthington, Z. E., Carbonetti, N. H. Evading the proteasome: absence of lysine residues contributes to pertussis toxin activity by evasion of proteasome degradation. Infect. Immun. 75, 2946-2953 (2007).
- Pande, A. H., Moe, D., Jamnadas, M., Tatulian, S. A., Teter, K. The pertussis toxin S1 subunit is a thermally unstable protein susceptible to degradation by the 20S proteasome. Biochemistry. 45, 13734-13740 (2006).
- Pande, A. H. Conformational instability of the cholera toxin A1 polypeptide. J. Mol. Biol. 374, 1114-1128 (2007).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены