È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Rilevamento di Traslocazione tossina nel citosol Host Surface Plasmon Resonance
In questo articolo
Riepilogo
In questo rapporto, descriviamo come risonanza plasmonica di superficie viene utilizzato per rilevare ingresso tossina nel citosol ospitante. Questo metodo molto sensibile in grado di fornire dati quantitativi sulla quantità di tossina citosolica, e può essere applicata ad una gamma di tossine.
Abstract
Tossine AB consistono in un subunità enzimatica A e una cellula vincolante subunità B 1. Queste tossine vengono secreti nel milieu extracellulare, ma agiscono su bersagli all'interno del citoplasma degli eucarioti. Alcuni viaggi AB tossine da parte dei vettori delle vescicole dalla superficie cellulare verso il reticolo endoplasmatico (ER) prima di entrare nel citosol 2-4. Al pronto soccorso, la dissocia catalitico Una catena dal resto della tossina e si muove attraverso una proteina conduttore canale per raggiungere il suo obiettivo citosolico 5. Il traslocato, citosolica Una catena è difficile da rilevare perché il traffico di tossina al pronto soccorso è un processo estremamente inefficiente: la tossina più interiorizzato viene indirizzato ai lisosomi per la degradazione, in modo che solo una piccola frazione di superficie è legato tossina raggiunge l'apparato di Golgi e ER 6 -12.
Per monitorare traslocazione di tossine dal ER al citosol in cellule in coltura, abbiamo combinato un protocollo con il frazionamento subcellulare highly metodo di rilevazione sensibile di risonanza di plasmoni superficiali (SPR) 13-15. La membrana plasmatica delle cellule trattate con tossina è selettivamente permeabilizzate con digitonina, permettendo la raccolta di una frazione citosolica che viene successivamente perfuso su un sensore SPR rivestito con un anti-tossina A anticorpi a catena. L'anticorpo-rivestito sensore in grado di catturare e rilevare pg / mL quantità di tossina citosolico. Con questo protocollo, è possibile seguire la cinetica di entrata tossina nel citosol e caratterizzare effetti inibitori sulla manifestazione traslocazione. La concentrazione della tossina citosolica può anche essere calcolato da una curva standard generata con quantità note di una catena che gli standard sono stati irrorati sul sensore. Il nostro metodo rappresenta un rapido, sistema di rilevamento sensibile e quantitativa che non richiede radiomarcatura o altre modifiche alla tossina di destinazione.
Protocollo
1. Preparazione del digitonina
- Aggiungere 500 ml di etanolo al 100% di una provetta e collocarla in un blocco di calore a 80 ° C per 10 min.
- Sciogliere 2,5 mg di digitonina in 250 ml di etanolo riscaldato per produrre una soluzione madre 1% del digitonina.
- Per generare una soluzione di lavoro del 0,04% digitonina, aggiungere 40 ml di soluzione di riserva digitonina a 960 ml di HCN tampone (50 Hepes mM pH 7,5, 150 mM NaCl, 2 mM CaCl 2, 10 mM N-ethylmaleimide, e un inibitore della proteasi cocktail).
2. Intossicazione cellulare e permeabilizzazione
Il nostro test traslocazione può essere applicato a una serie di tossine e linee cellulari. Di seguito, forniamo un protocollo dettagliato per la rilevazione di tossina colerica (CT). Una panoramica della procedura è prevista in Figura 1.
- Cellule HeLa vengono seminate nel 6 pozzetti contenenti 1 ml di DMEM supplementato con 10% di siero fetale bovino e antibiotici antimicoticiper raggiungere 1x10 6 cellule / pozzetto dopo una notte di incubazione a 37 ° C. Per generare abbastanza tossina citosolico per il rilevamento riproducibile, pozzi triplice copia sono necessari per ogni condizione.
- A seguito di una notte di incubazione, sostituire il terreno di coltura con 1 ml di DMEM contenente 100 ng / mL di ganglioside GM1. Questo aumenta il numero di siti di legame per il CT, in quanto il GM1 recettore di CT sarà intercalare nella membrana plasmatica delle cellule esposte ad una soluzione di GM1.
- Dopo una incubazione di 1 ora a 37 ° C, togliere il GM1 contenenti medie e lavare le cellule due volte con DMEM. Allora, posto le cellule a 4 ° C per 30 minuti in 1 ml di DMEM contenente 1 mg / mL di CT.
- Rimuovere la tossina mezzo contenente, lavare le cellule due volte con DMEM, e incubare le cellule in 1 ml di DMEM a 37 ° C per l'intervallo di tempo desiderato (s).
- Alla fine di ogni periodo di caccia, lavare le cellule con PBS e incubare ciascun pozzetto con 250 microlitri di 0.5 mM EDTA in PBS. Lasciate che le cellule sedere per 10 minuti a temperatura ambiente e poi togliere dal 6 pozzetti di triturazione vigoroso con un p1000 Pipetman. Dopo un pozzetto di cellule sono stati raccolti, si combinano con il secondo e poi terzo pozzo dalla stessa condizione. Raschiatori cellulare può essere utilizzato anche per raccogliere le cellule.
- Posizionare la sospensione combinato di cellule dai tre pozzi replicare (750 microlitri di volume totale) in una provetta sola, e spin in una microcentrifuga da tavolo per 5 min a 5.000 x g. Pellet cellulari di dimensioni più o meno equivalente deve essere ottenuta per tutte le condizioni.
- Eliminare il surnatante e risospendere il pellet cellulare in 100 microlitri della soluzione del 0,04% di lavoro digitonina. Posizionare la sospensione cellulare in ghiaccio per 10 min.
- Spin le cellule digitonina-permeabilizzate a 16.000 xg per 10 minuti in una microcentrifuga da tavolo. Trasferire il citosol frazione contenente benzina supernatante in una provetta fresco, e mantenere l'organulo frazione contenente benzina pellet.
- Frazioni surnatante citosol contenenti sono diluiti in tampone HCN ad un volume finale di 1 ml. Volumi di campione di almeno 1 mL sono necessarie per garantire l'aria viene estratta dal ciclo campione di 500 microlitri prima dell'iniezione.
- Organello contenenti frazioni di pellet sono risospesi in 1 ml di HCN tampone contenente 1% Triton X-100. Aggiunta di detersivo è necessario per rilasciare il membrana rivestita pool di tossina.
- Standard di tossine a concentrazioni di 100, 10, 1, e 0,1 ng / mL sono preparato in tampone HCN.
- Paralleli di frazioni citosoliche e organelli sono preparati per un esperimento di controllo per confermare la fedeltà della procedura di frazionamento. Frazioni generato come descritto nella Sezione 2 sono risospesi in 20 ml di tampone campione 4x (frazione citosolica) o 120 ml di 1x tampone campione (frazione organello). Volumi equivalenti di ogni frazione sono risolti con sodio dodecil elettroforesi su gel di poliacrilamide solfato e sondato by Western blot per dimostrare il partizionamento di una proteina citosolica nella frazione surnatante e solubile, la proteina ER residente nella frazione pellet 16-19.
4. SPR scivolo preparazione
- La Reichert SR7000 SPR rifrattometro viene usato per gli esperimenti SPR.
- Impostare un dorato vetrino con un monostrato auto-assemblato nello strumento SPR. Per attivare il sensore di scorrimento, profumato un (v: v) 1:1 soluzione di 0,4 M EDC SSN e 0,1 M sul vetrino per 10 minuti ad un flusso di 41 microlitri / min. Tutti perfusione successive utilizzeranno la stessa portata.
- Per rimuovere l'EDC: buffer di attivazione del Servizio Sanitario Nazionale, lavare la piastra per 5 minuti con PBS contenente 0,05% di Tween 20 (PBST). La piastra contiene ora pastoie ammide reattiva a causa uncapping dal EDC: soluzione NHS.
- Profumato anti-CTA anticorpi sopra la diapositiva sensore attivato a una diluizione di 1:20.000 in 20 mM acetato di sodio (pH 5,5) per 15 minuti. Un calo iniziale nel rifrazione index unità (RIU), si vedrà per effetto della variazione del pH. Questo sarà seguito da un aumento della RIU come l'anticorpo viene catturato dalla amide-reattiva pastoie sul vetrino del sensore.
- Rimuovere l'anticorpo non legato dal vetrino del sensore con un lavaggio PBST 5 minuti. Il segnale prodotto dal RIU anticorpi catturata verrà plateau e stabilizzare, fornendo un nuovo segnale di base.
- Profumato etanolammina 1 M (pH 8,5) sopra il vetrino del sensore per 5 min. Questo tappi e rende inattivi eventuali attacchi non legato lasciato sul vetrino del sensore.
5. SPR analisi dei campioni
- Per stabilire una lettura di base, PBST perfusione negli legate agli anticorpi sensore per 5 min.
- Perfusione un campione sperimentale o standard tossina sopra il sensore per 300 sec. Rimuovere il ligando dal buffer e PBST profumato sul sensore per altri 200 sec.
- Dopo ogni perfusione, tossina legato viene rimosso dal sensore da un lavaggio 100 sec con PBST a pH 5.0. Ciò restituirà il segnaledi lettura di base iniziale, permettendo così un altro campione da elaborare sul sensore stesso.
- Prima di caricare un nuovo campione, spingere una piccola quantità di aria attraverso il ciclo di campionamento per espellere eventuali residui di liquido dal campione precedente. Utilizzando la procedura descritta in 5,2-5,4, dobbiamo correre fino a 12 campioni su una diapositiva senza sostanziale perdita del segnale di base.
- L'analisi dei dati è effettuata con il software 2 Scrubber, Igor e il software viene utilizzato per la preparazione figura.
6. Rappresentante Risultati
Tossina della pertosse (PT) è una tossina AB che si muove dalla superficie cellulare al pronto soccorso prima della sua Una catena (PTS1) entra nel citosol 3, 12. Come mostrato nella Figura 2, il nostro SPR-saggio basato su traslocazione in grado di rilevare PTS1 nel citosol delle cellule CHO intossicato. Nessun segnale è stato generato dal citosol di cellule unintoxicated, che ha confermato l'anticorpo anti-PTS1 non cross-reagiscono con un componente del citosol ospitante. Ilfrazione citosolica intossicati dalle cellule in presenza di brefeldin A (BFA) non è riuscito a produrre un segnale positivo. BfA tossina impedisce di trasporto al sito di traslocazione ER 6-8, 12, 20-25 e, quindi, una catena di consegna al citosol. Alla fine di ogni esecuzione, la tossina legata è spogliato dalla diapositiva sensore. Questo ha permesso di campioni multipli di essere proiettato su un vetrino singolo sensore e quindi fornito un confronto diretto tra i risultati ottenuti con differenti condizioni sperimentali.
CT è un altro AB-tipo, ER-translocating tossina 4. In Figura 3A, CTA1 è stato rilevato nella frazione citosolica da CT-trattate cellule HeLa. Questo ha sottolineato che la nostra metodologia funziona con più tipi di cellule e può essere applicato a qualsiasi tossina per il quale un anticorpo anti-A catena è disponibile. Nessun segnale è stato rilevato quando la frazione citosolica dal CT cellule trattate è stato perfuso su un sensore SPR rivestiti con un anticorpo anti-CTB (Fig. 3B), dimostrando così che la CTA1subunità, ma non la cellula vincolante CTB pentamero entra nel citosol. Figura 3C mostra il segnale dalla frazione organello è fuori scala rispetto al segnale più debole dalla frazione citosolica. Ciò era coerente con la nota inefficienza del CT di trasporto al sito di traslocazione ER 6, 7, che a sua volta limita la quantità di tossina che può raggiungere il citosol. Inoltre, la frazione organello contiene holotoxin CT e ER-CTA1 localizzata, in modo che il segnale risultante SPR per la frazione organello è gonfiato dalla massa aggiuntiva del holotoxin associati CTB pentamero. Quindi, non è pratico per tracciare i dati provenienti dalle frazioni di organello e citosolica sul sensorgram stesso.
Il nostro test in grado di monitorare il tempo-dipendente accumulo di traslocato, tossina citosolica (Fig. 4). Le cellule sono state esposte a CT a 4 ° C, una temperatura che permette di tossina legandosi alla membrana plasmatica, ma impedisce l'interiorizzazione della cellula associato tossina. Dopo il removal di tossina non legata, le cellule sono state riscaldate a 37 ° C. Sia il trasporto della tossina al pronto soccorso e A traslocazione catena al citosol può avvenire a questa temperatura. Non tossina è stata rilevata nel citosol 15 minuti dopo il riscaldamento a 37 ° C. Questo riflette l'intervallo di tempo necessario per (i) il traffico holotoxin al pronto soccorso, (ii) A / dissociazione subunità B al pronto soccorso, e (iii) Una catena di esportazione al citosol. Un pool minori di tossina citosolico è stata rilevata dopo 30 minuti a 37 ° C, e le quantità progressivamente crescenti di tossina citosolico sono stati individuati dopo il 45 e 60 minuti inseguimento. Livelli ancora maggiori di tossina citosolico sono stati individuati dopo un intervallo di 5 ore inseguimento 17, dimostrando così un continuo, a lungo termine di consegna delle cellule associate tossina alla citosol ospitante.
Il nostro test può anche rilevare l'inibizione della traslocazione di tossine al citosol (Fig. 5). Cellule trattate con il 10% dimetilsolfossido (DMSO), un chaperone chimico che impedisce il Disord termicoEring del isolate CTA1 subunità (T. Banerjee e K. Teter, osservazioni non pubblicate), esposto bassi livelli di CTA1 citosolico rispetto alle cellule controllo non trattato. Svolgimento della tossina Una catena è un prerequisito per traslocazione del citosol 16-18, in modo che il DMSO indotta stabilizzazione del CTA1 di conseguenza impedito il suo movimento dal pronto soccorso al citosol.
Il tasso di associazione costante (k a) calcolato da esperimenti di SPR è direttamente proporzionale alla concentrazione di ligando nel buffer di perfusione 14, 15, 26. Così, è possibile determinare la concentrazione di tossina citosolica da un grafico che traccia la K a valori per le norme tossina in funzione della concentrazione di tossine. Questa procedura è stata utilizzata per quantificare il DMSO indotta blocco di traslocazione di tossine presentato in Figura 5: la curva standard generata da concentrazioni note di tossina è stato utilizzato per calcolare un citosolico CTA1 concenione di 0,3 ng / mL per cellule non trattate e 0,1 ng / mL per DMSO cellule trattate (Fig. 6). L'inibizione della CTA1 svolgimento da parte di DMSO così generato una riduzione di 3 volte al pronto soccorso a citosol traslocazione di CTA1.

Figura 1. Protocollo panoramica. (A) Le cellule vengono incubate con la tossina AB a 4 ° C, una temperatura che permette di tossina legame alla superficie cellulare, ma impedisce endocitosi tossina. La subunità A e B della tossina sono rappresentati da cerchi rossi e blu, rispettivamente. (B) tossina non legato viene rimosso dal mezzo, e le cellule vengono riscaldati a 37 ° C al fine di promuovere il trasporto endocitosi e retrograda del holotoxin al pronto soccorso. Holotoxin dissociazione si verifica al Pronto Soccorso, che permette la isolato Una catena per entrare nel citosol passando attraverso una proteina-canale di conduzione (s) nella membrana ER. (C) Le cellule vengono trattate con digitonina per permeabilize selettivamente il plasmamembrana. (D) centrifugazione è usata per dividere le celle in parte frazioni citosoliche e organelli. Il citosol è spremuto fuori della cellula attraverso la digitonina generati pori e si trova nel surnatante. Il intatto, legata alla membrana organelli si trovano nella frazione di pellet. (E) Per rilevare la piscina traslocato Una catena di tossina nel citosol di accoglienza, la frazione surnatante è perfuso su un sensore SPR rivestiti con un anticorpo anti-A catena.
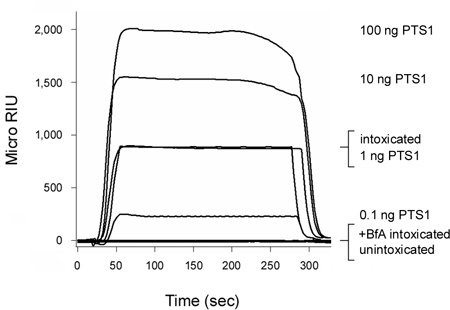
Figura 2. Rilevamento di PTS1 traslocazione nel citoplasma ospite. Cellule CHO sono stati marcati con impulsi a 4 ° C per 30 minuti con 1 mg / mL di PT. Le cellule sono state poi inseguito per 3 ore a 37 ° C in terreno privo di tossine che non contengono le aggiunte (ubriaco) o BfA 5 mcg / ml (+ BfA intossicati). Permeabilizzazione della membrana plasmatica con digitonina è stata usata per estratti cellulari in partizione separata organello e citosolica fractions. Un sensore SPR rivestiti con un anticorpo anti-PTS1 è stato utilizzato per rilevare la piscina citosolico di PTS1 da cellule non trattate o trattate con BfA. PTS1 standard sono stati perfusi sul sensore come controlli positivi, mentre la frazione citosolica dalle cellule unintoxicated è stato perfuso sopra la diapositiva sensore come controllo negativo. Alla fine di ogni esecuzione, legato campione è stato spogliato dalla diapositiva sensore.

Figura 3. Rilevamento di CTA1 traslocazione nel citoplasma ospite. Cellule HeLa impulso marcato a 4 ° C con 1 mg / mL di CT sono stati inseguiti per 2 ore a 37 ° C in terreno privo di tossine che non contengono le aggiunte (ubriaco) o BfA 5 mcg / ml (+ BfA intossicati). Permeabilizzazione della membrana plasmatica con digitonina è stata usata per estratti cellulari in partizione separata organello e frazioni citosoliche. (A) Le frazioni citosoliche sono stati perfusi su un sensore SPR rivestiti con un anticorpo anti-CTA. Notoquantità di CTA sono stati utilizzati come controlli positivi, mentre il citosol dalle cellule unintoxicated è stato utilizzato come controllo negativo. (B) La frazione citosolica intossicati dalle cellule in assenza di BfA è stato perfuso su un sensore SPR rivestiti con un anticorpo anti-CTB. A purificata CTB pentamero era perfuso sopra la diapositiva come controllo positivo. (C) La frazione organello è stato solubilizzato con 1% Triton X-100 prima di perfusione nel corso di un sensore SPR rivestiti con un anticorpo anti-CTA. Ai fini comparativi, la frazione citosolica (1 ml di volume finale) dall'estratto stessa cella e uno standard CTA sono stati perfusi sul sensore. Per tutti i pannelli, campione legato è stata spogliata dal sensore alla fine di ogni esecuzione.

Figura 4. Cinetica di CTA1 ingresso nel citosol. Cellule HeLa impulso marcato a 4 ° C con 1 mg / mL di CT sono stati inseguiti per 15, 30, 45 o 60 min a 37 ° C in tossina-libero Medium. Per rilevare la piscina traslocato di tossina, frazioni citosoliche da digitonina-permeabilizzate cellule sono state perfusi su un sensore SPR rivestiti con un anticorpo anti-CTA. Standard CTA sono stati perfusi sul sensore pure. Alla fine di ogni esecuzione, legato campione è stato spogliato dalla diapositiva sensore.
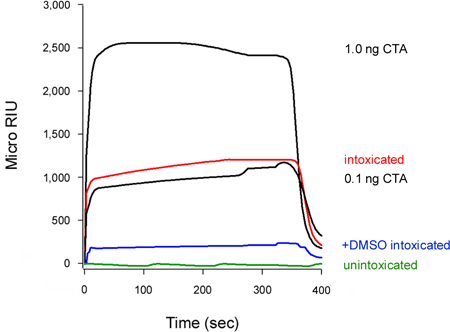
Figura 5. Inibizione della traslocazione CTA1 da DMSO. Cellule HeLa impulso marcato a 4 ° C con 1 mg / mL di CT sono stati inseguiti per 2 ore a 37 ° C in terreno privo di tossine che non contengono le aggiunte (ubriaco) o 10% di DMSO (+ DMSO intossicati). Per rilevare la piscina traslocato di tossina, frazioni citosoliche da digitonina-permeabilizzate cellule sono state perfusi su un sensore SPR rivestiti con un anticorpo anti-CTA. Standard CTA (100, 10, 1, e 0,1 ng / mL) sono stati perfusi sul sensore come controlli positivi, solo l'1 e 0,1 ng / mL standard sono mostrate per scopi di scala. Il citosol da unintoxicatecelle d è stato utilizzato come controllo negativo. Alla fine di ogni esecuzione, legato campione è stato spogliato dalla diapositiva sensore.
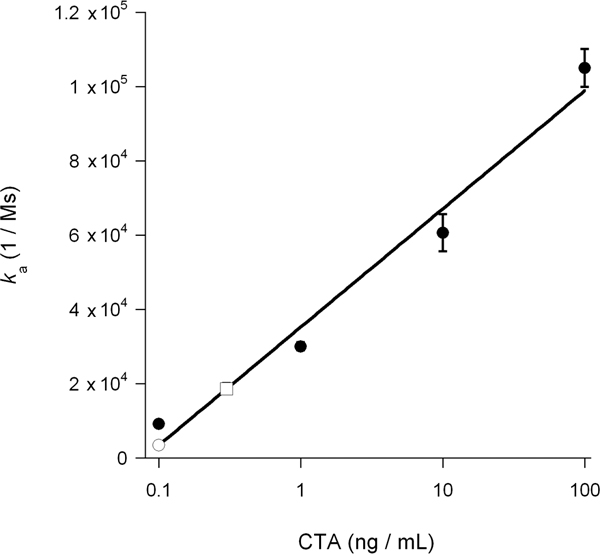
Figura 6. Calcolo del citosolico CTA1. K uno standard di valori per il CTA di figura 5 sono state tracciate in funzione della concentrazione di tossine. La curva risultante standard è stato utilizzato per determinare, sulla base dei valori di k uno dei campioni sperimentali di figura 5, la concentrazione di CTA1 citosolico in cellule non trattate e trattate con DMSO. Standard di tossina si presentano come cerchi pieni, il citosol non trattata si presenta come una piazza aperta, e il DMSO trattati citosol si presenta come un cerchio aperto. Le medie ± gamme di due esperimenti indipendenti sono mostrati.
Access restricted. Please log in or start a trial to view this content.
Discussione
Confronto con metodologia esistente
Il nostro SPR-saggio basato su traslocazione rappresenta un metodo rapido, sensibile e quantitativa per rilevare la consegna tossina nel citosol ospitante. La tecnica non richiede radiomarcatura o altre modifiche alla tossina, e può essere applicato a qualsiasi tossina per i quali un anti-tossina A anticorpi catena è disponibile. Gli attuali metodi di monitorare il passaggio della tossina nel citosol anche contare su un protocollo di frazionamento subcellu...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Questo lavoro è stato finanziato dal NIH concedere R01 AI073783 a K. Teter. Ringraziamo il Dott. Shane Massey per l'assistenza nello sviluppo del protocollo di frazionamento subcellulare e Helen Burress per la lettura critica del manoscritto.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | |
| Digitonina | Sigma | D141 | |
| Etanolo | Acros | 61509-0010 | |
| DMEM | Invitrogen | 11995065 | |
| Siero bovino fetale | Atlanta Biologicals | S11550 | |
| Ganglioside GM1 | Sigma | G7641 | |
| CTA | Sigma | C2398 | |
| PTS1 | Lista | 182 | |
| NHS (N-Hydroxysuccinimide) | Perforare | 24500 | |
| EDC (1-etil-3-(3-dimetilamminopropil) carbodiimmide) | Thermo Scientific | 22981 | |
| Etanolammina | Sigma | E0135 | |
| PBST | Medicago | 09-8903-100 | |
| Anticorpi anti-CTA | Santa Cruz Biotech | sc-80747 | |
| Anticorpi anti-CTB | Calbiochem | 227040 | |
| Anticorpi anti-PTS1 | Santa Cruz Biotech | sc-57639 | |
| Rifrattometro | Reichert | SR7000, SR7000DC | |
| SPR Sensore di diapositive | Reichert | 13206060 | |
| Pompa siringa | Cole Palmer | 780200C |
Riferimenti
- Sandvig, K., van Deurs, B. Membrane traffic exploited by protein toxins. Annu. Rev. Cell Dev. Biol. 18, 1-24 (2002).
- Watson, P., Spooner, R. A. Toxin entry and trafficking in mammalian cells. Adv. Drug Deliv. Rev. 58, 1581-1596 (2006).
- Carbonetti, N. H. Pertussis toxin and adenylate cyclase toxin: key virulence factors of Bordetella pertussis and cell biology tools. Future Microbiol. 5, 455-469 (2010).
- Wernick, N. L. B., Chinnapen, D. J. -F., Cho, J. A., Lencer, W. I. Cholera toxin: an intracellular journey into the cytosol by way of the endoplasmic reticulum. Toxins. 2, 310-325 (2010).
- Lord, J. M., Roberts, L. M., Lencer, W. I. Entry of protein toxins into mammalian cells by crossing the endoplasmic reticulum membrane: co-opting basic mechanisms of endoplasmic reticulum-associated degradation. Curr. Top. Microbiol. Immunol. 300, 149-168 (2005).
- Lencer, W. I. Entry of cholera toxin into polarized human intestinal epithelial cells. Identification of an early brefeldin A sensitive event required for A1-peptide generation. J. Clin. Invest. 92, 2941-2951 (1993).
- Orlandi, P. A., Curran, P. K., Fishman, P. H. Brefeldin A blocks the response of cultured cells to cholera toxin. Implications for intracellular trafficking in toxin action. J. Biol. Chem. 268, 12010-12016 (1993).
- Sandvig, K., Prydz, K., Hansen, S. H., van Deurs, B. Ricin transport in brefeldin A-treated cells: correlation between Golgi structure and toxic effect. J. Cell. Biol. 115, 971-981 (1991).
- Sandvig, K., Prydz, K., Ryd, M., van Deurs, B. Endocytosis and intracellular transport of the glycolipid-binding ligand Shiga toxin in polarized MDCK cells. J. Cell Biol. 113, 553-562 (1991).
- van Deurs, B. Estimation of the amount of internalized ricin that reaches the trans-Golgi network. J. Cell Biol. 106, 253-267 (1988).
- Tam, P. J., Lingwood, C. A. Membrane cytosolic translocation of verotoxin A1 subunit in target cells. Microbiology. 153, 2700-2710 (2007).
- Plaut, R. D., Carbonetti, N. H. Retrograde transport of pertussis toxin in the mammalian cell. Cell. Microbiol. 10, 1130-1139 (2008).
- Willander, M., Al-Hilli, S. Analysis of biomolecules using surface plasmons. Methods Mol. Biol. 544, 201-229 (2009).
- Homola, J. Present and future of surface plasmon resonance biosensors. Anal. Bioanal. Chem. 377, 528-539 (2003).
- Medaglia, M. V., Fisher, R. J. Protein-Protein Interactions. Golemis, E. , Cold Spring Harbor Laboratory Press. Cold Spring Harbor, New York. 255-272 (2002).
- Banerjee, T. Contribution of subdomain structure to the thermal stability of the cholera toxin A1 subunit. Biochemistry. 49, 8839-8846 (2010).
- Massey, S. Stabilization of the tertiary structure of the cholera toxin A1 subunit inhibits toxin dislocation and cellular intoxication. J. Mol. Biol. 393, 1083-1096 (2009).
- Taylor, M. A therapeutic chemical chaperone inhibits cholera intoxication and unfolding/translocation of the cholera toxin A1 subunit. PLoS ONE. 6, e18825-e18825 (2011).
- Taylor, M. Hsp90 is required for transfer of the cholera toxin A1 subunit from the endoplasmic reticulum to the cytosol. J. Biol. Chem. 285, 31261-31267 (2010).
- Donta, S. T., Beristain, S., Tomicic, T. K. Inhibition of heat-labile cholera and Escherichia coli enterotoxins by brefeldin A. Infect. Immun. 61, 3282-3286 (1993).
- Donta, S. T., Tomicic, T. K., Donohue-Rolfe, A. Inhibition of Shiga-like toxins by brefeldin. A. J. Infect. Dis. 171, 721-724 (1995).
- Nambiar, M. P., Oda, T., Chen, C., Kuwazuru, Y., Wu, H. C. Involvement of the Golgi region in the intracellular trafficking of cholera toxin. J. Cell. Physiol. 154, 222-228 (1993).
- Rapak, A., Falnes, P. O., Olsnes, S. Retrograde transport of mutant ricin to the endoplasmic reticulum with subsequent translocation to cytosol. Proc. Natl. Acad. Sci. U. S. A. 94, 3783-3788 (1997).
- Xu, Y., Barbieri, J. T. Pertussis toxin-mediated ADP-ribosylation of target proteins in Chinese hamster ovary cells involves a vesicle trafficking mechanism. Infect. Immun. 63, 825-832 (1995).
- Yoshida, T., Chen, C. C., Zhang, M. S., Wu, H. C. Disruption of the Golgi apparatus by brefeldin A inhibits the cytotoxicity of ricin, modeccin, and Pseudomonas toxin. Exp. Cell Res. 192, 389-395 (1991).
- Godber, B. Direct quantification of analyte concentration by resonant acoustic profiling. Clin. Chem. 51, 1962-1972 (2005).
- Bernardi, K. M., Forster, M. L., Lencer, W. I., Tsai, B. Derlin-1 facilitates the retro-translocation of cholera toxin. Mol. Biol. Cell. 19, 877-884 (2008).
- Wernick, N. L., De Luca, H., Kam, W. R., Lencer, W. I. N-terminal Extension of the Cholera Toxin A1-chain Causes Rapid Degradation after Retrotranslocation from Endoplasmic Reticulum to Cytosol. J. Biol. Chem. 285, 6145-6152 (2010).
- Simpson, J. C. Ricin A chain utilises the endoplasmic reticulum-associated protein degradation pathway to enter the cytosol of yeast. FEBS. Lett. 459, 80-84 (1999).
- Veithen, A., Raze, D., Locht, C. Intracellular trafficking and membrane translocation of pertussis toxin into host cells. Int. J. Med. Microbiol. 290, 409-413 (2000).
- Castro, M. G., McNamara, U., Carbonetti, N. H. Expression, activity and cytotoxicity of pertussis toxin S1 subunit in transfected mammalian cells. Cell. Microbiol. 3, 45-54 (2001).
- Schmitz, A., Herrgen, H., Winkeler, A., Herzog, V. Cholera toxin is exported from microsomes by the Sec61p complex. J. Cell Biol. 148, 1203-1212 (2000).
- Teter, K., Allyn, R. L., Jobling, M. G., Holmes, R. K. Transfer of the cholera toxin A1 polypeptide from the endoplasmic reticulum to the cytosol is a rapid process facilitated by the endoplasmic reticulum-associated degradation pathway. Infect. Immun. 70, 6166-6171 (2002).
- Winkeler, A., Godderz, D., Herzog, V., Schmitz, A. BiP-dependent export of cholera toxin from endoplasmic reticulum-derived microsomes. FEBS Lett. 554, 439-442 (2003).
- Yu, M., Haslam, D. B. Shiga toxin is transported from the endoplasmic reticulum following interaction with the luminal chaperone HEDJ/ERdj3. Infect. Immun. 73, 2524-2532 (2005).
- LaPointe, P., Wei, X., Gariepy, J. A role for the protease-sensitive loop region of Shiga-like toxin 1 in the retrotranslocation of its A1 domain from the endoplasmic reticulum lumen. J. Biol. Chem. 280, 23310-23318 (2005).
- Teter, K., Jobling, M. G., Sentz, D., Holmes, R. K. The cholera toxin A13 subdomain is essential for interaction with ADP-ribosylation factor 6 and full toxic activity but is not required for translocation from the endoplasmic reticulum to the cytosol. Infect. Immun. 74, 2259-2267 (2006).
- Redmann, V. Dislocation of ricin toxin a chains in human cells utilizes selective cellular factors. J. Biol. Chem. 286, 21231-21238 (2011).
- Yamaizumi, M., Mekada, E., Uchida, T., Okada, Y. One molecule of diphtheria toxin fragment A introduced into a cell can kill the cell. Cell. 15, 245-250 (1978).
- Bellisola, G. Reductive activation of ricin and ricin A-chain immunotoxins by protein disulfide isomerase and thioredoxin reductase. Biochem. Pharmacol. 67, 1721-1731 (2004).
- McKee, M. L., FitzGerald, D. J. Reduction of furin-nicked Pseudomonas exotoxin A: an unfolding story. Biochemistry. 38, 16507-16513 (1999).
- Orlandi, P. A. Protein-disulfide isomerase-mediated reduction of the A subunit of cholera toxin in a human intestinal cell line. J. Biol. Chem. 272, 4591-4599 (1997).
- Spooner, R. A. Protein disulphide-isomerase reduces ricin to its A and B chains in the endoplasmic reticulum. Biochem. J. 383, 285-293 (2004).
- Fujinaga, Y. Gangliosides that associate with lipid rafts mediate transport of cholera and related toxins from the plasma membrane to endoplasmic reticulm. Mol. Biol. Cell. 14, 4783-4793 (2003).
- Guerra, L. Cellular internalization of cytolethal distending toxin: a new end to a known pathway. Cell. Microbiol. 7, 921-934 (2005).
- Johannes, L., Tenza, D., Antony, C., Goud, B. Retrograde transport of KDEL-bearing B-fragment of Shiga toxin. J. Biol. Chem. 272, 19554-19561 (1997).
- Deeks, E. D. The low lysine content of ricin A chain reduces the risk of proteolytic degradation after translocation from the endoplasmic reticulum to the cytosol. Biochemistry. 41, 3405-3413 (2002).
- Hazes, B., Read, R. J. Accumulating evidence suggests that several AB-toxins subvert the endoplasmic reticulum-associated protein degradation pathway to enter target cells. Biochemistry. 36, 11051-11054 (1997).
- Rodighiero, C., Tsai, B., Rapoport, T. A., Lencer, W. I. Role of ubiquitination in retro-translocation of cholera toxin and escape of cytosolic degradation. EMBO Rep. 3, 1222-1227 (2002).
- Worthington, Z. E., Carbonetti, N. H. Evading the proteasome: absence of lysine residues contributes to pertussis toxin activity by evasion of proteasome degradation. Infect. Immun. 75, 2946-2953 (2007).
- Pande, A. H., Moe, D., Jamnadas, M., Tatulian, S. A., Teter, K. The pertussis toxin S1 subunit is a thermally unstable protein susceptible to degradation by the 20S proteasome. Biochemistry. 45, 13734-13740 (2006).
- Pande, A. H. Conformational instability of the cholera toxin A1 polypeptide. J. Mol. Biol. 374, 1114-1128 (2007).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon