Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Yüzey Plasmon Rezonans Host Cytosol Toksin Translokasyon Tespiti
Bu Makalede
Özet
Bu raporda, yüzey plazmon rezonans ev sahibi sitoplazmada içine toksin girişini tespit etmek için nasıl kullanıldığını açıklar. Bu son derece duyarlı bir yöntem sitozolik toksin miktarı nicel veri sağlayabilir ve toksinlerin bir dizi yapılabilir.
Özet
AB toksinler A alt biriminin bir enzimatik ve hücre bağlayıcı B alt ünite 1 oluşur. Bu toksinler ekstraselüler ortam içine salgılanan, ancak ökaryotik sitoplazmada içinde hedefleri doğrultusunda hareket. Bazı AB toksinler hücre yüzeyinde sitoplazmada 2-4 girmeden önce endoplazmik retikulum (ER) vezikül taşıyıcılar tarafından seyahat ER, toksin ve hamle geri kalanı protein iletken bir kanal aracılığıyla katalitik Bir zincir ayrışmaktadır onun sitozolik hedef 5 ulaşmak için . ER toksin ticareti son derece verimsiz bir süreç olmasından dolayı, transloke, sitozolik zinciri tespit etmek zordur: en içselleştirilmiş toksin golgi ve ER 6 ulaşır yüzey bağlı toksin yüzden sadece küçük bir bölümünü, bozulması için lizozomlar yönlendirilir -12.
ER kültürlü hücrelerde sitoplazmada toksin translokasyon izlemek için highl Subselüler fraksiyonasyon protokolü kombineyüzey plazmon rezonans (SPR) 13-15 y hassas algılama yöntemi. Toksin-tedavili hücrelerde plazma zarı seçici, daha sonra bir anti-toksin A zinciri antikor ile kaplı bir SPR sensör üzerinden perfüze bir sitozolik fraksiyonu toplanması için izin verirler digitonin ile permeabilize. Antikor kaplı sensör sitozolik toksin pg / mL miktarlarda yakalamak ve tespit edebilir. Bu protokol ile, sitoplazmada toksin giriş kinetiği takip etmek ve translokasyon olayı üzerine inhibitör etkileri karakterize etmek mümkündür. Sitozolik toksin konsantrasyonu sensör üzerindeki perfüze edilmiştir zinciri standartları bilinen miktarlarda üretilen standart bir eğri de hesaplanabilir. Bizim yöntem, hedef toksin Radyoaktif veya diğer modifikasyonlar gerektirmeyen bir, hızlı, duyarlı, ve kantitatif algılama sistemi temsil eder.
Protokol
1. Digitonin, hazırlanması
- Bir mikrosantrifüj tüp 500% 100 etanol mcL ekleyin ve 80 ° C de 10 dakika süreyle bir ısı bloğu yerleştirin.
- Digitonin% 1 hisse çözüm üretmek için ısıtmalı etanol 250 mcL digitonin 2.5 mg eritin.
- % 0.04 digitonin çalışan bir çözüm üretmek için, 960 mcL HCN tampon (50 mM HEPES pH 7.5, 150 mM NaCl, 2 mM CaCl 2, 10 mM N-ethylmaleimide, ve proteaz inhibitörü digitonin stok solüsyonu 40 mcL ekleyin kokteyl).
2. Hücre zehirlenme ve permeabilization
Bizim translokasyon tahlil toksinler ve hücre hatları bir dizi yapılabilir. Aşağıda, kolera toksini (CT) tespiti için detaylı bir protokol sağlar. Prosedürün bir bakış Şekil 1'de verilmiştir.
- HeLa hücrelerinde% 10 ile desteklenmiş 1 ml DMEM içeren 6-kuyucuğu numaralı seribaşı fetal sığır serumu ve antibiyotik-antimikotik1x10 6 hücre elde etmek için / iyi bir gecelik inkübasyon 37 ° C Tekrarlanabilir tespiti için yeterli sitozolik toksin oluşturmak için, üç nüsha kuyuları, her bir durum için gereklidir.
- Bir gecelik inkübasyondan sonra, 1 ml DMEM gangliozid GM1 100 ng / ml içeren kültür ortamı değiştirin. BT GM1 reseptör GM1 bir çözüm maruz kalan hücrelerin plazma zarı içine enterkale Bu, CT için bağlayıcı sitelerinin sayısını artırır.
- 37 1 saat inkübasyondan sonra ° C, GM1 içeren orta kaldırmak ve DMEM ile hücreler iki kez yıkayın. Sonra, 4 hücrelerin ° C 30 dakika 1 ml DMEM CT 1 mcg / ml içeren.
- 37, toksin içeren orta çıkarın DMEM ile hücreler iki kez yıkamak ve 1 ml DMEM hücrelerin inkübe ° C istenilen zaman aralığı (ler).
- Her kovalama dönemi sonunda, hücreler PBS ile yıkama ve PBS içinde 0.5 mM EDTA 250 mcL ile her kuyu kuluçkaya yatmaktadır. Hücreler 10 için bekletin sonra oda sıcaklığında dakika ve 6-P1000 Pipetman dinç öğütme plaka bunları kaldırmak. Hücrelerinin bir kuyu toplanan edildikten sonra, aynı durum ikinci ve ardından üçüncü birleştirin. Hücre kazıyıcılar hücreleri toplamak için kullanılabilir.
- Kombine hücre süspansiyonu, tek bir mikrosantrifüj tüp içinde üç çoğaltmak kuyu (750 mcL toplam hacim), koyun ve 5.000 x g. 5 dakika için bir masaüstü mikrosantrifüj çok spin Kabaca eşdeğer büyüklükte Hücre pelet tüm koşulları sağlanmalıdır.
- Süpernatantı atın ve% 0.04 digitonin çalışma çözeltisi 100 mcL hücre pelletini tekrar süspansiyon. Hücre süspansiyonu 10 dakika buz koyun.
- 16.000 xg de 10 dakika süreyle bir masaüstü mikrosantrifüj digitonin permeabilize hücreleri dönerler. Sitoplazmada içeren süpernatant fraksiyonu, taze bir mikrosantrifüj tüp transferi ve organel içeren pelet fraksiyonu korumak.
- Cytosol içeren süpernatant kesirleri HCN son hacim 1 ml tampon seyreltilir. En az 1 mL örnek hacmi, hava enjeksiyon öncesi 500 mcL örnek döngü temizlenir sağlamak için gerekli.
- Organel içeren pelet kesirler 1 ml% 1 Triton X-100 içeren HCN tampon yeniden süspanse. Deterjan eklenmesi toksin membran kaplı havuzu serbest bırakmak için gereklidir.
- 100 konsantrasyonları, 10, 1, ve 0.1 ng / ml Toksin standartları HCN tampon hazırlanır.
- Sitozolik ve organel kesirler paralel setleri fraksiyonasyon prosedürünün doğruluğunu onaylamak için bir kontrol deneyi için hazırlanmıştır. Kesirler Bölüm 2'de açıklandığı gibi 20 mcL 4x örnek tamponu (sitozolik fraksiyonu) veya 1x örnek tamponu (organel fraksiyonu) 120 mcL yeniden süspanse oluşturulur. Her fraksiyonu eşdeğer miktarda sodyum dodesil sülfat poliakrilamid jel elektroforezi ile çözümlenir ve b probedy Western Blot analizi supernatant fraksiyonu sitozolik protein bölümleme ve pelet fraksiyonu 16-19 çözünür, yerleşik ER protein göstermek.
4. SPR slayt hazırlama
- Reichert SR7000 SPR Refraktometre SPR deneyler için kullanılır.
- SPR enstrüman Kendi oluşturduğunuz bir tek tabaka ile altın kaplamalı bir cam slayt ayarlayın. 41 mcL / dak akış hızında 10 dakika için slayt üzerinde 0.4 M EDC ve 0,1 M NHS çözüm: sensör slayt etkinleştirmek için, 1:1 (v v) serpmek. Tüm sonraki perfüzyonları aynı akış hızı kullanacaktır.
- EDC kaldırmak için: NHS aktivasyon tampon, plaka PBS% 0.05 Tween 20 (PBST) içeren 5 dakika yıkayınız. NHS çözüm: plaka EDC tarafından Sır nedeniyle reaktif amid hayvan iplerini içerir.
- 15 dakika için 20 mM sodyum asetat (pH 5.5) 1:20,000 bir seyreltme aktif sensör slayt üzerinde bir anti-CTA antikor serpmek. Refraktif bir ilk düşüşdex birimi (RIU) pH değişikliği nedeniyle görülecektir. Bu antikor sensör slayt amid-reaktif hayvan iplerini tarafından yakalanır RIU bir artış ile takip edilecektir.
- 5 dakikalık bir PBST yıkama ile sensör slayt bağlanmamış antikor çıkarın. Yakalanan antikor tarafından üretilen RIU sinyal plato ve stabilize, yeni bir temel sinyal sağlayarak.
- 5 dakika boyunca sensör slayt üzerine serpmek 1 M etanolamin (pH 8.5). Bu kapaklar ve sensör slayt sol bağlanmamış hayvan iplerini inaktive.
5. Numune SPR analizi
- 5 dakika süreyle antikor kaplı bir sensör üzerinde bir temel okuma, yayma PBST kurmak için.
- 300 saniye boyunca sensör üzerinde deneysel bir örnek veya toksin standart serpmek. Başka bir 200 sn için tampon ve sensörün üzerine serpmek PBST ligand çıkarın.
- Her perfüzyonu takiben, bağlı toksin pH 5.0 PBST ile 100 saniye yıkama sensörü kaldırılır. Bu sinyal dönecektirböylece başka bir örnek aynı sensör üzerinde işlenecek sağlar. ilk temel okuma,
- Yeni bir örnek yüklemeden önce, bir önceki örnekten herhangi bir kalıntı sıvı sınırdışı örnek döngü içinde küçük bir miktar hava itin. 5,2-5,4 özetlenen yordamı kullanarak, önemli temel sinyal kaybı olmadan bir slayt 12 örnek için çalıştırmak.
- Veri analizi Scrubber 2 yazılımı ile yapılır, ve Igor yazılım rakam hazırlanması için kullanılır.
6. Temsilcisi Sonuçlar
Pertussis toksini (PT) Bir zincir (PTS1) 3, 12 sitoplazmada girmeden önce ER hücre yüzeyinde hareket bir AB toksin. Şekil 2'de görüldüğü gibi, SPR tabanlı translokasyon testi sarhoş CHO hücreler sitoplazmada PTS1 tespit olabilir. Sinyal yok PTS1 anti-antikor ev sahibi sitoplazmada bir bileşeni ile çapraz tepki vermedi doğruladı unintoxicated hücreleri, sitoplazmada oluşturulmuştur.brefeldin A (BFA) varlığı sarhoş hücreleri sitozolik fraksiyonu da olumlu bir sinyal üretmek için başarısız oldu. BFA ER translokasyon sitesinde 6-8, 12, 20-25 ve böylece sitoplazmada zinciri teslim toksin taşıma önler. Her çalışma sonunda, bağlı toksin sensör slayt kaldırılır. Bu izin çok sayıda örnekleri tek bir sensörü slayt gösterildi ve böylece farklı deneysel koşullar altında elde edilen sonuçlar arasında doğrudan bir karşılaştırma sağlanacak.
BT, başka bir AB-tipi, ER-translocating toksin 4. Şekil 3A, CTA1 CT-tedavi HeLa hücrelerinde sitozolik bir kısmını tespit edildi. Bu bizim metodoloji birden fazla hücre tipleri ile çalışır ve bir anti-Bir zincir antikor mevcut olduğu için herhangi bir toksin uygulanabilir olduğunu vurguladı. CT-tedavili hücrelerde sitozolik fraksiyonu, bir anti-CTB antikor (Şekil 3B) ile kaplı bir SPR sensör üzerinden perfüze iken sinyal böylece CTA1 gösteren tespit edildisubunit ancak hücre bağlayıcı CTB pentamer sitoplazmada girer. Şekil 3C organel fraksiyonu sinyal zayıf sinyal sitozolik fraksiyonu karşılaştırma ölçekli gösterir. Bu da sitoplazmada ulaşabilirsiniz toksin miktarını sınırlar ER translokasyon sitesi 6, 7, BT ulaşım bilinen verimsizlik ile uyumlu idi. Ayrıca, organel fraksiyonu CT holotoksin yanı sıra ER-lokalize CTA1, organel kısmı için sonuç SPR sinyali holotoksin ilişkili CTB pentamer ek bir kitle tarafından şişirilir içerir. Böylece, aynı sensorgram organel ve sitozolik kesirler verileri çizmek için pratik değildir.
Bizim test transloke, sitozolik toksin (Şekil 4) zaman bağımlı birikimi izleyebilirsiniz. Hücreler, 4 BT maruz kaldılar ° C, plazma zarı toksin bağlayıcı izin verir, ancak hücre ile ilişkili toksin içselleştirilmesi engelleyen bir sıcaklık. Remo sonrabağlanmamış toksin val, hücreler 37 ° C'ye kadar ısındı. ER toksin taşıma zinciri ve sitoplazmada translokasyon Her ikisi de bu sıcaklıkta oluşabilir. Sitoplazmada 15 dakika ısıttıktan sonra toksin 37 ° C tespit edildi Bu ER (i) holotoksin ticareti için gerekli gecikme süresi yansıtıyordu; ER (ii) A / B altbirim ayrılma ve sitoplazmada (iii) Bir zincir ihracat. Sitozolik toksin küçük bir havuz C ° 37 30 dakika sonra tespit edildi ve 45 ve 60 dakikalık bir kovalamaca aralıklarla sitozolik toksin aşamalı olarak büyük miktarlarda sonra tespit edildi. Sitozolik toksin bile daha fazla düzeyde, bu nedenle, ev sahibi sitoplazmada hücre ile ilişkili toksin sürekli, uzun vadeli teslimat gösteren, 5 saat kovalamaca aralığı 17 sonra tespit edildi.
Bizim tahlil de sitoplazmada toksin translokasyon inhibisyonu (Şekil 5) algılayabilir. Hücreler% 10 dimetil sülfoksit (DMSO), termal bozukluklar engelleyen kimyasal bir hastabakıcı ile tedavisi izole CTA1 subunit (T. Banerjee ve K. Teter, yayınlanmamış gözlemler), tedavi edilmemiş kontrol hücrelere kıyasla düşük seviyelerde sitozolik CTA1 sergiledi. Toksin Unfolding Bir zincir sitoplazmada 16-18 translokasyon için bir ön koşul olduğunu, buna göre CTA1 DMSO indüklenen istikrar ER sitoplazmada hareketini engelledi.
SPR deneyler hesaplanan dernek hız sabiti (k), perfüzyon tampon 14, 15, 26 ligand konsantrasyonu ile doğru orantılıdır . Böylece, bir grafik sitozolik toksin konsantrasyonu belirlemek mümkün k toksin konsantrasyonunun bir fonksiyonu olarak toksin standartları için bir değerler çizer. Bu prosedür Şekil 5 sunulan toksin translokasyon DMSO bağlı blok ölçmek için kullanılır: toksin bilinen konsantrasyonlarda üretilen standart eğri bir sitozolik CTA1 concentrat hesaplamak için kullanılır.iyon 0.3 ng / ml, tedavi edilmezse hücreleri ve DMSO muamele edilen hücreler için 0.1 ng / mL (Şekil 6). DMSO tarafından unfolding CTA1 inhibisyonu böylece CTA1 ER-sitoplazmada translokasyonu 3 kat bir azalma elde etti.

Şekil 1. Protokolü genel bakış. (A) Hücreler, 4 AB toksin ile inkübe ° C, hücre yüzeyinde toksin bağlayıcı sağlar ancak toksin endositoz engeller bir sıcaklık. Toksin A ve B alt birimden, sırasıyla, kırmızı ve mavi çevreler tarafından temsil edilmektedir. (B) Sınırsız toksin ortamdan uzaklaştırılması ve hücreler ° C ER holotoksin endositoz ve retrograd ulaşım teşvik etmek amacıyla 37 ısındı. Holotoksin disosiasyon ER, izole bir zincir ER membran protein iletken bir kanal (lar) geçerek sitoplazmada girmenizi sağlar oluşur. (C) Hücreler için seçici plazma permeabilize digitonin ile tedavi edilirmembran. (D) Santrifüj ayrı sitozolik ve organel kesirler bölümü hücreler için kullanılır. Digitonin oluşturulan gözenekler aracılığıyla hücrenin sitoplazmada sıkılarak ve süpernatant yer almaktadır. Sağlam, membrana bağlı organelleri pelet fraksiyonunda bulunur. (E), ev sahibi sitoplazmada toksin A zincirinin transloke havuzu algılamak için supernatant fraksiyonu, bir anti-A zinciri antikor ile kaplı bir SPR sensör üzerinden perfüze.
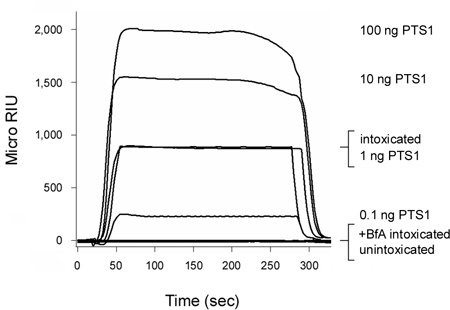
Şekil 2 ana sitoplazmada içine PTS1 translokasyon belirlenmesi. CHO hücreler darbe etiketli 4 ° C de 30 dakika ile 1 mcg / ml PT. Hücreler daha sonra 37 saat süreyle 3 kovaladı hiçbir eklemeler (sarhoş) veya 5 mg BFA / ml (+ BFA sarhoş) içeren ° C toksin içermeyen orta. Digitonin ile plazma membran Permeabilization ayrı organel ve sitozolik fracti bölüm hücre ekstreleri için kullanılanEklentiler. Bir anti-PTS1 antikor ile kaplı bir SPR sensörü, tedavi edilmezse veya BFA tedavi edilen hücrelerin PTS1 sitozolik havuzu algılamak için kullanıldı. PTS1 standartları unintoxicated hücrelerden sitozolik fraksiyonu sensör slayt üzerinde bir negatif kontrol olarak perfüze iken, pozitif kontrol olarak sensörün üzerine perfüze edildi. Her çalışma sonunda, ciltli örneği sensör slayt elimden alındı.

Şekil 3 ana sitoplazmada içine CTA1 translokasyon belirlenmesi. HeLa hücrelerinde darbe etiketli 4 ° CT 1 mcg / ml ile 37 ° C 2 saat kovaladı hiçbir eklemeler (sarhoş) veya 5 mg BFA / ml (+ BFA sarhoş) içeren ° C toksin içermeyen orta. Digitonin ile plazma membran Permeabilization ayrı organel ve sitozolik kesirler bölüm hücre ekstreleri kullanılmıştır. (A) sitozolik kesirler, bir anti-CTA antikor ile kaplı bir SPR sensör üzerinden perfüze edildi. Bilinenunintoxicated hücrelerden sitoplazmada bir negatif kontrol olarak kullanılan iken KTHY miktarları, pozitif kontrol olarak kullanıldı. (B) BFA yokluğunda sitozolik sarhoş hücrelerin bir kısmı, bir anti-CTB antikor ile kaplı bir SPR sensör üzerinden perfüze edildi. Pozitif kontrol olarak saflaştırılmış bir CTB pentamer slayt üzerinde perfüze edildi. (C) organel fraksiyonu çözünür% 1 Triton X-100, bir anti-CTA antikor ile kaplı SPR sensörün üzerine perfüzyon önce. Karşılaştırmalı amaçlar için, aynı hücre özü ve CTA standart sitozolik fraksiyonu (1 ml final hacim) sensör üzerindeki perfüze edildi. Tüm panelleri için, bağlı örnek her çalışma sonunda sensörü elimden alındı.

Şekil 4 sitoplazmada içine CTA1 girdi Kinetiği. HeLa hücrelerinde darbe etiketli ° C 1 mcg / ml CT kovaladı, 15, 30, 45 veya 60 dakika 37 ° C toksin Mediu (4)m. Toksin transloke havuzu algılamak için, digitonin-permeabilize hücrelerin sitozolik kesirler, bir anti-CTA antikor ile kaplı bir SPR sensörün üzerine perfüze edildi. KTHY standartları yanı sıra sensör üzerindeki perfüze edildi. Her çalışma sonunda, ciltli örneği sensör slayt elimden alındı.
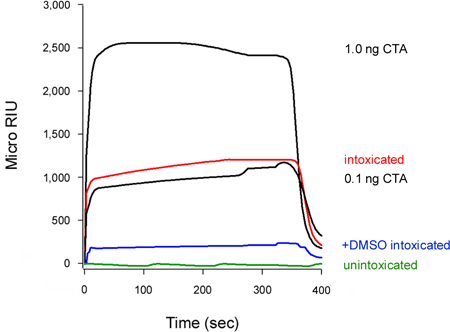
Şekil 5 DMSO tarafından CTA1 translokasyon inhibisyonu. HeLa hücrelerinde darbe etiketli 4 ° CT 1 mcg / ml ile 37 ° C 2 saat kovaladı hiçbir eklemeler (sarhoş) veya% 10 DMSO (+ DMSO sarhoş) içeren ° C toksin içermeyen orta. Toksin transloke havuzu algılamak için, digitonin-permeabilize hücrelerin sitozolik kesirler, bir anti-CTA antikor ile kaplı bir SPR sensörün üzerine perfüze edildi. KTHY standartları (100, 10, 1 ve 0.1 ng / ml) pozitif kontrol olarak sensörün üzerine perfüze edildi; sadece 1 ve 0.1 ng / ml standartlarına ölçekleme amaçlar için gösterilmiştir. Unintoxicate gelen sitoplazmadad hücreler negatif kontrol olarak kullanılmıştır. Her çalışma sonunda, ciltli örneği sensör slayt elimden alındı.
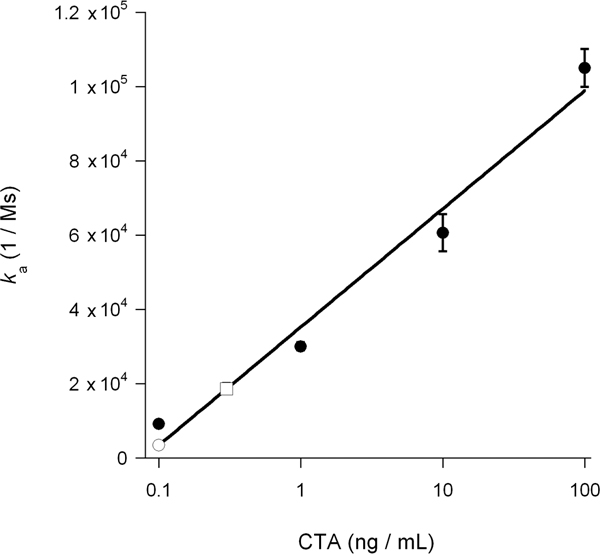
Şekil 6 sitozolik CTA1 hesaplanması Şekil 5 CTA standartları için bir değerler k toksin konsantrasyonunun bir fonksiyonu olarak çizilmiştir. K dayalı standart eğri, belirlemek için kullanılan, Şekil 5, tedavi edilmemiş ve DMSO ile tedavi edilen hücrelerin sitozolik CTA1 konsantrasyonu deney örneklerinin a değerleri . Tedavi edilmezse sitoplazmada açık bir kare olarak sunulmaktadır; Toksin standartları dolu daireler olarak sunulmaktadır ve DMSO tedavi sitoplazmada açık bir daire olarak sunulmaktadır. Ortalamaları ± aralıkları iki bağımsız deneyler göstermiştir.
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Mevcut metodoloji ile Karşılaştırma
Bizim SPR tabanlı translokasyon tahlil ev sahibi sitoplazmada içine toksin teslim algılamak için hızlı, duyarlı ve kantitatif bir yöntem temsil eder. Teknik Radyoaktif veya toksin diğer modifikasyonlar gerektirebilir ve bu zinciri antikor mevcut olan bir anti-toksin herhangi bir toksin uygulanabilir. Sitoplazmada içine toksin geçişini izlemek için varolan yöntemleri de ayrı sitoplazmada ve membran fraksiyonları 11, 23, 27, 28 b...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Bu çalışma K. Teter NIH hibe R01 AI073783 tarafından finanse edildi. Biz yazının eleştirel okuma Subselüler fraksiyonasyon protokolü ve Helen Burress gelişimi Dr. Shane Massey yardım için teşekkür ederim.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktifi Adı | Şirket | Katalog numarası | |
| Digitonin | Sigma | D141 | |
| Etanol | Acros | 61509-0010 | |
| DMEM | Invitrogen | 11995065 | |
| Fetal sığır serumu | Atlanta Biyolojik | S11550 | |
| Gangliozid GM1 | Sigma | G7641 | |
| CTA | Sigma | C2398 | |
| PTS1 | Liste | 182 | |
| NHS (N-Hydroxysuccinimide) | Delmek | 24500 | |
| EDC (1-Etil-3-(3-Gaz sistemlerinde) carbodiimide) | Thermo Scientific | 22981 | |
| Etanolamin | Sigma | E0135 | |
| PBST | Medicago | 09-8903-100 | |
| Anti-CTA antikor | Santa Cruz Biotech | sc-80.747 | |
| Anti-CTB antikor | Calbiochem | 227040 | |
| Anti-PTS1 antikor | Santa Cruz Biotech | sc-57.639 | |
| Refraktometre | Reichert | SR7000, SR7000DC | |
| SPR algılayıcı slaytlar | Reichert | 13206060 | |
| Şırınga pompası | Cole Palmer | 780200C |
Referanslar
- Sandvig, K., van Deurs, B. Membrane traffic exploited by protein toxins. Annu. Rev. Cell Dev. Biol. 18, 1-24 (2002).
- Watson, P., Spooner, R. A. Toxin entry and trafficking in mammalian cells. Adv. Drug Deliv. Rev. 58, 1581-1596 (2006).
- Carbonetti, N. H. Pertussis toxin and adenylate cyclase toxin: key virulence factors of Bordetella pertussis and cell biology tools. Future Microbiol. 5, 455-469 (2010).
- Wernick, N. L. B., Chinnapen, D. J. -F., Cho, J. A., Lencer, W. I. Cholera toxin: an intracellular journey into the cytosol by way of the endoplasmic reticulum. Toxins. 2, 310-325 (2010).
- Lord, J. M., Roberts, L. M., Lencer, W. I. Entry of protein toxins into mammalian cells by crossing the endoplasmic reticulum membrane: co-opting basic mechanisms of endoplasmic reticulum-associated degradation. Curr. Top. Microbiol. Immunol. 300, 149-168 (2005).
- Lencer, W. I. Entry of cholera toxin into polarized human intestinal epithelial cells. Identification of an early brefeldin A sensitive event required for A1-peptide generation. J. Clin. Invest. 92, 2941-2951 (1993).
- Orlandi, P. A., Curran, P. K., Fishman, P. H. Brefeldin A blocks the response of cultured cells to cholera toxin. Implications for intracellular trafficking in toxin action. J. Biol. Chem. 268, 12010-12016 (1993).
- Sandvig, K., Prydz, K., Hansen, S. H., van Deurs, B. Ricin transport in brefeldin A-treated cells: correlation between Golgi structure and toxic effect. J. Cell. Biol. 115, 971-981 (1991).
- Sandvig, K., Prydz, K., Ryd, M., van Deurs, B. Endocytosis and intracellular transport of the glycolipid-binding ligand Shiga toxin in polarized MDCK cells. J. Cell Biol. 113, 553-562 (1991).
- van Deurs, B. Estimation of the amount of internalized ricin that reaches the trans-Golgi network. J. Cell Biol. 106, 253-267 (1988).
- Tam, P. J., Lingwood, C. A. Membrane cytosolic translocation of verotoxin A1 subunit in target cells. Microbiology. 153, 2700-2710 (2007).
- Plaut, R. D., Carbonetti, N. H. Retrograde transport of pertussis toxin in the mammalian cell. Cell. Microbiol. 10, 1130-1139 (2008).
- Willander, M., Al-Hilli, S. Analysis of biomolecules using surface plasmons. Methods Mol. Biol. 544, 201-229 (2009).
- Homola, J. Present and future of surface plasmon resonance biosensors. Anal. Bioanal. Chem. 377, 528-539 (2003).
- Medaglia, M. V., Fisher, R. J. Protein-Protein Interactions. Golemis, E. , Cold Spring Harbor Laboratory Press. Cold Spring Harbor, New York. 255-272 (2002).
- Banerjee, T. Contribution of subdomain structure to the thermal stability of the cholera toxin A1 subunit. Biochemistry. 49, 8839-8846 (2010).
- Massey, S. Stabilization of the tertiary structure of the cholera toxin A1 subunit inhibits toxin dislocation and cellular intoxication. J. Mol. Biol. 393, 1083-1096 (2009).
- Taylor, M. A therapeutic chemical chaperone inhibits cholera intoxication and unfolding/translocation of the cholera toxin A1 subunit. PLoS ONE. 6, e18825-e18825 (2011).
- Taylor, M. Hsp90 is required for transfer of the cholera toxin A1 subunit from the endoplasmic reticulum to the cytosol. J. Biol. Chem. 285, 31261-31267 (2010).
- Donta, S. T., Beristain, S., Tomicic, T. K. Inhibition of heat-labile cholera and Escherichia coli enterotoxins by brefeldin A. Infect. Immun. 61, 3282-3286 (1993).
- Donta, S. T., Tomicic, T. K., Donohue-Rolfe, A. Inhibition of Shiga-like toxins by brefeldin. A. J. Infect. Dis. 171, 721-724 (1995).
- Nambiar, M. P., Oda, T., Chen, C., Kuwazuru, Y., Wu, H. C. Involvement of the Golgi region in the intracellular trafficking of cholera toxin. J. Cell. Physiol. 154, 222-228 (1993).
- Rapak, A., Falnes, P. O., Olsnes, S. Retrograde transport of mutant ricin to the endoplasmic reticulum with subsequent translocation to cytosol. Proc. Natl. Acad. Sci. U. S. A. 94, 3783-3788 (1997).
- Xu, Y., Barbieri, J. T. Pertussis toxin-mediated ADP-ribosylation of target proteins in Chinese hamster ovary cells involves a vesicle trafficking mechanism. Infect. Immun. 63, 825-832 (1995).
- Yoshida, T., Chen, C. C., Zhang, M. S., Wu, H. C. Disruption of the Golgi apparatus by brefeldin A inhibits the cytotoxicity of ricin, modeccin, and Pseudomonas toxin. Exp. Cell Res. 192, 389-395 (1991).
- Godber, B. Direct quantification of analyte concentration by resonant acoustic profiling. Clin. Chem. 51, 1962-1972 (2005).
- Bernardi, K. M., Forster, M. L., Lencer, W. I., Tsai, B. Derlin-1 facilitates the retro-translocation of cholera toxin. Mol. Biol. Cell. 19, 877-884 (2008).
- Wernick, N. L., De Luca, H., Kam, W. R., Lencer, W. I. N-terminal Extension of the Cholera Toxin A1-chain Causes Rapid Degradation after Retrotranslocation from Endoplasmic Reticulum to Cytosol. J. Biol. Chem. 285, 6145-6152 (2010).
- Simpson, J. C. Ricin A chain utilises the endoplasmic reticulum-associated protein degradation pathway to enter the cytosol of yeast. FEBS. Lett. 459, 80-84 (1999).
- Veithen, A., Raze, D., Locht, C. Intracellular trafficking and membrane translocation of pertussis toxin into host cells. Int. J. Med. Microbiol. 290, 409-413 (2000).
- Castro, M. G., McNamara, U., Carbonetti, N. H. Expression, activity and cytotoxicity of pertussis toxin S1 subunit in transfected mammalian cells. Cell. Microbiol. 3, 45-54 (2001).
- Schmitz, A., Herrgen, H., Winkeler, A., Herzog, V. Cholera toxin is exported from microsomes by the Sec61p complex. J. Cell Biol. 148, 1203-1212 (2000).
- Teter, K., Allyn, R. L., Jobling, M. G., Holmes, R. K. Transfer of the cholera toxin A1 polypeptide from the endoplasmic reticulum to the cytosol is a rapid process facilitated by the endoplasmic reticulum-associated degradation pathway. Infect. Immun. 70, 6166-6171 (2002).
- Winkeler, A., Godderz, D., Herzog, V., Schmitz, A. BiP-dependent export of cholera toxin from endoplasmic reticulum-derived microsomes. FEBS Lett. 554, 439-442 (2003).
- Yu, M., Haslam, D. B. Shiga toxin is transported from the endoplasmic reticulum following interaction with the luminal chaperone HEDJ/ERdj3. Infect. Immun. 73, 2524-2532 (2005).
- LaPointe, P., Wei, X., Gariepy, J. A role for the protease-sensitive loop region of Shiga-like toxin 1 in the retrotranslocation of its A1 domain from the endoplasmic reticulum lumen. J. Biol. Chem. 280, 23310-23318 (2005).
- Teter, K., Jobling, M. G., Sentz, D., Holmes, R. K. The cholera toxin A13 subdomain is essential for interaction with ADP-ribosylation factor 6 and full toxic activity but is not required for translocation from the endoplasmic reticulum to the cytosol. Infect. Immun. 74, 2259-2267 (2006).
- Redmann, V. Dislocation of ricin toxin a chains in human cells utilizes selective cellular factors. J. Biol. Chem. 286, 21231-21238 (2011).
- Yamaizumi, M., Mekada, E., Uchida, T., Okada, Y. One molecule of diphtheria toxin fragment A introduced into a cell can kill the cell. Cell. 15, 245-250 (1978).
- Bellisola, G. Reductive activation of ricin and ricin A-chain immunotoxins by protein disulfide isomerase and thioredoxin reductase. Biochem. Pharmacol. 67, 1721-1731 (2004).
- McKee, M. L., FitzGerald, D. J. Reduction of furin-nicked Pseudomonas exotoxin A: an unfolding story. Biochemistry. 38, 16507-16513 (1999).
- Orlandi, P. A. Protein-disulfide isomerase-mediated reduction of the A subunit of cholera toxin in a human intestinal cell line. J. Biol. Chem. 272, 4591-4599 (1997).
- Spooner, R. A. Protein disulphide-isomerase reduces ricin to its A and B chains in the endoplasmic reticulum. Biochem. J. 383, 285-293 (2004).
- Fujinaga, Y. Gangliosides that associate with lipid rafts mediate transport of cholera and related toxins from the plasma membrane to endoplasmic reticulm. Mol. Biol. Cell. 14, 4783-4793 (2003).
- Guerra, L. Cellular internalization of cytolethal distending toxin: a new end to a known pathway. Cell. Microbiol. 7, 921-934 (2005).
- Johannes, L., Tenza, D., Antony, C., Goud, B. Retrograde transport of KDEL-bearing B-fragment of Shiga toxin. J. Biol. Chem. 272, 19554-19561 (1997).
- Deeks, E. D. The low lysine content of ricin A chain reduces the risk of proteolytic degradation after translocation from the endoplasmic reticulum to the cytosol. Biochemistry. 41, 3405-3413 (2002).
- Hazes, B., Read, R. J. Accumulating evidence suggests that several AB-toxins subvert the endoplasmic reticulum-associated protein degradation pathway to enter target cells. Biochemistry. 36, 11051-11054 (1997).
- Rodighiero, C., Tsai, B., Rapoport, T. A., Lencer, W. I. Role of ubiquitination in retro-translocation of cholera toxin and escape of cytosolic degradation. EMBO Rep. 3, 1222-1227 (2002).
- Worthington, Z. E., Carbonetti, N. H. Evading the proteasome: absence of lysine residues contributes to pertussis toxin activity by evasion of proteasome degradation. Infect. Immun. 75, 2946-2953 (2007).
- Pande, A. H., Moe, D., Jamnadas, M., Tatulian, S. A., Teter, K. The pertussis toxin S1 subunit is a thermally unstable protein susceptible to degradation by the 20S proteasome. Biochemistry. 45, 13734-13740 (2006).
- Pande, A. H. Conformational instability of the cholera toxin A1 polypeptide. J. Mol. Biol. 374, 1114-1128 (2007).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır