A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
أسلوب مبسط لل
In This Article
Summary
وتصف الورقة تقنية مبسطة لاستئصال القرنية وسلب أنسجة شبكية العين من الكرة الأرضية من الجهات المانحة جثي الإنسان. ووصف هذه التقنية هنا ستساعد على استئصال الأنسجة ذات نوعية جيدة لاستخدامها في زراعة الأعضاء، وأغراض الجراحية أو البحث دون الإضرار الأنسجة الأخرى من الكرة الأرضية العين.
Abstract
Enucleation is the process of retrieving the ocular globe from a cadaveric donor leaving the rest of the globe undisturbed. Excision refers to the retrieval of ocular tissues, especially cornea, by cutting it separate from the ocular globe. Evisceration is the process of removing the internal organs referred here as retina. The ocular globe consists of the cornea, the sclera, the vitreous body, the lens, the iris, the retina, the choroid, muscles etc (Suppl. Figure 1). When a patient is suffering from corneal damage, the cornea needs to be removed and a healthy one must be transplanted by keratoplastic surgeries. Genetic disorders or defects in retinal function can compromise vision. Human ocular globes can be used for various surgical procedures such as eye banking, transplantation of human cornea or sclera and research on ocular tissues. However, there is little information available on human corneal and retinal excision, probably due to the limited accessibility to human tissues. Most of the studies describing similar procedures are performed on animal models. Research scientists rely on the availability of properly dissected and well-conserved ocular tissues in order to extend the knowledge on human eye development, homeostasis and function. As we receive high amount of ocular globes out of which approximately 40% (Table 1) of them are used for research purposes, we are able to perform huge amount of experiments on these tissues, defining techniques to excise and preserve them regularly.
The cornea is an avascular tissue which enables the transmission of light onto the retina and for this purpose should always maintain a good degree of transparency. Within the cornea, the limbus region, which is a reservoir of the stem cells, helps the reconstruction of epithelial cells and restricts the overgrowth of the conjunctiva maintaining corneal transparency and clarity. The size and thickness of the cornea are critical for clear vision, as changes in either of them could lead to distracted, unclear vision. The cornea comprises of 5 layers; a) epithelium, b) Bowman's layer, c) stroma, d) Descemet's membrane and e) endothelium. All layers should function properly to ensure clear vision4,5,6. The choroid is the intermediate tunic between the sclera and retina, bounded on the interior by the Bruch's membrane and is responsible for blood flow in the eye. The choroid also helps to regulate the temperature and supplies nourishment to the outer layers of the retina5,6. The retina is a layer of nervous tissue that covers the back of the ocular globe (Suppl. Figure 1) and consists of two parts: a photoreceptive part and a non-receptive part. The retina helps to receive the light from the cornea and lens and converts it into the chemical energy eventually transmitted to the brain with help of the optic nerve5,6.
The aim of this paper is to provide a protocol for the dissection of corneal and retinal tissues from human ocular globes. Avoiding cross-contamination with adjacent tissues and preserving RNA integrity is of fundamental importance as such tissues are indispensable for research purposes aimed at (i) characterizing the transcriptome of the ocular tissues, (ii) isolating stem cells for regenerative medicine projects, and (iii) evaluating histological differences between tissues from normal/affected subjects. In this paper we describe the technique we currently use to remove the cornea, the choroid and retinal tissues from an ocular globe. Here we provide a detailed protocol for the dissection of the human ocular globe and the excision of corneal and retinal tissues. The accompanying video will help researchers to learn an appropriate technique for the retrieval of precious human tissues which are difficult to find regularly.
Protocol
1. في الاستئصال الموقعي للقرنية العين من الكرات
- التبديل على تدفق الهواء الصفحي مجلس الوزراء حوالي 15 دقيقة قبل الاستخدام. تنظيف غطاء محرك السيارة باستخدام تدفق رقائقي ايزوبروبيل 70٪. ارتداء ملابس الوقاية الشخصية مثل قبعة الجراحية وقناع. فرك اليدين والساعدين وتجفيف باستخدام منشفة معقمة. ارتداء قفازات معقمة وثوب أو الأكمام باستخدام تقنية العقيم.
- إعداد حقل معقمة عن طريق وضع صك علبة معقم جو معقم و مطهر. تحقق من أن الصكوك هي عقيمة. فتح حزمة الأدوات المعقمة والوجه إلى حقل معقمة تجنب أي تلوث.
- وضع جميع المواد المعقمة والصكوك (الجدول 2) جنبا إلى جنب مع زجاجات (الجرار العين) التي تحتوي على الكرات العين بحيث تكون بالقرب من حافة مجال العقيمة لسهولة الاستخدام.
- تسمية الزجاجات مع المحافظة أعدت سابقا / وسائط تخزين كما هو مبين في الجدول رقم (3) ووضعم عن سطح تدفق الهواء على طول غطاء محرك السيارة الصفحي مع PVP-I (بوفيدون اليود)، ثيوكبريتات الصوديوم ومحلول معقم المالحة في برنامج تلفزيوني (فوسفات المالحة عازلة).
- السماح للأنسجة العين والحلول للوصول إلى درجة حرارة الغرفة العادية كما يتم الاحتفاظ بها في الثلاجات في 4 درجة مئوية. تجنب تكرار ظاهرة الاحتباس / التبريد دورات. الحفاظ على أغطية من الحل والجرار العين مع الجانب الداخلي متجهة لأعلى بجوار الجرار كل منهما.
- إزالة الشاش والضمادات من جرة العين باستخدام ملقط معقم. تزج العالم في معقم 0.5٪ I-PVP لمدة 2 دقيقة لإزالة التلوث من الكرات بصري. ضع ملقط اثنين على غطاء علبة معقم، خارج مجال معقم. نقل في العالم في الصوديوم 0.1٪ ثيوكبريتات لمدة 1 دقيقة باستخدام زوج آخر من ملقط معقم. باستخدام ملقط نفسه، نقل العالم إلى زجاجة تحتوي على محلول ملحي معقم (PBS) وتركه حتى يتم تشغيله. كرر نفس الإجراء في العالم في العين الأخرى من تيهو المانح نفسه.
- تعمل تحت غطاء محرك السيارة رقائقي تدفق الهواء، والتفاف العالم باستخدام شاش معقم (الضمادات) ترك القرنية والصلبة حوالي 5 ملم من القرنية وكشف. ويمكن لمبة العين عقد ببساطة في يد الحفاظ على ضغط كاف. يجب أن تبقى في الأنسجة رطبة أثناء عملية جراحية كامل.
- وتستخدم جنبا إلى جنب مع مقص ملقط لإزالة كافة بقايا في نهاية المطاف في الملتحمة. الحفاظ على الأدوات المستخدمة في العملية المذكورة أعلاه منفصلة عن غيرها من الصكوك. استخدام شفرة المشرط لإجراء شق الصلبة من 3-4 ملم من منطقة حوف، ثم توسيع الشق من 360 درجة، وتجنب أن خرم الأنسجة الكامنة العنبي أو التسبب في أي تشويه للانحناء القرنية طبيعية. خفض 4 شقوق كبيرة ترك أربع فجوات صغيرة تجنب إفراز الجسم الزجاجي. يتم قطع كل الفجوات الأربع ضمان عدم إزالة أي نوع من الأنسجة الأخرى.
- وجود لويحات الصلبة الصغيرة قد تعرقل عدة قطاعات، وذلك للتأكد من شركاتوليته في استئصال الصلبة مع مقص المجهرية. يجب أن يتم تنفيذ هذه العملية دون الإضرار هيئة المشيمية، الشبكية والجسم الزجاجي.
- تفقد شق للتأكد من أنها كاملة. إذا كان قد تم تنفيذ شق بشكل صحيح corneo-الصلبة تلتزم حافة إلى الهيئات الهدبية فقط عند نقطة في المراسلات مع القرنية.
- تعيين العالم بصري ملفوفة عليها بالقرب من وسط الميدان العقيمة. إتمام إزالة القرنية باستخدام ملقط لعقد حافة الصلبة الثابتة واليد تستخدم لاستئصال لسحب الجسم الهدبي، المشيمية الهبوط وبعيدا عن زر corneo-الصلبة.
- فصل بلطف أي التصاقات المتبقية من زر corneo-الصلبة. لا سحب حافة corneo-الصلبة في الطريقة التي يمكن أن تسبب التوتر عبر القرنية ولا يسمح لها أن تنخفض مرة أخرى يسقط على الغرفة الأمامية.
- يتم فحص كثافة الخلايا البطانية للقرنية باستخدام محلول ناقص التوتر ويتم التحقق من وفيات الخلية باستخدام فندق Trypثم يتم عد 1 تلطيخ الزرقاء لحوالي 1 دقيقة والخلايا تحت المجهر الضوئي وقياس مثل خلايا / مم 2. يجب على الغرفة الأمامية مواجهة غطاء الخلفي في حين يجب ان يواجه الجزء السفلي من لوحة بيتري. يمكن الاعتماد على كثافة الخلية البطانية يدويا باستخدام الشبكة في موضوعي تحت التكبير 100X. الحد الأدنى لعدد خلايا المقبولة للزرع في إيطاليا 2200 الخلايا البطانية / مم 2.
- نقل حافة corneo-الصلبة باستخدام مخلب القرنية إلى معدة مسبقا وسائط تخزين القرنية الحفاظ على RT (درجة حرارة الغرفة) كما هو مبين في الجدول رقم 3.
- دراسة لغرفة الخلفي عدسة البلورية الطبيعية. اذا كان مستعدا للالصلبة، وإزالة كافة المخلفات من العنبية والفكاهة زجاجي من العالم. بسط بعناية ويعود الجزء المتبقي الخلفي إلى جرة له عين كل منها، وذلك باستخدام تقنية العقيم. كرر الإجراء العالم الأخرى باستخدام أدوات جديدة. إصلاح الطرافة القرنيةح مخلب القرنية والحفاظ عليها في ظل وسائط التخزين (ثقافة الجهاز) في 31 درجة مئوية. ويمكن بعد ذلك القرنية استئصاله، كما هو مبين في الشكل 1A، أن تستخدم لالقرنية أو البحث.
- تخلص من المواد غير الضرورية والحيوية للنفايات الخطرة في صناديق النفايات المناسبة. تنظيف منطقة العمل بمجرد الانتهاء من العمل باستخدام 70٪ رذاذ ايزوبروبيل.
- إذا، بعد 28 يوما القرنية يحافظ على جميع المعلمات التقييم [مثل التشكل، عدد الخلايا، والشفافية، وسماكة واختبارات علم الأحياء الدقيقة - البكتيرية والفطرية باستخدام Bactec 9240 صك (بيكتون ديكنسون، ميلانو، ايطاليا)]، ويمكن بعد ذلك يتم نقلها إلى للمستشفيات باستخدام وسيلة النقل هو مبين في الجدول رقم 4. وينبغي إزالة القرنية وضعت من تخزين لنقل المتوسطة تحت الهواء الصفحي مجلس الوزراء تدفق.
- كما، خلال التخزين، والقرنية يحصل على أكثر سمكا من حجمها المعتاد اللازمة لزراعة الأعضاء، وبنوك العيون استخدام دي تورم وكلاء للحد من سمك. نحناستخدام 6٪ ديكستران T500 للحصول على قرنية العين يعود إلى حجمه الطبيعي في وسط النقل. على الرغم من ويمكن استخدام 4-8٪ ديكستران T500، وقد عمل 6٪ أفضل بالنسبة لنا. هذا يجعل من الاسهل للجراحين زرع القرنية بمجرد الحصول عليها.
2. سلب للشبكية العين من الكرة الأرضية بعد استئصال القرنية
- بعد الاستئصال، يتم تحديد لعملية زرع قرنية أو البحوث على أساس التشكل، وكثافة الخلايا البطانية ويتم وضعها في التخزين أو المتوسطة المحافظة في 31 درجة مئوية. ثم تتم معالجة ما تبقى من العالم بصري لاستخدامها مرة أخرى مثل العزلة الصلبة للأغراض الجراحية، وشبكية العين للبحوث الخ.
- قبل الختان في شبكية العين، تأكد من أن الكرة الأرضية العين غير سليمة والقرنية فقط مع جزء من الصلبة تتم إزالة. إذا كان الجسم الزجاجي هلامي هو إفراز من يصبح من الصعب إزالة أنسجة الشبكية.
- إذا كانت الجهات المانحة هي أقل من 65 سنة من العمر، وغير الصلبةحفظت تحت برنامج تلفزيوني العقيمة للأغراض الجراحية بعد الاختبار المصلي. في هذه الحالة، لا يتم قطع الصلبة، تتم إزالة فقط الجسم الزجاجي ويتم الاحتفاظ الصلبة كله.
- للختان في شبكية العين، وتبدأ مع قطع صغيرة أو شق من الجانب القرنية الصلبة من التحرك نحو العصب البصري باستخدام ملقط معقم، ومقص. عقد جزء من الصلبة باستخدام ملقط وقطع مع مقص مباشرة نحو العصب البصري قطع جزءا جزءا تفادي الأضرار التي لحقت الجسم الزجاجي.
- يجب أن يتم فصل الصفائح المشيمية من الصلبة كما عالقون معا. قطع الصلبة كامل لفضح الأنسجة المشيمية. بمجرد أن يتم قطع تماما الصلبة، فصل الصلبة مع ما تبقى من الجسم الزجاجي بواسطة قطع عليه بالقرب من العصب البصري. سيكون لكرة كامل من الجسم الزجاجي مغطاة المشيمية تكون واضحة كما هو مبين في الشكل 2A.
- باستخدام اثنين من ملقط معقم إزالة الطبقة المشيمية بلطف عن طريق التقاط أنه حتى مع واحدزوج من الملقط وإزالته مع الآخر. بدلا من ذلك، يمكن إزالة طبقة المشيمية باستخدام مقص ولكن ينبغي من الناحية المثالية هذا يمكن تجنبها لأنها قد تتسبب في الأضرار التي لحقت في شبكية العين. إزالة الطبقة المشيمية جزئيا وقطع عليه لتسهيل إزالة.
- وبمجرد إزالة طبقة المشيمية، سوف ينظر طبقة شفافة من شبكية العين بشكل واضح كما هو مبين في الشكل 2B. طبقة المشيمية لديه غشاء 1 بروك الداخلية التي يمكن أيضا إزالة ولكن من الصعب تحديد ذلك مع بالعين المجردة.
- وبالمثل، استخدام اثنين من الملقط لإزالة طبقة شبكية العين كما هو موضح في الشكل 2C. فمن السهل أن عزل كمية عالية من شبكية العين إذا رفعه بالقرب من العصب البصري. ويمكن جميع طبقات العين ينظر إليها الآن كما هو مبين في الشكل 2D.
- مرة واحدة تمت إزالة أنسجة الشبكية، يمكن أن تستخدم لأغراض مختلفة، وبالتالي فإن الخطوات اللاحقة والظروف المستخدمة لحفظ قد تختلف وفقا لذلك. على سبيل المثال،يمكن وضعها في نسيج الشبكية التي تحتوي على الحمض النووي الريبي في أنابيب استقرار الكواشف (مثل RNAlater) أو تحلل عازلة (على الحمض النووي الريبي DNA أو الاستخراج)، dispase / التربسين (لعزل الخلايا)، وحلول تحديد (قبل تضمين الأنسجة في البارافين أو أكتوبر لل المناعية).
- مسح كل منطقة عمل وتنظيف المنطقة باستخدام 70٪ رذاذ ايزوبروبيل.
3. ممثل النتائج
حافة corneo-الصلبة كما رأينا في الشكل 1A هو قرنية رفعه بشكل صحيح مع المبلغ المطلوب من حافة الصلبة والصرف البطانية، وهذا النوع من القرنية ويستخدم عادة لاختراق القرنية. في حالة تلف سدى الأمامي للقرنية استئصاله مع وجود غموض، يمكن أن تستخدم في القرنية لالقرنية البطانية / القرنية صفاحي الخلفي (البطانة مع جزء من سدى). في حين، في حالة تلف طبقة بطانة أو إذا كانت كثافة الخلية البطانية هو <2200 خلية / مم 2 (وعليان قياسي)، يمكن أن تستخدم في القرنية لالقرنية صفاحي الأمامي (ظهارة مع جزء من سدى الأمامي). إذا كان عدد خلايا بطانة الأوعية الدموية أقل من المطلوب، يمكن أن تستخدم في القرنية لالقرنية صفاحي الأمامي أو الأبحاث في حين، في حالة تلف القرنية تماما، ويمكن استخدامه للبحث كما هو مبين في الشكل 1B، 3B و 3C أو التخلص منها. الأضرار التي يمكن أن تكون سببا في سوء النسيج، جراحة إعتام عدسة العين قبل مما أدى إلى ندوب البطانية اللحمية أو descemet، ووضع الأذى الجسدي خلال إلخ حياة المريض وبالتالي، يصبح من الضروري للتأكد من كل الأنسجة مع المصباح الشقي ثم تحت المجهر الضوئي لل غرامة ندوب / طيات / المفارز. يتم الاحتفاظ عادة القرنية تحت ظرفين مختلفين مثل ثقافة الأعضاء (حوالي 31 درجة مئوية) تستخدم عادة في البلدان الأوروبية أو شروط منخفض الحرارة (حوالي 4 درجات مئوية) عادة ما تستخدم في الولايات المتحدة. نحن نستخدم الثقافة الجهاز لأنه يساعد على تجديد السدالخلايا الظهارية المسنين، لإعادة تنشيط الخلايا البطانية شيك مع الوقت بعد الوفاة عالية، وفترة التخزين من 4 أسابيع الذي يعطي نافذة كافية للتخطيط لعملية جراحية، ويعطي وقتا كافيا لإجراء الاختبارات الميكروبيولوجية (البكتيرية والفطرية) والمصلية الخ القرنية ويمكن الحفاظ عليها بشكل جيد في وسيلة النقل لمدة 7 أيام.
ويمكن خفض الصلبة جزءا جزءا ضمان إزالة جميع لوحات لطيف من المشيمية. يمكن أن تفرز السائل الزجاجي عندما يتم قطع العصب البصري، المشيمية أو شبكية العين بشكل حاد كما هو مبين في الشكل (4). ينبغي الحفاظ على شبكية العين إذا رفعه لتحليل الحمض النووي الريبي في RNAlater حالما يتم رفعه للأنسجة. وعادة ما يتم استئصاله 1X1 سم من طبقة المشيمية والشبكية، وبعد حفظها في RNAlater لمدة 24 ساعة في 4 درجات مئوية تحت يتم الاحتفاظ -80 درجة مئوية في أنابيب إيبندورف الطازجة (آمن للانغلاق أنابيب، 2 مل) حتى المستخدمة أو التي يتم شحنها مع جاف الجليد. وينبغي استئصاله من الأنسجة الشبكية باستخدام اثنين من ملقط قرب العصب البصري بعيدا عن قزحيةأو هامش الهدبية لتجنب التلوث مع الهياكل الأخرى المصطبغة وينبغي نقلها إلى الحاوية الحفاظ على الفور كما يحصل على الحمض النووي الريبي غير مستقر في حين استرجاع شبكية العين.
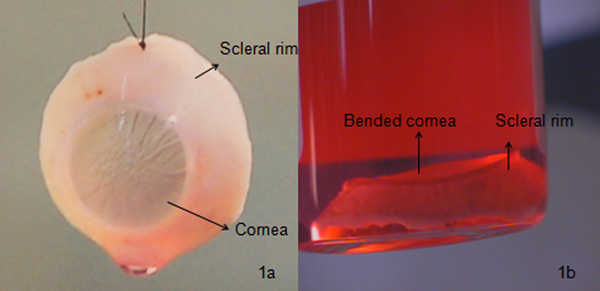
الشكل 1 مقارنة بين الجيد والقرنية نوعية رديئة: أ) قرنية رفعه بشكل صحيح. يتم الاحتفاظ عادة مثل هذه القرنية تحت ثقافة الجهاز لمدة 4 أسابيع. يتم تنفيذ الميكروبيولوجية (باستخدام أداة Bactec 9240)، والمورفولوجية (تلطيخ الخلايا مع أزرق التريبان لتحديد معدل الوفيات الخلية ومراقبة الخلايا تحت المجهر الضوئي مع التكبير 100X) فحص قبل نقله إلى المستشفى (الشكل 3A)؛ ب) قرنية عازمة ، الأمر الذي يؤدي في نهاية المطاف إلى رفض الطعم بسبب طيات descemet عالية وعالية تلف الخلايا البطانية دراسة باستخدام مجهر المصباح الشقي. وعادة ما تستخدم مثل هذه القرنية عن الدقةيتم تجاهل أو earch.

الشكل 2. الطريقة المستخدمة لضمان الاستئصال الدقيق للأنسجة الشبكية. أ) تشريح الصلبة العينية من العين في العالم باستخدام شفرة 24MM مع 95 مم المنحني أو مقص نهاية حادة معقمة و11X2 100 ملم يحكمها 0،70 ملم أسنان ملقط معقم. وينبغي قطع الصلبة من خلال عقد جانب واحد مع ملقط قطع عليه مباشرة نحو العصب البصري باستخدام مقص. والآن طبقة المشيمية أن ينظر إليه بسهولة؛ ب) استخدام 2 11X2 100 ملم يحكمها أسنان مم 0،70 ملقط معقم، تتم إزالة المشيمية من قبل تمزيقه، الذي يكشف عن الكامنة وراء طبقة الشبكية شفافة؛ ج) يتم استئصاله طبقة الشبكية شفاف بعناية فائقة قرب العصب البصري دون إفراز السائل الزجاجي باستخدام ملقط نفسه. وينبغي على كل من ملقط عقد كل جانب من شبكية العين، وينبغي أن بلطف الأنسجة يمكن إزالتها startinز بالقرب من العصب البصري يتجه نحو القرنية، للحصول على كمية لا بأس بها من أنسجة الشبكية. يمكن قطع نسيج إلى أحجام مختلفة وتستخدم لتحليل التجارب د) يمكن الاطلاع على طبقات مختلفة في العين بعد إزالة القرنية في هذا الرقم. تتم إزالة الجسم المشيمية أولا تليها شبكية العين دون الإضرار أجزاء أخرى من العين.

الشكل 3. مقارنة بين أنواع مختلفة من كثافة الخلايا والصرف ينظر تحت التكبير 100X من المجهر الضوئي. أ) جيد كثافة الخلايا البطانية (> 2200 خلية / ملم 2) والتشكل (أقل تعدد الأشكال، انحطاط منخفضة، وضمور لا و 0٪ معدل وفيات) في قرنية العين التي هي مناسبة لزرع ب) ضعيف كثافة الخلية البطانية (1200 تقريبا - 1400 خلية / ملم 2) ومورفولوجية (تعدد الأشكال عالية جدا وديجينويلاحظ مواصلة النظر الخلايا) جنبا إلى جنب مع معدل الوفيات 30-40٪ تقريبا العام للدورة بعد تلطيخ أزرق التريبان ج) في حالة تلف جزء من الخلايا البطانية بسبب انفصال ورقة البطانية أثناء استرداد القرنية من العالم بصري. ويتأكد هذا من خلال مراقبة وفيات من الخلايا في المنطقة من خلال ملون أزرق التريبان د) تتشكل الطيات وdescemet وبسبب سوء التعامل من القرنية عن طريق الانحناء، وخلق التوتر عبر القرنية، وذلك باستخدام الأدوات وغيرها بشكل مكثف في وقت الختان. هذا الرقم يدل على سميك طيات علاجي المنشأ نموا وجدت بين المحيط والمنطقة البصرية للقرنية.
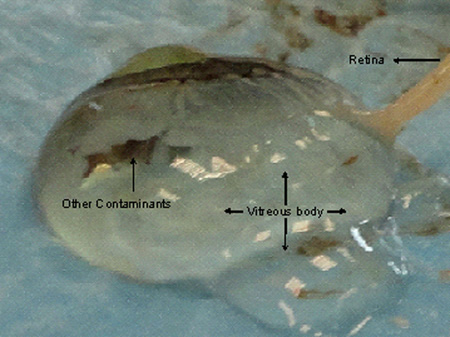
الشكل 4. إلى إلحاق أضرار المشيمية والأنسجة الشبكية في حين استئصال القرنية يؤدي في النهاية إلى إفراز السائل الزجاجي. يحصل على المتورطين في شبكية العين في الجسم الزجاجي مما يجعل من الصعب استئصال نسيج نوعية جيدة وايthout تلوث.

الجدول رقم 1. ملخص مجموعة من الأنشطة التي تقوم باستخدام الكرات بصري الإنسان خلال عامي 2009 و 2010 في بانكا Fondazione ديغلي Occhi (فينيسيا، إيطاليا). واستخدمت ما يقرب من 60٪ من أنسجة للزرع، وبالتالي ترك عدد كبير من الكرات بصري (حوالي 40٪) للبحوث العلمية والطبية.
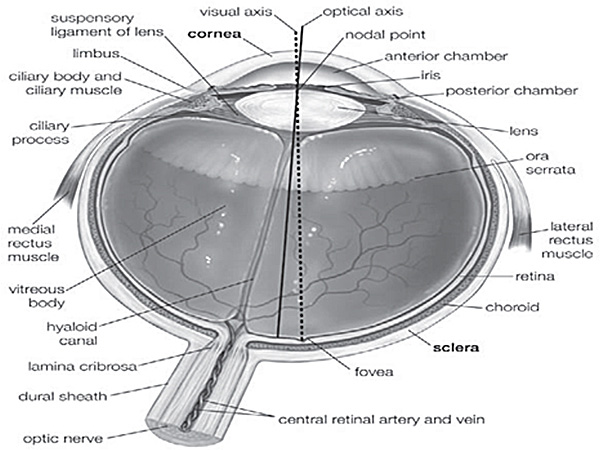
الشكل التكميلية 1. تشريح العين البشرية 5. يشار إلى أجزاء مختلفة من العين البشرية في هذا الشكل، وتستخدم لمتابعة الموقف الدقيق للأنسجة.
Access restricted. Please log in or start a trial to view this content.
Discussion
كلا، الختان الصحيح والسليم لحفظ الأنسجة القرنية والشبكية حاسمة كما وجود بعض العيوب البسيطة مثل تلف بطانة الأوعية الدموية أو عدد كبير من طيات descemet ويمكن أن يؤدي إلى فشل الكسب غير المشروع للقرنية في حين التعديلات درجة الحرارة أو سوء يمكن ان تعرض للخطر سلامة أنسجة الشب...
Access restricted. Please log in or start a trial to view this content.
Disclosures
الكتاب ليس لديهم تعارض في المصالح.
Acknowledgements
وأيد هذا العمل جزئيا عن طريق المنح من فينيتو Regione (من Ricerca Sanitaria Finalizzata n.292/2008 ومن Ricerca Sanitaria Finalizzata 2009). الكتاب أشكر الدكتور جيم Griffoni للبيانات 2009/2010 ملخص عن استخدام الكرات العين البشرية.
Access restricted. Please log in or start a trial to view this content.
Materials
المواد اللازمة لاستئصال القرنية والشبكية.
| Name | Company | Catalog Number | Comments |
| وصف المنتج | الأبعاد | شركة / معهد | |
| حراسة المتاح مشرط | حجم شفرة 15 | سوان، مورتون | |
| ضمادات معقمة | 5 سم × 5 سم، 8 الطبقات، 5 قطع | Artsana | |
| منشفة معقمة الطبية القابل للتصرف | 35 X 50 سم | U.Jet | |
| معقم مقص | ريش 24 مم / الطول الاجمالي. 95 مم المنحني، كليل | e.janach | |
| ملقط معقم | الفولاذ المقاوم للصدأ 11 ملم -100 X 2 يحكمها 0،70 ملم أسنان | e.janach | |
| القرنية مخلب - الجهاز الطبي المتاح | NIIOS (Hippocratech) | ||
| الاستعدادات | |||
| برنامج تلفزيوني | 100 مل PBS [10X] في 900 مل (الماء المقطر) د / ث | سيغما الدريخ | |
| NA-ثيوكبريتات | 1 جرام الصوديوم، ثيوكبريتات في 1 لتر من برنامج تلفزيوني [1X] | سيغما الدريخ | |
| I-PVP | 5 جم I-PVP في 1 د لتر / ث | سيغما الدريخ |
الجدول 2. يصف الجدول المواد التي تستخدم في استئصال القرنية والشبكية والشركة تلقيها من.
مواد وسيطة تخزين (2000 مل).
| مكونات | المزود | فهرس العدد | تركيز | كمية |
| MEM(1X) السائل | إينفيتروجن | 32360-034 | 1900 مل | |
| الصوديوم البيروفات | إينفيتروجن | 11360-039 | 1MM (10ML / لتر) | 20 مل |
| L-الجلوتامين | إينفيتروجن | 25030-032 | 2mm في (10ML / لتر) | 20 مل |
| مضاد حيوي / مضاد فطري | سيغما الدريخ | A5955-20ML | 10ML / لتر | 20 مل |
| الوليد العجل المصل | إينفيتروجن | 26010-74 | 2٪ (20 مل / لتر) | 40 مل |
الجدول 3. مواد وسيطة تخزين.
إعداد وسائط تخزين
إضافة جميع المكونات باستخدام تركيزات محددة على النحو المبين أعلاه في وعاء وتخلط جيدا. تصفية لهمباستخدام حجم المسام من فلتر ميكرون 0.2 (ميليبور، ميلانو، ايطاليا) مع مساعدة من مضخة تمعجية. الحفاظ على المتوسط في زجاجات على RT.
المواد اللازمة لنقل متوسطة (2000 مل).
| مكونات | المزود | فهرس العدد | تركيز | كمية |
| MEM (1X) السائل | إينفيتروجن | 32360-034 | 1800 مل | |
| الصوديوم البيروفات | إينفيتروجن | 11360-039 | 1MM (10 مل / لتر) | 20ml |
| L-الجلوتامين | إينفيتروجن | 25030-032 | 2mm في (10 مل / لتر) | 20ml |
| الوليد العجل المصل | إينفيتروجن | 26010-74 | 2٪ (20 مل / لتر) | 40 مل |
| ديكستران T500 | Pharmacosmos | 551005004007 | 6٪ (60 جم / لتر) | 120 غرام / لتر |
الجدول 4. المواد لمتوسطة وسائل النقل.
إعداد المتوسطة النقل
إضافة ديكستران 6٪ في لتر من 1.5 ~ MEM وترك الأمر بين عشية وضحاها. إضافة باقي المكونات في وسائل الاعلام وتصفيتها باستخدام 0.2 ميكرون فلتر (ميليبور، ميلانو، ايطاليا) باستخدام مضخة فراغ. الحفاظ على المتوسط في زجاجات على RT.
References
- Fay, A. Diseases of the visual system. Cecil Medicine. Goldman, L., Ausiello, D. , 23rd ed, Saunders Elsevier. Philadelphia, Pa. (2007).
- Parekh, M., Megaw, R., Ray-Chaudhuri, A., Ahmad, S. Patents in Limbal Stem Cell Biology. Recent patents on Regenerative Medicine. 1, 207-212 (2011).
- Pharm, U. S. The Eye: The physiology of human perception. Britannica educational publishing. 36, 19-27 (2011).
- Lang, G. Ophthalmology: A pocket textbook atlas. , 2nd Edition, 115-117 Forthcoming.
- Liesbeth, P. els Organ Culture: The method of choice for preservation of human donor corneas. Br. J. Ophthalmol. 81, 523-525 (1997).
- Meyer, J. S., Howden, S. E., Wallace, K. A., Verhoeven, A. D., Wright, L. S., Capowski, E. E., Pinilla, I., Martin, J. M., Tian, S., Stewart, R., Pattnaik, B., Thomson, J., Gamm, D. M. Optic vesicle-like structures derived from human pluripotent stem cells facilitate a customized approach to retinal disease treatment. Stem Cells. , (2011).
- Trifunovic, D., Karali, M., Camposampiero, D., Ponzin, D., Banfi, S., Marigo, V. A high-resolution RNA expression atlas of retinitis pigmentosa genes in human and mouse retinas. Invest. Ophthalmol. Vis. Sci. 49, 2330-2336 (2008).
- Mora, P., Montanini, L., Ferrari, S. Retina. 30, 1555(2010).
- Claybon, A., Bishop, A. J. R. Dissection of a Mouse Eye for a Whole Mount of the Retinal Pigment Epithelium. J. Vis. Exp. (48), e2563(2011).
- Skeie, J. M., Tsang, S. H., Mahajan, V. B. Evisceration of Mouse Vitreous and Retina for Proteomic Analyses. J. Vis. Exp. (50), e2795(2011).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved