A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
טכניקה פשוטה עבור
In This Article
Summary
העיתון מתאר שיטה פשוטה כדי הקרנית בלו וכדי להוציא את העקר רקמות רשתית העין מן העולם של תורמים גווייה אדם. הטכניקה המתוארת כאן יעזור ובלו רקמות באיכות טובה כדי לשמש להשתלה, למטרות מחקר או ניתוח מבלי לפגוע ברקמות אחרות של הגלובוס העין.
Abstract
Enucleation is the process of retrieving the ocular globe from a cadaveric donor leaving the rest of the globe undisturbed. Excision refers to the retrieval of ocular tissues, especially cornea, by cutting it separate from the ocular globe. Evisceration is the process of removing the internal organs referred here as retina. The ocular globe consists of the cornea, the sclera, the vitreous body, the lens, the iris, the retina, the choroid, muscles etc (Suppl. Figure 1). When a patient is suffering from corneal damage, the cornea needs to be removed and a healthy one must be transplanted by keratoplastic surgeries. Genetic disorders or defects in retinal function can compromise vision. Human ocular globes can be used for various surgical procedures such as eye banking, transplantation of human cornea or sclera and research on ocular tissues. However, there is little information available on human corneal and retinal excision, probably due to the limited accessibility to human tissues. Most of the studies describing similar procedures are performed on animal models. Research scientists rely on the availability of properly dissected and well-conserved ocular tissues in order to extend the knowledge on human eye development, homeostasis and function. As we receive high amount of ocular globes out of which approximately 40% (Table 1) of them are used for research purposes, we are able to perform huge amount of experiments on these tissues, defining techniques to excise and preserve them regularly.
The cornea is an avascular tissue which enables the transmission of light onto the retina and for this purpose should always maintain a good degree of transparency. Within the cornea, the limbus region, which is a reservoir of the stem cells, helps the reconstruction of epithelial cells and restricts the overgrowth of the conjunctiva maintaining corneal transparency and clarity. The size and thickness of the cornea are critical for clear vision, as changes in either of them could lead to distracted, unclear vision. The cornea comprises of 5 layers; a) epithelium, b) Bowman's layer, c) stroma, d) Descemet's membrane and e) endothelium. All layers should function properly to ensure clear vision4,5,6. The choroid is the intermediate tunic between the sclera and retina, bounded on the interior by the Bruch's membrane and is responsible for blood flow in the eye. The choroid also helps to regulate the temperature and supplies nourishment to the outer layers of the retina5,6. The retina is a layer of nervous tissue that covers the back of the ocular globe (Suppl. Figure 1) and consists of two parts: a photoreceptive part and a non-receptive part. The retina helps to receive the light from the cornea and lens and converts it into the chemical energy eventually transmitted to the brain with help of the optic nerve5,6.
The aim of this paper is to provide a protocol for the dissection of corneal and retinal tissues from human ocular globes. Avoiding cross-contamination with adjacent tissues and preserving RNA integrity is of fundamental importance as such tissues are indispensable for research purposes aimed at (i) characterizing the transcriptome of the ocular tissues, (ii) isolating stem cells for regenerative medicine projects, and (iii) evaluating histological differences between tissues from normal/affected subjects. In this paper we describe the technique we currently use to remove the cornea, the choroid and retinal tissues from an ocular globe. Here we provide a detailed protocol for the dissection of the human ocular globe and the excision of corneal and retinal tissues. The accompanying video will help researchers to learn an appropriate technique for the retrieval of precious human tissues which are difficult to find regularly.
Protocol
1. כריתת באתרו של הקרנית מן גלובס העינים
- הפעל את ארון האוויר זרימה למינרית כ 15 דקות לפני השימוש. לנקות את מכסה המנוע באמצעות זרימה למינרית איזופרופיל אלכוהול 70%. ללבוש ביגוד מגן אישי, כגון שווי המסכה כירורגית. לשפשף את הידיים והאמות ומייבשים בעזרת מגבת סטרילית. ללבוש כפפות סטריליות ועל שמלת שרוולים או באמצעות טכניקה מזוהם.
- הגדר את השדה הסטרילי על ידי הצבת מכשיר מגש סטרילי בסביבה נקייה מחיידקים. לוודא כי המכשירים הם סטריליים. פתח את חבילת כלי סטרילי להפוך למגרש סטרילי להימנע מכל זיהום.
- מקם את כל החומרים והכלים סטריליים (טבלה 2) יחד עם בקבוקים צנצנות (עיניים) המכילים גלובס עיניים, כך שהם הסמוכים קצה השדה הסטרילי עבור קלות שימוש.
- תוויות הבקבוקים עם שימור שהוכן קודם לכן / בינוני אחסון כמצוין בטבלה 3 ואת המקוםמ 'על פני השטח של מכסה המנוע באוויר זרימה למינרית יחד עם I-PVP (יוד polyvinylpyrrolidone), thiosulphate נתרן תמיסת מלח סטרילית PBS (פוספט מלוחים למאגר).
- אפשר הרקמות עינית ופתרונות להגיע לטמפרטורת החדר הרגיל כפי שהם נשמרים במקררים ב 4 ° C. למנוע הופעה חוזרת של ההתחממות / קירור מחזורים. לשמור את המכסים של פתרון ואת צנצנות עין עם הצד הפנימי כלפי מעלה ליד צנצנות של כל אחד מהם.
- הסר gauzes וספוגים מצנצנת את העין באמצעות מלקחיים סטריליות. לטבול את כדור הארץ ב 0.5% סטרילי I-PVP 2 דקות כדי לטהר את גלובס עיניים. מניחים את שני מלקחיים על מכסה מגש סטרילי, מחוץ לשדה סטרילית. מעבירים את כדור הארץ thiosulphate% 0.1 סודיום דקה 1 באמצעות זוג נוסף של מלקחיים סטריליות. באמצעות מלקחיים אותם, להעביר את כדור הארץ כדי בקבוק המכיל תמיסת מלח סטרילית (PBS) ולהשאיר אותה עד שזה מופעל. חזור על אותו תהליך של העולם עיניים והשני לאהוא תורם אותו.
- עבודה מתחת למכסה המנוע אוויר למינרית זרימה, עוטפים את כדור הארץ בעזרת גזה סטרילית (תחבושות) עוזב את הקרנית וכ 5 בלובן העין מ"מ מהקרנית חשף. הנורה העין יכול להתקיים רק ביד שמירה על לחץ מספיק. רקמת צריך להישמר לחה במהלך הניתוח כולו.
- מלקחיים המשמשים יחד עם מספריים כדי להסיר את כל שרידי הסופי של הלחמית. לשמור את המכשירים המשמשים לניתוח מעל נפרד ממכשירים אחרים. השתמש בלהב סכין המנתחים לבצע חתך scleral של 3-4 מ"מ מאזור לימבוס, ואז להרחיב את החתך של ° 360, הימנעות לחדור אל הרקמה uveal הבסיסית או לגרום לכל עיוות של עקמומיות הרגיל של הקרנית. חותכים ארבעה חתכים גדולים עוזבים ארבעה פערים קטנים הימנעות הפרשת הגוף הזגוגי. כל ארבעת הפערים נחתכים להבטיח שום הסרה של רקמה אחרת.
- נוכחות של פלאק scleral קטנים עשויים לעכב את החיתוך, כדי לוודא complete כריתה scleral במספריים microsurgery. פעולה זו יש לבצע מבלי לפגוע בגוף, דמית העין הרשתית הזגוגית.
- בדוק את החתך, כדי להבטיח שהיא תושלם. אם החתך שבוצעה כהלכה corneo-scleral שומרת השפה אל הגופים ריסי רק בשלב בתכתובת עם הקרנית.
- הגדר את העולם עיניים עטופה ליד מרכז שדה סטרילי. להשלים את הסרת הקרנית באמצעות מלקחיים להחזיק את שפת scleral נייח יד המשמש כריתה למשוך את ריסי הגוף דמית העין כלפי מטה, הרחק כפתור corneo-scleral.
- להפריד בעדינות את כל הידבקויות הנותרים מלחצן corneo-scleral. לא למשוך את שפת corneo-scleral בצורה שעלולה לגרום בין הקרנית המתח ולא לאפשר לו לרדת חזרה למטה, אל החדר הקדמי.
- צפיפות תא האנדותל של הקרנית נבדק באמצעות פתרון hypotonic ואת התמותה התא נבדק באמצעות Trypכתמים כחולים דקות סביב 1 והתאים נספרים מכן תחת מיקרוסקופ אופטי כפי שהיא נמדדת על תאים / מ"מ 2. החדר הקדמי צריך להתמודד עם המכסה האחורי תוך צריך להתמודד עם החלק התחתון של צלחת פטרי. צפיפות תא האנדותל אפשר לסמוך באופן ידני באמצעות רשת ב המטרה בהגדלה 100x. מספר מינימלי התא קיבל להשתלה באיטליה הוא 2200 לתאי אנדותל / 2 מ"מ.
- מעבירים את שפת corneo-scleral באמצעות טופר הקרנית עד בינוני מוכן בעבר אחסון הקרנית נשמר ב RT (בטמפרטורת החדר) כפי שניתן לראות בלוח 3.
- בדוק את החדר האחורי של העדשה גבישי טבעי. אם בלובן העין מוכן, להסיר את כל שאריות של ענביה והומור הזגוגית מן העולם. לגולל בזהירות ולחזור קטע האחורי שנותר כדי צנצנת העין שלו בהתאמה, תוך שימוש בטכניקה האספטי. לחזור על התהליך עבור העולם השנייה באמצעות מכשירים חדשים. תקן שנינות הקרניתH טופר הקרנית ולשמר תחת אמצעי אחסון (תרבות איבר) בשעה 31 ° C. הקרנית נכרת, כפי שמוצג באיור 1 א ', לאחר מכן ניתן להשתמש עבור keratoplasty או מחקר.
- השליכו חומרים מיותרים ביו מסוכנים פסולת לתוך פחי אשפה המתאימים. לנקות את שטח עבודה אחת את העבודה הושלמה באמצעות 70% ספריי אלכוהול איזופרופיל.
- אם לאחר 28 יום הקרנית שומרת על כל הפרמטרים ההערכה [כגון מורפולוגיה, ספירת תאים, שקיפות, עובי בדיקות מיקרוביולוגיה - חיידקים פטריות באמצעות מכשיר Bactec 9240 (בקטון דיקינסון, מילאנו, איטליה)], הוא יכול להיות מועבר אל בתי החולים באמצעות המדיום התחבורה מוצגים בלוח 4. הקרנית יש להסיר והניח מ אחסון להובלת בינוני מתחת לארון זרימה למינרית האוויר.
- כתוצאה, במהלך האחסון, הקרנית מקבלת עבה יותר בגודל הרגיל הנדרש להשתלה, הבנקים עיניים להשתמש דה נפיחות סוכני להפחית עובי. אנו6% משתמשים dextran T500 כדי לקבל את הקרנית חזרה לגודל הרגיל שלו במדיום התחבורה. אם כי 4-8% dextran T500 יכול לשמש, 6% שימש הטוב ביותר עבורנו. זה מקל על המנתחים להשתיל קרנית ברגע שהם מקבלים את זה.
2. הוצאת הקרביים של הרשתית מן גלוב Ocular לאחר מבתקת הקרנית
- לאחר כריתה, הקרנית נבחרה להשתלה או מחקר מבוסס על המורפולוגיה שלה צפיפות התאים האנדותל ממוקם אחסון או בינוני שימור על 31 ° C. הנותרים של כדור העין מעובד מכן לשימוש נוסף כגון בידוד בלובן העין לצורך ניתוח, הרשתית למחקר וכו '
- לפני כריתה ברשתית, לוודא כי העולם עינית שלם ורק הקרנית עם החלק של בלובן העין מוסר. אם הגוף הזגוגי דביקות הוא מפריש החוצה הוא הופך להיות קשה להסיר רקמת הרשתית.
- אם התורם הוא מתחת גיל 65, בלובן העין הואנשמר תחת PBS סטרילי לצורך ניתוח לאחר בדיקה סרולוגית. במקרה זה, בלובן העין לא לחתוך, רק את הגוף הזגוגי יוסר בלובן העין כולה נשמר.
- עבור כריתה ברשתית, להתחיל לחתוך חתך קטן או מהצד של הקרנית בלובן העין נעה לכיוון עצב הראייה באמצעות מלקחיים סטריליות ומספריים. להחזיק חלק בלובן העין באמצעות מלקחיים ולחתוך עם מספריים ישר כלפי עצב הראייה חיתוך בין השאר על ידי הימנעות חלק נזק הגוף הזגוגי.
- לוחות כורוידאלית יש להפריד בלובן העין כפי שהם תקועים יחד. חותכים את בלובן העין כולה לחשוף את הרקמה דמית העין. לאחר בלובן העין נחתך לגמרי, להפריד בלובן העין עם הנותרים של הגוף הזגוגי על ידי חיתוך זה ליד עצב הראייה. כדור שלם של הגוף הזגוגי מכוסה דמית העין יהיה גלוי כפי שמוצג באיור 2 א.
- באמצעות שני מלקחיים סטריליות להסיר את השכבה דמית העין בעדינות על ידי מרים אותו עם 1זוג מלקחיים והסרה אותו עם האחר. לחלופין, שכבה דמית העין ניתן להסיר באמצעות מספריים אך רצוי להימנע מכיוון שהוא עלול לגרום נזקים ברשתית. להסיר את השכבה דמית העין באופן חלקי ופצע אותו כדי להקל על ההסרה.
- ברגע שכבה דמית העין מוסר, שכבה שקופה של הרשתית שנראה בבירור כפי שמוצג באיור 2 ב. שכבה דמית העין יש קרום ברוך הפנים אשר יכול גם להסיר אך קשה לזהות אותה בעין בלתי מזוינת.
- כמו כן, משתמשים בשני מלקחיים כדי להסיר את שכבת הרשתית כפי שמוצג באיור 2 ג. קל לבודד כמות גבוהה של הרשתית אם נכרת ליד עצב הראייה. כל השכבות של העין ניתן לראות כעת כפי שמוצג באיור 2.
- לאחר רקמת הרשתית הוסר, הוא יכול לשמש למטרות שונות, ולכן הצעדים הבאים ותנאים המשמשים לשימור עשויה להיות שונה בהתאם. למשל,רקמת הרשתית ניתן להציב צינורות המכילים RNA ייצוב חומרים כימיים (כמו RNAlater) או בולם תמוגה (להפקת RNA או DNA), dispase / טריפסין (עבור בידוד של תאים), פתרונות תיקון (לפני להטביע הרקמות פרפין או אוקטובר על אימונוהיסטוכימיה).
- לנקות את כל שטח עבודה ולנקות את האזור באמצעות ספריי 70% אלכוהול איזופרופיל.
3. נציג תוצאות
שפת corneo-scleral כפי שניתן לראות באיור 1 א הוא הקרנית נכרת כראוי עם הסכום הנדרש של שפת scleral ומורפולוגיה האנדותל, זה סוג של הקרנית משמש בדרך כלל עבור keratoplasty חודר. אם stroma הקדמי של הקרנית נכרת פגום עם נוכחות של אטימות, הקרנית יכול לשמש keratoplasty האנדותל / keratoplasty lamellar האחורי (האנדותל עם חלק stroma). לעומת זאת, אם שכבת האנדותל ניזוק או אם צפיפות תא האנדותל הוא <2200 תאים / מ"מ 2 (הואעליאן רגילה), הקרנית יכול לשמש keratoplasty lamellar הקדמי (אפיתל עם החלק הקדמי של stroma). אם ספירת תא האנדותל הוא פחות הנדרש, הקרנית יכול לשמש keratoplasty lamellar מחקר הקדמי או בעוד, אם הקרנית ניזוקה לחלוטין, יכול לשמש למחקר, כפי שמוצג באיור 1 ב, 3 ב ו 3 ג או מושלך. הנזק יכול להיות הגורם טיפולו הכושל רקמות, ניתוחי קטרקט לפני המובילים צלקות אנדותל סטרומה או descemet, פיתוח של פגיעה פיזית וכו 'במהלך חייו של החולה לכן, יהיה צורך לבדוק כל רקמה עם מנורת סדק ולאחר מכן תחת מיקרוסקופ אופטי צלקות עדינים / קפלים / ופלוגות. הקרנית נשמרת בדרך כלל תחת שני תנאים שונים כגון תרבות איבר (כ -31 ° C) משמש בדרך כלל במדינות אירופה או תנאים היפותרמיה (כ 4 ° C) משמש בדרך כלל בארצות הברית. אנו משתמשים בתרבות איבר כמו זה עוזר לחדש את הסכרבתאי אפיתל בגיל, כדי לבדוק מחדש להחיות תא האנדותל עם הזמן שלאחר מות, תקופת אחסון של 4 שבועות אשר נותן חלון מספיק לתכנון ניתוח, נותן מספיק זמן לבדיקות מיקרוביולוגיות (חיידקים פטריות) ו סרולוגית וכו הקרנית ניתן לשמר גם במדיום התחבורה למשך 7 ימים.
בלובן העין אפשר לחתוך חלק אחר חלק להבטיח הסרה עדינה של כל לוחות כורוידאלית. נוזל זגוגי יכול להפריש כאשר עצב הראייה, דמית העין או ברשתית נחתך בחדות כפי שמוצג באיור 4. הרשתיות אם הכרותות לניתוח RNA צריך להישמר RNAlater ברגע רקמות נכרת. בדרך כלל 1x1 ס"מ דמית העין שכבת הרשתית הוא נכרת ואחרי שמירה על אותה ב RNAlater במשך 24 שעות ב 4 ° C נשמר תחת -80 עד ° C ב טריים צינורות Eppendorf (בטוח נעילת צינורות, 2 מ"ל), או להשתמש המצורף יבש קרח. רקמת הרשתית יש נכרת באמצעות שני מלקחיים ליד עצב הראייה מן איריסאו שולי ריסי כדי למנוע זיהום פיגמנט עם מבנים אחרים יש להעביר למיכל שמירה מיד RNA נעשה לא יציב בעת אחזור הרשתית.
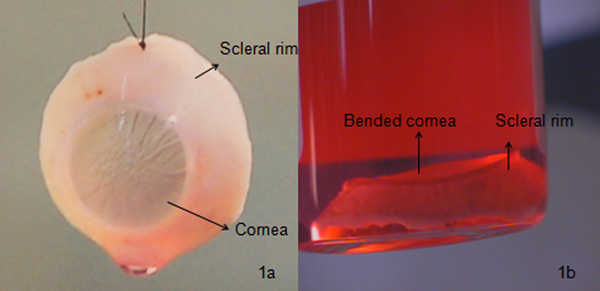
תרשים 1 השוואה בין טוב הקרנית באיכות ירודה.) הקרנית נכרת כראוי. כך הקרנית נשמרת בדרך כלל למשך 4 שבועות תחת התרבות איברים. מיקרוביולוגית (באמצעות מכשיר Bactec 9240) ו מורפולוגי (מכתים את התאים עם trypan כחול לקביעת המוות התא התבוננות תאים תחת מיקרוסקופ אופטי עם הגדלה 100x) בדיקה מתבצעת לפני העברת אותו לבית החולים (איור 3 א) ב) הקרנית מכופף , אשר מוביל בסופו של דבר דחיית השתל בשל קפלי descemet העליון של התא גבוהה נזק האנדותל לבחון באמצעות מיקרוסקופ מנורת סדק. כך הקרנית משמש בדרך כלל מילearch או נמחק.

איור 2. שיטת להבטיח כריתה מדויקת של רקמת הרשתית.) הביתור בלובן העין מן העולם עיניים באמצעות להב 24 מ"מ עם 95 מ"מ מעוגלת או מספריים הקצה הקהה סטריליים ו 100 11X2 מ"מ הנשלט על ידי מלקחיים שיניים 0.70 מ"מ סטריליים. בלובן העין יש לצמצם על ידי החזקת צד אחד עם מלקחיים את חיתוך ישר לכיוון עצב הראייה באמצעות מספריים. שכבה דמית העין עכשיו יהיה לראות בקלות, ב) באמצעות שני 100 11X2 מ"מ הנשלט על ידי השיניים 0.70 מ"מ מלקחיים סטריליות, דמית העין מוסר, והרסנו אותו לגזרים, אשר חושף את השכבה הבסיסית רשתית שקוף, ג) ברשתית שכבת שקוף הוא נכרת בזהירות ליד עצב הראייה ללא הפרשת נוזל הזגוגית באמצעות מלקחיים אותם. שני מלקחיים את צריכה להחזיק בכל צד של הרשתית רקמה יש להסיר בעדינות ומתחילהגר ליד עצב הראייה נע לכיוון הקרנית, כדי לקבל כמות טובה של רקמת הרשתית. רקמת ניתן לחתוך בגדלים שונים המשמשים בניסויים ניתוח, ד) שכבות שונות של העין לאחר הסרת הקרנית ניתן לראות בנתון זה. הגוף דמית העין יוסר בעקבות לראשונה על ידי הרשתית מבלי לפגוע בחלקים אחרים של העין.

איור 3. השוואה בין סוגים שונים של צפיפות התאים ומורפולוגיה הנצפים בהגדלה 100x של מיקרוסקופ אופטי.) תא טוב צפיפות האנדותל (> 2200 תאים / מ"מ 2) ומורפולוגיה (פולימורפיזם פחות, ניוון נמוכה, ללא ניוון ו 0% תמותה) ב הקרנית אשר מתאים להשתלה, ב) התא המסכן צפיפות האנדותל (כ 1200 - 1400 תאים / מ"מ 2) ומורפולוגיה (פולימורפיזם גבוהה מאוד degeneration של תאים) עם 30-40% בתמותה הכוללת כ נצפות לאחר צביעה בכחול trypan, ג) חלק לתאי אנדותל ניזוקו עקב ניתוק של גיליון אנדותל תוך אחזור הקרנית מן העולם עינית. זה אושר על ידי התבוננות התמותה של התאים צבעונית באזור על ידי trypan כחול; ד) קפלים של descemet נוצרות בשל טיפולו הכושל של הקרנית על ידי כיפוף, יצירת מתח הקרנית צלב, תוך שימוש בכלים מאוד וכו 'בזמן של כריתה. האיור מציג את קפלי עבים רפואיות המפותחות שנמצאו בין הפריפריה לאזור הראייה של הקרנית.
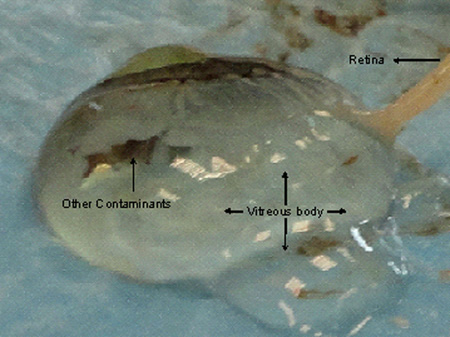
באיור 4. נזקי דמית העין ורקמות רשתית תוך מבתקת הקרנית מוביל בסופו של דבר הפרשה של נוזל זגוגי. הרשתית מקבלת מעורב הגוף הזגוגי ולכן קשה בלו רקמה באיכות טובה Without זיהום.

טבלה 1. סיכום של מגוון של פעילויות המבוצעות באמצעות גלובס עינית אדם במהלך 2009 ו -2010 ב Fondazione Bancà דגלי Occhi (ונציה, איטליה). כ -60% רקמות שימשו להשתלה, ובכך להשאיר מספר גבוה של גלובס עינית (סביב 40%) למחקר המדעי והרפואי.
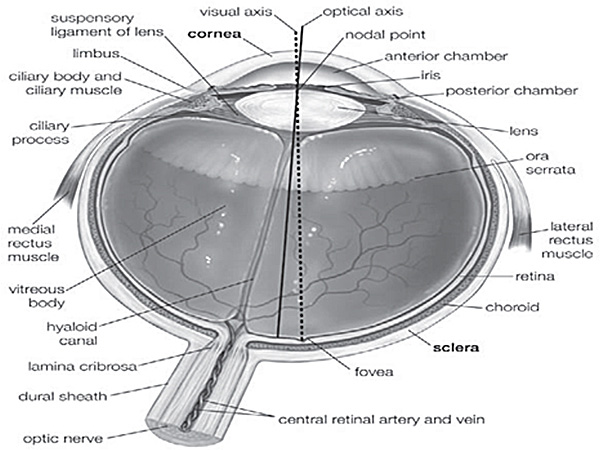
משלים באיור 1. אנטומיה של העין האנושית 5. בחלקים שונים של העין האנושית מצוינים בנתון זה, נהג לעקוב אחר המיקום המדויק של הרקמות.
Discussion
שניהם, כריתה נכונה ושמירה נכונה של רקמות הקרנית הרשתית הם קריטיים כמו פגמים קלים כגון נזק האנדותל או מספר גבוה של קפלים של descemet יכול להוביל לכישלון השתל של הקרנית ואילו שינויים בטמפרטורה או טיפולו הכושל יכול להתפשר על שלמות רקמות הרשתית. מטרת מאמר זה היא להראות כיצד ?...
Disclosures
החוקרים אין ניגוד עניינים.
Acknowledgements
עבודה זו נתמכה בחלקה באמצעות מענקים של ונטו Regione (Ricerca Sanitaria Finalizzata n.292/2008 ו Ricerca Sanitaria Finalizzata 2009). המחברים מודים לד"ר ג Griffoni עבור הנתונים 2009/2010 סיכום על השימוש גלובס עיניים אנושיות.
Materials
חומרים כריתה של הקרנית ואת הרשתית.
| Name | Company | Catalog Number | Comments |
| תאור המוצר | מידות | החברה / המוסד | |
| שמרו הפנויה אזמל | Blade בגודל 15 | סוואן, מורטון | |
| תחבושות סטריליות | 5 ס"מ על 5 ס"מ, 8 שכבות, 5 יח' | Artsana | |
| מגבת סטרילית רפואי חד פעמי | 35 X 50 ס"מ | U.Jet | |
| עקרות מספריים | להבים 24 מ"מ / אורכו הכולל. 95 מ"מ מעוגלת, בוטה | e.janach | |
| סטרילית מלקחיים | נירוסטה -100 מ"מ 11 X 2 הנשלט על ידי השיניים 0.70 מ"מ | e.janach | |
| טופר הקרנית - מכשיר רפואי חד פעמי | NIIOS (Hippocratech) | ||
| ההכנות | |||
| PBS | 100 מ"ל PBS [10x] ב 900 (מים מזוקקים) מ"ל ד / ל | Sigma-Aldrich | |
| Na-thiosulphate | 1 גרם Na-thiosulphate ב 1 ליטר של PBS [1x] | Sigma-Aldrich | |
| I-PVP | 5 גרם I-PvP ב 1 ליטר ד / ל | Sigma-Aldrich |
טבלה 2. הטבלה מתארת את החומרים המשמשים כריתה של הקרנית ואת הרשתית לבין החברה הם מתקבלים.
חומרים עבור אמצעי אחסון (2000 מ"ל).
| רכיבי | ספק | מספר קטלוגי | ריכוז | כמות |
| MEM(1X) נוזלי | Invitrogen | 32360-034 | 1900 מ"ל | |
| נתרן פירובט | Invitrogen | 11360-039 | 1 מ"מ (10 מ"ל / ל ') | 20 מ"ל |
| L-גלוטמין | Invitrogen | 25030-032 | 2 מ"מ (10 מ"ל / ל ') | 20 מ"ל |
| אנטיביוטיקה / antimycotic | Sigma-Aldrich | A5955-20ML | 10 מ"ל / ליטר | 20 מ"ל |
| סובך של יילוד בסרום | Invitrogen | 26010-74 | 2% (20 מ"ל / ל ') | 40 מ"ל |
לוח 3. חומרים בינוני האחסון.
הכנת אמצעי אחסון
להוסיף את כל החומרים באמצעות ריכוזים ספציפיים שניתנו לעיל בצנצנת ומערבבים היטב. לסנן אותםבאמצעות גודל הנקבוביות של 0.2 מיקרון המסנן (Millipore, מילאנו, איטליה) עם עזרה של המשאבה peristaltic. לשמר את המדיום בבקבוקים ב RT.
חומרים בינוני הובלה (2000 מ"ל).
| רכיבי | ספק | מספר קטלוגי | ריכוז | כמות |
| MEM (1X) נוזלי | Invitrogen | 32360-034 | 1800 מ"ל | |
| נתרן פירובט | Invitrogen | 11360-039 | 1 מ"מ (10 מ"ל / ל ') | 20ml |
| L-גלוטמין | Invitrogen | 25030-032 | 2 מ"מ (10 מ"ל / ל ') | 20ml |
| סובך של יילוד בסרום | Invitrogen | 26010-74 | 2% (20 מ"ל / ל ') | 40 מ"ל |
| Dextran T500 | Pharmacosmos | 551005004007 | 6% (60 גרם / ליטר) | 120 גר '/ ל |
לוח 4. חומר בינוני התחבורה.
הכנת אמצעי התחבורה
הוסף dextran 6% ב 1.5 ליטר ~ של MEM ולהשאיר אותה בן לילה. מוסיפים את יתר החומרים בכלי התקשורת ולסנן באמצעות 0.2 מיקרון המסנן (Millipore, מילאנו, איטליה) באמצעות משאבת ואקום. לשמר את המדיום בבקבוקים ב RT.
References
- Fay, A., Goldman, L., Ausiello, D. Diseases of the visual system. Cecil Medicine. , (2007).
- Parekh, M., Megaw, R., Ray-Chaudhuri, A., Ahmad, S. Patents in Limbal Stem Cell Biology. Recent patents on Regenerative Medicine. 1, 207-212 (2011).
- Pharm, U. S. The Eye: The physiology of human perception. Britannica educational publishing. 36, 19-27 (2011).
- Lang, G. . Ophthalmology: A pocket textbook atlas. , 115-117 .
- Liesbeth, P. e. l. s. Organ Culture: The method of choice for preservation of human donor corneas. Br. J. Ophthalmol. 81, 523-525 (1997).
- Meyer, J. S., Howden, S. E., Wallace, K. A., Verhoeven, A. D., Wright, L. S., Capowski, E. E., Pinilla, I., Martin, J. M., Tian, S., Stewart, R., Pattnaik, B., Thomson, J., Gamm, D. M. Optic vesicle-like structures derived from human pluripotent stem cells facilitate a customized approach to retinal disease treatment. Stem Cells. , (2011).
- Trifunovic, D., Karali, M., Camposampiero, D., Ponzin, D., Banfi, S., Marigo, V. A high-resolution RNA expression atlas of retinitis pigmentosa genes in human and mouse retinas. Invest. Ophthalmol. Vis. Sci. 49, 2330-2336 (2008).
- Mora, P., Montanini, L., Ferrari, S. . Retina. 30, 1555 (2010).
- Claybon, A., Bishop, A. J. R. Dissection of a Mouse Eye for a Whole Mount of the Retinal Pigment Epithelium. J. Vis. Exp. (48), e2563 (2011).
- Skeie, J. M., Tsang, S. H., Mahajan, V. B. Evisceration of Mouse Vitreous and Retina for Proteomic Analyses. J. Vis. Exp. (50), e2795 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved