È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Una tecnica semplificata per
In questo articolo
Riepilogo
Il documento descrive una tecnica semplificata per corneale accise e di sviscerare i tessuti della retina dal globo oculare di donatori cadaveri umani. La tecnica qui descritta aiuterà a accise tessuti di buona qualità da usare per il trapianto, a fini chirurgici o di ricerca senza danneggiare altri tessuti del globo oculare.
Abstract
Enucleazione è il processo di recupero del globo oculare da un donatore cadavere lasciando il resto del globo indisturbata. Escissione si riferisce al recupero dei tessuti oculari, in particolare cornea, tagliandolo separato dal globo oculare. L'eviscerazione è il processo di rimozione degli organi interni di cui qui retina. Il globo oculare consiste nella cornea, sclera, il corpo vitreo, la lente, l'iride, la retina, coroide, etc muscoli (Suppl. Figura 1). Quando un paziente è affetto da danno corneale, la cornea deve essere rimosso e un sano deve essere trapiantato da interventi cheratoplastica. Malattie genetiche o difetti della funzione retinica, può compromettere la visione. Globi oculari umani possono essere utilizzate per varie procedure chirurgiche come banche degli occhi, il trapianto di cornea o la sclera umana e ricerca su tessuti oculari. Tuttavia, vi sono poche informazioni disponibili sulla cornea umana escissione e della retina, probabilmente a causa della Limited accessibilità ai tessuti umani. La maggior parte degli studi che descrivono procedure simili vengono eseguiti su modelli animali. Ricercatori contare sulla disponibilità di tessuti oculari adeguatamente sezionati e ben conservata al fine di estendere la conoscenza sui diritti umani lo sviluppo degli occhi, l'omeostasi e la funzione. Come riceviamo elevata quantità di globi oculari di cui circa il 40% (Tabella 1) di essi sono utilizzati per scopi di ricerca, siamo in grado di eseguire la grande quantità di esperimenti su questi tessuti, la definizione di tecniche per accise e conservare regolarmente.
La cornea è un tessuto avascolare che consente la trasmissione della luce sulla retina e per questo scopo deve sempre mantenere un buon grado di trasparenza. All'interno della cornea, la regione limbus, che è un serbatoio delle cellule staminali, aiuta la ricostruzione delle cellule epiteliali e limita la crescita eccessiva della congiuntiva mantenere trasparenza corneale e chiarezza. La dimensione e th ickness della cornea sono essenziali per la visione chiara, come cambiamenti di una di esse potrebbe portare a distrarsi, la visione chiara. La cornea è composto da 5 strati: a) epitelio, b) strato di Bowman, c) stroma, d), della membrana di Descemet e e) endotelio. Tutti i livelli dovrebbe funzionare correttamente per garantire una visione chiara 4,5,6. La coroide è la tunica intermedia tra la sclera e retina, delimitata all'interno dalla membrana del Bruch ed è responsabile del flusso di sangue nell'occhio. Il coroide aiuta anche a regolare la temperatura e fornisce nutrimento per gli strati esterni della retina 5,6. La retina è uno strato di tessuto nervoso che copre la parte posteriore del globo oculare (Suppl. figura 1) e consiste di due parti: una parte fotosensibile e un non-ricettivo dell'articolo. La retina aiuta a ricevere la luce dalla cornea e del cristallino e lo converte in energia chimica eventualmente trasmessa al cervello con l'aiuto del nervo ottico 5,6. ove_content "> Lo scopo di questo lavoro è quello di fornire un protocollo per la dissezione dei tessuti corneali e retiniche da globi oculari umani. Evitare la contaminazione incrociata con i tessuti adiacenti e preservando l'integrità dell'RNA è di fondamentale importanza in quanto tali tessuti sono indispensabili per scopi di ricerca finalizzati a (i) che caratterizza il trascrittoma dei tessuti oculari, (ii) isolare le cellule staminali per i progetti di medicina rigenerativa, e (iii) valutare le differenze istologiche tra i tessuti normali da / soggetti interessati. In questo articolo descriviamo la tecnica attualmente si sta adoperando per rimuovere la cornea, la coroide e dei tessuti retinici da un globo oculare. Qui forniamo un protocollo dettagliato per la dissezione del globo oculare umana e l'asportazione dei tessuti corneali e retiniche. Il video di accompagnamento aiuterà i ricercatori a imparare una tecnica appropriata per il recupero di preziosi tessuti umani, che sono difficili da trovare regolarmente.
Protocollo
1. Excisione situ della cornea da globi oculari
- Accendere la cappa a flusso laminare d'aria circa 15 minuti prima dell'uso. Pulire la cappa a flusso laminare con il 70% di alcool isopropilico. Indossare indumenti protettivi, come cappello e maschera chirurgica. Scrub mani e gli avambracci e asciugare con un telo sterile. Indossare guanti sterili e camice o maniche con tecnica asettica.
- Impostare il campo sterile inserendo un vassoio sterile strumento asettico. Verificare che gli strumenti sono sterili. Aprire la confezione sterile strumenti e capovolgere sul campo sterile evitando qualsiasi contaminazione.
- Posizionare tutti i materiali sterili e strumenti (Tabella 2) con bottiglie vasetti oculari) contenenti globi oculari in modo che siano adiacenti al bordo del campo sterile per facilità di utilizzo.
- Etichettare le bottiglie con conservazione precedentemente preparata / supporto di memorizzazione come indicato nella tabella 3 e posizionare l'm sulla superficie della cappa a flusso laminare d'aria con I-PVP (polivinilpirrolidone-iodio), tiosolfato di sodio e soluzione salina sterile PBS (tampone fosfato salino).
- Lasciare i tessuti oculari e le soluzioni a temperatura ambiente normale, in quanto sono conservate in frigorifero a 4 ° C. Evitare il ripetersi di riscaldamento / raffreddamento cicli. Mantenere i coperchi della soluzione e dei vasi dell'occhio con parte interna rivolta verso l'alto accanto ai loro rispettivi vasi.
- Rimuovere garze e spugne dal vaso degli occhi utilizzando pinze sterili. Immergere il globo in sterile I-PVP 0,5% per 2 minuti per decontaminare i globi oculari. Porre le due pinze sul coperchio del vassoio sterile, fuori del campo sterile. Trasferire il mondo in tiosolfato di sodio 0,1% per 1 minuto con un altro paio di pinze sterili. Utilizzando le pinze stesse, trasferire il globo per il flacone contenente una soluzione salina sterile (PBS) e lasciarlo fino a che non viene azionato. Ripetere la stessa procedura per il globo oculare altro da tegli stesso donatore.
- Lavorare sotto la cappa a flusso laminare d'aria, avvolgere il mondo utilizzando una garza sterile (bende), lasciando la cornea e la sclera circa 5 mm dalla cornea scoperto. Il bulbo oculare può essere semplicemente tenuto in mano mantenere la pressione adeguata. Il tessuto deve essere mantenuto umido durante l'intervento chirurgico intero.
- Pinza vengono utilizzati insieme con le forbici per rimuovere tutte le eventuali resti della congiuntiva. Mantenere gli strumenti utilizzati per l'operazione sopra descritta separato da altri strumenti. Utilizzare una lama di bisturi per eseguire una incisione sclerale di 3-4 mm dalla regione limbus, quindi estendere l'incisione di 360 °, evitando di perforare il tessuto sottostante uveale o causare alcuna deformazione della normale curvatura della cornea. Tagliare quattro grandi incisioni che lasciano quattro piccoli spazi evitando la secrezione del corpo vitreo. Tutte e quattro le lacune vengono tagliati garantendo l'assenza di rimozione di qualsiasi altro tessuto.
- Presenza di piccole placche sclerali può ostacolare il taglio, quindi assicuratevi di complete l'escissione sclerale con le forbici microchirurgia. Questa operazione deve essere effettuata senza danneggiare il corpo coroide, retina e vitreo.
- Controllare l'incisione per assicurarsi che sia completa. Se l'incisione è stata eseguita correttamente i corneo-sclerali cerchio aderisce ai corpi ciliari solo nel punto in corrispondenza della cornea.
- Impostare il globo oculare avvolto in basso vicino al centro del campo sterile. Completa la rimozione corneale mediante pinza per tenere il cerchio sclerale stazionaria e la mano utilizzata per escissione per tirare il corpo ciliare-coroide verso il basso e lontano dalla corneo-sclerale pulsante.
- Separare delicatamente le aderenze rimanenti dalla corneo-sclerale pulsante. Né tirare il corneo-sclerale cerchio in modo che potrebbe causare cross-corneale tensione né consentono di cadere giù sulla camera anteriore.
- La densità delle cellule endoteliali della cornea viene controllata utilizzando una soluzione ipotonica e la mortalità cellulare viene controllata mediante un trypuna colorazione blu per circa 1 min e le cellule vengono quindi contate sotto un microscopio ottico e misurato come cellule / mm 2. La camera anteriore deve essere rivolto verso il coperchio, mentre la parte posteriore deve essere rivolto verso il fondo della piastra Petri. La densità delle cellule endoteliali può essere contato manualmente attraverso una griglia in dell'obiettivo sotto ingrandimento 100X. Il conteggio delle cellule minima accettata per il trapianto in Italia è di 2200 cellule endoteliali / mm 2.
- Trasferire la corneo-sclerale cerchione utilizzando un artiglio corneale precedentemente preparato supporto di memorizzazione corneale conservato a RT (temperatura ambiente) come mostrato nella Tabella 3.
- Esaminare la camera posteriore per un cristallino naturale. Se la sclera viene preparato, rimuovere tutti i residui di uvea e l'umore vitreo dal globo. Scartare con cura e restituire il segmento rimanente posteriore al suo barattolo occhio rispettiva, usando una tecnica asettica. Ripetere la procedura per il globo altro utilizzando nuovi strumenti. Fissare l'arguzia corneah artiglio corneale e mantenere sotto il supporto di memorizzazione (organo coltura) a 31 ° C. La cornea asportata, come mostrato in Figura 1a, può quindi essere utilizzato per cheratoplastica o di ricerca.
- Smaltire i materiali inutili e pericolosi bio-rifiuti in cassonetti appropriati. Pulire l'area di lavoro, una volta completato il lavoro con il 70% a spruzzo alcool isopropilico.
- Se, dopo 28 giorni la cornea mantiene tutti i parametri di valutazione [quali la morfologia, conta cellulare, trasparenza, spessori e test microbiologia - batteri e funghi con BACTEC 9240 strumento (Becton Dickinson, Milano, Italia)], esso può essere trasportato gli ospedali, usando il mezzo di trasporto mostrati in Tabella 4. La cornea deve essere rimosso e collocato dallo stoccaggio al trasporto medio sotto cappa a flusso d'aria laminare.
- Come, durante lo stoccaggio, la cornea diventa più spessa rispetto alle dimensioni solito richiesto per il trapianto, le banche degli occhi utilizzare de-gonfiore agenti per ridurre lo spessore. Noiutilizzare il 6% di destrano T500 per ottenere la cornea torna alla sua dimensione normale in un mezzo di trasporto. Sebbene 4-8% destrano T500 potrebbe essere utilizzato, 6% ha servito meglio per noi. Questo rende più facile per i chirurghi al trapianto della cornea, non appena lo ricevono.
2. L'eviscerazione del Retina dal globo oculare dopo ablazione del Cornea
- Dopo escissione, la cornea viene selezionato per il trapianto o la ricerca in base alla sua morfologia e la densità delle cellule endoteliali e si trova nel mezzo di memorizzazione o di conservazione a 31 ° C. Il rimanente del globo oculare viene quindi elaborato per un ulteriore uso come isolamento sclera fini chirurgici, ecc retina per la ricerca
- Prima di escissione della retina, assicurarsi che il globo oculare è intatto e solo la cornea con una parte della sclera viene rimosso. Se il corpo vitreo gelatinosa è secernendo fuori diventa difficile rimuovere un tessuto retinico.
- Se il donatore è inferiore a 65 anni di età, la sclera èconservati sotto PBS sterile a fini chirurgici dopo test sierologici. In questo caso, la sclera non viene tagliato, solo il corpo vitreo viene rimosso e la sclera tutto viene mantenuto.
- Per escissione della retina, iniziare con un piccolo taglio o incisione della cornea dal lato della sclera verso il nervo ottico, l'uso di pinze e forbici sterili. Tenere la parte della sclera con pinze e tagliare con le forbici dritto verso il nervo ottico di taglio parte per parte evitando di danneggiare il corpo vitreo.
- Placche coroide devono essere separati dalla sclera in quanto sono bloccati insieme. Tagliare la sclera intera per esporre il tessuto coroide. Una volta che la sclera è completamente tagliata, separare la sclera con il resto del corpo vitreo tagliandolo vicino al nervo ottico. Una sfera intero corpo vitreo ricoperto coroide sarà visibile come mostrato in Figura 2a.
- Utilizzando due pinze sterili rimuovere lo strato coroide delicatamente raccoglierlo con unpinza e rimozione con l'altra. In alternativa, lo strato coroide può essere rimossa con le forbici, ma questo dovrebbe idealmente essere evitata in quanto potrebbe causare danni alla retina. Rimuovere lo strato coroide parzialmente e tagliarla a facilitare la rimozione.
- Una volta che lo strato coroide è rimosso, uno strato trasparente di retina si vede chiaramente come mostrato nella Figura 2b. Lo strato coroide membrana ha uno Bruch interna, che può anche essere eliminato, ma è difficile identificare con un occhio nudo.
- Analogamente, utilizzare due pinze per rimuovere lo strato retinico come mostrato in Figura 2c. È facile isolare elevata quantità di retina se escisso vicino al nervo ottico. Tutti gli strati dell'occhio può essere ora visto come mostrato in figura 2d.
- Una volta che il tessuto retinico è stato rimosso, potrebbe essere utilizzata per scopi diversi e quindi le successive fasi e le condizioni utilizzate per la conservazione può variare di conseguenza. Ad esempio,la retina può essere collocato in provette contenenti RNA reagenti stabilizzazione (come RNAlater) o tampone di lisi (per l'estrazione di RNA o DNA), dispasi / tripsina (per l'isolamento di cellule), soluzioni di fissaggio (prima di incorporare tessuti in paraffina o PTOM immunoistochimica).
- Cancella tutto l'area di lavoro e pulire l'area con il 70% a spruzzo alcool isopropilico.
3. Risultati rappresentativi
Il corneo-sclerale cerchio come visto nella figura 1a è una cornea propriamente escisso con quantità richiesta di cerchio sclerale e morfologia endoteliale, questo tipo di cornea viene generalmente utilizzato per cheratoplastica penetrante. Se lo stroma anteriore della cornea asportato è danneggiato con presenza di opacità, la cornea potrebbe essere utilizzato per cheratoplastica endoteliale / posteriore cheratoplastica lamellare (endotelio con una parte di stroma). Considerando che, se lo strato endoteliale è danneggiato o se la densità delle cellule endoteliali è <2200 cellule / mm 2 It (alian standard), la cornea potrebbe essere utilizzata per anteriore cheratoplastica lamellare (epitelio con una parte anteriore di stroma). Se il conteggio delle cellule endoteliali è inferiore al desiderato, la cornea potrebbe essere utilizzata per anteriore cheratoplastica lamellare o di ricerca che, se la cornea è danneggiato completamente, potrebbe essere usato per la ricerca come mostrato in Figura 1b, 3b e 3c o scartato. Il danno potrebbe essere una causa della cattiva gestione del tessuto, prima di interventi chirurgici alla cataratta che portano cicatrici endoteliali stromali o Descemet, lo sviluppo di lesioni fisiche, ecc durante la vita del paziente Pertanto, si rende necessario controllare ogni tessuto con lampada a fessura e poi al microscopio ottico per cicatrici sottili pieghe / / distacchi. La cornea è di solito conservata in due diverse condizioni quali la cultura d'organo (circa 31 ° C), di solito utilizzata nei paesi europei o condizioni di ipotermia (circa 4 ° C) di solito utilizzato negli Stati Uniti. Usiamo cultura organistica in quanto aiuta a rigenerare la digaetà cellule epiteliali, per rivitalizzare controllo delle cellule endoteliali, con un elevato tempo di post mortem, un periodo di conservazione di 4 settimane finestra che dà sufficiente per pianificare un intervento chirurgico, dà il tempo sufficiente per i test microbiologici (batteri e funghi) e sierologici ecc cornea può essere ben conservati nel mezzo di trasporto per 7 giorni.
La sclera può essere tagliato parte per parte garantendo la rimozione delicata di tutte le placche della coroide. Il liquido vitreo può espellere quando il nervo ottico, coroide o retina viene tagliato bruscamente come mostrato nella Figura 4. Retine se asportati per l'analisi dell'RNA deve essere conservata in RNAlater appena i tessuti sono rimossi. Solitamente 1X1 cm della coroide e retina strato viene asportato e dopo conservazione in RNAlater per 24 ore a 4 ° C viene conservato sotto -80 ° C in provette Eppendorf fresco (Safe-Lock provette da 2 ml) fino utilizzati o trasferiti con secco ghiaccio. Il tessuto retinico deve essere asportato con due pinze in prossimità del nervo ottico lontano da iriso margine ciliare per evitare la contaminazione con altre strutture pigmentati e deve essere trasferito nel contenitore preservare immediatamente come RNA ottiene instabile durante il recupero della retina.
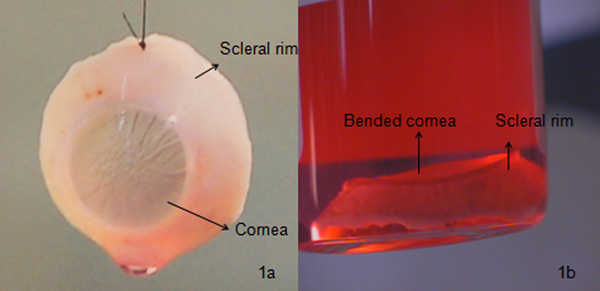
Figura 1 Confronto tra una buona e una cornea scarsa qualità:. A) una cornea correttamente asportato. Tale cornea viene solitamente conservato sotto coltura organo per 4 settimane. Microbiologica (utilizzando BACTEC 9240 strumento) e morfologiche (colorazione delle cellule con trypan blu per la determinazione delle cellule di mortalità e di osservare le cellule al microscopio ottico con ingrandimento 100X) l'esame viene eseguito prima del trasporto in ospedale (Figura 3a), b) una cornea piegato , che finisce per rigetto dell'innesto a causa pieghe alta Descemet e alta danni alle cellule endoteliali esaminato usando un microscopio lampada a fessura. Tale cornea è di solito utilizzato per la research o viene scartato.

Figura 2. Metodo utilizzato per garantire un accurata asportazione del tessuto retinico. A) Uno sguardo all'interno sclera dal globo oculare con lama di 24 millimetri con 95 millimetri curva o le forbici spuntate finali sterili e 100 11x2 mm retti da 0.70 mm Pinza denti sterili. La sclera dovrebbe essere tagliato tenendo un lato con le pinze che il taglio dritto verso il nervo ottico con le forbici. Lo strato coroide sarà ora facilmente visibili; b) L'uso di due 100 11x2 mm retti da 0.70 mm denti pinze sterili, coroide viene rimosso strapparla a parte, che rivela il sottostante strato trasparente della retina; c) trasparente strato retinico viene asportato con molta attenzione nei pressi di il nervo ottico, senza l'escrezione di fluido vitreale con le pinze stesse. Entrambe le pinze dovrebbe contenere entrambi i lati della retina e del tessuto deve essere rimosso con delicatezza starting vicino al nervo ottico verso la cornea, per ottenere una buona quantità di tessuto retinico. Il tessuto può essere tagliato in diverse dimensioni e utilizzato per esperimenti di analisi; d) diversi strati della cornea dell'occhio dopo la rimozione può essere visualizzato in questa figura. Il corpo coroide viene rimosso prima seguita da retina senza danneggiare le altre parti dell'occhio.

Figura 3. Confronto tra diversi tipi di densità e la morfologia cellulare visti sotto ingrandimento 100X di un microscopio ottico. A) buona densità delle cellule endoteliali (> 2200 cellule / mm 2) e la morfologia (meno polimorfismo, degenerazione bassa, non distrofia e 0% mortalità) in una cornea che è adatto al trapianto; b) scarsa densità delle cellule endoteliali (circa 1200 - 1400 cellule / mm 2) e morfologia (polimorfismo molto elevata e Degenperazione di cellule) con circa il 30-40% di mortalità totale sono stati osservati dopo colorazione blu tripano, c) Una parte di cellule endoteliali sono danneggiati a causa di distacco di un foglio endoteliale della cornea durante il recupero dal globo oculare. Ciò è confermato osservando la mortalità delle cellule nella regione tinto trypan blue, d) pieghe Il Descemet si formano a causa della cattiva gestione cornea mediante piegatura, creando croce tensione corneale, utilizzando gli strumenti intensamente etc al momento di escissione. La figura mostra le spesse pieghe sviluppati iatrogene trovati tra la periferia e zona ottica della cornea.
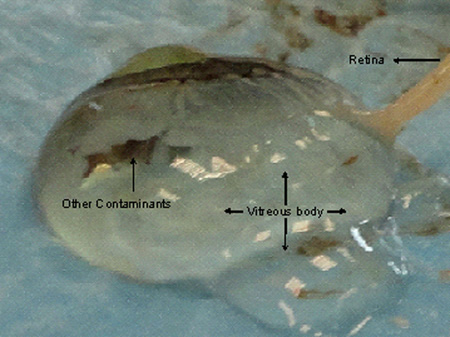
Danni Figura 4. Alla coroide e retina tessuti mentre escissione della cornea, infine, porta a escrezione di fluido vitreo. La retina viene implicato nel corpo vitreo rendendo difficile accise una buona qualità del tessuto wiThout contaminazione.

Tabella 1. Sintesi della gamma delle attività svolte con globi oculari umani nel corso del 2009 e il 2010 presso la Fondazione Banca Degli Occhi (Venezia, Italia). Circa il 60% dei tessuti sono stati utilizzati per i trapianti, lasciando così un elevato numero di globi oculari (circa il 40%) per la ricerca scientifica e medica.
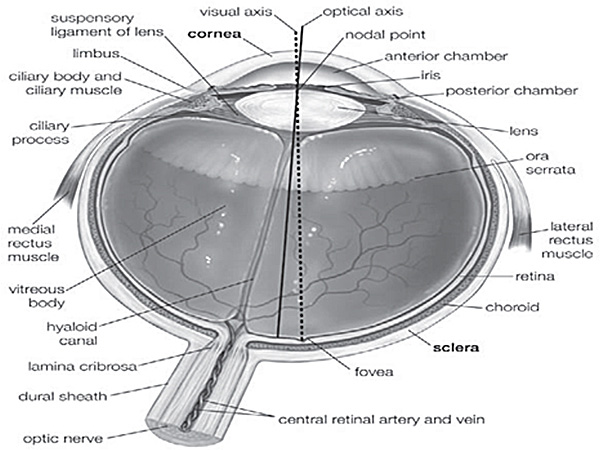
Supplementare Figura 1. Anatomia dell'occhio umano 5. Varie parti dell'occhio umano sono indicati in questa figura, utilizzata per seguire la posizione esatta dei tessuti.
Access restricted. Please log in or start a trial to view this content.
Discussione
Entrambi, l'escissione e la corretta conservazione dei tessuti corneali e retiniche sono fondamentali come difetti minori come il danno endoteliale o elevato numero di pieghe Descemet può portare al fallimento del trapianto di cornea, mentre alterazioni di temperatura o di maltrattamento può compromettere l'integrità dei tessuti retinici. Lo scopo di questo lavoro è quello di mostrare come i tessuti corneali e retiniche possono essere isolate in modo ottimale, senza indurre danni o alterazioni che possono co...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno alcun conflitto di interessi.
Riconoscimenti
Questo lavoro è stato finanziato in parte attraverso borse di studio della Regione Veneto (Ricerca Sanitaria Finalizzata n.292/2008 e la Ricerca Sanitaria Finalizzata 2009). Gli autori ringraziano il dottor C. Griffoni per i dati 2009/2010 riassunto sull'uso dei globi oculari umane.
Access restricted. Please log in or start a trial to view this content.
Materiali
Materiali per l'asportazione della cornea e della retina.
| Name | Company | Catalog Number | Comments |
| Descrizione del prodotto | Dimensioni | Azienda / Istituto | |
| Custodito bisturi monouso | Lama taglia 15 | Swann-Morton | |
| Bende sterili | 5 cm x 5 cm, 8 strati, 5 pezzi | Artsana | |
| Sterile asciugamano usa e getta medica | 35 X 50 cm | U.Jet | |
| Forbici sterili | Lame 24 mm / lunghezza complessiva. 95 mm curvato, smussato | e.janach | |
| Pinza sterile | In acciaio inox -100 mm 11 X 2 governato da 0,70 mm denti | e.janach | |
| Corneale claw - dispositivi medici monouso | NIIOS (Hippocratech) | ||
| Preparativi | |||
| PBS | 100 ml di PBS [10x] in 900 ml d / w (acqua distillata) | Sigma-Aldrich | |
| Na-tiosolfato | 1 gm Na-tiosolfato in 1 litro di PBS [1x] | Sigma-Aldrich | |
| I-PVP | 5 gm I-PVP in 1 litro d / w | Sigma-Aldrich |
Tabella 2. La tabella descrive i materiali utilizzati per escissione della cornea e della retina e la società sono ricevute dal.
Materiali per supporto di memorizzazione (2000 ml).
| Componenti | Fornitore | Numero di catalogo | Concentrazione | Quantità |
| MEM(1X) di liquido | Invitrogen | 32360-034 | 1900 ml | |
| Sodio piruvato | Invitrogen | 11360-039 | 1mM (10 ml / l) | 20 ml |
| L-glutammina | Invitrogen | 25030-032 | 2 mM (10 ml / l) | 20 ml |
| Antibiotico / antimicotico | Sigma-Aldrich | A5955-20ML | 10 ml / l | 20 ml |
| Newborn di siero di vitello | Invitrogen | 26010-74 | 2% (20 ml / l) | 40 ml |
Tabella 3. Materiali per supporto di memorizzazione.
Preparazione del supporto di memorizzazione
Aggiungere tutti gli ingredienti utilizzando le concentrazioni di specifici sopra riportati in un barattolo e mescolare bene. Filtra lorocon dimensione dei pori di 0,2 micron (Millipore, Milano, Italia) con l'aiuto di una pompa peristaltica. Conservare il terreno nelle bottiglie a temperatura ambiente.
Materiali per mezzo di trasporto (2000 ml).
| Componenti | Fornitore | Numero di catalogo | Concentrazione | Quantità |
| MEM (1X) di liquido | Invitrogen | 32360-034 | 1800 ml | |
| Sodio piruvato | Invitrogen | 11360-039 | 1mM (10 ml / l) | 20ml |
| L-glutammina | Invitrogen | 25030-032 | 2 mM (10 ml / l) | 20ml |
| Newborn di siero di vitello | Invitrogen | 26010-74 | 2% (20 ml / l) | 40 ml |
| Destrano T500 | Pharmacosmos | 551005004007 | 6% (60 g / litro) | 120 g / l |
Tabella 4. Materiale per mezzo di trasporto.
Preparazione del mezzo di trasporto
Aggiungi Destrano 6% in ~ 1,5 litri di MEM e lasciare tutta la notte. Aggiungere il resto degli ingredienti nei media e filtrare su 0,2 micron (Millipore, Milano, Italia) utilizzando una pompa a vuoto. Conservare il terreno nelle bottiglie a temperatura ambiente.
Riferimenti
- Fay, A. Diseases of the visual system. Cecil Medicine. Goldman, L., Ausiello, D. , 23rd ed, Saunders Elsevier. Philadelphia, Pa. (2007).
- Parekh, M., Megaw, R., Ray-Chaudhuri, A., Ahmad, S. Patents in Limbal Stem Cell Biology. Recent patents on Regenerative Medicine. 1, 207-212 (2011).
- Pharm, U. S. The Eye: The physiology of human perception. Britannica educational publishing. 36, 19-27 (2011).
- Lang, G. Ophthalmology: A pocket textbook atlas. , 2nd Edition, 115-117 Forthcoming.
- Liesbeth, P. els Organ Culture: The method of choice for preservation of human donor corneas. Br. J. Ophthalmol. 81, 523-525 (1997).
- Meyer, J. S., Howden, S. E., Wallace, K. A., Verhoeven, A. D., Wright, L. S., Capowski, E. E., Pinilla, I., Martin, J. M., Tian, S., Stewart, R., Pattnaik, B., Thomson, J., Gamm, D. M. Optic vesicle-like structures derived from human pluripotent stem cells facilitate a customized approach to retinal disease treatment. Stem Cells. , (2011).
- Trifunovic, D., Karali, M., Camposampiero, D., Ponzin, D., Banfi, S., Marigo, V. A high-resolution RNA expression atlas of retinitis pigmentosa genes in human and mouse retinas. Invest. Ophthalmol. Vis. Sci. 49, 2330-2336 (2008).
- Mora, P., Montanini, L., Ferrari, S. Retina. 30, 1555(2010).
- Claybon, A., Bishop, A. J. R. Dissection of a Mouse Eye for a Whole Mount of the Retinal Pigment Epithelium. J. Vis. Exp. (48), e2563(2011).
- Skeie, J. M., Tsang, S. H., Mahajan, V. B. Evisceration of Mouse Vitreous and Retina for Proteomic Analyses. J. Vis. Exp. (50), e2795(2011).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon