Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Una técnica simplificada para
En este artículo
Resumen
El artículo describe una técnica simplificada para extirpar la córnea y la retina para destripar los tejidos del globo ocular de donantes cadavéricos humanos. La técnica descrita aquí ayudará a tejidos especiales de buena calidad para ser utilizadas para el trasplante, con fines quirúrgicos o de investigación, sin dañar otros tejidos del globo ocular.
Resumen
La enucleación es el proceso de recuperar el globo ocular de un donante cadáver, dejando el resto del mundo sin ser molestados. La escisión se refiere a la recuperación de los tejidos oculares, especialmente la córnea, cortándolo separado del globo ocular. La evisceración es el proceso de eliminación de los órganos internos a que se refiere aquí como la retina. El globo ocular está formado por la córnea, la esclera, el cuerpo vítreo, el cristalino, el iris, la retina, la coroides, etc músculos (Figura Suplemento 1). Cuando un paciente sufre de daños en la córnea, la córnea debe ser eliminado y una sana debe ser trasplantados por cirugías queratoplástico. Los trastornos genéticos o defectos en la función retiniana puede comprometer la visión. Globos oculares humanos puede ser utilizado para diversos procedimientos quirúrgicos, como la banca del ojo, el trasplante de córnea humana o de la esclerótica y la investigación sobre los tejidos oculares. Sin embargo, existe poca información disponible sobre la escisión humana la córnea y la retina, probablemente debido a la laccesibilidad imited a los tejidos humanos. La mayoría de los estudios que describen procedimientos similares se realizan en modelos animales. Los investigadores científicos se basan en la disponibilidad de los tejidos oculares correctamente disecados y bien conservada con el fin de ampliar el conocimiento sobre el desarrollo humano los ojos, la homeostasis y la función. Al recibir gran cantidad de globos oculares fuera de las cuales aproximadamente el 40% (Tabla 1) de ellos se utilizan con fines de investigación, que son capaces de realizar gran cantidad de experimentos en estos tejidos, la definición de las técnicas de los impuestos especiales y preservar de forma regular.
La córnea es un tejido avascular que permite la transmisión de luz en la retina y para este propósito debe mantener siempre un buen grado de transparencia. Dentro de la córnea, la región limbo, que es un depósito de las células madre, ayuda a la reconstrucción de las células epiteliales y restringe el sobrecrecimiento de la conjuntiva mantener la transparencia corneal y la claridad. El tamaño y TH ickness de la córnea son fundamentales para la visión clara, como los cambios en cualquiera de ellos podría dar lugar a distraerse, visión borrosa. La córnea comprende de 5 capas; una) epitelio, b) la membrana de Bowman, c), estroma, d), la membrana de Descemet y e) endotelio. Todas las capas deben funcionar adecuadamente para garantizar una visión clara 4,5,6. La coroides es la túnica intermedia entre la esclerótica y la retina, limita al interior por la membrana de Bruch y es responsable del flujo de sangre en el ojo. El coroides también ayuda a regular la temperatura alimento y suministros a las capas externas de la retina 5,6. La retina es una capa de tejido nervioso que cubre la parte posterior del globo ocular (Figura Supl. 1) y consta de dos partes: una parte fotorreceptora y una parte no receptiva. La retina ayuda a recibir la luz de la córnea y el cristalino y la convierte en la energía química eventualmente en el cerebro con la ayuda del nervio óptico 5,6. ove_content "> El objetivo de este documento es proporcionar un protocolo para la disección de los tejidos de la córnea y la retina de los globos oculares humanos. Evitar la contaminación cruzada con los tejidos adyacentes y la preservación de la integridad del ARN es de una importancia fundamental como tales tejidos son indispensables para fines de investigación dirigidos en (i) la caracterización del transcriptoma de los tejidos oculares, (ii) el aislamiento de células madre para los proyectos de medicina regenerativa, y (iii) la evaluación de las diferencias histológicas entre los tejidos normales del / los sujetos afectados. En este trabajo se describe la técnica que actualmente se utiliza para eliminar la córnea, la coroides, la retina y los tejidos de un globo ocular. A continuación presentamos un protocolo detallado para la disección del globo ocular humano y la escisión de tejidos de la córnea y la retina. El vídeo que acompaña ayudará a los investigadores a aprender una técnica apropiada para la recuperación de preciosos tejidos humanos que son difíciles de encontrar regularmente.
Protocolo
1. En escisión in situ de la córnea a partir de globos oculares
- Conectar la campana de flujo laminar de aire de aproximadamente 15 minutos antes de su uso. Limpie la campana de flujo laminar utilizando el 70% de alcohol isopropílico. Ponga en la ropa de protección personal como gorro quirúrgico y la máscara. Frote las manos y los antebrazos y seque con una toalla estéril. Use guantes estériles y bata o mangas utilizando una técnica aséptica.
- Configure el campo estéril, colocando una bandeja de instrumental estéril de forma aséptica. Verificar que los instrumentos son estériles. Abra el paquete de instrumentos estériles y dar la vuelta en el campo estéril para evitar cualquier contaminación.
- Coloque todos los materiales e instrumentos estériles (Tabla 2) junto con botellas (frascos oculares) que contienen los globos oculares de modo que son adyacentes al borde del campo estéril para facilidad de uso.
- Etiquete las botellas con preservación previamente preparado / medio de almacenamiento como se indica en la Tabla 3 y colocar elm en la superficie de la campana de flujo laminar de aire junto con I-PVP (yodo-polivinilpirrolidona), tiosulfato de sodio y una solución salina estéril PBS (solución salina de tampón fosfato).
- Permita que los tejidos oculares y soluciones para alcanzar la temperatura ambiente normal, ya que se conservan en frigorífico a 4 º C. Evitar una repetición de calentamiento / enfriamiento de los ciclos. Mantenga las tapas de la solución y los tarros con la cara interna del ojo hacia arriba al lado de sus respectivos frascos.
- Retirar gasas y esponjas de la jarra de ojo utilizando unas pinzas estériles. Sumerja el mundo en estériles I-PVP 0,5% durante 2 minutos para descontaminar los globos oculares. Coloque las dos pinzas en la tapa de la bandeja estéril, fuera del campo estéril. Transferir el mundo en tiosulfato de sodio al 0,1% durante 1 minuto con otro par de pinzas estériles. Usando las pinzas mismas, la transferencia del globo a la botella que contiene una solución salina estéril (PBS) y se deja hasta que se opera. Repita el mismo procedimiento para el globo ocular otra a partir de tque un mismo donante.
- Trabajo por debajo de la campana de flujo laminar de aire, envolver el mundo con una gasa estéril (vendas), dejando la córnea y la esclerótica de aproximadamente 5 mm de la córnea al descubierto. El bulbo del ojo podría ser simplemente en la mano se mantiene la presión adecuada. El tejido debe mantenerse húmeda durante toda la cirugía.
- Los fórceps se utilizan junto con las tijeras para eliminar todos los restos posibles de la conjuntiva. Mantenga los instrumentos utilizados para la operación anterior por separado de otros instrumentos. Utilizar una hoja de bisturí para realizar una incisión escleral de 3-4 mm de la región de limbo, a continuación, extender la incisión por 360 °, evitando perforar el tejido uveal subyacente o causar cualquier deformación de curvatura normal de la córnea. Corte cuatro incisiones grandes que salen de cuatro pequeños huecos evitando la secreción del cuerpo vítreo. Las cuatro lagunas están cortadas asegurando que no la eliminación de cualquier otro tejido.
- La presencia de pequeñas placas esclerales puede dificultar el corte, así que asegúrese de borradorlete la escisión escleral con tijeras de microcirugía. Esta operación debe realizarse sin dañar el cuerpo de la coroides, la retina y el vítreo.
- Revise la incisión para asegurarse de que se haya completado. Si la incisión se ha realizado correctamente las corneo-escleral se adhiere a los órganos del borde ciliar sólo en el punto en correspondencia con la córnea.
- Ajuste el globo ocular hacia abajo envuelta cerca del centro del campo estéril. Completar la eliminación de córnea utilizando fórceps para sujetar el borde escleral estacionaria y la mano del utilizado para la escisión para tirar del cuerpo ciliar-coroides hacia abajo y lejos del botón córneo-escleral.
- Suavemente separar las adherencias restantes del botón córneo-escleral. Ni sacar la llanta corneo-escleral en una forma que podría causar la cruz-corneal tensión ni la deje caer hacia abajo en la cámara anterior.
- La densidad de las células endoteliales de la córnea se comprueba mediante una solución hipotónica y la mortalidad celular se comprueba utilizando un trypuna tinción con azul de alrededor de 1 min y las células se cuentan entonces bajo un microscopio óptico y se mide como células / mm 2. La cámara anterior debe hacer frente a la tapa, mientras que el posterior debe hacer frente a la parte inferior de la placa de Petri. La densidad de células endoteliales podrían ser contados manualmente usando una rejilla en el objetivo en un aumento de 100X. El mínimo número de aceptados para el trasplante de células en Italia es de 2200 células endoteliales / mm 2.
- Transferir el borde córneo-escleral utilizando una garra córnea a medio previamente preparado almacenamiento corneal conservado a temperatura ambiente (temperatura ambiente) como se muestra en la Tabla 3.
- Examine la cámara posterior de una lente cristalino natural. Si la esclerótica se prepara, eliminar todos los residuos de la úvea y el humor vítreo del globo. Desenrolle cuidadosamente y devolver el resto del segmento posterior del ojo a su bote correspondiente, utilizando una técnica aséptica. Repita el procedimiento para el mundo sí mediante nuevos instrumentos. Fijar el ingenio de la córneah córnea garra y preservar en los medios de almacenamiento (cultivo de órganos) a 31 ° C. La córnea extirpada, como se muestra en la Figura 1a, a continuación, se puede utilizar para queratoplastia o de investigación.
- Deseche los materiales innecesarios y los residuos biológicos peligrosos en los contenedores de desechos apropiados. Limpie el área de trabajo una vez que el trabajo se completa con un 70% aspersión de alcohol isopropílico.
- Si, después de 28 días la córnea mantiene todos los parámetros de evaluación [tales como la morfología, conteo de células, la transparencia, el grosor y las pruebas de microbiología - bacterias y hongos usando Bactec 9240 instrumento (Becton Dickinson, Milán, Italia)], que puede ser transportado a la los hospitales, utilizando el medio de transporte se muestra en la Tabla 4. La córnea debe ser retirado y colocado en el almacenamiento para transportar medio bajo campana de flujo laminar de aire.
- Como, durante el almacenamiento, la córnea se hace más gruesa que su tamaño usual requerido para el trasplante, los bancos de ojos utilizar dispositivos hinchables en agentes para reducir el espesor. Nosotrosel 6% de dextrano T500 para conseguir la córnea vuelve a su tamaño normal en un medio de transporte. Aunque 4-8% de dextrano T500 podría ser utilizado, el 6% ha servido mejor por nosotros. Esto hace que sea más fácil para los cirujanos de trasplante de la córnea tan pronto como lo reciba.
2. La evisceración de la retina del globo ocular después de la eliminación de la córnea
- Tras la escisión, la córnea se selecciona para el trasplante o de investigación en base a su morfología y la densidad de células endoteliales y se coloca en el medio de almacenamiento o conservación a 31 ° C. El restante del globo ocular se procesa a continuación para su uso posterior como el aislamiento esclerótica para fines quirúrgicos, la retina para investigación, etc
- Antes de la escisión de retina, asegurarse de que el globo ocular está intacta y sólo la córnea con una parte de la esclerótica se elimina. Si el cuerpo vítreo gelatinoso es secretar a cabo se hace difícil eliminar un tejido de la retina.
- Si el donante está por debajo de 65 años de edad, la esclerótica esconservado en PBS estéril para uso quirúrgico después de las pruebas serológicas. En este caso, la esclerótica no se corta, sólo el cuerpo vítreo se retira y la esclerótica entera se conserva.
- Para la escisión de retina, comenzar con un pequeño corte o incisión del lado de la córnea de la esclera avanzar hacia el nervio óptico, utilizando pinzas y tijeras estériles. Sostenga la parte de la esclerótica con las pinzas y cortar con las tijeras en línea recta hacia el nervio óptico cortar parte por parte para evitar daños en el cuerpo vítreo.
- Placas coroideas debe ser separado de la esclerótica, ya que están pegadas. Cortar la esclerótica entero para exponer el tejido coroides. Una vez que la esclerótica se corta completamente, separar la esclerótica con el resto del cuerpo vítreo cortándolo cerca del nervio óptico. Una bola de todo el cuerpo vítreo cubierto de coroides será visible, como se muestra en la Figura 2a.
- El uso de dos pinzas estériles quitar la capa de la coroides con cuidado al escoger para arriba con unapar de fórceps y retirarla con la otra. Alternativamente, la capa de la coroides se pueden eliminar con unas tijeras pero que idealmente deberían evitarse ya que puede causar daños a la retina. Retire la capa de la coroides y la cortó en parte para facilitar la eliminación.
- Una vez que la capa coroidea se elimina, una capa transparente de la retina se verá claramente como se muestra en la Figura 2b. La capa de la coroides tiene una membrana de Bruch interior, que también podría ser eliminado, pero es difícil de identificar a simple vista.
- Asimismo, el uso de dos pinzas para eliminar la capa retiniana como se muestra en la Figura 2c. Es fácil de aislar alta cantidad de retina si extirpado cerca del nervio óptico. Todas las capas del ojo puede ser visto ahora como se muestra en la Figura 2d.
- Una vez que el tejido de la retina se ha eliminado, podría ser usada para fines diferentes y por lo tanto, los pasos subsiguientes y condiciones utilizados para la conservación puede variar en consecuencia. Por ejemplo,el tejido de la retina se puede colocar en tubos que contienen ARN reactivos estabilización (como RNAlater) o tampón de lisis (para la extracción de ARN o ADN), dispasa / tripsina (para el aislamiento de las células), las soluciones de fijación (antes de incrustar los tejidos en parafina o octubre para inmunohistoquímica).
- Borrar todo el área de trabajo y limpiar el área con el 70% de pulverización alcohol isopropílico.
3. Los resultados representativos
El borde córneo-escleral como se ve en la Figura 1a es una córnea correctamente escindió con la cantidad requerida de borde escleral y morfología endotelial, este tipo de córnea se usa generalmente para queratoplastia penetrante. Si el estroma anterior de la córnea dañada se escindió con la presencia de opacidad, la córnea se podría utilizar para queratoplastia endotelial / queratoplastia lamelar posterior (endotelio con una parte de estroma). Considerando que, si la capa endotelial está dañada o si la densidad de células endoteliales es <2200 células / mm 2 It (Alian estándar), la córnea se podría utilizar para queratoplastia lamelar anterior (epitelio con una parte de estroma anterior). Si el recuento de células endoteliales es menor que la requerida, la córnea se podría utilizar para queratoplastia lamelar anterior o de investigación que, si la córnea está dañada por completo, que podría ser utilizado para la investigación como se muestra en la Figura 1b, 3b y 3c o desechado. El daño podría ser una causa de mal manejo del tejido, antes de cirugías de cataratas que conducen a cicatrices endoteliales del estroma o Descemet, el desarrollo de lesiones físicas durante etc la vida del paciente Por lo tanto, se hace necesario comprobar todos los tejidos con lámpara de hendidura y luego bajo microscopio óptico para cicatrices finas o pliegues o desprendimientos. La córnea suele estar conservada bajo dos condiciones diferentes tales como el cultivo de órganos (aproximadamente 31 ° C) suelen utilizar en los países de Europa o las condiciones de hipotermia (aproximadamente 4 ° C) por lo general utilizados en los EE.UU.. Nuestro método de cultivo de órganos, ya que ayuda a regenerar la presaedad las células epiteliales, para revitalizar las células endoteliales de verificación con un alto cargo el tiempo mortem, un período de almacenamiento de 4 semanas, lo que da la ventana suficiente para planificar una cirugía, le da tiempo suficiente para los análisis microbiológicos (bacterias y hongos) y serológicos, etc La córnea puede ser bien conservados en el medio de transporte durante 7 días.
La esclerótica se podía cortar parte por parte asegurar la eliminación suave de todas las placas de la coroides. El líquido vítreo pueden excretar cuando el nervio óptico, la coroides o de la retina se corta bruscamente como se muestra en la Figura 4. Retinas si extirpados para el análisis de ARN debe ser preservada en RNAlater tan pronto como los tejidos son extirpados. Por lo general, 1X1 cm de la coroides y la retina se extirpa la capa y después de mantenerla en RNAlater durante 24 horas a 4 ° C se mantiene en -80 ° C en tubos Eppendorf frescas (Safe-Lock tubos de 2 ml) hasta su uso o que se expidan con la seca hielo. El tejido de la retina debe ser extirpado mediante dos pinzas de cerca del nervio óptico fuera de iriso margen ciliar para evitar la contaminación con otras estructuras pigmentadas y debe ser transferido al recipiente preservar inmediatamente como ARN obtiene inestable al recuperar la retina.
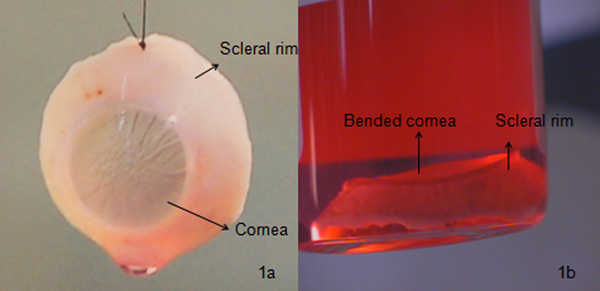
Figura 1 Comparación entre una buena y una mala calidad de la córnea: a.) Una córnea correctamente extirpado. Esta córnea suele estar conservada en cultivo de órganos durante 4 semanas. Microbiológicos (usando Bactec 9240 instrumentos) y morfológica (tinción de las células con azul tripán para la determinación de la mortalidad celular y la observación de las células bajo un microscopio óptico con un aumento de 100X) el examen se lleva a cabo antes de transportarlo al hospital (Figura 3a), b) una córnea doblada , que finalmente conduce a un rechazo del injerto debido a los pliegues de alta de Descemet y el daño de las células endoteliales de alta examinados con un microscopio con lámpara de hendidura. Esta córnea se usa generalmente para resolución deearch o se desecha.

Figura 2. Método utilizado para garantizar una escisión precisa del tejido de la retina. A) La disección de la esclera del globo ocular con hoja de 24 mm con 95 mm de curva o tijeras de punta roma finales estériles y 100 mm 11x2 gobernados por 0.70 mm pinza de dientes estériles. La esclerótica se debe cortar por sosteniendo un lado con las pinzas que cortar en línea recta hacia el nervio óptico con las tijeras. La capa coroidea ahora se ve fácilmente, b) El uso de dos de 100 mm 11x2 gobernados por 0.70 mm de los dientes con fórceps estériles, la coroides se separa por destrozarlo, lo que pone de manifiesto la subyacente capa de la retina transparente; c) la capa de la retina transparente se extirpa con mucho cuidado cerca de el nervio óptico sin excreción de fluido vítreo utilizando las pinzas mismos. Tanto las pinzas debe sostener cada lado de la retina y el tejido suavemente debe ser retirado starting cerca del nervio óptico en movimiento hacia la córnea, para obtener una buena cantidad de tejido de la retina. El tejido puede ser cortado en diferentes tamaños y utilizado para los experimentos de análisis, d) las diferentes capas del ojo tras la retirada de córnea se puede ver en esta figura. El cuerpo coroides se elimina primero seguido de la retina sin dañar las otras partes del ojo.

Figura 3. Comparación de los diferentes tipos de densidad celular y la morfología se observa bajo un aumento de 100X de un microscopio óptico. Una) buena densidad de células endoteliales (> 2200 células / mm 2) y la morfología (menos polimorfismo, la degeneración baja, distrofia no y 0% mortalidad) en una córnea que es adecuado para el trasplante, b) la densidad de células endoteliales pobre (aproximadamente 1200 - 1400 células / mm 2) y la morfología (polimorfismo muy alta y Degenración de las células), junto con aproximadamente el 30-40% de mortalidad general se observan después de tinción con azul de tripano, c) Una parte de las células endoteliales se dañan debido al desprendimiento de una capa de endotelio, mientras que la recuperación de la córnea del globo ocular. Esto se confirma por la observación de la mortalidad de las células en la región por manchado azul de tripano, d) El pliegues de Descemet se forman debido al uso indebido de la córnea por la flexión, creando una tensión córnea transversal, utilizando los instrumentos, etc intensamente en el momento de la escisión. La figura muestra los gruesos pliegues desarrollados iatrogénicas se encuentran entre la periferia y zona óptica de la córnea.
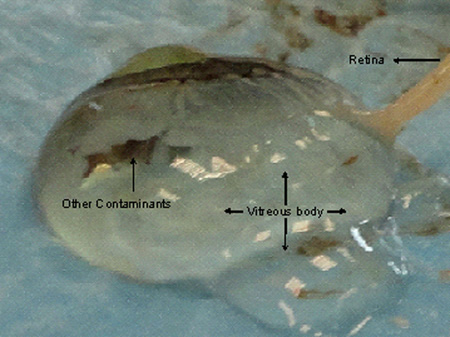
Daños Figura 4. A la coroides, la retina y los tejidos, mientras que la escisión de la córnea con el tiempo conduce a la excreción de líquido vítreo. La retina se implicado en el cuerpo vítreo lo que hace difícil para escindir una buena calidad de los tejidos wiThout contaminación.

Tabla 1. Resumen de la gama de actividades realizadas con globos oculares humanos durante 2009 y 2010 a la Fundación Banca Degli Occhi (Venezia, Italia). Aproximadamente el 60% de los tejidos se utilizan para el trasplante, dejando así un gran número de globos oculares (40%) para la investigación científica y médica.
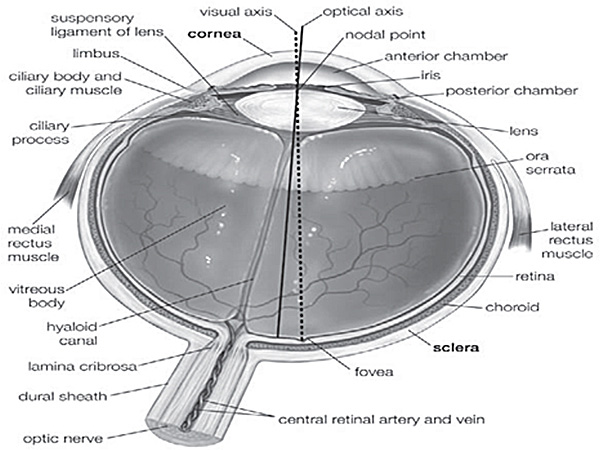
Complementario Figura 1. Anatomía del ojo humano 5. Diferentes partes de ojo humano se indican en esta figura, utilizado para seguir la posición exacta de los tejidos.
Access restricted. Please log in or start a trial to view this content.
Discusión
Ambos, la escisión correcta y adecuada conservación de los tejidos de la córnea y la retina son críticos, como los defectos de menor importancia tales como el daño endotelial o elevado número de pliegues de Descemet puede conducir al fracaso del injerto de córnea, mientras que las alteraciones de temperatura o mal manejo puede poner en peligro la integridad de los tejidos retina. El objetivo de este trabajo es mostrar cómo los tejidos corneales y retinianas se pueden aislar de manera óptima, sin provocar daños...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no tienen conflicto de intereses.
Agradecimientos
Este trabajo fue apoyado en parte por subvenciones de la Regione Veneto (Ricerca Sanitaria Finalizzata n.292/2008 y Ricerca Sanitaria Finalizzata 2009). Los autores agradecen al Dr. C. Griffoni para los datos de 2009/2010 de resumen sobre el uso de globos oculares humanos.
Access restricted. Please log in or start a trial to view this content.
Materiales
Materiales para la escisión de la córnea y la retina.
| Name | Company | Catalog Number | Comments |
| Descripción del producto | Dimensiones | Empresa / Instituto | |
| Vigilado bisturí desechable | Hoja tamaño 15 | Swann-Morton | |
| Vendajes estériles | 5 cm x 5 cm, 8 capas, 5 piezas | Artsana | |
| Estéril toalla médica desechable | 35 X 50 cm | U.Jet | |
| Tijeras estériles | Hojas de 24 mm / longitud total. 95 mm de curvas, romas | e.janach | |
| Pinzas estériles | De acero inoxidable de 11 mm -100 x 2 gobernado por los dientes de 0.70 mm | e.janach | |
| Corneal garras - de dispositivos médicos desechables | NIIOS (Hippocratech) | ||
| Preparativos | |||
| PBS | 100 ml de PBS [10x] en 900 ml de D / W (agua destilada) | Sigma-Aldrich | |
| Na-tiosulfato | 1 g de Na-tiosulfato en 1 litro de PBS [1x] | Sigma-Aldrich | |
| I-PVP | 5 g de PVP-I en 1 litro D / W | Sigma-Aldrich |
Tabla 2. La tabla se describen los materiales utilizados para la escisión de la córnea y la retina y la compañía son recibidos desde.
Materiales para medio de almacenamiento (2000 ml).
| Componentes | Proveedor | Número de catálogo | Concentración | Cantidad |
| MEM(1X) líquida | Invitrogen | 32360-034 | 1900 ml | |
| Piruvato de sodio | Invitrogen | 11360-039 | 1mM (10 ml / l) | 20 ml |
| L-glutamina | Invitrogen | 25030-032 | 2 mM (10 ml / l) | 20 ml |
| Antibiótico / antimicótico | Sigma-Aldrich | A5955-20ML | 10ml / l | 20 ml |
| Suero de ternero recién nacido | Invitrogen | 26010-74 | 2% (20 ml / l) | 40 ml |
Tabla 3. Materiales para soporte de almacenamiento.
Preparación del medio de almacenamiento
Añadir todos los ingredientes que utilizan las concentraciones específicas dadas anteriormente en un frasco y mezcle bien. Filtrarlosusando tamaño de poro de 0,2 micras (Millipore, Milán, Italia) con ayuda de una bomba peristáltica. Preservar el medio en las botellas a temperatura ambiente.
Materiales para el medio de transporte (2000 ml).
| Componentes | Proveedor | Número de catálogo | Concentración | Cantidad |
| MEM (1X) líquida | Invitrogen | 32360-034 | 1800 ml | |
| Piruvato de sodio | Invitrogen | 11360-039 | 1mM (10 ml / l) | 20 ml |
| L-glutamina | Invitrogen | 25030-032 | 2 mM (10 ml / l) | 20 ml |
| Suero de ternero recién nacido | Invitrogen | 26010-74 | 2% (20 ml / l) | 40 ml |
| El dextrano T500 | Pharmacosmos | 551005004007 | 6% (60 g / litro) | 120 g / l |
Tabla 4. El material para el medio de transporte.
Preparación del medio de transporte
Añadir dextrano al 6% en alrededor de 1,5 litro de MEM y deja toda la noche. Añadir el resto de ingredientes en los medios de comunicación y filtrar con filtro de 0,2 micras (Millipore, Milán, Italia), utilizando una bomba de vacío. Preservar el medio en las botellas a temperatura ambiente.
Referencias
- Fay, A. Diseases of the visual system. Cecil Medicine. Goldman, L., Ausiello, D. , 23rd ed, Saunders Elsevier. Philadelphia, Pa. (2007).
- Parekh, M., Megaw, R., Ray-Chaudhuri, A., Ahmad, S. Patents in Limbal Stem Cell Biology. Recent patents on Regenerative Medicine. 1, 207-212 (2011).
- Pharm, U. S. The Eye: The physiology of human perception. Britannica educational publishing. 36, 19-27 (2011).
- Lang, G. Ophthalmology: A pocket textbook atlas. , 2nd Edition, 115-117 Forthcoming.
- Liesbeth, P. els Organ Culture: The method of choice for preservation of human donor corneas. Br. J. Ophthalmol. 81, 523-525 (1997).
- Meyer, J. S., Howden, S. E., Wallace, K. A., Verhoeven, A. D., Wright, L. S., Capowski, E. E., Pinilla, I., Martin, J. M., Tian, S., Stewart, R., Pattnaik, B., Thomson, J., Gamm, D. M. Optic vesicle-like structures derived from human pluripotent stem cells facilitate a customized approach to retinal disease treatment. Stem Cells. , (2011).
- Trifunovic, D., Karali, M., Camposampiero, D., Ponzin, D., Banfi, S., Marigo, V. A high-resolution RNA expression atlas of retinitis pigmentosa genes in human and mouse retinas. Invest. Ophthalmol. Vis. Sci. 49, 2330-2336 (2008).
- Mora, P., Montanini, L., Ferrari, S. Retina. 30, 1555(2010).
- Claybon, A., Bishop, A. J. R. Dissection of a Mouse Eye for a Whole Mount of the Retinal Pigment Epithelium. J. Vis. Exp. (48), e2563(2011).
- Skeie, J. M., Tsang, S. H., Mahajan, V. B. Evisceration of Mouse Vitreous and Retina for Proteomic Analyses. J. Vis. Exp. (50), e2795(2011).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados