Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Упрощенная Техника
В этой статье
Резюме
В статье описывается упрощенная техника акцизного роговицы и сетчатки потрошить тканей глазной шар трупа человека доноров. Техника, описанная здесь поможет акцизного хорошее качество ткани использовать для трансплантации, хирургическому или исследовательских целей, не повреждая другие ткани глазного шара.
Аннотация
Enucleation is the process of retrieving the ocular globe from a cadaveric donor leaving the rest of the globe undisturbed. Excision refers to the retrieval of ocular tissues, especially cornea, by cutting it separate from the ocular globe. Evisceration is the process of removing the internal organs referred here as retina. The ocular globe consists of the cornea, the sclera, the vitreous body, the lens, the iris, the retina, the choroid, muscles etc (Suppl. Figure 1). When a patient is suffering from corneal damage, the cornea needs to be removed and a healthy one must be transplanted by keratoplastic surgeries. Genetic disorders or defects in retinal function can compromise vision. Human ocular globes can be used for various surgical procedures such as eye banking, transplantation of human cornea or sclera and research on ocular tissues. However, there is little information available on human corneal and retinal excision, probably due to the limited accessibility to human tissues. Most of the studies describing similar procedures are performed on animal models. Research scientists rely on the availability of properly dissected and well-conserved ocular tissues in order to extend the knowledge on human eye development, homeostasis and function. As we receive high amount of ocular globes out of which approximately 40% (Table 1) of them are used for research purposes, we are able to perform huge amount of experiments on these tissues, defining techniques to excise and preserve them regularly.
The cornea is an avascular tissue which enables the transmission of light onto the retina and for this purpose should always maintain a good degree of transparency. Within the cornea, the limbus region, which is a reservoir of the stem cells, helps the reconstruction of epithelial cells and restricts the overgrowth of the conjunctiva maintaining corneal transparency and clarity. The size and thickness of the cornea are critical for clear vision, as changes in either of them could lead to distracted, unclear vision. The cornea comprises of 5 layers; a) epithelium, b) Bowman's layer, c) stroma, d) Descemet's membrane and e) endothelium. All layers should function properly to ensure clear vision4,5,6. The choroid is the intermediate tunic between the sclera and retina, bounded on the interior by the Bruch's membrane and is responsible for blood flow in the eye. The choroid also helps to regulate the temperature and supplies nourishment to the outer layers of the retina5,6. The retina is a layer of nervous tissue that covers the back of the ocular globe (Suppl. Figure 1) and consists of two parts: a photoreceptive part and a non-receptive part. The retina helps to receive the light from the cornea and lens and converts it into the chemical energy eventually transmitted to the brain with help of the optic nerve5,6.
The aim of this paper is to provide a protocol for the dissection of corneal and retinal tissues from human ocular globes. Avoiding cross-contamination with adjacent tissues and preserving RNA integrity is of fundamental importance as such tissues are indispensable for research purposes aimed at (i) characterizing the transcriptome of the ocular tissues, (ii) isolating stem cells for regenerative medicine projects, and (iii) evaluating histological differences between tissues from normal/affected subjects. In this paper we describe the technique we currently use to remove the cornea, the choroid and retinal tissues from an ocular globe. Here we provide a detailed protocol for the dissection of the human ocular globe and the excision of corneal and retinal tissues. The accompanying video will help researchers to learn an appropriate technique for the retrieval of precious human tissues which are difficult to find regularly.
протокол
1. В местах иссечения роговицы от глазных глобус
- Включите ламинарного потока воздуха шкаф примерно 15 минут перед использованием. Очистите капот ламинарного потока с использованием 70% изопропилового спирта. Положите на индивидуальную защитную одежду, таких как хирургические шапки и маски. Скраб для рук и предплечий и вытереть их насухо стерильной салфеткой. Носите стерильные перчатки и халат или рукава использованием асептических условиях.
- Настройка стерильной зоне, поставив стерильный лоток инструмент стерильно. Убедитесь, что инструменты стерильны. Откройте стерильный пакет инструментов и щелкнуть на поле стерильными избежать любого загрязнения.
- Поместите все стерильные материалы и инструменты (табл. 2), а также бутылки (банки глаз), содержащий глаз шары так, чтобы они примыкают к краю стерильной зоны для удобства использования.
- Этикетка бутылки с заранее подготовленного сохранение / носителе, как это указано в таблице 3 и поместитем на поверхности ламинарного потока воздуха капотом вместе с I-ПВП (поливинилпирролидон йода), тиосульфата натрия и стерильным физиологическим раствором PBS (фосфатный буфер солевом растворе).
- Позвольте глазные ткани и решений для достижения нормальной комнатной температуре, поскольку они хранятся в холодильниках при температуре 4 ° C. Избегайте повторных потепление / циклов охлаждения. Держите крышки решения и глаз банки с внутренней стороной вверх рядом с их банками.
- Удаление сетки и губки от глаз банке стерильным пинцетом. Погрузитесь мире в стерильный I-PVP 0,5% в течение 2 минут для очистки глазных глобусы. Поместите два пинцета на крышке стерильный лоток, вне стерильной зоны. Передача мира в тиосульфата натрия 0,1% в течение 1 минуты с помощью другой пары стерильных щипцов. Используя те же щипцы, передает земного шара, чтобы флакон, содержащий стерильный физиологический раствор (PBS) и оставить его, пока он работает. Повторите ту же процедуру для другого мира глазных от тон же донора.
- Рабочие под капотом поток воздуха ламинарным, обернуть земной шар стерильные марлевые (бандажи), оставляя роговицы и около 5 мм склеры с роговицей раскрыты. Глаза лампы можно просто держать в руке поддержания нормального давления. Ткань должна быть влажной в течение всего операция.
- Щипцы используются вместе с ножницами, чтобы удалить все возможные остатки конъюнктивы. Держите инструменты, используемые для этой операции отдельно от других инструментов. Используйте лезвие скальпеля для выполнения разреза склеры в 3-4 мм от лимба регионе, то расширить разрез на 360 °, не допуская к перфорации основного увеальной ткани или вызывать деформацию нормальной кривизны роговицы. Отрежьте четыре больших разрезов оставив четыре небольших недостатков избежать выделения стекловидного тела. Все четыре пробелы вырезаются обеспечение не удаление любых других тканей.
- Наличие небольшого склеры бляшки могут помешать резки, поэтому убедитесь, что компЛете склеры вырезание ножницами микрохирургии. Эта операция должна быть выполнена без повреждения сосудистой оболочки, сетчатки и стекловидного тела.
- Проверьте разрез чтобы убедиться в его полной. Если разрез был выполнен правильно Corneo-склеры обода придерживается цилиарного тела только в точке в соответствии с роговицы.
- Установить завернутый глазной шар вниз рядом с центром стерильной зоне. Завершите удаление роговицы с помощью щипцов для хранения склеры обода стационарных и рука используется для удаления тянуть цилиарного тела, сосудистую оболочку вниз и от склеры Corneo-кнопку.
- Аккуратно отделить оставшиеся спайки с Corneo-склеры кнопку. Ни вытащить Corneo-склеры край таким образом, что может привести к перекрестной роговицы напряжения, ни позволить ей бросить вниз на передней камере.
- Эндотелиальных плотность клеток роговицы проверяется с помощью гипотонического раствора и клетка смертность проверяется с помощью Trypсиняя окраска около 1 мин, и клетки, затем учитываются в оптический микроскоп и измеряется как клеток / мм 2. Передняя камера должна быть обращена к крышке, а задние приходится сталкиваться в нижней части чашки Петри. Эндотелиальные клетки плотности можно пересчитать вручную с помощью сетки в цель при увеличении 100х. Минимальная принято клеток для трансплантации в Италии составляет 2200 эндотелиальных клеток / мм 2.
- Передача Corneo-склеры обода использованием роговицы когтей на заранее подготовленные роговицы носителе сохраняется при комнатной температуре (комнатной температуры), как показано в таблице 3.
- Проверьте заднюю камеру для естественного хрусталика. Если склеры готово, удалите все остатки сосудистая оболочка глазного яблока и стекловидного тела с земной шар. Осторожно развернуть и вернуть оставшуюся заднюю часть с соответствующим банка глаз, с использованием асептических условиях. Повторите процедуру для других миру с помощью новых инструментов. Закрепите роговицы остроумиеч роговицы когтей и сохранить под носители (орган культуры) при 31 ° C. Вырезали роговицы, как показано на рисунке 1а, могут быть использованы для кератопластики или исследования.
- Утилизировать ненужных материалов и биологически опасных отходов в соответствующие мусорные баки. Очистите рабочую область после завершения работ с использованием 70% изопропиловый спирт спрей.
- Если после 28 дней роговица сохраняет все оценки параметров [такие, как морфология, клеток, прозрачности, толщины и микробиологии тестов - бактериальные и грибковые использовании инструмент Bactec 9240 (Becton Dickinson, Милан, Италия)], это могут быть доставлены в больницы использованием транспортной среды приведены в таблице 4. Роговицы должны быть удалены и помещены на хранение в транспортную среду в ламинарный шкаф воздушного потока.
- Как во время хранения, роговица становится более толстым, чем его обычный размер необходимых для трансплантации глаза банки используют де-набухание агентов уменьшить толщину. Мыиспользовать 6% декстрана T500, чтобы получить роговицы обратно в нормальный размер, в транспортной среды. Хотя 4-8% декстрана T500 может быть использован, 6% послужило для нас лучше. Это облегчает для хирургов пересадки роговицы, как только они получают его.
2. Потрошение сетчатки от глазных Globe после вырезания роговицы
- После удаления, роговицы выбран для трансплантации или исследования, основанные на морфологии и эндотелиальных клеток и плотность находится в хранении и сохранение среды при 31 ° C. Остальные глазного миру затем обрабатывается для дальнейшего использования, такие как изоляция склеры для хирургических целей, сетчатки для исследований и т.д.
- До удаления сетчатки, убедитесь, что глазные мире цела, и только роговица с частью склеры удаляется. Если желатиновых стекловидным телом является выделять из этого становится трудно удалить ткани сетчатки.
- Если донор находится ниже 65 лет, склерысохраняется при стерильной PBS для хирургических целей после серологического тестирования. В этом случае, склеры не вырезано, только в стекловидное тело удаляется, а все склеры сохраняется.
- Для удаления сетчатки, начните с небольшой разрез или разрез от роговицы сторону склеры движется в направлении зрительного нерва использованием стерильного пинцета и ножниц. Держите части склеры с помощью щипцов и вырезать ножницами прямо к зрительному нерву резка по частям избежать повреждения стекловидного тела.
- Хориоидеи таблички должны быть отделены от склеры, как они слиплись. Вырезать все склеры, чтобы разоблачить сосудистой ткани. После того, склера полностью вырезать, отделить склеры с остальными стекловидного тела за счет сокращения его рядом зрительного нерва. Весь шар стекловидного тела покрыта сосудистой будет видно, как показано на рисунке 2а.
- Использование двух стерильных щипцов удалите слой сосудистой оболочки осторожно поднять его с однимПара щипцов и удаления его с другими. Кроме того, сосудистого слоя можно удалить с помощью ножниц, но это в идеале должны избегать, так как это может привести к повреждению сетчатки. Удалите слой сосудистой оболочки частично и разрезать его, чтобы облегчить удаление.
- После того, сосудистое слой удаляется, прозрачный слой сетчатки будет хорошо видно, как показано на рисунке 2б. Сосудистого слоя мембраны Бруха интерьера, которые могут быть удалены, но это трудно определить ее невооруженным глазом.
- Кроме того, использование двух щипцы для удаления сетчатки слой, как показано на рисунке 2в. Легко выделить большое количество сетчатки, если вырезали около зрительного нерва. Все слои глаза можно теперь рассматривать как показано на рисунке 2-й.
- После того, ткани сетчатки была удалена, она может быть использована для различных целей и, следовательно, последующие шаги и условия, используемые для сохранения могут отличаться соответственно. Например,ткани сетчатки могут быть помещены в пробирки, содержащие РНК стабилизации реагенты (например, RNAlater) или лизис буфера (для экстракции РНК или ДНК), dispase / трипсина (для выделения клеток), крепежные решения (до вставлять тканей в парафин или октябре для иммуногистохимии).
- Очистить все рабочую зону и очистить территорию с использованием 70% изопропиловый спирт спрей.
3. Представитель Результаты
Corneo-склеры край, как показано на рисунке 1а правильно вырезали роговицы с необходимым количеством склеры обода и эндотелиальных морфологии, этот вид роговицы, как правило, используются для сквозной кератопластики. Если передняя стромы роговицы вырезали поврежден при наличии прозрачности, роговица может быть использован для эндотелиальной кератопластики / задние пластинчатые кератопластики (эндотелий с частью стромы). Принимая во внимание, если эндотелиальные слой поврежден или, если эндотелиальные клетки плотностью <2200 клеток / мм 2 (онаАлеан стандарт), роговицы могут быть использованы для передних кератопластика пластинчатые (эпителий с частью передней стромы). Если количество клеток эндотелия меньше, чем требуется, роговицы могут быть использованы для передних пластинчатые кератопластика или исследования в то время как, если роговица повреждена полностью, она может быть использована для исследования, как показано на рисунке 1б, 3б и 3в или выбросить. Ущерб может быть причиной неправильной ткани, до операции катаракты приводит к стромальные или десцеметовой эндотелиальных шрамов, развитию физической травмы в течение жизни и т.д. пациента Таким образом, возникает необходимость проверить каждую ткань с щелевой лампой, а затем под оптическим микроскопом штрафа шрамы / складки / отрядов. Роговицы, как правило, сохраняется при двух различных условиях, таких как органной культуры (около 31 ° C) обычно используется в европейских странах или гипотермия условиях (около 4 ° С) обычно используется в США. Мы используем органной культуры, поскольку это помогает восстанавливать плотинувозраста эпителиальные клетки, чтобы вновь оживить эндотелиальные клетки проверки с высоким время после смерти, срок хранения 4 недели, что дает достаточный окно для планирования операции, дает достаточно времени для микробиологических (бактерий и грибков) и серологическое тестирование и т.д. роговицы могут быть также сохранены в транспортной среде в течение 7 дней.
Склеры могут быть сокращены по частям обеспечения нежного удаления всех хориоидеи бляшек. Стекловидной жидкости могут выделять при зрительного нерва, сосудистого или сетчатки резко сократить, как показано на рисунке 4. Сетчатки, если вырезали для анализа РНК должна быть сохранена в RNAlater как только ткань вырезали. Обычно 1X1 см от сосудистой оболочки и сетчатки слой вырезали и, продержав его в RNAlater в течение 24 часов при температуре 4 ° С сохраняется при -80 ° С в свежих труб Эппендорф (безопасный замок труб, 2 мл) до использования или отгружено с сухим льда. Ткани сетчатки должны быть изъяты при помощи двух пинцетов около зрительного нерва от диафрагмыили ресничного края, чтобы избежать загрязнения с другими пигментированных структур и должны быть переданы в сохранении контейнер сразу же, как РНК становится неустойчивым при получении сетчатки.
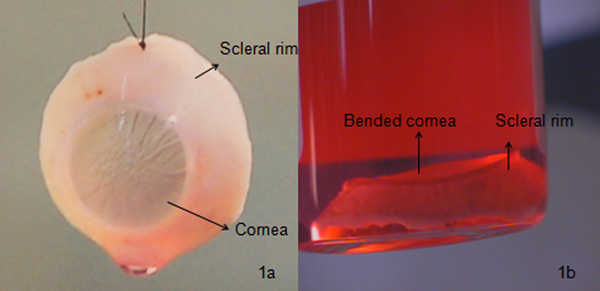
Рисунок 1 Сравнение между хорошим и плохим качеством роговицы.) Правильно вырезали роговицы. Такая роговица обычно сохраняется при органной культуры в течение 4 недель. Микробиологические (с помощью инструмента Bactec 9240) и морфологических (окрашивание клеток с трипановым синим для мобильных определение смертности и наблюдения клеток под оптическим микроскопом с увеличением 100х), осмотр проводится до его транспортировки в больницу (рис. 3а), б) изогнутые роговицы , которые в конечном итоге приводит к отторжения трансплантата из-за складок высокий Десцеметова и высокой повреждение эндотелия клетки исследовали с помощью микроскопа щелевой лампы. Такая роговица обычно используется для разрешенияearch или удаляется.

Рисунок 2. Метод, используемый для обеспечения точного иссечения ткани сетчатки.) Разбор склеры из глазного миру использованием 24mm лезвия 95 мм изогнутые или тупым концом стерильными ножницами и 100 мм 11x2 правит 0,70 мм зубов стерильными щипцами. Склеры должны быть сокращены, держа одну сторону с щипцы резки его прямо к зрительному нерву помощью ножниц. Сосудистого слоя, теперь легко увидеть, б) с помощью двух 100 мм 11x2 правит 0,70 мм зубы стерильный пинцет, сосудистая оболочка удаляется разрывая его на части, которая раскрывает основные прозрачный слой сетчатки, в) прозрачный слой сетчатки вырезали очень осторожно рядом зрительного нерва без выделения стекловидной жидкости с использованием тех же пинцетом. И щипцы должны держать обе стороны сетчатки и ткани должны быть удалены осторожно Startinг около зрительного нерва движется к роговице, чтобы получить хорошее количество ткани сетчатки. Ткань может быть разрезана на различные размеры и используются для анализа экспериментов, г) различные слои роговицы глаза после удаления можно посмотреть на этом рисунке. Сосудистое тело сначала удаляется затем сетчатки без повреждения других частей глаза.

Рисунок 3. Сравнение различных типов плотности клеток и морфология рассматривается под 100X увеличение оптического микроскопа.) Хорошо эндотелиальной клеточной плотности (> 2200 клеток / мм 2) и морфологии (менее полиморфизм, низкая дегенерации, дистрофии и не 0% смертность) в роговице, которая подходит для трансплантации, б) Бедный эндотелиальной клеточной плотности (около 1200 - 1400 клеток / мм 2) и морфологии (очень высокий полиморфизм и вырождениечество клеток), а примерно 30-40% общей смертности наблюдаются после окрашивания трипанового синий, в) часть эндотелиальных клеток повреждены из-за отряд эндотелиальных лист при получении от глазной роговицы миру. Это подтверждают наблюдения смертность клеток в регионе окрашенных по трипанового синий, г) складки Десцеметова образуются в результате неправильного обращения с роговицы изгиб, создавая поперечное напряжение роговицы, используя инструменты, активно и т.д. во время удаления. На рисунке показана толстая развитых ятрогенные складки находится между периферией и оптической зоны роговицы.
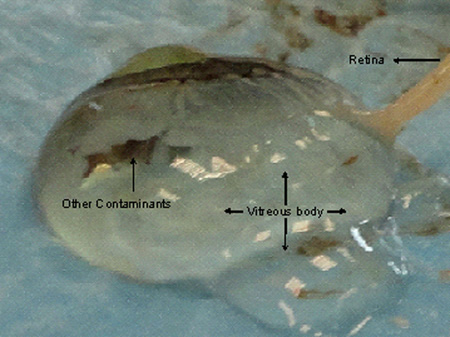
Рисунок 4. Повреждение сосудистой оболочки и сетчатки тканей в то время как вырезанием роговицы в конечном итоге приводит к выделению стекловидной жидкостью. Сетчатка получает вовлечены в стекловидное тело затрудняет акцизного хорошее качество ткани шthout загрязнения.

Таблица 1. Резюме спектр деятельности, осуществляемой с использованием человеческих глобусы глазные в течение 2009 и 2010 в Fondazione Banca дельи Occhi (Венеция, Италия). Примерно 60% тканей для трансплантации, в результате чего большое количество глазных шаров (около 40%) для научных и медицинских исследований.
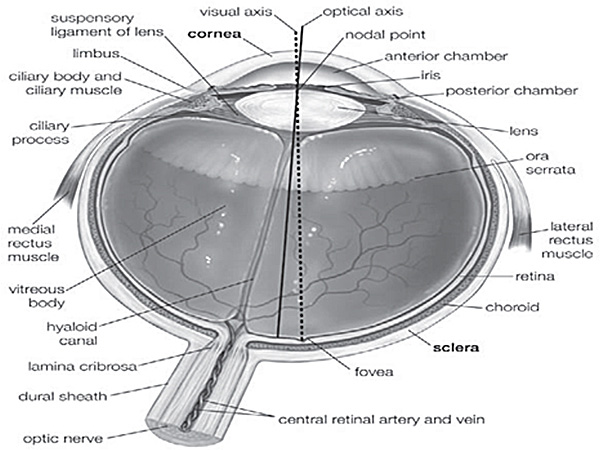
Дополнительные рисунке 1. Анатомия человеческого глаза 5. Различные части человеческого глаза указывается в эту цифру, используемых для контроля за точное положение ткани.
Обсуждение
И, правильное удаление и надлежащую сохранность роговицы и сетчатки тканей являются критическими как незначительные дефекты, такие как повреждение эндотелия или большим количеством складок Десцеметова может привести к недостаточности трансплантата роговицы в то время как температ?...
Раскрытие информации
Авторы не имеют конфликта интересов.
Благодарности
Эта работа была поддержана частично за счет грантов Regione Венето (Ricerca Sanitaria Finalizzata n.292/2008 и Ricerca Sanitaria Finalizzata 2009). Авторы выражают благодарность д-р C. Griffoni на 2009/2010 сводные данные по использованию человеческих глобусы глаз.
Материалы
Материалы для удаления роговицы и сетчатки.
| Name | Company | Catalog Number | Comments |
| Описание товара | Размеры | Компания / Институт | |
| Охраняемая одноразовый скальпель | Размер лезвия 15 | Swann-Morton | |
| Стерильные бинты | 5 см х 5 см, 8 слоистые, 5 шт | Artsana | |
| Стерильные одноразовые медицинские полотенце | 35 X 50 см | U.Jet | |
| Стерильные ножницы | Лезвия 24 мм / длина. 95 мм изогнутые, тупые | e.janach | |
| Стерильные пинцеты | Нержавеющая сталь -100 мм 11 X 2 правит 0,70 мм зубы | e.janach | |
| Роговицы когтей - одноразовые медицинские устройства | NIIOS (Hippocratech) | ||
| Подготовка | |||
| PBS | 100 мл PBS [10 раз] в 900 мл д / ш (дистиллированная вода) | Sigma-Aldrich | |
| Na-тиосульфата | 1 г Na-тиосульфата в 1 л PBS [1x] | Sigma-Aldrich | |
| I-PVP | 5 г I-PVP в 1 л D / W | Sigma-Aldrich |
Таблица 2. Таблице описаны материалы, используемые для удаления роговицы и сетчатки и компании они получены от.
Материалы для носителя (2000 мл).
| Компоненты | Поставщик | Номер по каталогу | Концентрация | Количество |
| MEM(1X) жидкости | Invitrogen | 32360-034 | 1900 мл | |
| Натрия пируват | Invitrogen | 11360-039 | 1 мм (10 мл / л) | 20 мл |
| L-глютамин | Invitrogen | 25030-032 | 2 мм (10 мл / л) | 20 мл |
| Антибиотикам / противогрибковым | Sigma-Aldrich | A5955-20ML | 10 мл / л | 20 мл |
| Новорожденные телячьей сыворотки | Invitrogen | 26010-74 | 2% (20 мл / л) | 40 мл |
Таблица 3. Материалы для носителя.
Подготовка носителя
Добавить все ингредиенты при помощи специальных концентрациях, как указано выше в банке и хорошо перемешать. Фильтр ихиспользование размером пор 0,2 мкм фильтр (Millipore, Милан, Италия) с помощью перистальтического насоса. Сохранение среды в бутылках при комнатной температуре.
Материалы для транспортной среды (2000 мл).
| Компоненты | Поставщик | Номер по каталогу | Концентрация | Количество |
| MEM (1X) жидкости | Invitrogen | 32360-034 | 1800 мл | |
| Натрия пируват | Invitrogen | 11360-039 | 1 мм (10 мл / л) | 20 мл |
| L-глютамин | Invitrogen | 25030-032 | 2 мм (10 мл / л) | 20 мл |
| Новорожденные телячьей сыворотки | Invitrogen | 26010-74 | 2% (20 мл / л) | 40 мл |
| Декстрана T500 | Pharmacosmos | 551005004007 | 6% (60 г / л) | 120 г / л |
Таблица 4. Материал для транспортной среды.
Подготовка транспортной среды
Добавить декстран 6% в ~ 1,5 литра MEM и оставить его на ночь. Добавить остальные ингредиенты в средствах массовой информации и с помощью расширения 0,2 мкм фильтр (Millipore, Милан, Италия) с помощью вакуумного насоса. Сохранение среды в бутылках при комнатной температуре.
Ссылки
- Fay, A., Goldman, L., Ausiello, D. Diseases of the visual system. Cecil Medicine. , (2007).
- Parekh, M., Megaw, R., Ray-Chaudhuri, A., Ahmad, S. Patents in Limbal Stem Cell Biology. Recent patents on Regenerative Medicine. 1, 207-212 (2011).
- Pharm, U. S. The Eye: The physiology of human perception. Britannica educational publishing. 36, 19-27 (2011).
- Lang, G. . Ophthalmology: A pocket textbook atlas. , 115-117 .
- Liesbeth, P. e. l. s. Organ Culture: The method of choice for preservation of human donor corneas. Br. J. Ophthalmol. 81, 523-525 (1997).
- Meyer, J. S., Howden, S. E., Wallace, K. A., Verhoeven, A. D., Wright, L. S., Capowski, E. E., Pinilla, I., Martin, J. M., Tian, S., Stewart, R., Pattnaik, B., Thomson, J., Gamm, D. M. Optic vesicle-like structures derived from human pluripotent stem cells facilitate a customized approach to retinal disease treatment. Stem Cells. , (2011).
- Trifunovic, D., Karali, M., Camposampiero, D., Ponzin, D., Banfi, S., Marigo, V. A high-resolution RNA expression atlas of retinitis pigmentosa genes in human and mouse retinas. Invest. Ophthalmol. Vis. Sci. 49, 2330-2336 (2008).
- Mora, P., Montanini, L., Ferrari, S. . Retina. 30, 1555 (2010).
- Claybon, A., Bishop, A. J. R. Dissection of a Mouse Eye for a Whole Mount of the Retinal Pigment Epithelium. J. Vis. Exp. (48), e2563 (2011).
- Skeie, J. M., Tsang, S. H., Mahajan, V. B. Evisceration of Mouse Vitreous and Retina for Proteomic Analyses. J. Vis. Exp. (50), e2795 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены