このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
の簡略化手法
要約
本稿では、消費税角膜に単純化した技術を説明し、人間の死体ドナーの眼の世界から網膜組織を骨抜きにする。ここで説明する手法は眼球の他の組織を損なうことなく移植、外科的または研究目的のために使用されて消費税質の良い組織に役立ちます。
要約
摘出は世界の残りの部分が邪魔されずに残して死体ドナーから眼球を取得するプロセスです。切除は眼球からそれは別カットし、眼組織、特に角膜の取得を指します。内臓全摘術は、網膜としてここに呼ばれる内臓を除去するプロセスです。眼球、角膜、強膜、硝子体、レンズ、虹彩、網膜、脈絡膜、筋肉など(補遺図1)で構成されています。患者が角膜損傷に苦しんでいるときに、角膜を削除する必要があり、健全なものがkeratoplastic手術で移植しなければなりません。遺伝性疾患または網膜機能の欠陥は、視力を損なう可能性があります。人間の眼の地球儀は、眼組織にそのような目の銀行、人間の角膜または強膜の移植や研究など様々な外科手術に使用することができます。しかし、人間の角膜と網膜切除で利用可能な情報はほとんどおそらく、Lのためにありますヒトの組織にimitedアクセシビリティ。同様の手順を説明する研究のほとんどは、動物モデルで実行されます。研究者達は、人間の目の開発、恒常性と機能に関する知識を拡張するために適切に解剖し、よく保存された眼組織の可用性に依存しています。我々は彼らの約40%( 表1)研究目的のために使用されているのうち眼地球儀の高い金額を受け取るように、我々は消費税に技術を定義し、これらの組織の実験の膨大な量を実行し、定期的にそれらを保存することができます。
角膜は網膜上に光の透過を可能にし、この目的のために、常に透明性の良好な程度を維持する必要があります血管組織である。角膜内に、幹細胞の貯水池である縁領域は、上皮細胞の再建を助け、角膜の透明性と明確性を維持する結膜の異常増殖を制限します。大きさや目それらのいずれかの変化が気を取られ、不明瞭なビジョンにつながるとして、角膜のicknessは、明確なビジョンのために重要である。角膜は5層から成り、内皮細胞)上皮、b)のボーマン層、c)の間質、d)はデスメ膜と、e)。すべての層は、明確なビジョン4,5,6を確保するため適切に機能する必要があります。脈絡膜は、ブルッフの膜でインテリアに囲まれた強膜と網膜の間の中間的なチュニックであり、そして目の血流を担当しています。脈絡膜はまた、網膜5,6の外側の層に温度と供給栄養を調整するのに役立ちます。受光部と非受容部:網膜は眼球(補遺図1)の背面をカバーし、2つの部分から構成され神経組織の層である。網膜は角膜とレンズからの光を受け取るために役立ち、最終的には視神経5,6の助けを借りて脳に伝達化学エネルギーに変換します。 ove_contentは、 ">この論文の目的は、人間の眼の地球儀から角膜と網膜組織の解剖のプロトコルを提供することです。隣接組織との交差汚染を回避し、RNAの完全性を維持するような組織が目的とした研究目的のために不可欠であるとして、基本的に重要である(i)で、再生医療プロジェクトのための幹細胞を単離、及び(iii)影響を受ける/健常者から組織間の組織の違いを評価する(II)、眼組織のトランスクリプトームを特徴づける。本論文で我々は現在、削除するために使用するテクニックについて説明します。角膜、眼球から脈絡膜と網膜組織。ここでは、人間の眼球の解剖と角膜と網膜組織の切除のための詳細なプロトコルを提供しています。付属のビデオは、研究者は、取得のために適切なテクニックを学ぶのに役立ちます定期的に見つけることが困難な貴重なヒト組織の。
プロトコル
1。角膜の上皮切除における眼のグローブから
- 約15分使用する前に、層流キャビネットのスイッチをオンにします。 70%イソプロピルアルコールを使用して、層流フードをきれいにします。そのような手術帽、マスクなどの個人防護服を着用します。手と前腕をスクラブし、滅菌タオルを使用して乾燥させます。無菌テクニックを使用して滅菌手袋とガウンまたはスリーブを着用してください。
- 無菌的に滅菌器具トレイを配置することにより、滅菌フィールドを設定します。楽器は無菌であることを確認します。滅菌器械パックを開き、すべての汚染を回避し、滅菌フィールドに反転させます。
- 彼らは、使いやすさのための滅菌フィールドの端に隣接しているように目の地球儀を含むボトル(目のjarファイル)と一緒にすべて滅菌材料、楽器( 表2)を置きます。
- 表3に示すように、予め調製し保存/記憶媒体でボトルにラベルを付け、配置I-PVP(ポリビニルピロリドンヨウ素)、チオ硫酸ナトリウムと滅菌生理食塩水、PBS(リン酸緩衝生理食塩水)とともに、層流フードの表面上のメートル。
- 彼らは4℃で冷蔵庫内に保存される眼組織およびソリューションは、通常の室温に到達できるように繰り返される地球温暖化/冷却サイクルを避けることができます。ソリューションと、それぞれの瓶の隣に上向きに直面している内側の目の瓶の蓋を保持します。
- 滅菌ピンセットを使って目の瓶から、ガーゼやスポンジを取り外します。眼の地球儀を浄化するために2分間滅菌したI-PVP 0.5%世界を浸す。滅菌フィールドの外側を、滅菌トレイの蓋にある2つの鉗子を挿入します。滅菌ピンセットの別のペアを使用して1分間チオ硫酸ナトリウム0.1%、地球を転送します。同じ鉗子を使用して、滅菌生理食塩水(PBS)を含むボトルに地球儀を転送し、それが作動するまでそれを残す。 tから他の眼球に対して同じ手順を繰り返します。彼と同じドナー。
- 層流フードの下で働く、明らかに角膜から角膜と約5 mmの強膜を残して滅菌ガーゼを(包帯)を使用して、地球を包む。目の電球は、単に十分な圧力を維持する手で開催することができます。組織は、全体の手術中に湿った保たれるべきです。
- 鉗子は、結膜のすべての最終的な遺跡を削除するには、はさみと一緒に使用されています。他の楽器とは別に、上記の操作に使用される楽器を保持します。縁領域から3〜4ミリメートルの強膜切開を行うために外科用メスの刃を使用して、基礎となるブドウ膜組織を穿孔や角膜の正常な湾曲の変形を引き起こすことを避け、360°で切開を拡張します。硝子体の分泌を回避する4小さな隙間を残して4つの大きな切開をカットします。すべての4つのギャップは、他の組織のない除去を確実にしないカットされています。
- 小さな強膜プラークの存在は、切断を阻害する可能性がありますので、試しに確認してください顕微鏡のはさみで強膜切除をlete。この操作は、脈絡膜、網膜と硝子体に損傷を与えることなく実行する必要があります。
- それは完全であることを確認し切開を点検してください。切開は、角膜との対応の時点における繊毛のボディに正しくcorneo·強膜縁付着を実行されている場合。
- 滅菌野の中心付近に包まれた眼球を下に置く。定常強膜縁とcorneo·強膜ボタンから下方に離れて体脈絡膜毛様体を引っ張って切除に使用される手を保持するために鉗子を用いて角膜の除去を完了します。
- 優しくcorneo-強膜ボタンから任意の残りの癒着を分離します。どちらもクロス角膜の緊張を引き起こすことも、それが前房に戻ってドロップダウンする可能性がありますようにcorneo·強膜の縁を引っ張らない。
- 角膜の内皮細胞密度が低張液を使用して、細胞の死亡率は、トリップを使用してチェックされてチェックされている約1分とセルの青色染色し光学顕微鏡下でカウントし、細胞/ mm 2として測定されます。後は、ペトリ皿の底に直面している必要がありますが前房には、蓋に直面している必要があります。内皮細胞密度は100X倍率下で目的のグリッドを使用して手動でカウントすることができます。イタリアでの移植のための最小受け入れセル数は2200内皮細胞/ mm 2である。
- 表3に示すように、RT(室温)で保存先に調製した角膜の記憶媒体に角膜の爪を使用してcorneo·強膜の縁を転送します。
- 天然の水晶体のために後部室を調べます。強膜が用意されている場合は、地球からブドウ膜および硝子体液の全ての残基を削除します。慎重に開けて、無菌技術を使用して、それぞれの目の瓶に残りの後部セグメントを返します。新しい楽器を使用して、他の世界のための手順を繰り返します。角膜のウィットを修正しました。H角膜の爪と31で記憶媒体(器官培養)の下で維持℃、 図1aに示すように、摘出した角膜は、角膜移植後や研究に使用することができます。
- 適切な廃棄容器に不必要な材料やバイオ有害廃棄物を廃棄してください。仕事は70%イソプロピルアルコールスプレーを使用して完了したら、作業領域をきれいにします。
- 、それがその後に輸送することができます - 28日後に角膜は、すべての評価パラメータ[細菌および真菌を使用してBACTEC 9240計測器(ベクトン·ディッキンソン、ミラノ、イタリア)などの形態、細胞数、透明性、厚さ、微生物検査など]を維持した場合は、 表4に示すように輸送培地を使用して病院。角膜は、層流キャビネットの下にメディアを転送するためにストレージから削除し、配置する必要があります。
- として、貯蔵中に、角膜が移植に必要な、通常のサイズよりも厚みを増し、アイバンクは、厚さを減らすために脱膨潤剤を使用しています。我々輸送培地には通常のサイズに戻す角膜を得るために6%デキストランT500を使用しています。 4から8パーセントデキストランT500を使用することができるものの、6%が私たちのために最善を務めています。これは、すぐに彼らはそれを受信するように角膜を移植する手術のためにそれが容易になります。
2。角膜を切除後、眼球から網膜の内臓全摘術
- 切除後、角膜は、その形態と内皮細胞密度に基づいて、31のストレージまたは保存媒体に配置されている移植や研究用に選択され℃の眼球の残りは、その後、手術の目的のためにそのような強膜分離などのさらなる使用のために処理研究のための網膜等されてい
- 網膜切除する前に、眼球が無傷であると強膜の一部のみ角膜が削除されていることを確認してください。ゼラチン状の硝子体は、アウトを分泌する場合、それは網膜組織を削除することが困難となる。
- ドナーは、以下の65歳である場合は、強膜です。血清学的検査の後、外科的な目的のために滅菌したPBSの下に保持されます。このケースでは、強膜が切断されていない、唯一の硝子体が削除され、全体の強膜が保持されます。
- 網膜の切除のために、滅菌ピンセットやハサミを使用して、視神経に向かって強膜角膜側から小さなカットや切開で始まります。鉗子を用いて強膜の一部を保持し、ストレート硝子体への損傷を避けるための部分で一部を切断視神経に向かってハサミでカット。
- 彼らは一緒に立ち往生しているように脈絡膜プラークが強膜から分離する必要があります。脈絡膜組織を露出させる全体の強膜を切り取ります。強膜が完全に切断されると、視神経の近くにそれをカットして硝子体の残りと強膜を分離します。 図2aに示すように、脈絡膜で覆われて硝子体の全体のボールが見えるようになります。
- 2滅菌ピンセットを使用することで、1つでそれをピックアップして穏やかに脈絡膜層を除去鉗子のペアと他でそれを削除します。また、脈絡膜層は、はさみを使用して削除することができますが、それは網膜への損傷を引き起こす可能性があるので、これは理想的には避けるべきである。部分的に脈絡膜層を除去し、除去を容易にするためにそれをカット。
- 脈絡膜層が除去されると、 図2bに示すように、網膜の透明な層が明確に見られます。脈絡膜層は、除去することができたインテリアブルッフの膜を持っていますが、それは肉眼でそれを識別することは困難です。
- 同様に、 図2cに示すように、網膜の層を除去するために2つの鉗子を使用しています。それは視神経の近くに摘出した場合、網膜の高い量を分離することは容易である。 図2dに示すように、目のすべての層は、現在見ることができました。
- 網膜組織が削除されていたら、それは異なる目的のために使用することができるため、保全のために使用される後続の手順および条件に応じて異なる場合があります。例えば、網膜組織は、(前にパラフィンまたはOCT用の組織を埋め込むためのソリューションを固定し、ディスパーゼ/トリプシン(細胞の単離のための)、(RNAまたはDNA抽出のための)RNA安定化試薬(例えば、RNAlater中など)や、溶解緩衝液を含むチューブに配置することができます免疫組織化学)。
- すべての作業領域をクリアし、70%イソプロピルアルコールスプレーを使用して領域を清掃してください。
3。代表的な結果
図1aに見られるようにcorneo·強膜の縁は、強膜縁と内皮細胞形態の必要な量で適切に摘出した角膜は、角膜のこの種は、一般的に全層角膜移植に使用されます。摘出した角膜の前方ストロマが不透明の存在と損傷している場合は、角膜内皮角膜移植/後部層状角膜(角膜の一部と内皮細胞)を使用することができる。内皮層が損傷しているか、内皮細胞密度は<2200細胞/ mm 2である場合(これはされている場合、一方アルヤン標準)、角膜が前方表層角膜移植(前方ストロマの一部と上皮)を使用することができる。内皮細胞数が必要なより小さい場合は、角膜は、角膜が完全に破損している場合、それは図1B、3Bおよび3Cに示すように、研究のために使用または廃棄することができ、一方、前部層状角膜移植や研究のために使用することができる。損傷等の患者の寿命の間に、間質やデスメ内皮傷跡に至る前に白内障手術、したがって、それがために光学顕微鏡下にしてスリットランプを持つすべての組織を確認し、することが必要となる物理的な損傷の開発組織を誤っの原因となる細かい傷/ひだ/剥離。角膜は通常、器官培養として2つの異なる条件下で保存されている(約31°C)は、通常のヨーロッパ諸国や低体温の条件で使用されている(約4°C)は、通常、米国で使用されます。それはダムを再生成するのに役立ちます私たちは、器官培養を使用し高齢者の上皮細胞は、高死後時間と再活性化内皮細胞のチェックに、手術を計画するための十分なウィンドウを与え、4週間の保管期間は、等角膜微生物(細菌および真菌)と血清学的検査のための十分な時間を与えるよく7日間の輸送媒体に保存することができます。
強膜は、すべての脈絡膜プラークの穏やかな除去を保証する部分で一部をカットすることができます。 図4に示すように、視神経、脈絡膜や網膜が大幅にカットされたときに硝子体の液体が排泄することができます。組織が切除され次第、RNA解析のために摘出した場合は、網膜をRNAlater中に保存されるべきである。通常°新鮮なエッペンドルフチューブ(セーフロックチューブ2ml)中のCまでの使用または出荷された乾燥した脈絡膜と網膜の層の1X1 CMが切り出されており、4℃で24時間RNAlater中でそれを維持した後°C、-80の下に保存されます氷。網膜組織を離れて虹彩から視神経の近くに2鉗子を用いて切除しなければならない他の色素の構造体による汚染を避けるために、網膜の取得中にRNAが不安定になるにつれて、すぐに保存するコンテナに転送されるべきか、毛様体縁。
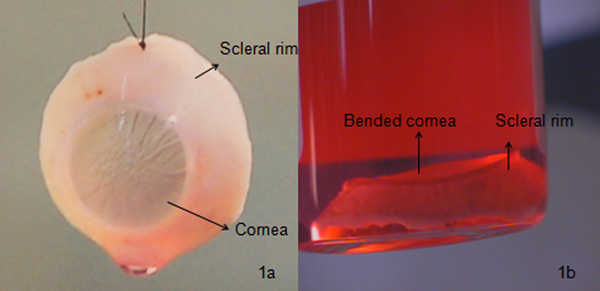
図1は良好で、低品質の角膜の間の比較:1)が正しく切り出さ角膜。このような角膜は通常、4週間器官培養下で維持されます。微生物(BACTEC 9240機器を使用)と形態(細胞死亡率決定のためにトリパンブルーで細胞を染色し、100Xの倍率の光学顕微鏡下で細胞を観察)検査は、病院( 図3a)にそれを輸送する前に実行されると、b)曲げ角膜、これは最終的には高いデスメひだによる移植片拒絶につながると高内皮細胞の損傷は、細隙灯顕微鏡を用いて検討した。このような角膜は、通常解像度で使用されearchまたは破棄されます。

図2の方法は、網膜組織の正確な切除を確実にするために使用されます。)95ミリメートル湾曲または平滑末端滅菌はさみと0.70ミリメートルの歯滅菌ピンセットによって支配さ100 mmの11X2と24ミリメートルの刃を用いて眼球から強膜の解剖。強膜は、はさみを使用して、視神経に向かってまっすぐに切断鉗子で片側を保持することによって削減されるべきである。脈絡膜層が簡単に見られるだろうと、b)0.70ミリメートルの歯滅菌ピンセットによって支配2 100ミリメートル11X2を使用して、脈絡膜は、基礎となる透明な網膜層を明らかにされ、それを引き裂くことによって削除されます。c)の透過的な網膜の層が近く、非常に慎重に切り出され同じ鉗子を使用して、硝子体液の排泄せずに視神経。鉗子の両方が網膜の各側面を保持しなければならないと組織が穏やかにのstartinを削除する必要があります網膜組織の良い量を取得するために、角膜に向かって視神経の近くにグラム。組織は、異なるサイズにカットし、分析実験のために使用することができること、d)、角膜を除去した後、眼のさまざまな層は、この図に表示することができます。脈絡膜本体は目の他の部分を損傷せずに最初の網膜に続いて削除されます。

図3光学顕微鏡の100倍の倍率で観察し、細胞密度および形態の異なるタイプの比較。)グッド内皮細胞密度(> 2200細胞/ mm 2)、形態(以下多型、低変性症、筋ジストロフィーないと0%移植に適した角膜の死亡率)と、b)悪い内皮細胞密度(約1200から1400細胞/ mm 2)、形態(非常に高い多型とDEGEN約30〜40%の全死亡率に沿ったセルの動作中は)トリパンブルー染色後に観察されています。眼球から角膜を取得中にc)は内皮細胞の一部が原因で内皮細胞シートの剥離に破損している。これは、トリパンブルーで染色したセル範囲の死亡率を観察することによって確認されていること、d)デスメひだは、切除の時点で激しく等の楽器を使用してクロス角膜の緊張を、作成、曲げによって角膜の誤操作により形成されています。図は、角膜の周辺部と光ゾーンの間にある厚さの発達した医原性の襞を示しています。
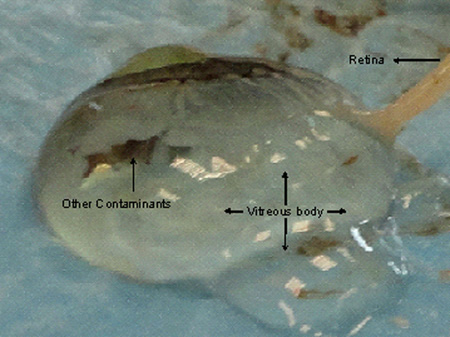
脈絡膜および網膜組織への図4。損害賠償最終的には角膜を切除しながらでは、硝子体液の排泄につながります。網膜は、それが困難な質の良い組織のWi消費税になって硝子体に関与される汚染をthout。

表1。Fondazioneバンカで2009年と2010年の間に人間の眼の地球儀を使って実行される活動の範囲の概要Occhi(ヴェネツィア、イタリア)グリオ。組織の約60%は、このように科学と医学研究のために(約40%)、眼の地球儀の高い数値を残して、移植のために使用された。
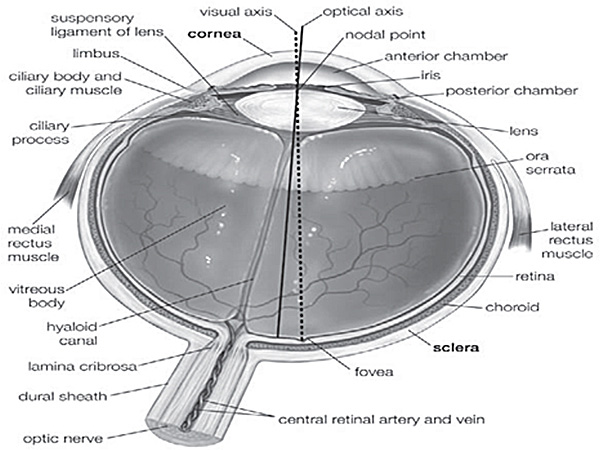
補足図1人間の目5の解剖学。人間の目の異なる部分は、組織の正確な位置を追跡するために使う、この図に示されています。
Access restricted. Please log in or start a trial to view this content.
ディスカッション
温度変化や誤操作は、網膜組織の整合性が損なわれる可能性があり、一方そのようなデスメ襞の内皮損傷または高数としてマイナー欠陥が角膜の移植失敗につながることができますので、正しい切除と角膜と網膜組織の適切な保全の両方が重要です。本稿の目的は、角膜と網膜の組織が移植や研究目的の使用を危険にさらす可能性が損害の変化を誘発することなく、最適に分離することがで?...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者らは、利害の衝突はありません。
謝辞
この作品は、Regioneヴェネト州(未公表Sanitaria Finalizzata n.292/2008と未公表Sanitaria Finalizzata 2009年)の助成金によって部分的にサポートされていました。著者らは、人間の眼の地球儀の使用に関する2010分の2009、サマリー·データに博士C. Griffoniに感謝します。
Access restricted. Please log in or start a trial to view this content.
資料
角膜と網膜の切除のための材料。
| Name | Company | Catalog Number | Comments |
| 製品記述 | 大きさ | 企業/研究所 | |
| 保護された使い捨てメス | ブレードサイズ15 | スワン·モートン | |
| 滅菌包帯 | は5cm x 5cm、8階層、5個 | Artsana | |
| 滅菌済みディスポーザブル医療タオル | 35 X 50センチメートル | U.Jet | |
| 滅菌はさみ | ブレード24ミリメートル/全体の長さ。無愛想な湾曲した95ミリメートル、 | e.janach | |
| 滅菌ピンセット | ステンレス鋼-100ミリメートル11 X 2は、0.70ミリメートルの歯によって支配さ | e.janach | |
| 角膜の爪 - 使い捨て医療機器 | NIIOS(Hippocratech) | ||
| 準備 | |||
| PBS | [10倍] 900ミリリットルD / W(蒸留水)100 mlのPBS | Sigma-Aldrich社 | |
| NA-チオ | PBS [1X]の1リットルの1 GMのNa-チオ | Sigma-Aldrich社 | |
| I-PVP | 1リットルD / Wの5、GM I-PVP | Sigma-Aldrich社 |
表2の表では、角膜と網膜の切除、それらがから受信されている会社のために使用される材料について説明します。
記憶媒体のための材料(2000ミリリットル)。
| コンポーネント | サプライヤー | カタログ番号 | 濃度 | 量 |
| MEM(1X)液体 | インビトロジェン | 32360-034 | 1900ミリリットル | |
| ピルビン酸ナトリウム | インビトロジェン | 11360-039 | 1mMの(10ミリリットル/リットル) | 20ミリリットル |
| L-グルタミン酸 | インビトロジェン | 25030-032 | 2mMの(10ミリリットル/リットル) | 20ミリリットル |
| 抗生物質/抗真菌剤 | Sigma-Aldrich社 | A5955-20mlの | 10ミリリットル/リットル | 20ミリリットル |
| 新生仔ウシ血清 | インビトロジェン | 26010から74 | 2%(20ミリリットル/リットル) | 40ミリリットル |
表3。記憶媒体のための材料。
記憶媒体の準備
瓶の上に与えられたとして、特定の濃度を用いてすべての材料を加え、よく混ぜる。それらをフィルタリングする蠕動ポンプの助けを借りて、0.2ミクロンのフィルター(ミリポア、ミラノ、イタリア)の細孔径を使用します。室温でボトルに培地を保持します。
輸送培地(2000 ml)のための材料。
| コンポーネント | サプライヤー | カタログ番号 | 濃度 | 量 |
| MEM(1X)液体 | インビトロジェン | 32360-034 | 1800ミリリットル | |
| ピルビン酸ナトリウム | インビトロジェン | 11360-039 | 1mMの(10ミリリットル/リットル) | 20ミリリットル |
| L-グルタミン酸 | インビトロジェン | 25030-032 | 2mMの(10ミリリットル/リットル) | 20ミリリットル |
| 新生仔ウシ血清 | インビトロジェン | 26010から74 | 2%(20ミリリットル/リットル) | 40ミリリットル |
| デキストランT500 | Pharmacosmos | 551005004007 | 6%(60グラム/リットル) | 120グラム/リットル |
表4。輸送媒体のための材料。
輸送培地の調製
MEMの〜1.5リットルのデキストラン6%を追加し、一晩そのままにしておきます。真空ポンプを用いて0.2ミクロンのフィルター(ミリポア、ミラノ、イタリア)を使用して、メディアやフィルターの成分の残りの部分を追加します。室温でボトルに培地を保持します。
参考文献
- Fay, A. Diseases of the visual system. Cecil Medicine. Goldman, L., Ausiello, D. , 23rd ed, Saunders Elsevier. Philadelphia, Pa. (2007).
- Parekh, M., Megaw, R., Ray-Chaudhuri, A., Ahmad, S. Patents in Limbal Stem Cell Biology. Recent patents on Regenerative Medicine. 1, 207-212 (2011).
- Pharm, U. S. The Eye: The physiology of human perception. Britannica educational publishing. 36, 19-27 (2011).
- Lang, G. Ophthalmology: A pocket textbook atlas. , 2nd Edition, 115-117 Forthcoming.
- Liesbeth, P. els Organ Culture: The method of choice for preservation of human donor corneas. Br. J. Ophthalmol. 81, 523-525 (1997).
- Meyer, J. S., Howden, S. E., Wallace, K. A., Verhoeven, A. D., Wright, L. S., Capowski, E. E., Pinilla, I., Martin, J. M., Tian, S., Stewart, R., Pattnaik, B., Thomson, J., Gamm, D. M. Optic vesicle-like structures derived from human pluripotent stem cells facilitate a customized approach to retinal disease treatment. Stem Cells. , (2011).
- Trifunovic, D., Karali, M., Camposampiero, D., Ponzin, D., Banfi, S., Marigo, V. A high-resolution RNA expression atlas of retinitis pigmentosa genes in human and mouse retinas. Invest. Ophthalmol. Vis. Sci. 49, 2330-2336 (2008).
- Mora, P., Montanini, L., Ferrari, S. Retina. 30, 1555(2010).
- Claybon, A., Bishop, A. J. R. Dissection of a Mouse Eye for a Whole Mount of the Retinal Pigment Epithelium. J. Vis. Exp. (48), e2563(2011).
- Skeie, J. M., Tsang, S. H., Mahajan, V. B. Evisceration of Mouse Vitreous and Retina for Proteomic Analyses. J. Vis. Exp. (50), e2795(2011).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved