A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
GC القائم على الكشف عن حمض Aldononitrile خلات الجلوكوزامين والموراميك Derivatized لتحديد بقايا الميكروبي في التربة
In This Article
Summary
وصفنا بروتوكول طريقة لتحليل GC القائم على المشتقات خلات aldonitrile من الجلوكوزامين وحامض الموراميك المستخرجة من التربة. لتوضيح الآلية الكيميائية، ونقدم أيضا استراتيجية لتأكيد بنية المشتقة وشظايا ايون شكلت بناء على التأين الإلكترون.
Abstract
نهج كمي إلى الكائنات الحية الدقيقة التي تميز حاسمة لفهم أوسع لوضع الميكروبية وظيفة في إطار النظم الإيكولوجية. الاستراتيجيات الحالية لتحليل الجراثيم تشمل كلا من مختبر الثقافة التقليدية التي تعتمد على التقنيات وتلك القائمة على استخراج مباشرة وتحديد المؤشرات الحيوية معينة 1 و 2. يمكن زرعها قليل بين تنوع الأنواع الجرثومية التي تعيش في التربة، وبالتالي الثقافة التي تعتمد على أساليب إدخال تحيزات كبيرة، وتحديد غائبة في تحليل العلامات البيولوجية.
وقد الحامض الجلوكوزامين، mannosamine، غالاكتوزامين والموراميك خدم كذلك اتخاذ تدابير لائق على حد سواء والأموات الشامل الجرثومية، من هذه الأحماض في الجلوكوزامين (الأكثر وفرة) والموراميك (فريد من الخلية البكتيرية) هي المكونات الأكثر أهمية في نظم التربة 3 (4). ومع ذلك، فإن الافتقار إلى المعرفة على تحليل يحد من تعميم واسع بين أقرانه العلمية. بين جميع EXIلسعة الطرق التحليلية، إلى اشتقاق aldononitrile الأسيتات تليها GC التحليل القائم على برزت كخيار جيد بالنسبة للتوازن على النحو الأمثل الدقة والحساسية، والبساطة، والفصل الكروماتوغرافي جيد، والاستقرار على تخزين عينة 5.
هنا، نقدم لبروتوكول مفصلة لإجراء تحليل موثوق وبسيطة نسبيا من الجلوكوزامين وحامض الموراميك من التربة بعد تحويلها إلى الأسيتات aldononitrile. ويتضمن البروتوكول أساسا أربع خطوات: حامض الهضم، وتنقية العينة، واشتقاق، وتقرير مجلس الإدارة. يتم تعديل هذا الإجراء خطوة بخطوة وفقا لمنشورات السابق 6، 7. وبالإضافة إلى ذلك، نقدم استراتيجية للتحقق من صحة هيكليا أيون الجزيئية المشتقة وشظايا ايون لها شكلت بناء على التأين الإلكترون. طبقنا GC-EI-MS-SIM، LC-ESI-MS-TOF والكواشف المسمى isotopically لتحديد الوزن الجزيئي للaldononitrile خلات الجلوكوزامين derivatized وMURحامض AMIC؛ استخدمنا تحول كتلة من النظائر المسمى المشتقات في الطيف ايون للتحقيق في شظايا ايون من كل المشتقات 8. بالإضافة إلى توضيح النظرية، فإن التحقق من أيون الجزيئية المشتقة وشظايا ايون لها أن تكون مفيدة للباحثين باستخدام δ 13 جيم أو شظايا أيون من هذه المؤشرات الحيوية في الدراسات البيولوجية الكيميائية 9 و 10.
Protocol
1. تحضير العينة واستخلاص حمض
- تجميد عينات من التربة الجافة بعد الجمع الميداني.
- طحن والتجانس عينات من التربة باستخدام طاحونة الكرة، طاحونة التربة، أو بمدافع الهاون ومدقة.
- وزن عينات من التربة (التي تحتوي على> 0.3 ملغم N) في دورق 25 مل من التحلل.
- إضافة 10 مل من حمض الهيدروكلوريك 6M في كل قارورة المائي، وملء N 2 الغاز في القوارير، والغطاء بإحكام.
- يتحلل عند درجة حرارة 105 مئوية في حاضنة لمدة 8 ساعات باستخدام مفتاح الموقت السيارات.
2. عينة تنقية
- إزالة قوارير من الحاضنة، بارد لدرجة حرارة الغرفة.
- أضف 100 ميكروليتر الداخلية معيار ميو، اينوزيتول (1 ملغ مل -1 في الماء) على كل قارورة، مزيج من دوامات.
- إنشاء مداخل البلاستيكية التي تصب في قوارير 200 مل على شكل كمثرى مع ST / NS 24/40 المفاصل، وتعيين على الأكواب البلاستيكية للاستقرار.
- طية Whatman # 2 دوائر النوعية (11 قطرها سم) إلى أرباع، ومجموعة في المداخن.
- عباب كل قارورة المائي، ويسكب المزيج في قمع لتصفية (قد شطف مزيد من كل قارورة مع مل 3 ~ من الماء).
- تجفيف الترشيح باستخدام التبخير الدوار في ~ 45 درجة مئوية، وتطبيق فراغ.
- Resuspend بقايا المجففة من كل قارورة الكمثرى مع 3 ~ 5 مل ماء (استخدام حمام بالموجات فوق الصوتية وإذا رغبت في ذلك)، وتصب في أنبوب 40 مل تفلون؛ شطف القارورة مع قسامة الثانية من المياه.
- ضبط درجة الحموضة إلى 6،6-6،8 باستخدام 1M KOH حل لايونات المعادن راسب والجزيئات العضوية الأخرى.
- إزالة الرواسب عن طريق الطرد المركزي في 2000 إطار التعاون الإقليمي لمدة 10 دقائق.
- صب طاف في أنبوب 40 مل زجاج، تغطية افتتاح أنبوب مع parafilm، وتجميد في -20 درجة مئوية، ثم كزة ثقوب في parafilm.
- تجميد تجفيف طاف المجمدة لازالة كل السائل.
- حل بقايا مع الميثانول 3 مل جاف، vortexing تماما (استخدام حمام بالموجات فوق الصوتية وإذا رغبت في ذلك)؛ غطاء الأنبوب، وأجهزة الطرد المركزي ثم في 2000 إطار التعاون الإقليمي لمدة 10 دقائق لتسويةمن الأملاح.
- نقل وطاف على قارورة مل 3 رد فعل مخروطي الشكل؛ تتبخر إلى جفاف بواسطة آلة RapidVap على 45 درجة مئوية (أو تحت تيار لطيف من غاز النيتروجين الجاف إذا رغبت).
- على كل قارورة، أضف 100 ميكروليتر انتعاش معيار N-methylglucamine (1 ملغ مل -1 في الماء) و 1 مل H 2 O، يكتم الافواه قارورة مع parafilm، وتجميد في -20 درجة مئوية، وخرم parafilm، ومن ثم تجميد جاف .
- جعل المعايير: إضافة 100 حامض الموراميك ميكرولتر (0.5 ملغ مل -1 في الميثانول)، و 100 الجلوكوزامين ميكروليتر (1 ملغ مل -1 في الماء)، و 100 ميكرولتر ميو، اينوزيتول (1 ملغ مل -1 في الماء)، و 100 N-ميكرولتر methylglucamine (1 ملغ مل -1 في الماء)، و 1 مل H 2 O، parafilm كل قارورة، وتجميد في -20 درجة مئوية، وخرم parafilm، ثم تجميد الجافة.
3. اشتقاق
- تحضير كاشف اشتقاق التي تحتوي على 32 ملغ مل هيدروكلوريد هيدروكسيل -1 و 40 مجم مل -1 4 dimethylamino-PYridine في بيريدين، الميثانول (4:1 V / V).
- إضافة 300 ميليلتر من كاشف اشتقاق إلى كل من reactivials، الغطاء بإحكام، ودوامة تماما.
- وضع قنينة في 75-80 درجة مئوية حمام الماء لمدة 35 دقيقة (مختومة جيدا قارورة لتجنب السماح لأي المياه للدخول في قارورة).
- إزالة قارورة من الحمام المائي، وباردا لدرجة حرارة الغرفة.
- إضافة 1 مل من الخل أنهيدريد إلى كل من كاب مل 3، reactivials بإحكام، ودوامة جيدا، ثم يسخن في حمام ماء 75-80 درجة مئوية لمدة 25 دقيقة.
- إزالة قارورة من الحمام المائي، وباردا لدرجة حرارة الغرفة.
4. فصل والقياس
- إضافة 1.5 مل من ثنائي كلورو ميثان إلى كل كأب، وقارورة بإحكام، ودوامة تماما.
- إضافة 1 مل من حمض الهيدروكلوريك 1M إلى كل كأب، وقارورة بإحكام ودوامة تماما للسماح للحلول على الجلوس دون عائق حتى العبارات منفصلين، نضح وتجاهل الجزء العلوي (مائي) مرحلة استخدام 1000 pipettor ميكرولتر.
- و في نفسashion، استخراج مرحلة العضوية 3 مرات ولكن مع 1 مل O 2 H (مع الخطوة غسل الماضي، عناية خاصة للتأكد من أن تمت إزالة جميع من مرحلة أعلى مائي).
- تجف الحل النهائي باستخدام RapidVap على 45 درجة مئوية (أو الجاف باستخدام غاز النيتروجين إذا رغبت).
- حل في 300 ميكروليتر خلات الإيثيل، الهكسين (1:1 V / V) ونقل إلى 2 مل من قنينات المسمار سقف العنبر مع ادخال وحجم صغير والغطاء بإحكام.
- لالكمي وتحليلها بواسطة GC-FID باستخدام قطبي العمود الشعري السيليكا تنصهر فيها: 30 مترا، 0.25 ملم معرف، 0.25 سماكة الفيلم أم؛ مرحلة ثابتة 5٪ فينيل، 95٪ ميثيل polysiloxane (DB-5 أو ما يعادلها) مع الهيدروجين أو الهليوم والغاز الناقل، في 0.5 مل تدفق -1 دقيقة ثابتة. واللوني هو أفضل على قسط مراحل "خاملة"، وغاز الهيدروجين الناقل، ولكن غير مقبول على أصناف أكثر شيوعا ومع الهيليوم. إعدادات كاشف هي 300 درجة مئوية، 400 مل دقيقة -1 الهواء و30 مل -1 دقيقة للنيتروجين على حد سواء وغازات الهيدروجين ماكياج. الحقن والمعلمات فرن هي كما يلي: 1 حقن الانقسام ميكرولتر (30:1) مع مدخل القيادة العامة التي حددت في 250 درجة مئوية؛ الأولية حرارة الفرن، و 120 درجة مئوية، عقد 1 دقيقة، وزيادة درجة حرارة الفرن عند 10 درجة مئوية دقيقة. -1 إلى 250 درجة مئوية؛ عقد 2،5 دقيقة؛. المنحدر إلى 270 درجة مئوية عند 20 درجة مئوية دقيقة -1؛ عقد 2 دقيقة، المنحدر إلى 290 درجة مئوية عند 20 درجة مئوية دقيقة -1، عقد 5 دقائق. ضبط معدل تدفق الغاز الناقل بحيث أزل اينوزيتول، الجلوكوزامين ومشتقات حمض الموراميك على 250 درجة مئوية، وelutes N-methylglucamine عند 270 درجة مئوية.
5. مشتق التحقق من صحة
- استخدم التأين الناعمة LC-ESI-TOF-MS لتحديد أيون الجزيئية وتحديد الوزن الجزيئي للمشتقات.
- استخدام GC-EI-MS-SIM أو GC-EI MSMS من أجل تعزيز حساسية للتحقيق في الأيونات المستهدفة من المشتقات المالية.
- استخدم العديد من الكواشف المسمى isotopically للإعداد للمشتقات، ومن ثم استخدام هذا التحول الشاملمن تلك المشتقات المسمى isotopically في MS للتحقيق أيون الجزيئية وشظايا أيون.
6. ممثل النتائج
بروتوكول للطريقة تتكون بصورة رئيسية من أربع خطوات: حامض الهضم، وتنقية العينة، واشتقاق، وتحديد GC (الشكل 1). ويرد مثال على تحليل للحمض الجلوكوزامين والموراميك من المخزونات ومعيار من عينة من التربة في الشكل 2. ويمكن بالإضافة إلى الجلوكوزامين وحمض الموراميك، mannosamine وغالاكتوزامين (أيزومرين الجلوكوزامين) أيضا أن تحدد في وقت واحد باستخدام طريقة. استنادا إلى عوامل استجابة للمعايير فيما يتعلق الداخلية معيار ميو، اينوزيتول، ويمكننا تحديد هذه المؤشرات الحيوية في عينات من التربة. وقد استخدم معيار استرداد لمراقبة النوعية في عملية اشتقاق. وتظهر مخططات لتشكيل حامض خلات aldononitrile الجلوكوزامين والموراميك derivatized في الشكل (3) .
وتم تحديد الهياكل المقترحة للمشتقات بواسطة GC-EIMS-SIM لتعزيز حساسية، أو التأين الناعمة LC-ESI-TOF MS-8، وتمت دراسة الهياكل المقترحة من شظايا ايون شكلت بناء على التأين الإلكترون من خلال مقارنة الأطياف ايون لل عينات أعدت مع المدرجه النظائر المختلفة 11. ويبين الشكل 4 التحول الشامل لايون المهيمنة م / ض 187 من aldononitrile خلات الجلوكوزامين derivatized في ثلاثة سيناريوهات، الذي أعد مع وكلاء غير المسمى، الأنهيدريت D-الخل، ويو -13 سي الجلوكوزامين. ويمكن الإشارة إلى معلومات تفصيلية أخرى وتفسيرات لمنشوراتنا الأخيرة 8 و 11. ويمكن هذه الاستراتيجية بمثابة نموذج لدراسة الكيمياء المشتقة.
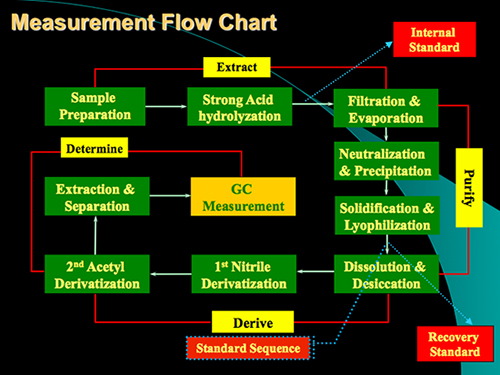
الرقم تدفق قياس 1. الرسم البياني للبروتوكول لتحليل الجلوكوزامين وحامض الموراميك في التربةعينات. ويتضمن البروتوكول أساسا 4 خطوات: حمض الهضم، تنقية، اشتقاق وتصميم GC.

الشكل 2. GC-FID المخططات الاستشرابية من الأسيتات aldononitrile من اينوزيتول، الجلوكوزامين، وحامض الموراميك، mannosamine، غالاكتوزامين وmethylglucamine لمعايير والتربة.
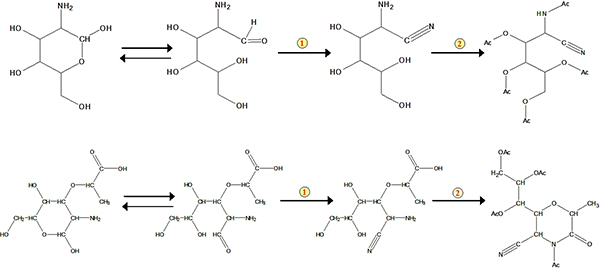
الشكل 3. خطط لتشكيل حامض خلات aldononitrile الجلوكوزامين والموراميك derivatized. الرقم 1 يمثل رد فعل النتريل. الرقم 2 يمثل أستلة.

الشكل 4. الأطياف كتلة من aldononitrile خلات الجلوكوزامين derivatized المرتبطة متطوره ايون مهيمنوفاق في ظل الوضع EI أعدت مع (A) وكلاء غير المسمى، (B) D-الخليك الأنهيدريت، (C) يو -13 C-الجلوكوزامين. نجم يمثل النظائر الثقيلة ذرة أو مجموعة النظير.
Discussion
وقدمت القيادة العامة المستندة إلى طريقة لتحليل الحمض aldononitrile خلات الجلوكوزامين والموراميك derivatized يوفر طريقة سريعة نسبيا لتحديد هذه السكريات الأمينية، والمستخرجة من التربة. والمشتقات هي مستقرة كيميائيا، ويمكن تحديدها في واحدة تحليل. لا يقتصر هذا الأسلوب على عينات م...
Disclosures
ليس لدينا ما يكشف.
Acknowledgements
وأيد هذا العمل من المنح المقدمة من وزارة الطاقة البحيرات العظمى مركز أبحاث الطاقة الحيوية (وزارة الطاقة BER مكتب العلوم DE-FC02-07ER64494). نحن ممتنون للدكتور تشانغ شو دونغ وأعضاء جماعته لإجراء مناقشات تقنية مفيدة والتعليقات لا تقدر بثمن في وضع الصيغة النهائية للبروتوكول.
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف | شركة | فهرس العدد | |
| حمض الموراميك | سيغما الدريخ | M2503-25MG | |
| D-(+)-الجلوكوزامين هيدروكلوريد | سيغما الدريخ | G1514-100G | |
| ن ميثيل مد glucamine | سيغما الدريخ | M2004-500G | |
| ميو، اينوزيتول | فيشر العلمية | A307003G025 | |
| الميثانول (الجاف) | العضوية Acros | AC326950010 | |
| 4-dimethylamino-بيريدين | العضوية Acros | AC148270050 | |
| خلات الإيثيل | VWR الدولية | BJGC100-4 | |
| Hydroxlamine هيدروكلوريد | فيشر العلمية | H330-100 | |
| بيريدين | فيشر العلمية | P368-500 | |
| أنهيدريد الأسيتيك | فيشر العلمية | A10-100 | |
| ثنائي كلورو ميثان (كلوريد الميثيلين) | فيشر العلمية | D37-500 | |
| الهكسين | فيشر العلمية | H303-4 | |
| حمض الهيدروكلوريك (6M) | فيشر العلمية | S456-4 | |
| هيدروكسيل هيدروكلوريد -15 N | أيقونة الخدمات | IN5280 | |
| أنهيدريد الأسيتيك -2 H (C D 6 4 O 3) | العضوية Acros | AC174670050 | |
| D-جلوكوز يو -13 سي | كامبردج معمل النظائر المشعة | CLM-1396-1 | |
| الأمونيوم sufate -15 N | كامبردج معمل النظائر المشعة | NLM-713-1 | |
| اسم المعدات | شركة | نوع | |
| سريع برنامج عمل فيينتيان | LabConco | 790002 | |
| Vacum مضخة | KNF Neuberger | D-79112 | |
| التحلل قارورة | فيشر العلمية | 06 423A | |
| اشتقاق microvial | فيشر العلمية | 06-100E | |
| GC | هيوليت باكارد | 6890 | |
| MS | هيوليت باكارد | 5972 | |
| LC-ESI-TOF-MS | اجيلنت | في 1200 اجيلنت نظام HPLC سلسلة بالإضافة إلى LC اجيلنت / MSD-TOF |
References
- Zelles, L. Fatty acid patterns of phospholipids and lipopolysaccharides in the characterisation of microbial communities in soil: a review. Biology and Fertility of Soils. 29, 111-129 (1999).
- Kirk, J. L. Methods of studying soil microbial diversity. Journal of Microbiological Methods. 58, 169-188 (2004).
- Joergensen, R. G., Emmerling, C. Methods for evaluating human impact on soil microorganisms based on their activity, biomass, and diversity in agricultural soils. Journal of Plant Nutrition and Soil Science. 169, 295-309 (2006).
- Guggenberger, G., Frey, S. D., Six, J., Paustian, K., Elliott, E. T. Bacterial and fungal cell-wall residues in conventional and no-tillage agroecosystems. Soil Science Society of America Journal. 63, 1188-1198 (1999).
- Amelung, W., Lal, R., Kimble, J. M., Follett, R. F., Stewart, B. A. . Assessment Methods for Soil Carbon. , 233-270 (2001).
- Guerrant, G. O., Moss, C. W. Determination of monosaccharides as aldononitrile, O-methyloxime, alditol, and cyclitol acetate derivatives by gas-chromatography. Analytical Chemistry. 56, 633-638 (1984).
- Zhang, X., Amelung, W. Gas chromatographic determination of muramic acid, glucosamine, mannosamine, and galactosamine in soils. Soil Biology and Biochemistry. 28, 1201-1206 (1996).
- Liang, C. Investigation of the molecular ion structure for aldononitrile acetate derivatized muramic acid. Journal of Microbiological Methods. 86, 224-230 (2011).
- He, H., Xie, H., Zhang, X. A novel GC/MS technique to assess 15N and 13C incorporation into soil amino sugars. Soil Biology and Biochemistry. 38, 1083-1091 (2006).
- Glaser, B., Gross, S. Compound-specific delta 13C analysis of individual amino sugars - a tool to quantify timing and amount of soil microbial residue stabilization. Rapid Communications in Mass Spectrometry. 19, 1409-1416 (2005).
- Liang, C., Balser, T. C. Mass spectrometric characterization of amino sugar aldononitrile acetate derivatives used for isotope enrichment assessment of microbial residues. Soil Biology and Biochemistry. 42, 904-909 (2010).
- Liang, C., Pedersen, J. A., Balser, T. C. Aminoglycoside antibiotics may interfere with microbial amino sugar analysis. Journal of Chromatography A. 1216, 5296-5301 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved