Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
GC basé sur la détection de l'acétate de Aldononitrile acide dérivé de glucosamine et de muramique pour la détermination des résidus microbienne dans le sol
Dans cet article
Résumé
Nous décrivons un protocole de la méthode pour l'analyse par GC-base des dérivés de l'acétate de aldonitrile glucosamine et d'acide muramique extrait du sol. Pour élucider le mécanisme chimique, nous présentons également une stratégie visant à confirmer la structure de l'instrument dérivé et les fragments d'ions formés sur l'ionisation d'électrons.
Résumé
Les approches quantitatives à des micro-organismes qui caractérisent sont cruciales pour une meilleure compréhension de l'état et la fonction microbiennes dans les écosystèmes. Les stratégies actuelles de l'analyse microbienne comprennent à la fois traditionnels de laboratoire de la culture-dépendantes techniques et celles qui sont basées sur l'extraction directe et la détermination de certains biomarqueurs 1, 2. Peu d'entre la diversité des espèces microbiennes qui habitent le sol peuvent être cultivées, afin de la culture-dépendantes des méthodes introduire des biais importants, une limitation absente dans l'analyse des biomarqueurs.
L'acide glucosamine, la mannosamine, la galactosamine et muramique ont été bien servis que les mesures à la fois de la vie et de la masse microbienne morts, de ces acides de la glucosamine (le plus abondant) et muramique (uniquement à partir de la cellule bactérienne) sont des constituants les plus importants dans les systèmes sol 3 , 4. Cependant, le manque de connaissances sur l'analyse limite la vulgarisation large entre pairs scientifiques. Parmi tous les exipiquer les méthodes d'analyse, de dérivatisation à aldononitrile acétates suivie par GC-analyse basée sur a émergé comme une bonne option par rapport à l'équilibre de façon optimale la précision, la sensibilité, la simplicité, une bonne séparation chromatographique, et la stabilité sur 5 stockage de l'échantillon.
Ici, nous présentons un protocole détaillé pour une analyse fiable et relativement simple de la glucosamine et l'acide muramique à partir du sol après leur conversion à acétates aldononitrile. Le protocole comprend principalement quatre étapes: la digestion acide, la purification de l'échantillon, et la détermination de dérivatisation GC. La procédure étape par étape est modifiée conformément à l'ancien publications 6, 7. En outre, nous présentons une stratégie visant à valider la structure de l'ion moléculaire du dérivé et ses fragments d'ions formés sur l'ionisation d'électrons. Nous avons appliqué GC-EI-MS-SIM, LC-ESI-TOF-MS et réactifs marqués par des isotopes pour déterminer le poids moléculaire de l'acétate aldononitrile dérivé de glucosamine et de muracide amique; nous avons utilisé le changement de masse de l'isotope-étiquetés dérivés dans le spectre des ions d'enquêter sur des fragments d'ions de chaque dérivés 8. En plus de l'élucidation théorique, la validation de l'ion moléculaire du dérivé et ses fragments d'ions sera utile aux chercheurs qui utilisent δ 13 C ou des fragments d'ions de ces biomarqueurs dans les études biogéochimiques 9, 10.
Protocole
1. Préparation de l'échantillon et extraction d'acide
- Lyophilisation des échantillons de sol après collecte sur le terrain.
- Broyer et homogénéiser les échantillons de sol en utilisant un broyeur à boulets, broyeur du sol, ou d'un mortier et un pilon.
- Peser les échantillons de sol (contenant> 0,3 mg N) dans un ballon de 25 ml d'hydrolyse.
- Ajouter 10 ml HCl 6M dans chaque flacon d'hydrolyse, remplissez gaz N 2 dans les flacons, et fermer hermétiquement.
- Hydrolyser à 105 ° C dans un incubateur pendant 8 heures en utilisant une minuterie automatique.
2. Purification de l'échantillon
- Retirer les flacons de l'incubateur et laisser refroidir à température ambiante.
- Ajouter 100 ul d'étalon interne myo-inositol (1 mg mL -1 dans l'eau) dans chaque flacon, mélanger en remuant.
- Mettre en place des entonnoirs en plastique se déversant dans 200 ml de poires en forme de flacons avec ST / NS 24/40 articulations, fixées sur des gobelets en plastique pour la stabilité.
- Plier Whatman n ° 2 cercles qualitatives (11 cm de diamètre) en quarts et mis en entonnoirs.
- Swirl chaque flacon d'hydrolyse, et versez suspension dans l'entonnoir pour filtrer (vous pouvez en outre rincer chaque flacon avec ~ 3 ml d'eau).
- Sécher le filtrat à l'aide d'un évaporateur rotatif à 45 ° C, application de vide.
- Reprendre le résidu séché dans chaque flacon de poire avec 3 ~ 5 ml d'eau (bain à ultrasons utiliser si vous le souhaitez), et verser dans un tube de 40 ml en téflon; rincer le ballon avec une seconde partie aliquote de l'eau.
- Ajuster le pH à 6.6 à 6.8 en utilisant une solution de KOH 1M à des ions métalliques précipiter et d'autres molécules organiques.
- Retirez le précipités par centrifugation à 2000 rcf pendant 10 minutes.
- Verser le surnageant dans un tube de 40 ml en verre, couvrir l'ouverture du tube avec du parafilm, congeler à -20 ° C, puis faire des trous dans le parafilm.
- Lyophiliser le surnageant congelé pour éliminer tout le liquide.
- Dissoudre le résidu avec 3 ml de méthanol sec, vortex soigneusement (utilisez bain à ultrasons si désiré); bouchon du tube, puis centrifuger à 2000 rcf pendant 10 minutes pour réglerles sels.
- Transférer le surnageant dans un flacon de 3 ml de réaction conique; évaporer à sec par la machine RapidVap à 45 ° C (ou sous un léger courant d'azote gazeux sec si désiré).
- Pour chaque flacon, ajouter 100 ul de récupération standard N-méthyl-(1 mg mL -1 dans l'eau) et 1 ml H 2 O, couvrir les bouches du flacon avec du parafilm, les congeler à -20 ° C, perforer le parafilm, puis congeler à sec .
- Faire des normes: ajouter 100 ul d'acide muramique (0,5 mg mL -1 dans le méthanol), 100 pl de la glucosamine (1 mg mL -1 dans l'eau), 100 pl myo-inositol (1 mg mL -1 dans l'eau), 100 N-ul méthylglucamine (1 mg mL -1 dans l'eau), et 1 ml H 2 O, parafilm chaque flacon, congeler à -20 ° C, perforer le parafilm, puis congelez-sec.
3. Dérivatisation
- Préparer le réactif de dérivatisation contenant 32 mg mL -1 de chlorhydrate d'hydroxylamine et 40 mg mL -1 4-diméthylamino-pydans la pyridine pipéridine-méthanol (4:1 en volume / volume).
- Ajouter 300 ul du réactif de dérivatisation à chacun des reactivials, fermer hermétiquement, et le vortex à fond.
- Mettre les flacons dans 75-80 ° C bain-marie pendant 35 minutes (bien scellé les flacons pour éviter toute permettant d'eau d'entrer dans les flacons).
- Retirer les flacons du bain-marie et laisser refroidir à température ambiante.
- Ajouter 1 ml d'anhydride acétique à chacun des reactivials mL 3, fermer hermétiquement, et le vortex à fond, puis les réchauffer au bain-marie 75-80 ° C pendant 25 minutes.
- Retirer les flacons du bain-marie et laisser refroidir à température ambiante.
4. Séparation et évaluation
- Ajouter 1,5 ml de dichlorométhane à chaque flacon, le bouchon hermétiquement, et le vortex à fond.
- Ajouter 1 ml d'HCl 1M à chaque flacon, bouchon et vortexer vigoureusement afin de permettre aux solutions de s'asseoir tranquillement jusqu'à ce que les deux phrases distinctes, aspirer et jeter la partie supérieure (aqueuse) à partir de 1000 pipette ul.
- Dans le même fashion, extraire la phase organique 3 fois, mais avec 1 ml de H 2 O (avec la dernière étape de lavage, de prendre un soin particulier à s'assurer que tous les de la phase aqueuse supérieure a été enlevée).
- Séchez la solution finale à l'aide RapidVap à 45 ° C (ou à sec en utilisant de l'azote gazeux si désiré).
- Dissoudre dans 300 uL d'acétate d'éthyle-hexane (1:1 v / v) et le transfert de 2 mL à bouchon à vis d'ambre flacons avec insert un petit volume et fermer hermétiquement.
- Pour la quantification, l'analyse par GC-FID en utilisant une colonne capillaire en silice fondue non polaire: 30 m de long, 0,25 mm de diamètre, épaisseur de film 0,25 um; phase stationnaire 5% phényl-, 95% de méthyl-polysiloxane (DB-5 ou équivalent) avec de l'hydrogène ou de l'hélium comme gaz porteur, à raison de 0,5 ml d'écoulement -1 min constante. La chromatographie est meilleure sur des primes "inertes" phases et de gaz porteur d'hydrogène, mais il est acceptable sur les variétés les plus courantes et à l'hélium. Les paramètres de détection sont de 300 ° C; 400 ml min -1 air et 30 ml min -1 pour la fois l'azote etgaz à effet de maquillage d'hydrogène. L'injection et les paramètres du four sont comme suit: 1 injection directe ul (30:1) avec l'entrée GC fixé à 250 ° C; température initiale du four, à 120 ° C; maintenir 1 min; augmenter la température du four à 10 ° C min. -1 à 250 ° C; maintenir 2,5 min;. rampe à 270 ° C à 20 ° C min -1; tenir 2 minutes; rampe à 290 ° C à 20 ° C min -1, maintenez 5 min. Régler le débit du gaz porteur de telle sorte que l'éluer inositol, la glucosamine et des dérivés d'acide muramique à 250 ° C, et les N-méthylglucamine s'élue à 270 ° C.
5. Validation Derivative
- Utilisez ionisation douce LC-ESI-TOF-MS pour identifier l'ion moléculaire et de déterminer le poids moléculaire du dérivé.
- Utilisez GC-EI-MS-SIM ou GC-EI-MSMS pour l'amélioration de la sensibilité pour étudier les ions ciblés de la dérivée.
- Utiliser plusieurs réactifs marqués par des isotopes pour la préparation des dérivés, et ensuite utiliser le décalage de massede ces dérivés marqués par des isotopes dans les États membres à enquêter sur l'ion moléculaire et des fragments d'ions.
6. Les résultats représentatifs
Le protocole de la méthode comprend principalement quatre étapes: la digestion acide, la purification de l'échantillon, et la détermination de dérivatisation GC (Figure 1). Un exemple de l'analyse de la glucosamine et l'acide muramique des stocks standard et à partir d'un échantillon de sol est montré dans la figure 2. Ailleurs glucosamine et l'acide muramique, la mannosamine et la galactosamine (deux isomères de glucosamine) peut également être déterminée simultanément en utilisant le procédé. Sur la base de facteurs de réponse de normes à l'égard de l'étalon interne myo-inositol, nous pouvons quantifier ces biomarqueurs dans des échantillons de sol. La norme de récupération a été utilisé pour surveiller le processus qualitativement dérivatisation. Les régimes pour la formation de l'acétate de l'acide aldononitrile dérivé de glucosamine et de muramique sont présentés dans la figure 3 .
Les structures proposées pour les produits dérivés ont été déterminées par GC-EIMS-SIM pour l'amélioration de la sensibilité, ou d'ionisation douce LC-ESI-TOF-MS 8; les structures proposées des fragments d'ions formés sur l'ionisation d'électrons ont été étudiés en comparant les spectres d'ions de l' échantillons préparés avec des incorporations des isotopes différents 11. La figure 4 montre le décalage de masse de l'ion dominante m / z 187 de l'acétate de aldononitrile dérivé de la glucosamine dans trois scénarios, préparés avec des agents non-étiquetés, D-acétique anhydrite, et U -13 ° C-glucosamine. Autres informations et des explications détaillées peuvent être référés à notre récente des publications 8, 11. Cette stratégie pourrait servir de modèle pour étudier la chimie dérivée.
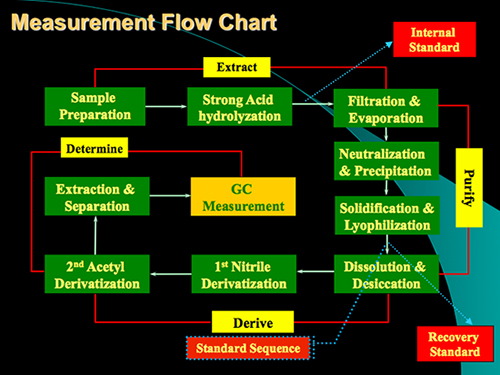
Figure 1. Diagramme de mesure du protocole pour l'analyse de la glucosamine et de l'acide dans le sol muramiqueéchantillons. Le protocole contient principalement 4 étapes: la digestion acide, purification, dérivatisation GC et la détermination.

Figure 2. GC-FID chromatogrammes des acétates aldononitrile de l'inositol, de la glucosamine, l'acide muramique, mannosamine, la galactosamine et méthylglucamine pour les normes et les sols.
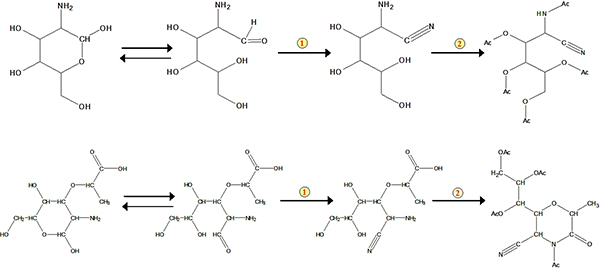
Figure 3. Systèmes pour la formation de l'acétate de l'acide aldononitrile dérivé de la glucosamine et muramique. Le numéro 1 représente la réaction nitrile. Le numéro 2 représente l'acétylation.

Figure 4. Les spectres de masse d'acétate de aldononitrile dérivé de la glucosamine associée à la structuration d'ions dominantees en mode AE préparé avec (A) des agents non marqués, (B) D-acétique l'anhydrite, (C) en U -13 C-glucosamine. Star représente lourde isotopes atome ou un groupe d'isotopes.
Discussion
Le présenté GC méthode basée sur l'analyse de l'acétate aldononitrile acide dérivé de la glucosamine et muramique fournit un procédé relativement rapide pour quantifier ces sucres aminés, des extraits du sol. Les dérivés sont chimiquement stables, et peut être déterminée dans une analyse. La méthode n'est pas limitée à des échantillons de sol, et peuvent être simplifiées pour les échantillons de non-matrice du sol.
La pompe à vide utilisée dans ce procéd?...
Déclarations de divulgation
Nous n'avons rien à communiquer.
Remerciements
Ce travail a été soutenu par des subventions de DOE des Grands Lacs Centre de recherche de la bioénergie (DOE BER Bureau de la science-DE-FC02 07ER64494). Nous sommes reconnaissants envers le Dr Xudong Zhang et ses membres du groupe pour des discussions techniques utiles et des commentaires précieux sur la finalisation du protocole.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | |
| L'acide muramique | Sigma-Aldrich | M2503-25MG | |
| D-(+)-chlorhydrate de glucosamine | Sigma-Aldrich | G1514-100G | |
| N-méthyl-D-glucamine | Sigma-Aldrich | M2004-500G | |
| Le myo-inositol | Fisher Scientific | A307003G025 | |
| Le méthanol (à sec) | Acros Organics | AC326950010 | |
| 4-diméthylamino-pyridine | Acros Organics | AC148270050 | |
| L'acétate d'éthyle | VWR International | BJGC100-4 | |
| Chlorhydrate Hydroxlamine | Fisher Scientific | H330-100 | |
| Pyridine | Fisher Scientific | P368-500 | |
| L'anhydride acétique | Fisher Scientific | A10-100 | |
| Le dichlorométhane (chlorure de méthylène) | Fisher Scientific | D37-500 | |
| Hexane | Fisher Scientific | H303-4 | |
| L'acide chlorhydrique (6M) | Fisher Scientific | S456-4 | |
| Chlorhydrate d'hydroxylamine -15 N | Icône de services | IN5280 | |
| L'anhydride acétique -2 H (D 6 C 4 O 3) | Acros Organics | AC174670050 | |
| D-glucose-U -13 C | Cambridge isotope de laboratoire | CLM-1396-1 | |
| D'ammonium sufate -15 N | Cambridge isotope de laboratoire | NLM-713-1 | |
| Nom de l'équipement | Entreprise | Type | |
| Rapid-Vap | Labconco | 790002 | |
| Vacum pompe | KNF Neuberger | D-79112 | |
| Flacon hydrolyse | Fisher Scientific | 06 423 | |
| Microtube dérivatisation | Fisher Scientific | 06-100E | |
| GC | Hewlett-Packard | 6890 | |
| MS | Hewlett-Packard | 5972 | |
| LC-ESI-TOF-MS | Agilent | Un Agilent série 1200 système HPLC couplée à une LC Agilent / MSD-TOF |
Références
- Zelles, L. Fatty acid patterns of phospholipids and lipopolysaccharides in the characterisation of microbial communities in soil: a review. Biology and Fertility of Soils. 29, 111-129 (1999).
- Kirk, J. L. Methods of studying soil microbial diversity. Journal of Microbiological Methods. 58, 169-188 (2004).
- Joergensen, R. G., Emmerling, C. Methods for evaluating human impact on soil microorganisms based on their activity, biomass, and diversity in agricultural soils. Journal of Plant Nutrition and Soil Science. 169, 295-309 (2006).
- Guggenberger, G., Frey, S. D., Six, J., Paustian, K., Elliott, E. T. Bacterial and fungal cell-wall residues in conventional and no-tillage agroecosystems. Soil Science Society of America Journal. 63, 1188-1198 (1999).
- Amelung, W., Lal, R., Kimble, J. M., Follett, R. F., Stewart, B. A. . Assessment Methods for Soil Carbon. , 233-270 (2001).
- Guerrant, G. O., Moss, C. W. Determination of monosaccharides as aldononitrile, O-methyloxime, alditol, and cyclitol acetate derivatives by gas-chromatography. Analytical Chemistry. 56, 633-638 (1984).
- Zhang, X., Amelung, W. Gas chromatographic determination of muramic acid, glucosamine, mannosamine, and galactosamine in soils. Soil Biology and Biochemistry. 28, 1201-1206 (1996).
- Liang, C. Investigation of the molecular ion structure for aldononitrile acetate derivatized muramic acid. Journal of Microbiological Methods. 86, 224-230 (2011).
- He, H., Xie, H., Zhang, X. A novel GC/MS technique to assess 15N and 13C incorporation into soil amino sugars. Soil Biology and Biochemistry. 38, 1083-1091 (2006).
- Glaser, B., Gross, S. Compound-specific delta 13C analysis of individual amino sugars - a tool to quantify timing and amount of soil microbial residue stabilization. Rapid Communications in Mass Spectrometry. 19, 1409-1416 (2005).
- Liang, C., Balser, T. C. Mass spectrometric characterization of amino sugar aldononitrile acetate derivatives used for isotope enrichment assessment of microbial residues. Soil Biology and Biochemistry. 42, 904-909 (2010).
- Liang, C., Pedersen, J. A., Balser, T. C. Aminoglycoside antibiotics may interfere with microbial amino sugar analysis. Journal of Chromatography A. 1216, 5296-5301 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon