Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
GC-basado en la detección de ácido Aldononitrile acetato derivado de glucosamina y murámico de la determinación de residuos microbiana en el suelo
En este artículo
Resumen
Se describe un protocolo método para el análisis de GC-basada de los derivados aldonitrile acetato de glucosamina y ácido murámico extraída del suelo. Para esclarecer el mecanismo químico, también presentan una estrategia para confirmar la estructura del derivado y los fragmentos de iones formados en la ionización de electrones.
Resumen
Los enfoques cuantitativos que caracterizan a los microorganismos son cruciales para una comprensión más amplia de la situación y función microbiana dentro de los ecosistemas. Las estrategias actuales para el análisis microbiológico de laboratorio incluyen tanto los tradicionales que dependen de la cultura y las técnicas basadas en la extracción directa y la determinación de ciertos biomarcadores 1 y 2. Pocos entre la diversidad de especies microbianas que habitan en el suelo pueden ser cultivadas, por lo que dependen de la cultura-los métodos de introducir sesgos significativos, una limitación ausente en el análisis de biomarcadores.
El ácido de glucosamina, manosamina, galactosamina y murámico han sido bien servido como medidas tanto de los vivos y los muertos masa microbiana, de ellos el ácido glucosamina (más abundante) y murámico (únicamente a partir de células bacterianas) son los componentes más importantes en los sistemas de suelo 3 , 4. Sin embargo, la falta de conocimiento en el análisis restringe la divulgación amplia de los pares científicos. Entre todas las exipicadura de los métodos analíticos, la derivación de aldononitrile acetatos seguido por GC-basado en el análisis se ha convertido en una buena opción con respecto al óptimo equilibrio entre precisión, sensibilidad, sencillez, buena separación cromatográfica, y la estabilidad en el almacenamiento de la muestra 5.
A continuación, presentamos un protocolo detallado para un análisis fiable y relativamente simple de la glucosamina y ácido murámico del suelo después de su conversión al acetatos aldononitrile. El protocolo comprende principalmente cuatro pasos: digestión ácida, la purificación de la muestra, la derivatización y la determinación de GC. El procedimiento paso a paso se modifica de acuerdo con el ex publicaciones 6, 7. Además, se presenta una estrategia para validar la estructura del ion molecular del derivado y sus fragmentos de iones formados en la ionización de electrones. Se aplicaron GC-EI-MS-SIM, LC-ESI-TOF-MS y reactivos marcados con isótopos para determinar el peso molecular de acetato derivado aldononitrile la glucosamina y el murácido amídico, se utilizó el cambio de masa de isótopos marcados derivados en el espectro de iones para investigar los fragmentos de iones derivados de cada 8. Además de la elucidación teórica, la validación de ión molecular del derivado y sus fragmentos de iones será útil para los investigadores que utilizan δ 13 C o fragmentos de iones de estos biomarcadores en estudios bioquímicos 9, 10.
Protocolo
1. Preparación de la muestra y la extracción de ácido
- Liofilizar las muestras de suelo después de la recolección de campo.
- Triturar y homogeneizar muestras de suelo utilizando un molino de bolas, molino de suelo, o un mortero y almirez.
- Pesar muestras de suelo (que contiene> 0,3 mg de N) en un matraz de 25 ml hidrólisis.
- Añadir 10 ml de HCl 6 M en cada frasco de la hidrólisis, llene N 2 gas en los frascos, y la tapa.
- Hidrolizar a 105 ° C en una incubadora durante 8 horas utilizando un interruptor de tiempo automático.
2. Purificación de la muestra
- Retirar los frascos de la incubadora y dejar enfriar a temperatura ambiente.
- Añadir 100 ml de patrón interno de myo-inositol (1 mg mL -1 de agua) a cada matraz, mezclar por agitación.
- Establecer embudos de plástico que desembocan en 200 ml en forma de pera frascos con ST / NS 24/40 articulaciones, establecidos en las tazas de plástico para la estabilidad.
- Doble Whatman # 2 Círculos cualitativos (11 cm de diámetro) en cuartos y poner en embudos.
- Agitar cada matraz hidrólisis, y verter purines en el embudo para filtrar (que además puede Enjuagar con ~ 3 ml de agua).
- Secar el filtrado utilizando un evaporador rotatorio a ~ 45 ° C, aplicando vacío.
- Volver a suspender el residuo seco de cada matraz pera con 3 ~ 5 ml de agua (uso de baño de ultrasonidos, si lo desea), y se vierte en un tubo de 40 ml de teflón, enjuagar el matraz con una segunda parte alícuota de agua.
- Ajustar el pH a 6,6 a 6,8 con solución 1M de KOH para precipitar los iones metálicos y otras moléculas orgánicas.
- Retirar los precipitados por centrifugación a 2000 rcf durante 10 minutos.
- Verter el sobrenadante en un tubo de vidrio 40 ml, cubrir la abertura del tubo con parafilm, congelación a -20 ° C, a continuación, hacer agujeros en la parafina.
- Liofilizar el sobrenadante congelado para eliminar todo el líquido.
- Disolver el residuo con 3 ml de metanol seco, agitación a fondo (uso de baño de ultrasonidos, si lo desea), tapar el tubo, y centrifugar a 2000 fcr durante 10 minutos para resolverlas sales.
- Transferir el sobrenadante a un vial de reacción 3 ml cónico; evaporar a sequedad por la máquina RapidVap a 45 ° C (o bajo una suave corriente de gas nitrógeno seco, si se desea).
- Para cada vial, añadir 100 ml de recuperación estándar de N-metilglucamina (1 mg mL -1 en agua) y 1 ml de H 2 O, cubrir la boca del vial con Parafilm, congelar a -20 ° C, perforar la parafina, y luego congelar en seco .
- Hacer normas: añadir 100 l de ácido murámico (0,5 mg mL -1 en metanol), 100 l de glucosamina (1 mg mL -1 de agua), 100 l de myo-inositol (1 mg mL -1 de agua), la N-100 l metilglucamina (1 mg mL -1 de agua) y 1 ml de H 2 O, parafina cada vial, congelar a -20 ° C, perforar la parafina, y luego congelar en seco.
3. Derivatización
- Preparar reactivo de derivatización que contiene 32 mg ml -1 hidrocloruro de hidroxilamina y 40 mg ml -1 4-dimetilamino-PYridine en piridina-metanol (4:1 v / v).
- Añadir 300 l del reactivo de derivatización para cada uno de los reactivials, tapa herméticamente, y mezclar bien.
- Ponga los frascos en un baño de agua 75-80 ° C durante 35 minutos (así se sellan los viales de evitar que el agua para entrar en los viales).
- Saque los frascos del baño de agua, y deje enfriar a temperatura ambiente.
- Añadir 1 ml de anhídrido acético a cada uno de los 3 ml reactivials, tapa herméticamente, y mezclar bien, a continuación, recalentar en 75-80 ° C baño de agua durante 25 minutos.
- Saque los frascos del baño de agua, y deje enfriar a temperatura ambiente.
4. Separación y Medición
- Añadir 1,5 ml de diclorometano a cada frasco, tapa bien, y mezclar bien.
- Añadir 1 ml de HCl 1 M a cada vial, tapa y mezclar bien para permitir que las soluciones para sentarse inalterado hasta que las dos frases separadas, aspirar y desechar la parte superior (acuosa) en fase inversa usando pipeta 1000 l.
- En la misma fAshion, se extrae la fase orgánica 3 veces pero con 1 ml de H 2 O (con la última etapa de lavado, tener especial cuidado para asegurar que toda la fase acuosa superior se ha eliminado).
- Se seca la solución final utilizando RapidVap a 45 ° C (o en seco con gas nitrógeno, si se desea).
- Disolver en 300 l de acetato de etilo-hexano (1:1 v / v) y transferencia a 2 ml de color ámbar con tapón de rosca viales con inserto de un pequeño volumen y tapa.
- Para la cuantificación, el análisis por GC-FID con una columna de sílice fundida capilar no polar: 30 m de largo, 0,25 mm de diámetro, espesor de la película 0,25 m; fase estacionaria 5% fenil-, el 95% de metil-polisiloxano (DB-5 o equivalente) con hidrógeno o helio como gas portador, en 0,5 ml min -1 flujo constante. La cromatografía es mejor en las primas "inerte" y las fases de gas portador de hidrógeno, pero es aceptable en las variedades más comunes y con helio. Los ajustes del detector son 300 ° C; 400 ml min -1 aire y 30 ml min -1 tanto para el nitrógeno y elgases de hidrógeno maquillaje. La inyección y los parámetros del horno son como sigue: 1 l de inyección de división (30:1) con la entrada de GC fijado a 250 ° C; temperatura del horno inicial, 120 ° C; mantener 1 min; aumentar la temperatura del horno a 10 ° C min. -1 a 250 ° C, tienen 2,5 minutos;. la rampa a 270 ° C a 20 ° C min -1; mantener 2 minutos; la rampa a 290 ° C a 20 ° C min -1, mantenga 5 min. Ajustar el caudal del gas portador de manera que el eluir inositol, glucosamina y derivados de ácido murámico a 250 ° C, y los N-metilglucamina eluye a 270 ° C.
5. Derivado de validación
- El uso de ionización suave LC-ESI-TOF-MS para identificar el ion molecular y determinar el peso molecular del derivado.
- El uso de GC-EI-MS-SIM o GC-IE-MSMS para la mejora de la sensibilidad para investigar los iones específicos de la derivada.
- El uso de múltiples reactivos marcados con isótopos para la preparación de los derivados, y luego usar el cambio de masade aquellos derivados marcadas isotópicamente en la EM para investigar ión molecular y los fragmentos de iones.
6. Los resultados representativos
El protocolo del método comprende principalmente cuatro pasos: digestión ácida, la purificación de la muestra, y la determinación derivatización GC (Figura 1). Un ejemplo del análisis de glucosamina y ácido murámico de las existencias de estándar y de una muestra de suelo se muestra en la Figura 2. Además de la glucosamina y ácido murámico, manosamina y galactosamina (dos isómeros de glucosamina) también se puede determinar simultáneamente utilizando el método. Con base en los factores de respuesta de las normas con respecto a la norma interna de myo-inositol, podemos cuantificar estos biomarcadores en muestras de suelo. El estándar de recuperación ha sido utilizado para controlar cualitativamente el proceso de derivatización. Los esquemas para la formación del ácido acetato aldononitrile derivatizado glucosamina y murámico se muestra en la Figura 3 .
Las estructuras propuestas de los derivados se determinó por GC-EIMS-SIM para la mejora de la sensibilidad, o ionización suave LC-ESI-TOF-MS 8; las estructuras propuestas de los fragmentos de iones formados en la ionización de electrones se estudiaron mediante la comparación de los espectros de iones del Las muestras preparadas con incorporaciones de isótopos diferentes 11. La Figura 4 muestra el cambio de masa del ion dominante m / z 187 de acetato de aldononitrile derivatizado glucosamina en tres escenarios, preparados con agentes no-etiquetados, anhidrita D-acético, y U -13 C-glucosamina. Otra información detallada y explicaciones pueden ser remitidos a nuestro publicaciones recientes de 8, 11. Esta estrategia podría servir como modelo para estudiar la química derivada.
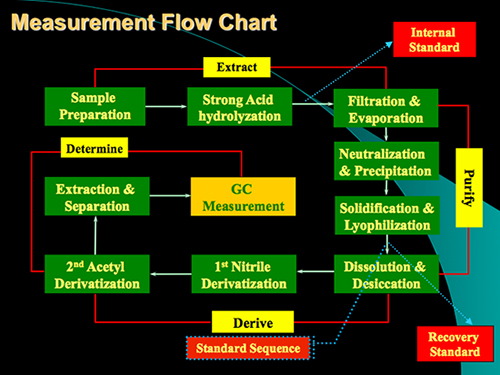
Figura 1. Medición diagrama de flujo del protocolo para el análisis de la glucosamina y ácido murámico en el suelomuestras. El protocolo contiene principalmente 4 pasos: digestión ácida, Purificación, la derivación y la determinación de GC.

Figura 2. GC-FID cromatogramas de acetatos aldononitrile de inositol, la glucosamina, ácido murámico, manosamina, galactosamina y metilglucamina de las normas y el suelo.
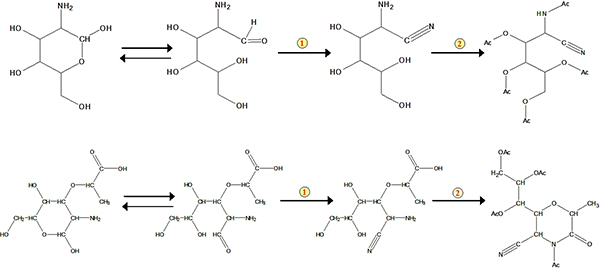
Figura 3. Esquemas para la formación del ácido acetato aldononitrile derivatizado glucosamina y murámico. El número 1 representa la reacción de nitrilo. El número 2 representa acetilación.

Figura 4. Los espectros de masas de acetato aldononitrile derivatizado glucosamina asociada con la estruc ión dominantees bajo modo EI preparado con (A) los agentes no-etiquetados, (B) de D-acético anhidrita, (C) U -13 C-glucosamina. Estrella representa pesado átomo o grupo isótopo isótopo.
Discusión
El GC presentó basado en el método para el análisis de ácido aldononitrile acetato derivado de glucosamina y murámico proporciona un método relativamente rápido para cuantificar los aminoácidos, los azúcares extraídos del suelo. Los derivados son químicamente estables, y se puede determinar en un análisis. El método no se limita a las muestras de suelo, y puede ser simplificado para muestras de matriz no-suelo.
La bomba de vacío utilizado en este método está construido para s...
Divulgaciones
No tenemos nada que revelar.
Agradecimientos
Este trabajo fue apoyado por becas de los Grandes Lagos DOE Centro de Investigación en Bioenergía (DOE BER Oficina de Ciencia-DE-FC02 07ER64494). Estamos muy agradecidos con el Dr. Zhang Xudong y sus miembros del grupo para las discusiones técnicas útiles y valiosos comentarios sobre la finalización del protocolo.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | |
| Ácido murámico | Sigma-Aldrich | M2503-25MG | |
| D-(+)-glucosamina clorhidrato | Sigma-Aldrich | G1514-100G | |
| N-metil-D-glucamina | Sigma-Aldrich | M2004-500G | |
| Myo-inositol | Fisher Scientific | A307003G025 | |
| El metanol (seco) | Acros orgánicos | AC326950010 | |
| 4-dimetilamino-piridina | Acros orgánicos | AC148270050 | |
| Acetato de etilo | VWR International | BJGC100-4 | |
| Hydroxlamine clorhidrato de | Fisher Scientific | H330-100 | |
| Piridina | Fisher Scientific | P368-500 | |
| El anhídrido acético | Fisher Scientific | A10-100 | |
| Diclorometano (cloruro de metileno) | Fisher Scientific | D37-500 | |
| Hexano | Fisher Scientific | H303-4 | |
| El ácido clorhídrico (6 M) | Fisher Scientific | S456-4 | |
| Hidroxilamina clorhidrato de N -15 | Icono de los servicios | IN5280 | |
| Anhídrido acético -2 H (D 6 C 4 O 3) | Acros orgánicos | AC174670050 | |
| D-glucosa-U -13 C | Cambridge laboratorio de isótopos | CLM-1396-1 | |
| Amonio sufate -15 N | Cambridge laboratorio de isótopos | NLM-713-1 | |
| Nombre del equipo | Empresa | Tipo | |
| Rapid-Vap | Labconco | 790002 | |
| Vacum bomba | KNF Neuberger | D-79112 | |
| La hidrólisis frasco | Fisher Scientific | 06 423A | |
| Derivatización microvial | Fisher Scientific | 06-100E | |
| GC | Hewlett-Packard | 6890 | |
| MS | Hewlett-Packard | 5972 | |
| LC-ESI-TOF-MS | Agilent | Un sistema de la serie 1200 de Agilent HPLC acoplado a un LC Agilent / MSD TOF- |
Referencias
- Zelles, L. Fatty acid patterns of phospholipids and lipopolysaccharides in the characterisation of microbial communities in soil: a review. Biology and Fertility of Soils. 29, 111-129 (1999).
- Kirk, J. L. Methods of studying soil microbial diversity. Journal of Microbiological Methods. 58, 169-188 (2004).
- Joergensen, R. G., Emmerling, C. Methods for evaluating human impact on soil microorganisms based on their activity, biomass, and diversity in agricultural soils. Journal of Plant Nutrition and Soil Science. 169, 295-309 (2006).
- Guggenberger, G., Frey, S. D., Six, J., Paustian, K., Elliott, E. T. Bacterial and fungal cell-wall residues in conventional and no-tillage agroecosystems. Soil Science Society of America Journal. 63, 1188-1198 (1999).
- Amelung, W., Lal, R., Kimble, J. M., Follett, R. F., Stewart, B. A. . Assessment Methods for Soil Carbon. , 233-270 (2001).
- Guerrant, G. O., Moss, C. W. Determination of monosaccharides as aldononitrile, O-methyloxime, alditol, and cyclitol acetate derivatives by gas-chromatography. Analytical Chemistry. 56, 633-638 (1984).
- Zhang, X., Amelung, W. Gas chromatographic determination of muramic acid, glucosamine, mannosamine, and galactosamine in soils. Soil Biology and Biochemistry. 28, 1201-1206 (1996).
- Liang, C. Investigation of the molecular ion structure for aldononitrile acetate derivatized muramic acid. Journal of Microbiological Methods. 86, 224-230 (2011).
- He, H., Xie, H., Zhang, X. A novel GC/MS technique to assess 15N and 13C incorporation into soil amino sugars. Soil Biology and Biochemistry. 38, 1083-1091 (2006).
- Glaser, B., Gross, S. Compound-specific delta 13C analysis of individual amino sugars - a tool to quantify timing and amount of soil microbial residue stabilization. Rapid Communications in Mass Spectrometry. 19, 1409-1416 (2005).
- Liang, C., Balser, T. C. Mass spectrometric characterization of amino sugar aldononitrile acetate derivatives used for isotope enrichment assessment of microbial residues. Soil Biology and Biochemistry. 42, 904-909 (2010).
- Liang, C., Pedersen, J. A., Balser, T. C. Aminoglycoside antibiotics may interfere with microbial amino sugar analysis. Journal of Chromatography A. 1216, 5296-5301 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados