A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
إعادة برمجة الخلايا الجسدية البشرية المستحثة إلى الخلايا الجذعية المحفزة (iPSCs) استخدام ناقلات فيروسات الرجعية مع GFP
In This Article
Summary
وهناك طريقة لتوليد الإنسان الجذعية المحفزة التي يسببها الخلايا (iPSCs) عبر الارتجاعي بوساطة التعبير خارج الرحم من OCT4، يوصف SOX2، KLF4 وMYC. ويناقش أيضا وسيلة عملية لتحديد المستعمرات iPSC الإنسان على أساس التعبير GFP.
Abstract
الخلايا الجذعية الجنينية البشرية (hESCs) متعددة الإمكانات ومصادر لا تقدر بثمن للخلوي في النمذجة مرض المختبر، والتجدد الطب 1. ولقد ثبت من قبل أنه يمكن إعادة برمجة الخلايا الجسدية البشرية إلى تعدد القدرات بواسطة التعبير خارج الرحم من عوامل النسخ الأربع (Oct4، Sox2، Klf4 وMyc)، وأصبح بفعل الخلايا الجذعية المحفزة (iPSCs) 2-4. مثل hESCs، iPSCs الإنسان هي المحفزة ومصدرا محتملا للخلايا ذاتي. نحن هنا وصف بروتوكول لإعادة برمجة الخلايا الليفية الإنسان مع العوامل الأربعة المستنسخة إلى إعادة برمجة GFP المحتوية على العمود الفقري فيروسات 4. باستخدام بروتوكول التالية، ونحن توليد iPSCs الإنسان في 3-4 أسابيع تحت حالة الإنسان ثقافة ESC. الإنسان المستعمرات iPSC تشبه hESCs في التشكل وعرض الخسائر في مضان GFP نتيجة لإسكات التحوير فيروسات. المستعمرات iPSC معزولة ميكانيكيا تحت microsco مضانPE تتصرف بطريقة مشابهة كما hESCs. في هذه الخلايا، ونحن للكشف عن التعبير عن الجينات متعددة تعدد القدرات وعلامات سطح.
Protocol
1. إعادة برمجة من قبل الفيروس الارتجاعي تعرب عن عوامل إعادة برمجة
- يتم استزراع الخلايا الليفية الإنسان في المتوسطة الليفية (10٪ FBS في DMEM مع القلم / بكتيريا).
- قبل يوم واحد عدوى، لوحة 1x10 5 الليفية الإنسان في بئر واحدة من لوحة 6 جيدا.
- نضح المتوسطة لإزالة الخلايا الميتة وإضافة 2 مل من الخلايا الليفية المتوسطة الطازجة. إضافة سلفات بروتامين بتركيز نهائي من 5 ميكروغرام / مل.
- إضافة بعناية القدر المناسب من كل فيروس GFP، معربا عن المقابلة لعدد وافر من العدوى (وزارة الداخلية) 5 5.
- يوم واحد بعد الإصابة، وإزالة طاف الفيروسية، ويغسل ثلاث مرات مع PBS 2 مل، ثم إضافة 2 مل الليفية المتوسطة.
- بعد ثلاثة أيام من الإصابة، والتحقق من مضان GFP وتجديد بشكل جيد مع 2 مل المتوسطة الليفية.
- بعد أربعة أيام من الإصابة، لوحة 1x10 الخلايا المغذية 4/2 سم من الخلايا الليفية الماوس المشع الجنينية (MEFs) في الخلايا الليفية المتوسطة في الصعود إلى10 سم طبق بيتري المغلفة مع 0.1٪ الجيلاتين. احتضان عند 37 درجة مئوية خلال الليل.
- بعد خمسة أيام من العدوى، وفصل الخلايا الليفية الإنسان بالعدوى مع 1 typsin 0.05٪ مل / EDTA لمدة 5 دقائق عند 37 درجة مئوية، وأجهزة الطرد المركزي لمدة 5 دقائق على 200 غرام. نضح على المديين المتوسط وresuspend الخلايا مع 10ML من الخلايا الليفية المتوسطة. نقل الخلايا في الصفيحة 10 سم، وقبل المغلفة.
- بعد 24 ساعة، بدلا من المتوسط مع الثقافة المتوسطة hESC (20٪ بالضربة القاضية استبدال المصل، DMEM/F12، 0.1 مل غير الأحماض الأمينية الأساسية، 4 نانوغرام / مل bFGF، القلم / بكتيريا / جلتاميت، بيتا merceptoethanol). تغيير المتوسط يوميا. وسوف ESC-مثل المستعمرات تبدأ في الظهور بعد يوم 20-27 بعد الإصابة.
2. العزل والتوسع في iPSCs
- تحت المجهر مضان، والتحقق من عدم وجود مضان GFP في مستعمرة تظهر لالتشكل مماثلة لhESCs.
- باستخدام ماصة 10 ميكرولتر، واختيار المستعمرات iPSC الفردية ووضعها في بئر واحدة من الجيلاتين وMEF، لجنة الزراعةتيد 12-جيدا لوحة وتستكمل مع متوسط hESC. تغيير المتوسط يوميا.
- عن الركض، وغسل لوحة مع 1 مل من DMEM/F12، ثم يضاف 0.5 مل من كولاجيناز، واحتضان لمدة 10 دقائق عند 37 درجة مئوية.
- غسل الخلايا مرتين مع DMEM/F12.
- أضف 2 مل من المتوسط hESC الطازجة. باستخدام رافع الخلية، تفكيك المستعمرات الى قطع صغيرة وفصل الخلايا المتبقية من لوحة.
- نقل القطع معلق من المستعمرات في بئر واحدة من لوحة 6 جيدا الجيلاتين وMEF المغلفة بالمطاط.
3. المناعي تحليل علامات المحفزة
- غسل الخلايا ثلاث مرات مع برنامج تلفزيوني واصلاحها مع بارافورمالدهيد 4٪ لمدة 20 دقيقة في درجة حرارة الغرفة.
- غسل بلطف الخلايا ثلاث مرات مع برنامج تلفزيوني وpermeabilize مع 0.2٪ تريتون X-100 في برنامج تلفزيوني لمدة 30 دقيقة.
- كتلة غير محددة وملزمة من قبل احتضان خلايا مع جيش صرب البوسنة 3٪ في برنامج تلفزيوني لمدة ساعتين.
- احتضان الخلايا مع الأجسام المضادة الأولية بين عشية وضحاها في 4 درجات مئوية. <لى> غسل الخلايا ثلاث مرات مع برنامج تلفزيوني واحتضان الخلايا مع الجسم المضاد الثانوي محدد لمدة ساعة في درجة حرارة الغرفة، يحمي من الضوء.
- غسل الخلايا ثلاث مرات مع برنامج تلفزيوني ودابي الوظيفة خلال غسل الماضي تلاها حضانة في درجة حرارة الغرفة لمدة 5 دقائق.
- الكشف عن تلطيخ مع المجهر مضان.
4. الكمية فحص PCR في الوقت الحقيقي لعلامات المحفزة
- عزل الحمض النووي الريبي من مجموع iPSCs حقوق الإنسان مستمد من الخلايا الليفية الإنسان باستخدام عدة QIAGEN في RNeasy.
- [كدنا] تجميع أول حبلا باستخدام مرتفع الناسخ العكسي الثاني.
- أداء qPCR للكشف عن الجينات تعدد القدرات باستخدام بادئات ذكرت سابقا. 6
5. ممثل النتائج
- المورفولوجية تغير خلال إعادة برمجة
نحن إصابة الخلايا الليفية الإنسان BJ1 وديترويت 551 مع مزيج من الفيروسات تحمل OCT4، SOX2، KLF4 وMYC،وكانت قادرة على الكشف عن تغيرات شكلية خلال إعادة برمجة (الشكل 1). واحد وعشرين يوما بعد العدوى، ونحن ندرك iPSC المستعمرات الصغيرة من قبل التشكل hESC تشبه بهم. وعلاوة على ذلك، فإننا ندرك iPSCs من مضان GFP. الخلايا الجذعية المحفزة، مثل المجالس الاقتصادية والاجتماعية وiPSCs، أعرب عن الآلية الجزيئية لقمع التعبير الجيني proviral 7-9. ناقلات لدينا فيروس فريد من نوعه يعبر عن GFP جنبا إلى جنب مع إعادة برمجة الجينات التي LTR فيروسات. وبالتالي، تعتبر خلايا تعبير مستمر GFP للتعبير عن الجينات المحورة دون إسكات الجينات proviral. المستعمرات iPSC برمجتها بأمانة أن الحصول على شبكة تعدد القدرات الجزيئية تبين عدم وجود تعبير GFP (الشكل 2) 10. - توصيف تعدد القدرات البشرية من iPSCs
قمنا بتحليل المستعمرات المستمدة من الخلايا الليفية-551 عن طريق ديترويت المناعية مع ترا-81-1، ترا-1-60، SSEA-4، 3-SSEA، OCT4 والأجسام المضادة NANOG ( الجدول 2). iPSCs برمجتها بنجاح أعبر عن كل هذه العلامات (الشكل 3A). نحن أيضا تحليل التعبير الجيني عن طريق تحليل RT-PCR الكمي. لاحظنا أن التعبير عن OCT4، وحدثت زيادة كبيرة SOX2، KLF4، MYC وNANOG مقارنة مع الخلايا الليفية والدية ولكن بما يتناسب مع ذلك من H9 hESCs (الشكل 3B).
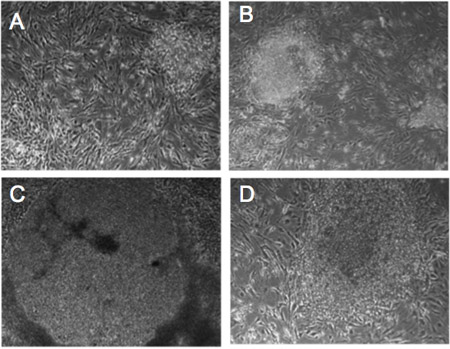
الشكل 1. التغييرات الشكلية من المصابين بعدوى الفيروس الارتجاعي الليفية الإنسان. (AD) التغيير الصرفي التقدمي في مستعمرات من الخلايا الليفية-551 ديترويت المصابين عوامل إعادة البرمجة. يوم 5 (أ)، يوم 10 (ب)، يوم 14 (ج)، يوم 21 (د). الخلايا إظهار مورفولوجيا hESC تشبه بعد 21 يوما.
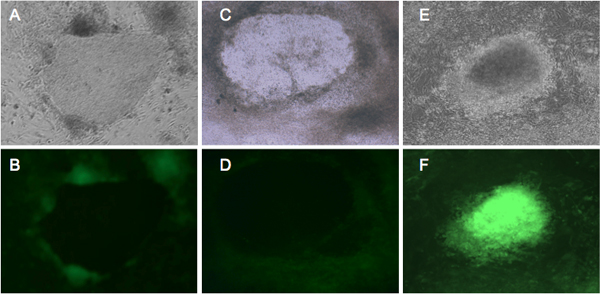
الشكل 2. ممثل GFP التعبير فلوري في الخلايا التي تمر برمجة. BJ وديترويت 551 الليفية مع الارتجاعي معربا عن أربعة عوامل إعادة برمجة 4، وحضنت في المتوسط hESC لمدة أربعة أسابيع. الليفية BJ (A، B)، وديترويت 551 (C، D) تظهر مشابهة الصرفي. من يوم 21، المستعمرات GFP السلبية تبدأ في تشكيل، والتي تمثل iPSCs حسن النية 10. (E، F) تظهر تحول ديترويت 551 الخلايا التي لم تخضع لإعادة البرمجة المناسبة. (A، C، E) مستعمرات تحت الرأي النقيض من المرحلة. (B، D) إعادة برمجة الخلايا التي تظهر بشكل صحيح إسكات GFP. (F) التعبير GFP مشرق من مستعمرة حولت.
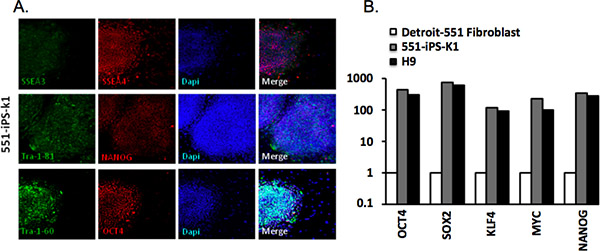
الشكل 3. توصيف فعل الإنسان الخلايا الجذعية المحفزة. (A) مستعمرات الإنسان الخلية 551-IPS-K1 التعبير عن علامات مشتركة بين الخلايا المحفزة. تلوين دابي يدل على محتوى الخلية إجمالي لكل حقل. (ب) الكمية في الوقت الحقيقي PCR (RT-qPCR) للتعبير عن OCT4، SOX2، KLF4، في MYC و الوالدينibroblast، 551-IPS-K1 iPSCs، وH9 الخلايا الجذعية الجنينية البشرية (hESCs). وتم تطبيع البيانات ضد الجينات التدبير المنزلي β-الأكتين وتآمر بالنسبة لمستوى التعبير في الخلايا الليفية الوالدين 4.
Access restricted. Please log in or start a trial to view this content.
Discussion
التعبير عن الخلايا الليفية النسخ 4 يعيد البرمجة العوامل البشرية إلى iPSCs. جرت محاولات عديدة لتوليد iPSCs الإنسان باستخدام أساليب غير دمج أو غير الجينية لتوليد iPSCs الآمنة سريريا. حتى الآن، هذه الأساليب تظهر كفاءة منخفضة للغاية وتتطلب التحسين إضافية لتحسين استنساخ 11-14.
Access restricted. Please log in or start a trial to view this content.
Disclosures
ليس لدينا ما يكشف.
Acknowledgements
وقد تم تمويل هذا العمل من قبل كلية الطب بجامعة ييل، وجائزة الطفل بحوث الصحية من مؤسسة تشارلز هود.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| DMEM/F12 | Invitrogen | 11330057 | 80% |
| Knockout Serum Replacer | Invitrogen | 10828-028 | 20% |
| L-Glutamine (200 mM) | Invitrogen | 25030081 | 2 mM |
| Nonessential Amino Acids (10 mM) | Invitrogen | 11140050 | 0.1 mM |
| β-Mercapt–thanol (14.3 M) or MTG | Invitrogen | M-6250 | 0.1 mM |
| bFGF-2 10 μg/ml | GIBCO, by Life Technologies | GF003AF | 4 ng/ml |
| Penicillin/Streptomycin | EMD Millipore | 15140-122 | 1% |
| DMEM | Invitrogen | 11965118 | 90% |
| FBS | Invitrogen | 10407028 | 10% |
| Penicillin/Streptomycin | EMD Millipore | 15140-122 | 1% |
| Table 1. Culture Medium | |||
| OCT4 | Abcam | Ab19857 | 1:500 |
| SSEA3 | EMD Millipore | MAB4303 | 1:100 |
| SSEA4 | BD Biosciences | BD560218 | 1:100 |
| Tra-1-81 | BD Biosciences | BD560173 | 1:100 |
| Tra-1-60 | BD Biosciences | BD560174 | 1:100 |
| NANOG | Abcam | Ab21624 | 1:500 |
| Alexa-Flur 488 | Invitrogen | A11008 | 1:1000 |
| Alexa-Flur 555 | Invitrogen | A21422 | 1:1000 |
| DAPI | Invitrogen | D1306 | 1:5000 |
| pMIG-OCT4 | Addgene | 17225 | |
| pMIG-SOX2 | Addgene | 17226 | |
| pMIG-KLF4 | Addgene | 17227 | |
| pMIG-MYC | Addgene | 18119 | |
| Collagenase type IV | Invitrogen | 17104019 | 1mg/ml |
| Gelatin, Porcine | Sigma-Aldrich | G 1890 | 0.1% |
| Triton | Sigma-Aldrich | X100-500ML | 0.2% |
| Paraformaldehyde | Sigma-Aldrich | 47608 | 4% |
| BSA | American Bioanalytical | AB01800 | 3% |
| MEF feeder cells | EMD Millipore | PMEF-N | |
| Cell Lifter | Corning | 3008 | |
| Fluorescent microscopy: inverted microscope with GFP filter | |||
| Table 2. Reagents and equipment | |||
References
- Murry, C. E., Keller, G. Differentiation of embryonic stem cells to clinically relevant populations: lessons from embryonic development. Cell. 132, 661-680 (2008).
- Takahashi, K., Tanabe, K., Ohnuki, M., Narita, M., Ichisaka, T., Tomoda, K., Yamanaka, S. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131, 861-872 (2007).
- Yu, J., Vodyanik, M. A., Smuga-Otto, K., Antosiewicz-Bourget, J., Frane, J. L., Tian, S., Nie, J., Jonsdottir, G. A., Ruotti, V., Stewart, R. Induced pluripotent stem cell lines derived from human somatic cells. Science. 318, 1917-1920 (2007).
- Park, I. H., Zhao, R., West, J. A., Yabuuchi, A., Huo, H., Ince, T. A., Lerou, P. H., Lensch, M. W., Daley, G. Q. Reprogramming of human somatic cells to pluripotency with defined factors. Nature. 451, 141-146 (2008).
- Park, I. H., Lerou, P. H., Zhao, R., Huo, H., Daley, G. Q. Generation of human-induced pluripotent stem cells. Nature Protocols. 3, 1180-1186 (2008).
- Park, I. H., Zhao, R., West, J. A., Yabuuchi, A., Huo, H., Ince, T. A., Lerou, P. H., Lensch, M. W., Daley, G. Q. Reprogramming of human somatic cells to pluripotency with defined factors. Nature. 451, 141-146 (2008).
- Hotta, A., Ellis, J. Retroviral vector silencing during iPS cell induction: an epigenetic beacon that signals distinct pluripotent states. Journal of Cellular Biochemistry. 105, 940-948 (2008).
- Matsui, T., Leung, D., Miyashita, H., Maksakova, I. A., Miyachi, H., Kimura, H., Tachibana, M., Lorincz, M. C., Shinkai, Y. Proviral silencing in embryonic stem cells requires the histone methyltransferase ESET. Nature. 464, 927-931 (2010).
- Wolf, D., Goff, S. P. Embryonic stem cells use ZFP809 to silence retroviral DNAs. Nature. 458, 1201-1204 (2009).
- Chan, E. M., Ratanasirintrawoot, S., Park, I. H., Manos, P. D., Loh, Y. H., Huo, H., Miller, J. D., Hartung, O., Rho, J., Ince, T. A. Live cell imaging distinguishes bona fide human iPS cells from partially reprogrammed cells. Nat. Biotechnol. 27, 1033-1037 (2009).
- Yu, J., Hu, K., Smuga-Otto, K., Tian, S., Stewart, R., Slukvin,, Thomson, J. A. Human induced pluripotent stem cells free of vector and transgene sequences. Science. 324, 797-801 (2009).
- Kim, D., Kim, C. H., Moon, J. I., Chung, Y. G., Chang, M. Y., Han, B. S., Ko, S., Yang, E., Cha, K. Y., Lanza, R. Generation of human induced pluripotent stem cells by direct delivery of reprogramming proteins. Cell Stem Cell. 4, 472-476 (2009).
- Warren, L., Manos, P. D., Ahfeldt, T., Loh, Y. H., Li, H., Lau, F., Ebina, W., Mandal, P. K., Smith, Z. D., Meissner, A. Highly efficient reprogramming to pluripotency and directed differentiation of human cells with synthetic modified mRNA. Cell Stem Cell. 7, 618-630 (2010).
- Ban, H., Nishishita, N., Fusaki, N., Tabata, T., Saeki, K., Shikamura, M., Takada, N., Inoue, M., Hasegawa, M., Kawamata, S. Efficient generation of transgene-free human induced pluripotent stem cells (iPSCs) by temperature-sensitive Sendai virus vectors. Proceedings of the National Academy of Sciences of the United States of America. 108, 14234-14239 (2011).
- Wolf, D., Goff, S. P. TRIM28 mediates primer binding site-targeted silencing of murine leukemia virus in embryonic cells. Cell. 131, 46-57 (2007).
- Park, I. H., Arora, N., Huo, H., Maherali, N., Ahfeldt, T., Shimamura, A., Lensch, M. W., Cowan, C., Hochedlinger, K., Daley, G. Q. Disease-specific induced pluripotent stem cells. Cell. 134, 877-886 (2008).
- Kim, K. Y., Hysolli, E., Park, I. H. Neuronal maturation defect in induced pluripotent stem cells from patients with Rett syndrome. Proceedings of the National Academy of Sciences of the United States of America. 108, 14169-14174 (2011).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved